具有离子交换材料的金属-空气电池的制作方法与工艺
具有离子交换材料的金属-空气电池在先申请的引用本申请要求2011年6月17日提交的美国临时申请号61/498,308和2011年12月9日提交的美国临时申请号61/568,875的优先权。政府资助支持本发明是由能源部授予的批准号DB-AR-0000038的美国政府支持下完成的。美国政府在本发明中具有一定的权利。发明领域本发明的实施方式涉及电化学金属-空气电池,其使用离子交换材料以促进电极间离子迁移或辅助离子迁移中离子传导介质。
背景技术:
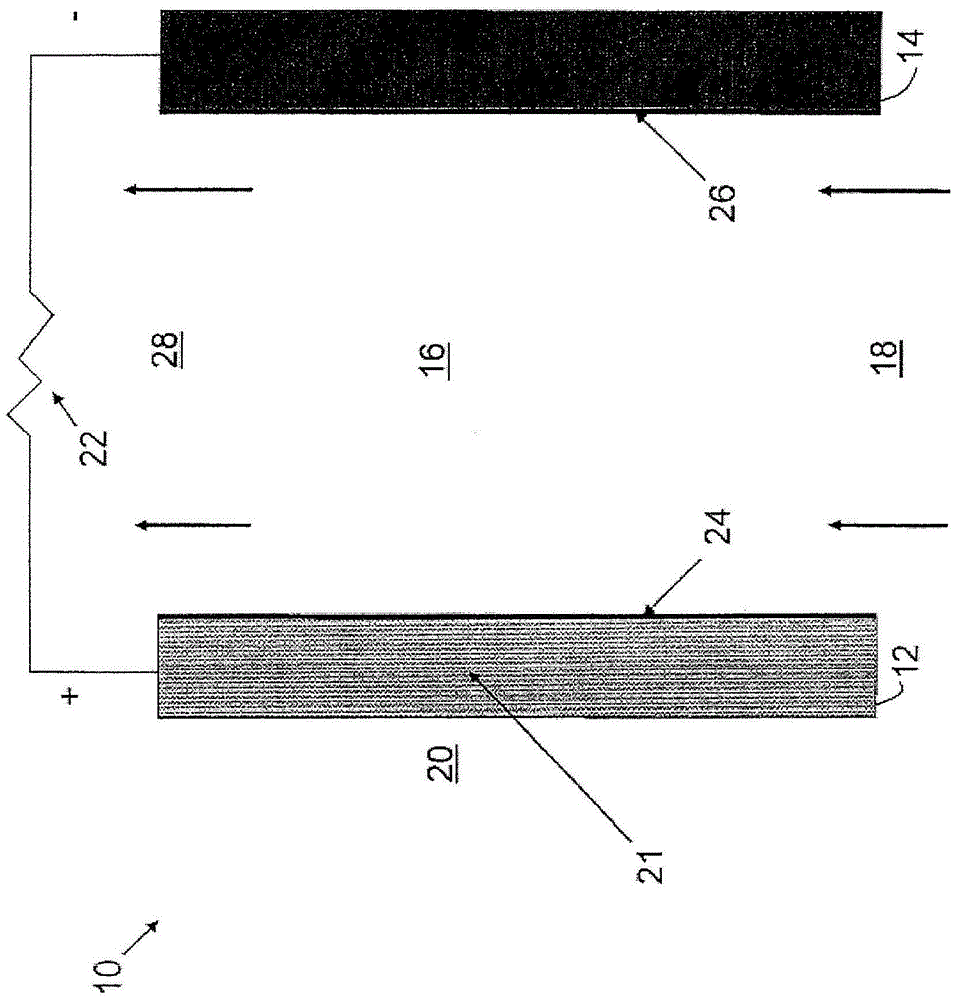
对大多数电池能量密度的一个显著损害是由电池的阴极造成的。对于使用例如锂或镍的电池化学也是如此。通常,氧化剂以低于阳极的摩尔充电容量的2至5倍的摩尔充电容量贮存在阴极。另一方面,许多燃料电池使用来自空气的氧作为氧化剂的来源。原则上,存在连续且事实上无限的氧化剂来源能够得到高能量密度。然而,使用氢和有机燃料由于蒸气压和系统平衡复杂性的问题,例如增湿和膜问题而妨碍高能量效率。金属-空气电化学电池能够联合电池的超高阳极容量与燃料电池的呼吸型(air-breathing)阴极,以便获得与现代能量需求有关的相当大的能量密度。金属-空气电池通常包括金属燃料在其上被氧化的燃料电极、氧在其上被还原的空气电极以及用于提供离子电导率的电解质。常规金属-空气电池的限制因素是电解质溶液(即离子传导介质)的蒸蒸发,尤其是溶剂例如水性电解质溶液中的水的蒸发。因为空气电极需要是空气可渗透的以吸收氧,所以它也可以允许溶剂蒸气例如水蒸气从电池逃逸。经过一段时间后,由于溶剂的枯竭,电池变得不能有效地工作。事实上,在许多电池设计中,该蒸发问题致使电池在燃料耗尽之前无法运行。并且该蒸发问题在二次(即可充)电池中会加剧,因为在电池的寿命中可以重复地再充燃料,而电解质溶液却不能(缺少来自外部来源的补充)。存在与水性电解质电池有关的其它问题:例如再充电期间的水电解和自放电。在再充电期间,电流流过电池,在燃料电极处还原氧化态燃料。然而,一些电流电解水,导致在燃料电极处析氢(还原)和在氧电极处析氧(氧化),如下面的方程所示:(1)还原∶2H2O(l)+2e-→H2(g)+2OH-(aq)和(2)氧化∶2H2O(l)→O2(g)+4H+(aq)+4e-以这种方式,更多的水性电解质从电池中损失。此外,在还原氢中所消耗的电子不可用于还原燃料氧化物。因此,水性电解质的寄生电解降低了二次电池的循环效率。自放电可以由电极中的杂质或者与电解质的反应造成。通常,来自电极中的杂质的自放电小(每月2-3%的损耗)。然而,活性金属与水和/或溶解在水中的O2的反应可能相当高(每月20-30%)。为了弥补这些问题,具有水性电解质溶液的金属-空气电池通常被设计为包含相对高的电解质溶液体积。一些电池设计甚至引入用于从附近的储液器补充电解质以维持电解质水平的装置。然而,任何方法既增加了电池的总体尺寸,也增加了电池的重量,却没有增强电池性能(除了确保存在显著体积的电解质溶液用以抵消水或者其它溶剂随时间的蒸发)。具体地,电池性能一般由燃料特性、电极特性、电解质特性以及可用于发生反应的电极表面积的量来确定。但是电池中电解质溶液的体积对电池性能一般没有显著的有益效果,因此一般仅在基于体积和重量比率(功 率比体积或重量和能量比体积或重量)方面减损电池性能。另外,过大的电解质体积可以在电极之间产生较大量的间距,这可能增加欧姆电阻并减损性能。已经建议使用用于电化学电池的非水体系(参见例如美国专利号5827602)。在非水体系中,水性电解质可以被离子液体取代。然而,已知包含强Lewis酸例如AlCl3的离子液体在暴露于水分时释放出有毒气体。在金属-空气电化学电池中使用低温或室温离子液体而不是水性电解质,其描述在以下序列号的美国临时申请:2010年9月6日提交的61/383,510;2010年6月15日提交的61/355,081;2010年5月12日提交的61/334,047;2010年4月29日提交的61/329,278;2009年5月11日提交的61/177,072,和2009年12月7日提交的61/267,240中,以及以下美国专利申请:在2011年5月11日提交的13/105,794;2011年4月28日提交的13/096,851;2011年4月13日提交的13/085714;和2010年5月10日提交的12/776,962中;每篇文献的公开内容以其整体通过引用并入本文。在电池中使用低温或室温离子液体基本上消除了与溶剂从电解液中蒸发相关的问题。室温离子液体具有极低蒸气压(一些具有在标准条件下基本上不可测量的蒸气压),并因此很少或不挥发。因此,使用低温或室温离子液体作为其离子性导电介质的电池不需要引入过量的溶液体积来弥补随着时间的蒸发。相对少量的离子液体足够支持电池操作所需的电化学反应,由此减少电池和重量和体积,并提高功率比体积/重量比率。而且,可以避免与溶剂有关的其它问题,例如在水性溶液中的析氢。金属-空气可充电池存在其它问题。例如,由于电池内锌和锌的氢氧化化(例如,锌酸根(Zn(OH)42-))的扩散,有时可以在空气电极形成树枝状晶体。树枝状晶体由锌(或其它金属)以针晶或支状样结构生长到阳极和阴极之间的电解质而形成。在充电期间该类型的生长可引起锌穿透多孔隔离体中的孔,当锌接触空气电极时,这可以引起短路和电池失效。来自空气电极的催化剂或杂质可以浸滤到电解质中,其可引起在金 属电极处放气和降低电池性能。如果持续一段时间,该浸滤可以最终导致空气电极分解。期望保持催化剂和任何杂质的稳定性,使得它们保持在空气电极上从而在空气电极在整个电池寿命期间保持完整,并且在任何催化剂或杂质变得与空气电极分离的情况下,期望防止其被运输到金属电极而降低金属电极放气的趋势。常规多孔聚合隔离体以及许多固体聚合物电解质一般允许锌和锌酸盐根在金属电极和空气电极之间扩散。锌酸根离子极易溶于碱性电解液例如KOH中,将扩散通过多孔隔离体。在隔离体的空气电极侧具有高浓度锌酸根的一些情况下,一旦达到锌酸根的溶解浓度并且ZnO开始沉淀,则可能出现氧化锌沉积。锌酸根的溶解性与OH-浓度密切相关,沉积的一种可能的解释可能是空气电极上的充电和放电期间OH-浓度变化。空气电极上锌酸根沉积可引起电池失效。在电化学发电应用中使用阴离子(或总体上离子)交换膜是已知的。在电化学发电应用中使用的已知阴离子交换膜描述在例如Gu等,“ASolubleandHighlyConductiveIonomerforHighPerformanceHydroxideExchangeMembraneFuelCells,”ACIE,pp.1-4(2009);Hwang等,“Preparationofanion-exchangemembranebasedonblockcopolymers...”,J.MembraneSci.,140,pp.195-203(1998);和Agel等,“CharacterizationandUseofAnionicMembranesforAlkalineFuelCells,”J.PowerSources,101,pp.267-274(2001)中。这些文献描述了常规膜,例如用某些官能团(例如三芳基膦或三乙胺)衍生的氯甲基聚砜聚合物。采用离子交换聚合膜包围阴极或阳极也是已知的,且描述在例如美国专利号4,333,993和4,975,172中。已经提出在金属/氧气电池中引入离子交换材料用于多种目的。作为一个实例,美国专利号4,137,371使用离子交换膜作为锌酸根限制膜以防止锌/氧气电池中电化学活性物质的中毒。离子交换膜直接连接氧电极,并位于该电极的多孔层和锌电极之间。美国专利号3,514,336描述了一种电化学电池,其在阳极和阴极之间设置的通道中使用离子交换树脂基质,该离子交换树脂基质具有包含游离电解质的大孔通道。当用于燃料电池中时,据说这样的基质充当混 合电流载体,使用作为内渗透迁移的结果树脂不能脱水,从而提供保持均匀的电解质。离子交换材料的其它用途描述在美国专利号3,097,115中,其中使用天然沸石和合成沸石来形成燃料电池的电极。总体上,电极一般通过将电极根据期望成型,并用来自具有期望活化金属交换性质的沸石的天然存在离子进行离子交换来形成。美国专利号3,097,116公开了通过将热稳定、离子交换沸石结合到气体扩散膜来形成电极结构,所述膜可以是亲水性的或疏水性的。美国专利号5,798,180公开了由聚芳香醚例如磺化的聚(2,6-二甲基-1,4-亚苯基氧化物)组成的电池隔离体(或在电极上的涂层)。其它已知的电池隔离体包括从DuPont,Wilmington,DE市售可获得的NafionTM,(磺化的聚四氟乙烯),从Daramic,Charlotte,NC可获得的氟化的TeflonTM,聚乙烯隔离体,及从Celgard,Charlotte,NC可获得的聚丙烯和聚乙烯隔离体。包含离子交换膜作为电极一部分或作为电池隔离体的金属-空气电池、电化学装置和/或燃料电池也公开在美国专利申请公开号2004/0157101、2008/0008937、2010/0137460和2011/0027666中,所述文献的公开内容通过引用并入本文。存在提供用于金属-空气可充电池的改善的离子交换材料的需要。发明简述本发明的实施方式涉及金属-空气电池,其包括用于氧化燃料的燃料电极、被构造用以吸收和还原气态氧的空气电极、及包括包含离聚物的离子交换材料的电解质。本发明的另一个实施方式涉及用于电化学电池的离子传导介质,所述电化学电池包括燃料电极和用于吸收和还原气态氧的空气电极,所述离子传导介质包括:离子交换材料,其包含固体离聚物、盐、及任选的一种或多种添加剂。本发明的另一个实施方式涉及离子交换材料,其包括包含被1,4-二氮杂双环[2.2.2]辛烷(DABCO)衍生化的酮或砜基团的聚合物。本发明的另一个实施方式涉及电化学电池,其包括阴极、阳极和固体电解质,该固体电解质包括包含被1,4-二氮杂双环[2.2.2]辛烷(DABCO)衍生化的酮 或砜基团的聚合物。其他实施方式涉及离子交换材料,其包括被阳离子衍生化的聚合物、盐、及由阳离子(其可以与聚合物连接的阳离子相同或不同)和阴离子组成的离子对。其他实施方式包括离子交换材料(其包括被阳离子衍生化的聚合物及其盐),制备任一种上述离子交换材料的方法,及包括阴极、阳极和含有至少本文描述的离子交换材料的电解质的电化学电池。本发明的其它目的、方面和优点通过下面的详细描述、附图和所附权利要求书将变得明晰。附图简述本发明可以通过参考下面的描述以及用于示出本发明的实施方式的附图被最好地理解。图1是根据本发明的实施方式的空气电极、燃料电极和离子交换材料(膜)的示意图。图2为根据本发明的实施方式的电化学电池的示意图。详细说明根据实施方式,包括被阳离子衍生化的聚合物的离子交换材料是任何电化学电池的固体电解质组分。根据另一个实施方式,包括包含被1,4-二氮杂双环[2.2.2]辛烷(DABCO)衍生化的酮或砜基团的聚合物的离子交换材料为任何电化学电池的固体电解质组分,所述电化学电池包括但不限于燃料电池、金属-空气电池、O2隔离体、氯碱电池或电解池。根据另一个实施方式,金属-空气电池包括离子交换材料,其计划有助于解决与电池内不期望的材料传输有关的问题。根据一个实施方式,离子交换材料可以以隔离体或膜的形式提供,或者可以包括在常规隔离体之内。根据其它实施方式,离子交换材料可以提供为膜或薄膜,其应用于(例如,层压在)空气电极的表面。根据其它实施方式,离子交换材料可以与用于形成空气电极的一层或多层(例如,空气电极的活性层或气 态扩散层的一层或多层)的材料混合,使得离子交换材料直接掺入到空气电极之内。根据其它实施方式,离子交换材料可以设置在液体电解质内充当隔离体,其中液体电解质可以包括碱性溶液或离子液体。应当理解,也可以根据各种其它示例性实施方式使用前述的任意组合。例如,金属-空气电池可以在空气电极本身的一层或多层中包含掺入的离子交换材料,还可以包含在空气电极表面上提供的离子交换材料。另外,金属-空气电池可以包括空气电极表面上的离子交换材料,以及含或不含液体电解质的充当隔离体的离子交换材料。在不存在液体电解质下,离聚物可以起唯一的电解质作用,在该实施方式中的金属-空气电池将以固态起作用。在其它实施方式中,离子传导介质可以包括液体/固体混合物,其中液体电解质和固体离聚物以变化的浓度存在。其它可能性和组合对本领域那些普通技术人员在阅读了本公开之后是明晰的,所有这样的可能性都旨在包括在本发明的范围之内。存在许多与在金属-空气电池中使用固体离聚物作为电解质相关的优点。例如,非限制性可能优点是防止从阴极内部析出气体和ZnO在阴极中沉淀;将所述膜应用于阳极防止显著量的Zn阳离子迁移到本体电解质(bulkelectrolyte)中,有助于减慢阳极形状变化、致密化和树枝状短路;将固体离聚物基本上单独的用作电解质防止了对液体电解质的需要,液体电解质可以蒸发和降低电池的可用寿命;和使电池更紧凑。电化学装置可以具有任何期望的构造,包括,但不限于钮扣电池或扣式电池、方形电池、圆柱形电池(例如,AA、AAA、C,或D电池,以及其它圆柱状构造)、液流电池、燃料电池等。进一步,金属-空气电池可以是一次电池(可丢弃的,单次使用)或二次电池(可充的)电池。由于双功能空气电极的发展和使用可充的阳极材料,可再充电的金属-空气电池是可用的。可以通过将本文描述的离子交换膜掺入金属-空气电池中获得多种优点。例如,离子交换膜的存在可以有利地减少或防止Zn(OH)42-朝着空气电极迁移,从而减少形成可引起电池内金属电极和空气电极之间的 短路的树枝状晶体的倾向。限制锌酸根扩散可以通过Zn电极本体提供更均匀的沉积、较少的表面反应,和因此树枝状晶体和形状变化的较小趋势。离子交换膜也可缓解或防止催化剂或杂质从空气电极浸滤到金属电极中,因此降低金属电极经历随着时间可以降低电池性能的不期望析气的趋势。根据某些实施方式,离子交换膜也可有助于防止击穿空气电极,并有助于帮助维持空气电极处的稳定的三相边界。出于本申请的目的,低温离子液体定义为在1atm下熔点等于或低于150℃的离子液体。这些低温离子液体也可以包括被称为室温离子液体的物质,所述室温离子液体定义为在1atm下熔点等于或低于100℃的离子液体。离子液体也称为液体盐。由定义可知,离子液体主要由盐的阴离子和阳离子组成。虽然离子液体本身相对于离子液体中存在的一种或多种其它可溶性产物(例如添加剂或由电池操作产生的反应副产物)而言可以是溶剂,但是离子液体并不需要使用溶剂来溶解所述盐,因为该液体本身是“自溶解的”,即其是电解盐的阴离子和阳离子通过自身特性的液体,而不需要使用单独的溶剂来溶解该盐。然而,虽然低温或室温离子液体通过其在1atm下的相应熔点定义,但在某些实施方式中,电池可能在具有不同压力的环境中操作,因此熔点可以随操作压力而变化。因此,对1atm下的熔点的指称是用于定义这些液体的参考点,并不暗示或限制其在操作中的实际使用条件。在一些非限制性实施方式中,可以将在一些情境中可以被视为溶剂的物质以相对少量加入离子液体中,用于增加溶质在离子液体中的溶解度,例如加入的添加剂或通过操作电池在离子液体中产生的副产物,或者用于提供非溶剂功能,例如促进某些电化学反应或离子的传输。因此,使用离子液体不完全排除可以在其他情境中被视为溶剂、或者充当相对于溶质在离子液体中的溶剂的物质的存在,但是因为不需要溶剂来溶解离子液体,其可以以与常规电解质盐所要求的用于溶解盐本身的大量溶剂(例如水性电解质溶液)相比基本上更少量使用。实际上,在一些非限制性实施方式中,有可能不使用添加剂溶剂。在一些非限制性实施方式中,燃料和空气电极之间的离子传导介质可以是纯低温离子液体,即其由离子液体组成。在其它非限制性实施方式中,其可以基本上由离子液体组成,意味着出于本申请的目的,其可以包括离子液体和不会实质性地影响其作为离子液体特性的一种或多种其它物质。当然,在由离子液体组成的实施方式中或基本上由离子液体组成的实施方式中允许存在任何反应副产品或离子液体中的离子,因为离子液体的本质会促进这样的离子和/或副产物的传输和/或形成。术语“无溶剂”或“不含溶剂”可用于表征离子液体,该术语应当理解为(a)仅仅排除出于溶解离子液体的目而提供的大量溶剂,而不排除离子液体本身,该离子液体可充当另一种物质(例如,添加剂或电池反应副产物)的溶剂;和(b)不排除存在一种或多种添加剂,以提高离子液体的离子传输功能、支持电池的电化学反应和/或提高溶质在离子液体中溶解性,即使这样的添加剂理论上可以在其它情境中或相对于离子液体中的溶质被视为溶剂,但是其功能不是出于溶解离子液体的目的(例如,在一些实施方式中,10-100ppm范围的水可以通过增加用于支持氧还原反应的质子可用性来促进电化学反应,但是水并不起离子液体的溶剂作用,尽管其可以在其它类型的电解质即水性电解质中起到溶剂的作用)。离子液体一般指形成包含离子的稳定液体的盐。也就是说,离子液体是充分解离的,其基本上由负离子和正离子构成。因此,离子液体固有地导电。进一步,离子液体具有可忽略的蒸气压力、低的粘度、宽的液体范围(最高达400℃)、高的热稳定性和大的电化学窗口(>5V)。由于这些特性,在电化学电池的充电/放电周期期间,离子液体通常不会挥发或者被消耗。离子液体一般存在两种形式:质子型和非质子型。质子型离子液体具有可以被氧化或被还原或者可以与负离子例如还原的氧配位的可用质子。质子型IL的一些实例由阴离子四氯铝酸根、双三氟甲基磺酰亚胺离子、甲基磺酸根、硝酸根和醋酸根,以及阳离子三乙基铵、二乙基甲铵、二甲基乙铵、二甲基乙基三氟甲磺酸铵、乙基铵、α-甲基吡啶鎓、吡啶鎓,以及1,8-双(二甲基氨基)萘、2,6-二叔丁基吡啶,以及胍 (guanadine)的衍生物的组合所合成。然而,非质子型离子液体一般不具有质子活性。非质子型室温离子液体的一些实例由选自氯离子(Cl-)、六氟磷酸根(PF6-)、碘离子、四氟硼酸根、双三氟甲基磺酰亚胺离子(C2F6NO4S2-)(TFSI)、三氟甲基磺酸根(CF3O3S-)的阴离子,以及选自咪唑鎓、锍、吡咯烷鎓、季铵化铵或磷鎓及它们的衍生物的阳离子的组合所合成。尽管缺乏质子活性,非质子型离子液体可以包含质子。例如,非质子型离子液体可以包含至少一种阳离子,其具有至少一个强结合于其上的质子。存在许多其它的离子液体的选项,并且这些实例的列举不旨在以任何方式进行限制。本领域公开的任何离子液体都可用于所述实施方式中。合适的离子液体公开在例如美国专利号4,892,944、5,826,602、5,865,513、7,605,297、7,863,458和7,960,061中,所述文献的公开内容以其全部通过引用并入本文。此外还有公开在2010年9月16日提交的61/383,510;2010年6月15日提交的61/355,081;2010年5月12日提交的61/334,047;2010年4月29日提交的61/329,278;2009年5月11日提交的61/177,072,和2009年12月7日提交的61/267,240的共同未决的临时申请中的任何离子液体,以及描述在2011年5月11日提交的13/105,794;2011年4月28日提交的13/096,851;2011年4月13日提交的13/085714;和2010年5月10日提交的12/776,962美国专利申请中的任何离子液体。使用本文提供的指导方针,本领域技术人员将能够制备包含离子液体和本文描述的离子交换膜的电化学电池。在一个实施方式中,离子交换材料包括被阳离子衍生化的聚合物主链,以提供离子交换材料,更特别地,阴离子交换材料能够起到电解质作用,以传输阴离子跨过其表面。多种聚合物的任一种都可用作主链,包括例如一种或多种选自下述的聚合物:聚醚、聚砜、聚醚醚酮(PEEK)、聚苯基砜、聚苯、聚苯乙烯、共聚物、一种或多种聚合物的掺合物或与聚乙烯醇的掺合物、与非离子型聚合物的掺合物、交联基质、及其混合物。根据一个实施方式,所述聚合物选自包括酮和/或砜基团的一种或多种聚合物、以及其共聚物、掺合物、交联聚合物、及混合物。适用于衍生化前述聚合材料的阳离子包括可用作在电化学电池中的电荷转移中心的任何已知阳离子、或其混合物及其组合。合适的阳离子包括,例如一种或多种选自下述的阳离子:四烷基铵、四烷基磷鎓、三烷基锍、咪唑鎓、吡啶鎓、吡咯烷鎓、吗啉鎓、膦鎓、磷杂鎓、环磷鎓、哌啶鎓、哌嗪鎓、奎宁环鎓、二环铵、咪鎓、胍鎓、链烷醇铵、单烷基铵、二烷基铵、三烷基铵、咪唑鎓、吡唑鎓、三唑鎓、噻唑鎓、噁唑鎓、吡啶鎓、咪唑并吡啶鎓、咪唑并嘧啶、单烷基膦鎓、二烷基磷鎓、三烷基磷鎓、单烷基磷鎓、二烷基磷鎓、三烷基磷鎓、三烷基磷鎓、磷单铵、磷二铵、磷三铵、噻吩鎓、二氢噻吩鎓、四氢噻吩鎓、二烷基氧化锍、二氮杂双环化合物、及其组合。使用本文描述的技术,可以用一种或多种上述阳离子衍生化上述聚合物。本领域技术人员在阅读本说明书时,将能够制备包含被阳离子衍生化的聚合物的离子交换材料。根据实施方式,离子交换材料包括包含被1,4-二氮杂双环[2.2.2]辛烷(DABCO)衍生的酮或砜基团的聚合物。本发明人已经发现多种聚合物,特别是具有酮和砜基团的聚合物,可以容易地在聚合物链上的不同于包含酮和砜基团(或包含双键氧或其它双键——如在聚苯或聚苯乙烯中——的其它基团)的位点上被氯化或氯甲基化。更密集地氯化或甲基氯化聚合离子交换结构嵌段的能力提供了更多的阳离子代替氯的位点,所述阳离子例如1,4-二氮杂双环[2.2.2]辛烷(DABCO)、3-二甲基氨基-2,2-二甲基-1-丙醇(炔醇胺)和1,1,2,3,3-五甲基胍(PMG),从而用允许阴离子(例如,氢氧根离子)移动跨过所述膜同时排除阳离子(例如,锌和锌酸根)以相反的方式移动的材料衍生化所述聚合结构嵌段。利用这种被DABCO衍生化的膜的电化学电池的一个示例性实施方式显示在图1中。如图1所示,离子交换膜——SAX安置在空气电极(或阴极)和金属电极(或阳极)之间。,空气中氧在阴极处还原,产生了氢氧根离子(OH-),其由于聚合主链上存在衍生的DABCO阳离子而能够移动跨越离子交换膜,但是锌或锌酸根离子不会从阳极移动跨越至阴极侧。因此,离子交换膜防止在电池的阴极侧形成树枝状晶体及其它不期望的离子 形成,并从而,保护了其功能和效用。如之前所述,离子交换膜可以结合电解质使用,电解质可以安置在所述膜的孔之内或安置在所述膜的任一侧(在此情况下,所述膜起到隔离体的作用),且任选地结合隔离体。图2中以数字18显示的电解质可以是氢氧化钾或其它氢氧根离子-传导材料、以及离子液体。如图2中一般所示,根据一个示例性的实施方式,电解质18基本上安置在金属电极12和空气电极14之间。优选地,电解质18包括在聚合物交换材料的孔之内,该两者一起在本文中称为“电解质18”。电解质18(例如,氢氧化钾(“KOH”)或其它氢氧根离子-传导介质)没有被电池10内的电化学反应所消耗,但是被构造成用于提供在放电期间将来自空气电极14的氢氧根离子(“OH-“)传输至金属电极12,并且在电池10是二次体系时,用以提供在充电期间将来自金属电极12的氢氧根离子传输至空气电极14。电解质18可以安置在金属电极12的孔的一些之中,和空气电极14的孔的一些之中。根据其它示例性的实施方式,电解质的分布和位置可以变化(例如,电解质可以设置在金属电极的孔中,而非空气电极的孔中,等)。根据示例性的实施方式,电解质18为用于保持金属电极和空气电极之间高离子导电率的碱性电解液。根据其它示例性的实施方式,电解质可以是具有高离子导电率和/或高的氧还原/析出和金属氧化/还原反应速率的任何电解质(例如,NaOH、LiOH等)。根据再其它实施方式,电解质可以包括给予目标应用(例如海洋/军事用途等)足够电导率的盐水或其它盐-基溶液。最优选地,如果使用,电解质为离子液体。离子交换材料优选地由具有不同厚度的聚合膜组成,所述聚合膜可以用作隔离体、与隔离体一起使用、与电解质一起使用或具有安置在其孔中的电解质材料,或者可以安置在空气电极12或金属电极14周围。在一个实施方式中可用的离子交换膜由包含被DABCO衍生化的砜或酮基团的聚合物主链组成,其中DABCO连接至远离砜或酮部分的苯基上。一种优选的离子交换膜为DABCO-衍生化的聚氯甲基砜。用DABCO对聚氯甲基砜的衍生化优选地根据下述反应进行:含有氯甲基基团的聚砜是已知的阳离子交换剂,如例如描述在美国专利号5,128,378中,所述文献以其整体通过引用并入本文。由该已知的离子交换膜开始,可以在合适的反应条件下,在二甲基甲酰胺的存在下,通过使氯甲基聚砜与DABCO接触来将所述膜用DABCO衍生化。例如,DABCO-衍生化的聚砜可以通过如下方法制备:在约25℃至约125℃、或约45℃至约95℃、或约50℃至约80℃范围内的温度下,将所述膜浸入含有过量DABCO(例如,1wt%至约25wt%)的DMF溶液中任何情况下约1小时至约48小时、或约5小时至约35小时、或约12小时至约20小时。可以除去未反应的DABCO。可以采用聚醚醚酮(PEEK)进行类似的反应,其中首先初始地将PEEK氯甲基化,然后用DABCO衍生化,如下所示:作为衍生包含酮和/或砜的聚合主链的替代方式,可以在类似于上述的合适条件下使双酚A进行氯甲基化,得到密集氯甲基化的聚砜或聚醚醚酮,然后用DABCO衍生化,如下述反应顺序所示:双酚A至衍生化的PEEK双酚A至衍生化的聚砜在上述方程中,n为可以在约1至约100,000、或约10至约50,000、或约25至约10,000的广泛地变化的整数。使用双酚A来衍生化含酮或砜的聚合物提供了更密集衍生化的交换聚合物,并从而提供更多经由侧链(pendant)季铵化DABCO部分跨过所述聚合物主链的离子传输。这样的密集衍生化的膜改善了效率和性能,以及可归因于使用固体电解质材料的其它期望的特征。使用如上所述用DABCO衍生化包含酮或砜基团的聚合物的相同方法,可以将其它阳离子合适地连接到其它聚合物主链上。例如,聚苯基砜、聚苯或聚苯乙烯可以用选自下述的阳离子衍生化:四烷基铵、四烷基磷鎓、三烷基锍、咪唑鎓、吡啶鎓、吡咯烷鎓、吗啉鎓、膦鎓、磷杂鎓、磷杂鎓、哌啶鎓、哌嗪鎓、奎宁环鎓、二环铵、咪鎓、胍鎓、链烷醇铵、单烷基铵、二烷基铵、三烷基铵、咪唑鎓、吡唑鎓、三唑鎓、噻唑鎓、噁唑鎓、吡啶鎓、咪唑并吡啶鎓、咪唑并嘧啶、单烷基膦鎓、二烷基磷鎓、三烷基磷鎓、单烷基磷鎓、二烷基磷鎓、三烷基磷鎓、三烷基磷鎓、磷单铵、磷二铵、磷三铵、噻吩鎓、二氢噻吩鎓、四氢噻吩鎓、二烷基氧化锍、二氮杂双环化合物、及其组合。可以通过与烷基氯、优选甲基氯反应来氯化所述聚合物主链进行衍生化,形成氯甲基衍生化的聚合物,然后在合适的反应条件下,在二甲基甲酰胺存在下,使该氯甲基聚合物与所述阳离子接触。例如,五甲基胍鎓-衍生化的聚合物可以通过如下方法制备:在约25℃至约125℃、或约45℃至约95℃、或约50℃至约80℃范围内的温度下,将所述聚合物膜浸入含有过量1,1,2,3,3-五甲基胍(PMG)的DMF溶液中在任何情况下约1小时至约48小时、或约5小时至约35小时、或约12小时至约20小时。未反应的PMG可以除去。在另一个实施方式中,将聚氯甲基砜用3-二甲基氨基-2,2-二甲基-1-丙醇(炔醇胺)衍生化,得到具有下式的聚合物交换材料:其中n为约1至约100,000的整数。可以采用聚醚醚酮(PEEK)进行类似的反应,其中初始地将PEEK氯甲基化,然后如上关于DABCO所述用PMG进行衍生化,得到下述聚 合物交换材料:其中n为约1至约100,000的整数。可以使用如上所述的双酚A至衍生化的聚砜和PEEK的相同方法来制备下述被炔醇胺衍生化的聚合物交换材料:其中在上述两种聚合物交换材料中,n为约1至约100,000的整数。在另一个实施方式中,将聚氯甲基砜用五甲基胍衍生化,得到具有下式的聚合物交换材料:其中n为约1至约100,000的整数。本发明人已经发现通过首先使四甲基胍(TMG)与氯化聚合物例如氯甲基聚砜(CMPSU)反应,形成中性聚合物-联接的TMG,可以将PMG附加至聚合物主链上。然后,由于加入甲基,该中性聚合物-联接的TMG可以与二烷基硫酸酯反应,形成聚合物-联接的PMG,并且在氮上形成正电荷。反应顺序如下进行:可以采用聚醚醚酮(PEEK)进行类似的反应,其中初始地将PEEK氯甲基化,然后如上所述用TMG衍生化,之后用二烷基硫酸酯反应,得到下述聚合物交换材料:其中n为约1至约100,000的整数。可以使用上述的双酚A至衍生化的聚砜和PEEK的相同方法,与制备聚合物-联接的PMG(氯化聚合物,与TMG反应,然后与二烷基硫酸酯反应)的方法联合,来制备下述用PMG衍生化的聚合物交换材料:其中在上述两种聚合物交换材料中,n为约1至约100,000的整数。以类似的方法,任意数量的阴离子可以接枝到本文描述的聚合物主链上,并用作阳离子交换离聚物。例如,多种聚合物可以改性为在聚合物链上的与包含酮和砜基团(或包含双键氧或其它双键(如在聚亚苯基或聚苯乙烯中)的其它基团)的位点分开的位点包含可替代的带正电荷物质。更密集地带电的能力提供了用阴离子替代带正电荷物质的更多位点,所述阴离子例如磷酸根、卤代磷酸根尤其是六氟磷酸根、烷基磷酸根、芳基磷酸根、硝酸根、硫酸根、硫酸氢根、烷基硫酸根、芳基硫酸根、全氟化烷基-和芳基硫酸根、磺酸根、烷基磺酸根、芳基磺酸根、全氟化烷基-和芳基磺酸根尤其是三氟甲基磺酸根、甲苯磺酸根、高氯酸根、四氯铝酸根、七氯二铝酸根、四氟硼酸根、烷基硼酸根、芳基硼酸根、酰胺尤其是全氟化酰胺、二氰胺、糖精酸根、硫代氰酸根、羧酸根、醋酸根优选三氟醋酸根、和双(全氟烷基磺酰基)酰胺阴离子、氯离子(Cl-)、氢氧根(OH-)、六氟磷酸根(PF6-)、碘离子、其它卤离子、四氟硼酸根、双三氟甲基磺酰亚胺离子(C2F6NO4S2-)、三氟甲烷磺酸根(CF3O3S-CF3SO3-;TfO-)、二氰胺离子(N(CN)2-;dca)、苯甲酸根、乙酰磺胺根、糖精酸根(saccharinate)、甲磺酸根、羟乙基磺酸根([ise])、牛磺酸根([tau])、3-吗啉基丙烷磺酸根(MOPS)、4-(2-羟乙基)-1-哌嗪丙烷磺酸根(HEPPS,EPPS)、1,4-哌嗪二乙烷磺酸根(PIPES)、N-(2-乙酰氨基)-2-氨基乙烷磺酸根(ACES)、N-环己基-3-氨基丙烷磺酸根(CAPS)、4-(2-羟乙基)-1-哌嗪乙烷磺酸根(HEPES)、2-[(2-羟基-1,1-双(羟甲基)乙基)氨基]乙烷磺酸根(TES)、N-[三(羟甲基)甲基]-3-氨基丙烷磺酸根(TAPS)、3-(N- 三[羟甲基]甲基氨基)-2-羟基丙烷磺酸根(TAPSO)、及其混合物。阴离子和带正电荷物质的这种取代使得允许阳离子移动跨过所述膜,而排除阴离子以相反方式移动的材料来衍生化所述聚合结构嵌段。本文描述的聚合物交换材料可用作电池优选金属-空气电池中唯一电解质,或者其可以与液体电解质结合使用。任何液体电解质都可以与交换膜结合使用,但是离子液体是优选的。在使用离子液体电解质的锌-空气电池中,水的含量通常被控制以最小化析氢、控制电镀形态、和保持电池内恒定的水的活性。当使用本文描述的聚合物交换材料时,尤其是当在没有另外电解质下单独使用时,可以进一步均匀地控制水含量。放电时,Zn金属在燃料电极处被氧化,并溶剂化或络合到溶液中,将电子释放到电路中。同时,分子氧在空气电极处被还原,消耗掉在阳极释放的那些电子。在达到锌离子的溶解度时,ZnO被沉淀在电池内。充电时,Zn2+离子在负(燃料)电极处被还原。同时,在空气电极发生导致分子氧析出的氧化反应。图1图示聚合交换膜如何起到防止Zn2+离子迁移至阴极(空气)电极的作用。在水性碱金属-空气电池充电期间,氢氧化物在空气电极处被氧化,形成水并释放O2气体,同时氧化的锌物质在金属电极处被还原为锌金属。法拉第效率或库仑效率为电子(电荷)在电化系统中转移的效率。效率损失通常是由参与非生产性反应和短路的电子引起。充电期间在金属电极处,来自水的还原的析氢是这种非生产性反应的一个实例。这种寄生反应降低了库仑效率。然而,因为锌在水性电解质中具有大的析氢反应的超电势,可看到库仑效率在95%的级别。可用于优选的实施方式中的某些离子液体允许在任何情况下0.1-50%(或甚至更高)水进入锌-空气离子液体电池中,其支持放电期间在空气电极处的氧还原反应(ORR)。另外,离子液体之内的少量水使熟知的超氧化物物质(O2●-)不稳定,所述超氧化物在高非质子型介质、高pKa共轭酸和碱性介质中经由歧化反应而生成。使用聚合物离子交换膜本身,而不使用电解质例如离子液体,稳定和/或防止了超氧化物物质的 产生,以及限制上面讨论的水在锌上的析氢。在金属-空气电池中,金属为燃料。也就是说,在放电期间,金属在阳极被氧化,提供可用于电气做功的电子。该氧化反应可以由下述方程表示:(3)金属→金属n++(n)e-金属燃料可以是任何类型,并且可以被电沉积、吸收、物理沉积,或者以其他方式提供在该燃料电极之上或构成该燃料电极。燃料可以是任何金属,例如,包括其合金或氢化物。例如,燃料可以包括过渡金属、碱金属、碱土金属和其它或“贱(poor)”金属。过渡金属包括但不限于锌、铁、锰和钒。最常见的碱金属是锂,但是可以使用其它碱金属。其它金属包括但不限于镁、铝和镓。如本文使用的术语金属燃料泛指包含金属的任何燃料,包括金属单质、键合在分子或络合物中的金属,其包括氧化物、金属合金、金属氢化物等。在某些实施方式中,燃料电极可以由作为电极体自身的金属燃料而形成。燃料电极可以具有任何构造或结构。例如,燃料电极可以是具有三维孔网络的多孔结构、网筛、多个彼此分离的网筛或任何其它适合的电极。燃料电极包括集电体,其可以为单独的元件,或者在其上接收燃料的本体可以是电子导电的并且因此也是集电体。在一个实施方式中,燃料电极被层压、键合或者附着到提供燃料电极外表面的背衬上。该背衬可以是液体不可渗透的或者对于离子液体基本上不可渗透的,以防止离子液体经由燃料电极外表面向外渗透通过燃料电极。更优选地,该背衬对于空气特别是氧或其它氧化剂也是不可渗透的,以防止任何不期望的寄生反应,例如在放电期间电极上发生的氧化剂在燃料氧化存在下的还原。有关金属燃料和燃料电极的更多细节可以在美国专利申请号12/385,217,12/385,489,12/885,268,12/901,410,12/631,484,12/549,617,13/019,923,13/028,496,61/193,540,61/301,377,61/323,384,61/329,278,61/365,645,61/394,954,61/358,339,61/383,510和61/243,970中找到,上 述文献的每一个的公开内容以其整体通过引用并入本文。在放电期间,空气电极处的氧被还原,消耗电子。存在若干可能的氧还原机制。例如,氧还原反应可以经由下面讨论的三种机制之一发生。然而,其它机制可以发生,取决于所选择的化学体系(离子液体、电极材料)。第一种可能的且非限制性机制是四电子氧还原反应(ORR),其中产物是完全还原的氧二价阴离子。该四电子氧还原反应可以由如下方程来表示:(4)O2+2H2O+4e-→4OH-取决于该体系的具体化学,该反应可以形成可溶性产物或者局部性地导致不溶性金属氧化物的形成。在该反应中,所释放的阴离子可以用于介导接下来的阳极反应。相对于其它氧还原机制,四电子氧还原反应具有增加能量密度以及每个氧分子提取最大数量的电子的优点。第二种可能的且非限制性机制是二电子过氧化物路线。该机制的示例可以由如下方程来表示:(6)Zn2++O2+2e-→ZnO2该机制具有相对低的过氧化物反应超电势的优点。该机制相对于第一种机制还往往具有增强的可再充性。然而,该二电子过氧化物机制相对于四电子工艺导致氧电极电池的较低能量密度。第三种可能的且非限制性机制是混合的二电子/四电子ORR,其利用某些异价阳离子的还原能力。该机制的示例可以由如下方程表示:(7)Mn2++O2+2e-→MnO2该机制中的细微之处是产物涉及通过异价金属的还原能力产生的完全还原的O2-物质。在该实例中,Mn2+形成右侧所示的Mn4+的状态。该机制由于异价阳离子的还原能力具有较低超电势的优点。而且,异价金属可以用于制造更高效的电池。然而,该混合的二电子/四电子机制相对于四电子工艺导致较低的能量密度电池。.空气电极通常是由聚四氟乙烯(PTFE)材料例如的所制成的多孔结构。优选地,空气电极材料对于电解质具有高度的疏溶剂性。空气电极内的疏溶剂性起到“防潮”(即防止液体电解质离开电池)和改善空气中氧与多孔结构内的氧气还原反应催化剂接触的双重作用。由于空气-催化剂-电解质的三接点连线长度的增加,所以疏溶剂性增强了与催化剂的接触。三接点连线长度的增加减少了传输限制。虽然强疏溶剂特性是有利的,然而,在电极中包括亲溶剂组分改善了三接点的弯曲度,从而改善了表面反应位置的密度。图2示出了根据本发明的实施方式的电化学电池(“电化学电池”),整体以10表示。如下面所示和描述,电化学电池10包括多个电极,该多个电极包括第一电极12和第二电极14。在其它实施方式中,电化学电池10的第一电极或第二电极可以通过非单电极的构造来提供。例如,电化学电池可以具有任何期望的构造,包括但不限于钮扣电池或扣式电池、方形电池、圆柱形电池(例如,AA、AAA、C,或D电池,以及其它圆柱状构造)、液流电池、燃料电池等。进一步,电化学电池可以是一次电池(可丢弃的,单次使用)或二次电池(可充的)电池。由于双功能空气电极的发展和使用可充的阳极材料,可充电电池是可用的。在图2中所示的非限制性实施方式中,第一电极12是阴极,并且更具体地是空气阴极,并且在下文中将被称为空气电极12。第二电极14是阳极,并且在下文中将被称为金属电极14。在一个实施方式中和如下所述,电化学电池10可以通过金属电极14上的燃料的氧化半反应与空气电极12上的氧化剂20的还原半反应并行(即基本上同时进行)来产生电。所示的实施方式并不旨在以任何方式限制。空气电极12和金属电极14优选地被隔开以在其间形成间隙16。聚合物交换材料(或阴离子交换膜)单独或与室温离子液体(RTIL,一般以18表示)组合可以沿着空隙16存在,以致电解质或聚合物交换材料18可以同时接触空气电极12和金属电极14。出于本讨论的目的,参考数字18可以仅指电解质18,条件是电解质18可以仅仅由聚合物交换材料或液 体电解质(如本文讨论的离子液体或水性电解质)与聚合物交换材料的组合组成。在实施方式中,应当理解,电化学电池10可以以任何方式定向,并且如果使用流动液体电解质,则该电解质可以以除由图2中箭头所示出的方向之外的方向流动。因此,任何方向上的参考均以如图2中所示的方向来参照,并且不旨在将工作实施方式限制到任何特定的方向。在其它实施方式中,电解质18可以是静态的,且完全不流动,例如当电解质18仅仅由聚合物交换材料组成时。电解质18可以在空气电极/电解质界面24上与空气电极12接触。电解质18可以在金属电极/电解质界面26上与金属电极14接触。在优选的实施方式中,仅仅聚合物交换材料被用作固体电解质,因此,该电解质不流动。也就是说,电池中不包括用于强制流动的机制。如果电解质18包括RTIL,则在某些实施方式中,优选RTIL包含水以促进电化学电池10之内发生的电化学反应(多次循环中放电和充电)。优选地,离子液体包括的水量为约15%至约50%、更优选约20%至约40%、最优选约25%至约30%。在不包括需要水来促进电化学反应的阴极和/或阳极的电化学电池10中,优选RTIL包含少于约25%的水、更优选少于约20%、甚至更优选少于约15%的水。本领域技术人员使用本文提供的指导方针,将能够确定根据实施方式制备的RTIL中所包括的水的合适量。如上面所提及,还原半反应可以发生在空气电极12上。在一个实施方式中,氧化剂20可以通过空气电极12上的还原半反应被还原。出于非限制性说明的目的,来自金属电极14的电子可以流到外部电路22(即负载)并且返回到空气电极12以促进氧化剂20的还原。氧化剂20优选在空气电极12上的氧化剂还原反应位置21被还原。在一个实施方式中,采用催化剂以促进在氧化剂还原反应位置21的氧化剂还原半反应。空气电极12可以包括催化剂材料(例如氧化锰、镍、热解钴、活性炭、银、铂)或对氧化剂的催化还原具有高氧还原活性的任何其他催化剂材料或材料混合物,这将在下面进行讨论。在一个实施方式中,空气电 极12可以是多孔的,并且具有高表面积的多孔体可以包含催化剂材料。在一个实施方式中,空气电极12可以是被动的或者“呼吸型”空气电极12,其被动地(例如通过窗口或者开口)暴露于氧化剂源(通常是存在于周围空气中的氧),并且吸收氧化剂20用于在电化学电池10的反应中的消耗。也就是说,氧化剂20将从氧化剂源渗透进入空气电极12中。因此,氧化剂20不需要被主动地泵入或者以其他方式导向空气电极12,例如经由入口。空气电极12的任何部分(氧化剂20通过其被吸收或以其他方式渗透或接触空气电极12)可以被统称为“输入”。术语输入可以广泛地包括将氧化剂递送到空气电极12以用于在空气电极12上在氧化剂还原反应位置21的氧化剂还原半反应的所有方式。通过非限制性的说明,空气电极12可以是具有暴露于环境空气的外表面的气体可渗透的电极,使得氧化剂20包含渗透进空气电极12的氧。类似地,空气电极12可以包含在空气电极12的外表面的气体可渗透且液体不可渗透的屏障膜,以允许氧化剂20经由空气电极12的外表面的渗透以及防止RTIL(如果使用的话)流过空气电极12的外表面。在一个实施方式中,空气电极12可以是内表面被液体可渗透层覆盖的多孔体,RTIL(如果使用的话)可以通过该液体可渗透层使得RTIL可以接触多孔体。电解质18和空气电极12之间的关系可以影响电化学电池10的总能量密度。出于这个原因,可以仔细选择基于空气电极12的电解质18的蒸汽压力和表面张力特性。比如,在一个实施方式中,空气电极12可以排斥所述RTIL(如果使用的话),以致它可以防止电解质18毛细作用,即,以毛细管状方式流动通过空气电极12。在另一实施方式中,可以设计空气电极12具有孔隙以吸收RTIL,使得其使RTIL暴露于更多的空气电极12表面积,目的在于能够在空气电极12上发生期望的电化学反应。空气电极12可以在氧化剂还原反应位置21负载催化剂装饰(decoration)以提高反应效率。在一个实施方式中,可以用金属离子(其可以增强在空气电极12上在氧化剂还原反应位置21催化氧化剂还原反应的催化剂活性)装饰催化剂。空气电极12可以具有高离子导电率以 提供反应物和从空气电极12去除氧化剂还原反应的产物。在一个实施方式中,空气电极12可以具有高导电特性以从外部负荷22携带电子到氧化剂还原反应位置21。可以进一步定义空气电极12和电解质18特性。在一个实施方式中,金属-氧化物副产物28可以形成于金属电极14。而还原的氧化剂离子在含水的电解质中配位(即将电子贡献)至水分子以形成水、过氧化物和/或氢氧化物,从而增加蒸汽压力和腐蚀问题。在这个非限制性的实施方式中,电解质18可以促进在空气电极12上的氧化剂还原反应和还原的氧化剂离子传导到金属电极14。为了支持这个结果,电解质18可以含有与还原的氧化剂离子相互作用的可溶的物质,尤其是与典型地是质子型的RTIL一起使用时。电解质18也可以还原的氧化剂离子迁移到金属电极14时支持它们。通过非限制性的说明的方法,还原的氧化剂离子的迁移可以指还原的氧化剂离子经由对流运输或传导运输或扩散运输的运输。电解质18也可以支持保持在金属电极14上的氧化的金属-燃料离子。在这样做时,电解质18促进还原的氧化剂离子和氧化的金属离子之间的反应以产生金属-氧化物副产物28。在一个实施方式中,金属-氧化物副产物28可以储存在金属电极14。在金属-氧化物副产物28储存在金属电极14的一个实施方式中,该实施方式最好被用作一次(非可充)电池,因为氧被储存于金属电极14,并且对于析氧电极——其氧化被还原的氧物种——不是局部可用的。金属氧化物在空气电极上的局部储存被如下的空气电极12促进:其在至少与离子液体接触的区域具有足以在空气电极12的主体内容纳氧化物的孔径。即,孔径可以取决于氧化物的大小。这种孔的网络可以增加空气电极12的储存容量。在一个实施方式中,氧化剂源是环境空气,并且氧化剂20是氧。在一个实施方式中,作为氧化剂20的氧可以在空气电极12被还原以形成还原的氧离子。在一个实施方式中,可以从用于再生电化学电池中的析氧回收系统供应氧。本文中可用的本发明实施方式的电化学电池的其他实例示于2009年8月28日提交的美国专利申请12/549,617中,其全 部内容通过引用并入本文。本发明的电解质可以用于其它电池构造。例如,可选的电池构造包括美国专利申请号61/267,240和12/776,962中示出的紧卷绕电池(compactwoundcell),其全部内容通过引用并入本文。由于蒸发、再充期间的水电解以及自放电,水性电解质对于金属空气电池而言可以是有问题的。这些问题不仅导致电解质的损失而且导致可充电池循环效率的降低。使用聚合物交换材料作为电解质(单独或与离子液体组合)减少或者可以消除这些问题中的一些问题。然而,即便使用离子液体电解质,水的存在可能引起有毒气体的释放和/或引起自放电。另一方面,离子液体可以包括少量的水。例如,已经发现10-100ppm的水性量改善了非质子型体系中的氧还原而不会引起不可接受的自放电或者有毒气体的释放。因此,一些优选的实施方式包括含在任何情况下约5至约100,000ppm的水、更优选约7至约1,000ppm的水、最优选约10至约100ppm的水的离子液体。在一些实施方式中,包括固体离聚物的离子交换材料可以含有一种或多种盐,例如加入到固体离聚物中作为添加剂的盐,和任选另外的添加剂。所述盐可以包括无机盐或有机盐,其可以作为掺杂剂添加剂加入。盐的非限制性实例包括下述盐,也可以使用其它盐。由于多种原因,在固体离聚物中使用盐被认为是有益的,包括提供下述功能的任一种或多种:增加离子导电率、通过经由Zn离子络合提高Zn溶解性而防止钝化、和尤其是在F-的情况下充当增加可用于电化学的水量的保湿剂。所使用的量可以低于或事实上远低于图表中所述最 大量,可以使用在痕量和所述最大量之间的范围。合适的添加剂包括在电化学领域中可用的任何已知添加剂,例如具有中性静电电荷的有机分子。非限制性实例包括邻苯二甲酸酯、己二酸酯、癸二酸酯、马来酸酯、苯甲酸酯、磺酰胺类、有机磷酸酯和聚丁烯。在其它实施方式中,离子交换材料可以含有未束缚到聚合物主链的游离阳离子,其被认为以类似于上述盐的方式起作用。也可以加入另外的添加剂。游离阳离子可以与束缚到聚合物上的阳离子相同或不同,或者可以含有束缚到聚合物上的阳离子和一种或多种上表中所列的阳离子的组合。含有游离阳离子的离子交换材料可以通过首先使用任一种上述技术制备由被阳离子衍生化的聚合物组成的固体离子交换材料来制备。然后,可以将所述固体离子交换材料溶于合适的溶剂中,优选地通过研磨固体和溶于溶剂中来促进。合适的溶剂包括例如醇、二-取代的酰胺、亚砜类和砜类。含有任一种本文描述阳离子(包括束缚到聚合物主链上的阳离子)及其混合物的离子液体,其可以加入到溶剂混合物中,使得游离或“未束缚的”阳离子存在于所述混合物中。可以使用加入阳离子的任何方法,包括加入离子液体,或加入含阳离子的离子固体。也可以向所述混合物中加入添加剂。然后,该混合物可以用于使用本领域已知的技术形成固体膜或涂层,以提供含有聚合物、游离阳离子和任选添加剂的固体离子交换材料。然后,该固体膜或涂层可以用作固体电解质,或者作为电极上的涂层或一或多个层。在本文中所引用的所有出版物、专利和专利申请以其整体通过引用并入本文。不定冠词在本文中用于指一个或多于一个(即,至少一个)该冠词的语法对象。例如,“聚合物树脂”是指一种聚合物树脂或多于一种聚合物树脂。本文所引用的任何范围都是包括性的。在整个说明书中使用的术语“基本上”和“约”用于描述和计量小的波动。例如,它们可以指 小于或等于±5%,例如小于或等于±2%,例如小于或等于±1%,例如小于或等于±0.5%,例如小于或等于±0.2%,例如小于或等于±0.1%,例如小于或等于±0.05%。提供了前述实施例仅用于说明本发明的示例,并且不应该被认为是限制性的。相反地,本发明涵盖了在所附权利要求的精神和范围之内的所有修改、替换、变更和等效。。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1