与其他生物医学成像方法,如X-射线计算机断层显像(CT)或核磁共振成像(MRI)结合的断层显像正电子发射断层显像(PET)是一种在用于可视化心脏病学、神经病学、肿瘤学或免疫学之体内过程的核医学中常用的诊断分子成像方法。
最广泛使用的放射性核素是18F,其半衰期为1.83小时,大多数为2-脱氧-2-(18F)氟代-D-葡萄糖(FDG)形式。这是由于生物医学回旋加速器的数量不断增加,其核衰变性质及其可用性导致的。18F-标记的化合物可以在集中式GMP-(良好生产规范(Good Manufacturing Practice))认证的放射性药厂(radiopharmacy)中大量合成并且通过较长的距离递送至操作PET中心的医院。18F适于标记小的有机分子,但是在标记肽或蛋白质中具有一些缺点。
放射性金属对于这些种类的分子更可行。近年来,获得自68Ge/68Ga放射性核素发生器系统并且半衰期为1.13小时的68Ga对于PET以多种68Ga-标记的化合物的形式显著升高。尽管68Ga-标记的化合物对于PET诊断而言具有许多优点,但是也存在几个相关的缺点。第一,相对短的半衰期要求操作PET扫描仪的每个点也安装满足立法强制的所有要求的放射性药物生产设施。第二,68Ge/68Ga-发生器能够提供有限量的放射性,每次洗脱最多为约2至3个患者剂量。此外,已经示出68Ga-标记的促生长素抑制素类似物与他们用于治疗的177Lu和90Y-标记的对应物相比显示出对于人促生长素抑制素受体亚型SSTR1-SSTR5的不同亲和力谱。因此,基于68Ga PET成像,患者的正确治疗计划和剂量测定(dosimetry)似乎有问题。
为了克服这些限制,本发明的目的是提供比68Ga更合适的替代物,其将需要以下性质:发射正电子的放射性核素的半衰期为数个小时;高正电子产率但是低正电子能量(导致高的PET分辨率);较少数目的具有低强度的伴随低能量γ-射线(如果有的话);以及与90Y或177Lu相似的络合物化学性质(用于治疗),以使得将其引入使用现有临床相关的放射性药物的诊断方法中。此外,其生产应以成本有效的方式在生物医学回旋加速器以大的活性获得并且其化学分离以短的、相对简单的过程完成,使得其可以直接用于后续的标记反应。
该目的根据本发明通过用于产生43Sc的方法实现,其中使用以下方法之一:
a)43Ca(p,n)43Sc,在5Me至24MeV的质子束能量下使用经富集43Ca;
b)42Ca(d,n)43Sc,使用经富集42Ca和3至12MeV的氘核束能量,或者
c)46Ti(p,a)43Sc,使用经富集46Ti和10Me至24MeV的质子束能量。
这三种产生路径是生成在体积和纯度方面达到期望程度的43Sc放射性核素的可行选择,所述43Sc放射性核素与前述放射性核素特别是18F和68Ga相比在价格上是有竞争力的。
用于上述第一选项的一个有利方法可以通过以下生产步骤实现:
a)用质子束辐照43Ca内容物(content)为50%或更高的Ca金属或者CaCO3、Ca(NO3)2、CaF2或CaO粉末形式的经富集43Ca靶标,由此将43Ca内容物转为43Sc;
b)将经辐照的经富集43Ca靶标溶解在酸性溶液中并且使所得溶液通过装载有DGA树脂的第一柱以吸附43Sc离子;
c)通过用HCl冲洗第一柱将所吸附的43Sc离子洗脱至装载有阳离子交换树脂如DOWEX 50W-X2或SCX阳离子交换树脂的第二柱中以使43Sc吸附在第二柱中;以及
d)使用乙酸铵/HCl或NaCl/HCl从第二柱洗脱43Sc。
用于上述第二选项的一个有利方法可以通过以下生产步骤实现:
a)用氘核束照射CaCO3、Ca(NO3)2、CaF2或CaO粉末形式的经富集42Ca靶标或42Ca内容物为50%或更高的Ca金属,由此将42Ca内容物转为43Sc;
b)将经照射的经富集42Ca靶标溶解在HCl中并且使溶解的溶液通过装载有DGA树脂的第一柱以吸附43Sc离子;
c)通过用HCl冲洗第一柱将所吸附的43Sc离子洗脱至装载有阳离子交换树脂如DOWEX 50W-X2或SCX阳离子交换树脂的第二柱中以使43Sc吸附在第二柱中;以及
d)使用乙酸铵/HCl或NaCl/HCl从第二柱洗脱43Sc。
为了循环42Ca或43Ca的部分(其在辐照之后没有转化成43Sc),可以使用以下步骤:
a)将来自第一柱的包含所讨论的有价值的经富集Ca同位素的流出物蒸发至干燥以形成得到的残余物;
b)将得到的残余物溶解在去离子水中并且分别用氨溶液和HCl调节至4.5至5的pH以形成包含溶解的Ca(II)离子的溶液;
c)通过添加草酸铵溶液使溶解的Ca(II)内容物沉淀成草酸钙;以及
d)过滤所沉淀的草酸钙并且通过缓慢加热经过滤的草酸钙将所述草酸盐转变成碳酸盐。
用于上述第三选项的一个有利方法可以通过以下生产步骤实现:
a)将以二氧化钛粉末形式的经富集46Ti靶标还原成Ti金属,其中用质子束辐照46Ti内容物为50%或更高的二氧化钛粉末,由此将46Ti内容物转变为43Sc;
b)将经辐照的46Ti靶标溶解在HCl中;添加去离子水以将溶液稀释成3M至5M HCl;
c)使所述溶液通过包含DGA树脂的第一柱,其中所述第一柱与包含SCX阳离子交换树脂的第二柱直接连接,由此使43Sc吸附在SCX树脂上;以及
d)用SCX-洗脱液(NaCl/HCl)从SCX柱洗脱所吸附的43Sc。
相应地,正电子发射断层显像中待应用的放射性药物包含基于放射性金属的放射性药剂(radiopharmaceutical agent),所述放射性药剂包含与靶向载体(例如,抗体、肽、纳米颗粒、维生素及其衍生物)缀合的双功能螯合剂,例如DOTA配体(1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸);以及与所述螯合剂结合的43Sc。优选地,该放射性药物包含放射性内容物为100MBq至500MBq(优选约200MBq)的43Sc,用于一次正电子发射断层显像的剂量。
特别参照以下附图在下文所述的本发明的优选实施方案进行更详细的描述,所述附图描述了:
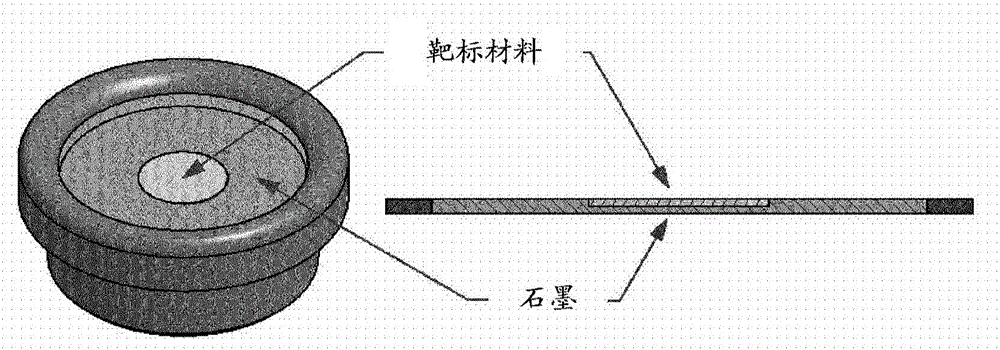
图1示意性地示出了与石墨粉末一起压制之后的靶标材料的位置和相对厚度的可能靶标设计;并且
图2使用经富集Ca的43Sc生产面板的示意图。
在这种更长寿、发射正电子的放射性核素的研究中,本发明鉴定了比68Ga更合适作为候选者的43Sc,其具有与Y和镧系元素更相似的化学性质,因此,比其Ga对应物更适合的匹配。43Sc的放射性衰变发生在0.476MeV(68Ga:0.830MeV)的低平均正电子能量、88.1%的高总正电子产率(68Ga:88.9%)和3.89小时的理想半衰期(68Ga:1.13小时)的情况下,从而允许其经远距离运输至客户(即,>500km)。其衰变与373keV的相对低能量γ-射线和23%丰度有关(68Ga:1077keV,3.2%),其不会不利地影响PET成像,因为现代PET扫描仪可以使用相对窄的能量窗口(即,440至665keV)操作。因此,该放射性核素具有克服68Ga上述限制的潜力,同时提供较优的性质。已知钪与DOTA(1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸)(在放射性药物化学中用于放射性金属的广泛使用的螯合剂)形成具有非常高稳定性常数的络合物。稳定性常数与镥或钇相当,因为它们都形成具有正方形-反棱柱几何形状的络合物,而它们对于具有扭曲八面体几何形状的镓较低。因此,在使用DOTA螯合剂的放射性药物中68Ga可以容易地用43Sc交换并且可直接引入符合GMP的盒式标记系统中,例如由Eckert&Ziegler提供的一种,用于标记形式为DOTA-TATE、DOTA-TOC、DOTA-BASS、DOTA-PSMA、DOTA-叶酸盐等的DOTA-配体。
本发明还描述了用于通过生物医学回旋加速器,即用在10至24MeV能量范围内的质子束(或在3至12MeV能量范围内的氘核束)以足够量和高放射性核素纯度生产43Sc的多种方法。
本发明还描述了以适用于直接标记反应和用于未来医学应用的质量和数量从43Sc的靶标材料中提取43Sc所需的放射性化学过程。此外,公开了回收有价值的、经富集靶标材料(enriched target material)的过程。
本领域研究的现状
包含金属放射性核素的放射性药物在诊断和治疗核医学中日益重要。一个主要实例是99mTc,其是目前在核医学中最广泛的金属诊断放射性核素,并且最近由于全球供应危机而受到关注。替代方案的研究是最重要的。治疗性金属放射性核素的实例是Zevalin@中使用的90Y(用90Y标记的Ibritumomab tiuxetan),也称为177Lu-DOTA-TATE(177Lu-DOTA0-Tyr3-Octreotate;177Lu-DOTA-DPhe-c(Cys-Tyr-DTrp-Lys-Thr-Cys)-Thr;DOTA:1,4,7,10-四氮杂环十二烷-1,4,7,10-四-乙酸)的中的177Lu,或者甚至用于治疗前列腺癌和骨转移的患者的中的223Ra(223RaCl2)。
近年来,神经内分泌肿瘤(NET,neuroendocrine tumor)的促生长素抑制素受体靶向放射性核素治疗已经获得了很多关注。使用90Y和177Lu的疗法已证明是如此成功,以致最近国际原子能机构(IAEA)与EANM和SNMMI合作发布了针对NET的肽受体放射性核素治疗(PRRNT,peptide receptor radionuclide therapy)的实践指南。PRRNT最初于1996年在瑞士巴塞尔施用。靶向G-蛋白偶联的受体与肽、叶酸盐/酯受体或使用与合适金属放射性核素缀合的单克隆抗体的其他疗法目前处于临床前和临床试验中或者已经许可为放射性药物。通常,这些药物还可以用相对短寿命的诊断放射性核素标记,尤其是如果药代动力学快速。研究工作的中心是为诊断和治疗目的(治疗诊断学或治疗诊断(theragnostic))提供理想放射性核素对的元素的同位素。以这种方式,相同的药物实体可以用诊断或治疗性核素标记,由于可忽略的同位素效应,可以假设治疗效果将发生在先前通过成像鉴定的位置。希望这种方法将促进患者的正确治疗计划和剂量测定,这是迄今为止没有有效解决的问题。
核素图表的检查揭示了非常少的这样“匹配对”的存在,尤其是如果一个要求是诊断放射性核素必须适合于PET。对于PRRNT中的两种最广泛使用的治疗放射性核素,90Y和177Lu而言,不存在合适的匹配的正电子发射体(没有应用校正方法,还考虑对患者和人员之辐射剂量的情况下,具有31.9%的低正电子分支和许多高强度、高能量γ射线的86Y不能被认为是特别适合的,但是已经用于患者)。
因此,应该考虑这样的放射性核素:表现出相似的化学性质,导致可比较的生物学特性。最近,使用奥曲肽(octreotide)的Ga-放射性标记的衍生物成功地进行了NET的诊断。68Ga从68Ge/68Ga放射性核素发生器系统获得,并且半衰期为1.13小时。虽然诊断结果远远优于111In-放射性标记的衍生物的单光子发射计算机断层显像(SPECT),但是由于使用68Ga存在缺点。相对短的半衰期要求操作PET扫描器的每个地点也设置放射性药物生产点,从而满足与GMP相关的立法强制的所有的新要求。此外,当前的68Ge/68Ga放射性核素发生器系统限于约2GBq的活性,这导致每次发生器洗脱产生不超过两至三个患者剂量。68Ge的半衰期(270.82d)最好需要每年更换发生器。当前的系统使得68Ga-标记的放射性药物及其所需的基础设施劳动密集,因此被认为是昂贵应用,如申请人最近引入68Ga-DOTA-TATE所经历的。
与例如可以在GMP认证的放射性药厂中合成并且以更远距离递送到操作PET中心之医院的18F-标记的化合物相比,68Ga的上述缺点可以限制该放射性核素用于PET成像的广泛应用。此外,已经显示68Ga-标记的促生长素抑制素类似物显示与他们用于治疗的177Lu和90Y对应物相比,对人生长抑素受体亚型SST1-SST5的不同亲和力谱。因此,基于68Ga成像的患者的正确治疗计划和剂量测定似乎是有问题的。
考虑到上述陈述,44Sc-放射性标记的放射性药物被认为是一种替代方案,尤其是因为Sc的化学特性预期比其Ga对应物更加类似于Y和Lu。这种有吸引力的半衰期为3.92小时的放射性核素可以从44Ti/44Sc放射性核素发生器系统中获得,或者在10至20MeV生物医学回旋加速器通过44Ca(p,n)44Sc核反应产生,从而产生比从发生器中提取其更大的产率。
44Sc作为发射正电子的放射性核素的唯一严重缺点是具有99.9%强度之1157keVγ-射线的共发射。康普顿散射的γ-射线可能干扰正电子的湮灭反应位置的正确重建,并且因此损害所获得的PET图像。高能量γ-射线还增加了患者和人员的辐射暴露。然而,应该提及的是,使用液氙作为检测介质的β+γ共存的检测,将44Sc共发射的1157keVγ射线用于“3γ成像”。通过施用37MBq的44Sc-DOTA-TOC(44Sc-DOTA0-Tyr3-奥曲肽;44Sc-DOTA-DPhe-c(Cys-Tyr-Trp-Lys-Thr-Cys)-Thr(ol))诊断第一位人类患者。甚至18小时注射后(p.i.)记录高质量PET/CT图像,证明与68Ga-标记的类似物相比,可以在相对长的时间内跟踪摄取动力学,并且更长寿命的90Y-或177Lu-类似物的后续治疗应用的单独剂量测定也是可能的。
主要用于18F生产的生物医学回旋加速器设计成加速质子,并且经常也加速氘核。根据本发明,使用生物医学回旋加速器的三个核反应用于产生43Sc临床相关的活性。所提出的反应为:
a)43Ca(p,n)43Sc,在5至24MeV的质子束能量下使用市售可得的富集43Ca(天然丰度0.153%);
b)42Ca(d,n)43Sc,使用市售可得的富集42Ca(天然丰度0.647%)和3至12MeV的氘核束能量;或者
c)46Ti(p,α)43Sc,使用市售可得的富集46Ti(天然丰度8.25%)和10至24MeV的质子束能量。
由于相对低的束能量,可以在装备有固体靶标站的大多数生物医学回旋加速器建立43Sc的生产,导致由于集中生产的总体成本降低。由于其较长的半衰期,43Sc-放射性药物可以同时或在18F-标记的药物之前生产,并一起运送给用户。
本公开内容描述了使用不同生产途径的43Sc生产,并且建立了最合适的一个途径,使得产物可以用于标记临床评价的化合物。基于主要结合SSTR2的配体,不同43Sc-标记的DOTA-肽关于结合亲和力、内化、稳定性和体内性质方面与177Lu、90Y和68Ga-标记的对应物进行比较。
43Sc可以在生物医学回旋加速器使用三种不同的生产路线来生产,这将进行更详细的讨论。在反应40Ca(α,n)43Ti→β+→43Sc中其使用α粒子束的生产是一种选择,然而,能够递送α粒子束的加速器很少且操作更昂贵。此外,在α粒子束显著降低了总体生产产率的情况下,活性靶标厚度更受限制。
因此,考虑43Ca(p,n)43Sc、42Ca(d,n)43Sc或46Ti(p,α)43Sc反应。TENDL-2013计算(基于TALYS评估的核数据库)用于估计可通过市售可得的富集靶标材料的辐照获得的活性和放射性核素纯度。当可用时,将预测的TENDL-2013计算与实验确定的生产反应横截面进行比较。假定在对应于两个小时内预测的激发函数之最大值的束能量和25μA的强度下辐照10mg/cm2的经富集靶标元素。在照射之后,在化学处理之前考虑1小时的等待时间,并且在1小时的处理时间内包括药物的标记。假设SC/Ca分离的化学产率为85%并且标记过程的产率为85%,则在上述条件下可以预期表1中所列出的理论产物产率。这些产率基于市售可得的、经富集靶标材料的以下同位素组成:
43Ca-靶标:
40Ca(28.50%)、42Ca(1.05%)、43Ca(57.9%)、44Ca(12.36%)、46Ca(<0.003%)、48Ca(0.19%)
42Ca-靶标:
40Ca(17.79%)、42Ca(80.80%)、43Ca(0.39%)、44Ca(0.97%)、46Ca(<0.01%)、48Ca(<0.05%)
46Ti-靶标:
46Ti(96.9%)、47Ti(0.45%)、48Ti(2.32%)、49Ti(0.17%)、50Ti(0.16%)表1:产生43Sc的三种不同反应的计算产率和放射性核素纯度
1)1患者剂量(200MBq)的富集靶标材料的价格,假定靶标回收率为80%。
43Ca(p,n)43Sc核反应:
在9MeV的束能量下,计算的激发反应最大值对应于约388mb(10-27cm2)。计算的横截面与实验数据和申请人自己的测量合理的一致。从表1可以看出,2GBq 43Sc的产率良好,然而,44gSc的共同生产是显著的。考虑到44gSc具有几乎相同的半衰期并且被讨论为合适的PET核素的事实,所有其他Sc核素贡献<0.12%的总Sc活性,长寿命44gSc仅占<2.1×10-5%的总活性。
42Ca(d,n)43Sc核反应:
在5MeV的束能量下,计算的激发反应最大值对应于约280mb(10-27cm2)。2GBq的43Sc的产率良好并且44gSc的共同生产<1%。关于43Sc+44gSc,所有其他Sc放射性核素贡献<0.11%的总Sc活性,最大贡献者为半衰期仅为57.2m的49Sc。长寿命46gSc仅占<3.5×10-6%的总活性。已经报道的最大生产横截面仅为约80mb(10-27cm2)。自己的测量表明,对于3.6至7.8MeV之间的束能量,生产横截面范围为125mb至225mb(10-27cm2)。
46Ti(p,α)43Sc核反应:
在16MeV的束能量下,计算的激发反应最大值对应于约31mb(10-27cm2)。可用的实验反应横截面数据在16MeV为约40mb(重新归一化为100%46Ti同位素丰度),并且因此,合理地一致。与其他两种生产反应相比,0.2GBq的43Sc的产率降低了一个数量级,但是44gSc的共同生产<1%。关于43Sc+44gSc,所有其他Sc放射性核素贡献<0.02%的总Sc活性。长寿命46gSc仅占总活性的3.6×10-4%。
建立了用于所有三种核反应的化学过程,定量回收富集的靶标材料。假设保守的回收率为80%,每患者剂量的材料成本(200MBq 43Sc)在表1中给出。靶标材料的目前成本如下:43Ca 94.50CHF/mg、42Ca 54.00CHF/mg和46Ti 13.65CHF/mg。为了比较,68Ga的成本在85CHF/剂量下计算,假设在68Ge的穿透开始发生之前发生器可以洗脱200次。提供上述考虑以证明43Sc的生产成本与放射性药物产品的成本相比是微不足道的,尤其是考虑到生物医学回旋加速器通常仅每天运行很少的小时数以产生18F。
考虑到43Sc的产率和作为长寿命污染物的46gSc的共同生产,42Ca(d,n)43Sc反应目前是最有利的。46Ti(p,α)43Sc反应还制造相对纯的产物。由于这个原因,横截面的仔细实验评估是必要的。43Ca(p,n)43Sc反应保持可行,尤其是如果更高的富集43Ca变得可用。因此,必须以实验方式研究所有三种反应的产物谱,并通过优化束能量来优化与长寿命46gSc相关的43Sc的生产。
通过将Ca金属或者以金属形式或以Ca化合物如CaCO3、Ca(NO3)2、CaF2或CaO粉末形式的经富集42Ca或43Ca压入靶标(holder)的凹槽中来制备靶标。靶标容纳器提供高达0.28cm3的体积,容纳高达100mg的所讨论的经富集同位素。在Ti靶标的情况下,经富集材料只能以TiO2的形式购买。如果要避免热硫酸或浓HF,则在热室(hot-cell)环境中快速溶解TiO2存在严重的困难。因此,经富集Ti靶标材料首先被定量还原成Ti金属。从表1可以看出,使用约100mg经富集46Ti将导致每次辐照产生>10个患者剂量,因此,使46Ti(ρ,α)反应成为可行的选择,尽管具有低的生产横截面。
提供了一种从放射性靶标材料中分离在数量和质量上足以用于放射性药物应用的43Sc的化学策略,其包括回收所讨论的有价值的靶标材料。所述产物必须是可直接用于后续标记过程的化学形式。
从经富集Ca靶标材料中生产43Sc的化学策略将与对于44Sc所建立的化学策略相似。
经富集42CaCO3或43CaCO3靶标的设计、制造和辐照:
为了制造靶标,将10±1mg经富集42CaCO3或43CaCO3粉末放置在~160mg石墨粉末(99.9999%)的顶部并且用10t的压力压制。靶标的尺寸为0.4mm至0.5mm厚并且直径为16mm(在圆盘中心,经压制的42CaCO3或43CaCO3粉末的计算出的深度为190μm,直径为6mm)。经封装的42CaCO3或43CaCO3压制的靶标在引入辐照设备中之前放置在靶标容纳器系统中(参见图1)。靶标的厚度由经富集材料的高成本驱动,因此对于生产运行可以增加。
图1表明示出与石墨粉末一起压制之后的靶标材料的位置和相对厚度的可能靶标设计。靶标材料在轰击结构中被铝盖覆盖。
树脂柱的制备:
柱(装有20μm玻璃料的1mL筒,切割成27mm的长度)填充有~70mg的DGA树脂(Triskem International,法国)并且在所述树脂顶部上放置20μm玻璃料。DGA柱用3M HCl预处理(preconditioned)。第二柱用于浓缩43Sc。两种方法可以相连以浓缩产物。方法A:第二柱(装有20μm玻璃料的1mL筒)填充有-140μL的DOWEX 50W-X2并且在所述树脂顶部上放置20μm玻璃料。所述柱用0.1M HCl溶液预处理。方法B:或者,SCX(Agilent Technologies Inc.,USA)筒用于浓缩步骤,其可以按照购买的使用而无需预处理。
43Sc与钙靶标材料的分离:
将活化的靶标从其铝封装中移出并转移到玻璃管(反应容器)中,溶解在2.5mL 3M HCl中并装载到DGA柱上,预先通过10mm长过滤器(装有20μm玻璃料的1mL筒)。靶标容器用2.5mL 3M HCl冲洗并使该溶液通过DGA树脂。将另外4mL 3M HCl直接施加到DGA柱上以确保残余Ca(II)的完全移除。使用注射器的系统和三通阀的系统将溶液从外部转移到热室中(图2)。第一柱与第二柱直接连接并且用4mL 0.1M HCl从DGA树脂中洗脱43Sc。溶液被吸附在包括DOWEX 50W-X2(方法A)或SCX(方法B)阳离子交换树脂的第二柱上。分别使用方法A的1.5mL 0.75M乙酸铵/0.2M HCl(pH 4.5至5.0)和方法B的0.7mL 5M NaCl/0.13M HCl(pH 0至0.5),通过单独阀洗脱43Sc(图2)。为了在合适小体积中收集43Sc,将乙酸盐/HCl洗脱液(方法A)细分到三个Eppendorf管中,每个管包含约500μL。用放射性传感器监测经洗脱的级分的活性。在方法B的情况下,细分收集不是必需的。Sc的化学产率>98%。
图2显示了使用经富集Ca的43Sc生产面板的示意图(方法B)。
循环经富集42CaCO3或43CaCO3靶标材料:
将来自数个生产运行的DGA柱的流出物(包含所讨论的有价值的经富集Ca同位素)蒸发至干燥。将所得的白色残余物溶解在20mL去离子水中并且分别用2.5%氨溶液和1M HCl将pH调节为4.5至5。通过添加20mL 0.3M草酸铵溶液将Ca(II)沉淀为草酸钙。将混合物静置2小时以确保完全沉淀,通过瓷过滤坩埚(8μm孔径)过滤,并通过缓慢加热至500℃将草酸盐转变成碳酸盐。因此,有价值经富集材料再次可用于制造靶标。先前的ICP-OES分析表明Ca浓度为450ppm,具有较小的金属污染物(2ppm Al和1ppm Sr)。用草酸铵沉淀法得到98%的总回收率。回收的靶标物质提供与用来自最初购买的43CaCO3的靶标获得的相同质量的43Sc。
使用46Ti(p,α)43Sc反应的43Sc的生产需要Sc与Ti的分离和经富集46Ti靶标物质的再循环步骤。化学分离策略基于文献数据和在PSI正在进行的研究和开发。随着44Ti/44gSc发生器系统的发展,Ti与Sc的化学分离已经成为一些研究工作的主题。
已证明Ti与Sc的化学分离是困难的,因为Ti易于氧化,并且其氧化物仅使用热的浓硫酸才有效溶解。另一个令人头痛的事实是,需要大量的热量来蒸发硫酸,因为它在300℃以上沸腾。分离这两种元素的更新尝试涉及使用氢氟酸(HF)。HF用于溶解靶标材料,然后稀释并装载在阴离子交换树脂柱上。保留Ti,将经洗脱的Sc(稀HF和稀硝酸)装载到阳离子交换树脂上并用稀乙酸铵洗脱。涉及44Ti与Sc靶标材料分离的另一个系统考虑盐酸的浓溶液用于通过阴离子交换树脂,使得Ti被保留并且Sc通过。
提供了一种从经照射的Ti靶标物质中分离在46Ti(ρ,α)反应中产生的在数量和质量上足以用于放射性药物应用的43Sc的化学策略,包括回收所讨论的有价值的靶标材料。产物必须是可直接用于后续标记过程的化学形式。
46TiO2的还原:
在无氧Ar-环境中,高达250mg的46TiO2与40%剩余CaH2(金属基点(metals basis))混合。在插入充满Ar的炉中的钼坩埚中并用5t压力将片剂压制2分钟。将炉在约30分钟内加热至900℃并且将温度在900℃下保持1小时。使所述炉冷却至100℃,其花费约2小时至3小时。当白色TiO2转变成黑色Ti时,还原完成。将片剂放置在布氏漏斗中的Millipore-过滤器(0.45μm)上并且用约20ml去离子水洗涤,由此片剂崩解。通过用100mL至150mL乙酸、suprapur(1∶4)在3小时的时间段内洗涤来溶解CaO。用去离子水冲洗过滤器直到布氏漏斗的流出物为pH中性。将所得的Ti粉末在干燥器中干燥过夜。
经富集46Ti金属靶标的设计、制造和辐照:
46Ti金属靶标的制造类似于富集CaCO3-靶标的制备进行。为了制造靶标,将10±1mg经富集46Ti金属粉末放置在约160mg石墨粉末(99.9999%)的顶部上,并用10t的压力压制。将所得的片剂封装在铝中并置于靶标容纳器系统中。
树脂柱的制备:
柱(装有20μm玻璃料的1mL筒,切割成27mm的长度)填充有约70mg的DGA树脂(TrisKem International,法国)和在树脂顶部上放置20μm玻璃料。DGA柱用4mL 6M HCl和9mL 4M HCl进行清洗和预处理。
43Sc与钛靶标材料的分离:
在180℃下,将经辐照的46Ti-石墨靶标溶解于5mL 6M HCl中保持10分钟,添加2mL去离子水以将所述溶液稀释成4M HCl。
将初始溶液穿过DGA树脂柱。将管用3mL 4M HCl冲洗,通过树脂柱,任何剩余的杂质用另外的8mL 4M HCl从DGA柱中移除。DGA柱与含有SCX阳离子交换树脂的第二柱直接连接。43Sc用10mL 0.05M HCl从DGA柱洗脱,并吸附在SCX柱上。使用700μL SCX-洗脱液(4.8M NaCl/0.1M HCl)将产物从SCX柱洗脱,得到直接用于标记反应的43Sc。Sc的化学产率为>98%。
标记反应:
将产物置于含有2mL 2M乙酸钠缓冲液和10μg肽(DOTA-螯合剂)的反应管中。将所得的溶液在100℃加热10分钟,然后使其通过Sep-Pak C18Lite筒(Waters Corporation,USA)。用2mL 0.9%盐水冲洗所述筒,然后用2mL 50%乙醇洗脱产物。添加龙胆酸确保不发生标记产物的辐射分解(radiolysis)。
申请人认为43Sc代表了具有独特和重要科学、临床和工业影响的高度有前景的放射性核素。