人源化C5和C3动物的制作方法
本申请要求于2014年5月5日提交的美国临时专利申请No.61/988,581和于2014年10月23日提交的美国临时专利申请No.62/067,836的优先权,通过援引将每篇的公开内容完整收入本文。
发明领域
本文中公开了包含编码包含人序列的C3蛋白和/或C5蛋白的核酸序列的非人动物以及包含整个或部分人的C3和/或C5基因的转基因非人动物。本文中还公开了表达人或人源化C3和/或C5蛋白的非人动物和使用包含人或人源化C3和/或C5核酸序列的非人动物的方法。
发明背景
补体蛋白C5和C3是用于治疗与补体活化有关的多种人疾病,病症和状况(例如眼炎症和视网膜变性疾病)的治疗性靶物。在非人动物,例如啮齿动物,例如小鼠或大鼠中例行实施特异性靶向人C5或人C3蛋白的治疗性分子的药动学(PK)和药效学(PD)的评估。然而,由于这些治疗性分子不靶向内源C5或C3蛋白,在某些非人动物中不能正确测定此类治疗性分子的PD。
此外,在与活化的补体系统有关的疾病的各种非人动物模型中评估人特异性C5或C3蛋白拮抗剂的治疗功效在此类物种特异性拮抗剂不与内源C5或C3蛋白相互作用的非人动物中是成问题的。
因而,需要如下的非人动物,例如啮齿动物,例如鼠类动物,例如小鼠或大鼠,其中所述非人动物的C5和/或C3基因是整个或部分人源化的或者是用包含分别编码人或人源化C5和/或C3蛋白的序列的人C5和/或C3基因替换的(例如,在内源非人基因座处)。需要以分别与分别表达功能性C5和/或C3蛋白但不包含人或人源化C5和/或C3基因的年龄匹配非人动物的血清中存在的C5和/或C3蛋白的浓度相似的浓度在血清中表达人或人源化C5和/或C3蛋白的此类人源化非人动物。
贯穿本说明书,援引了多份专利,专利申请和其它类型的出版物(例如,期刊论文,电子数据库条目,等)。在此通过援引完整收录本文中引用的所有专利,专利申请,和其它出版物的公开内容用于所有目的。
发明概述
提供了非人动物,其包含编码包含人序列的C3和/或C5的核酸序列。
提供了转基因非人动物,其包含整个或部分人的C3和/或C5基因。
提供了非人动物,其表达人或人源化C3和/或C5蛋白。
提供了非人动物,其具有内源非人动物C5和/或C3基因的替换(整个或部分)。
提供了非人动物,其包含内源非人C5和/或C3基因座处的C5和/或C3人源化(整个或部分)。
提供了具有人或人源化C5和/或C3基因的非人动物,其中所述非人动物不表达内源C5和/或C3蛋白,并且以分别与表达功能性内源C5和/或C3蛋白但不包含所述替换的年龄匹配非人动物的血清中存在的C5和/或C3蛋白的浓度相似的浓度在血清中表达人或人源化C5和/或C3蛋白。
在一个方面,提供了包含人或人源化C3和/或C5核酸序列的非人动物。
在一个方面,提供了经遗传修饰的非人动物,其包含内源C5和/或C3基因座处编码人或人源化C5和/或C3蛋白的基因对编码内源C5和/或C3的基因的替换。提供了如下的啮齿动物,例如小鼠或大鼠,其包含内源啮齿动物C5基因座处人C5基因对内源C5基因的替换,和/或包含内源啮齿动物C3基因座处人C3基因对内源C3基因的替换。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个方面,提供了经遗传修饰的啮齿动物,例如小鼠或大鼠,其包含内源啮齿动物C5基因座处编码人或人源化C5蛋白的人C5基因对编码C5蛋白的啮齿动物基因的替换,其中编码人或人源化C5蛋白的所述人C5基因的表达在所述内源啮齿动物C5基因座处的啮齿动物调节元件的控制下。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,编码人或人源化C5蛋白的所述人C5基因包含人C5基因的外显子2到外显子41。
在一个实施方案中,所述啮齿动物是不能表达小鼠C5蛋白的小鼠。
在一个实施方案中,所述啮齿动物是表达由内源小鼠C3基因编码的小鼠C3蛋白的小鼠。
在一个实施方案中,所述啮齿动物是表达人或人源化C3蛋白的小鼠。
在一个实施方案中,所述啮齿动物是小鼠,其包含内源小鼠C3基因座处编码人或人源化C3蛋白的人C3基因对编码C3蛋白的小鼠基因的替换。
在一个实施方案中,编码人或人源化C3蛋白的所述人C3基因的表达在所述内源小鼠C3基因座处的小鼠调节元件的控制下。
在一个方面,提供了经遗传修饰的啮齿动物,例如小鼠或大鼠,其包含内源啮齿动物C3基因座处编码人或人源化C3蛋白的人C3基因对编码C3蛋白的啮齿动物基因的替换,其中编码人或人源化C3蛋白的所述人C3基因的表达在所述内源啮齿动物C3基因座处的啮齿动物调节元件的控制下。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,编码人或人源化C3蛋白的所述人C3基因包含人C3基因的外显子1到外显子41。
在一个实施方案中,编码人或人源化C3蛋白的所述人C3基因包含人C3基因的外显子2到外显子41。
在一个实施方案中,所述啮齿动物是不能表达小鼠C3蛋白的小鼠。
在一个实施方案中,所述啮齿动物是表达由内源小鼠C5基因编码的小鼠C5蛋白的小鼠。
在一个实施方案中,所述啮齿动物是表达人或人源化C5蛋白的小鼠。
在一个实施方案中,所述啮齿动物是小鼠,其包含内源小鼠C5基因座处编码人或人源化C5蛋白的人C5基因对编码C5蛋白的小鼠基因的替换。
在一个实施方案中,编码人或人源化C5蛋白的所述人C5基因的表达在所述内源小鼠C5基因座处的小鼠调节元件的控制下。
在一个方面,提供了表达人或人源化C5蛋白的经遗传修饰的啮齿动物,例如小鼠或大鼠,其中表达人或人源化C5蛋白的啮齿动物包含正常的补体系统,例如表达人或人源化C5蛋白的啮齿动物的血液,血浆或血清中补体蛋白的水平与表达功能性内源C5蛋白的啮齿动物的血液,血浆或血清中补体蛋白的水平相似。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个方面,提供了从人C5基因表达C5蛋白的经遗传修饰的啮齿动物,例如小鼠或大鼠,其中所述啮齿动物在其血清中表达人或人源化C5蛋白。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,表达人或人源化C5蛋白的啮齿动物的血清与表达功能性内源C5蛋白的啮齿动物(例如野生型小鼠或大鼠)具有大致相同的C5蛋白水平。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,所述小鼠以表达功能性内源C5蛋白但不包含内源小鼠C5基因座处人C5基因对内源C5基因的替换的年龄匹配小鼠的血清中存在的C5蛋白的水平的至少约10%,20%,30%,40%,50%,60%,70%,80%,90%,100%,110%,120%,130%,140%,150%,160%,170%,180%,190%或200%的浓度在血清中表达人或人源化C5蛋白。
在一个实施方案中,所述小鼠以表达功能性内源C5蛋白但不包含内源小鼠C5基因座处人C5基因对内源C5基因的替换的年龄匹配小鼠的血清中存在的小鼠C5蛋白水平的约10%和约200%之间,约20%和约150%之间,或约30%和约100%之间的浓度在血清中表达人或人源化C5蛋白。
在一个实施方案中,所述小鼠以约10μg/ml和约150μg/ml之间,约10μg/ml和约125μg/ml之间,或约15μg/ml和约100μg/ml之间的浓度在血清中表达人或人源化C5蛋白。
在一个实施方案中,所述小鼠以至少约10,20,30,40,50,60,70,80,90,100,125或150μg/ml的浓度在血清中表达人或人源化C5蛋白。
在一个方面,提供了表达人或人源化C3蛋白的经遗传修饰的啮齿动物,例如小鼠或大鼠,其中表达人或人源化C3蛋白的啮齿动物包含正常的补体系统,即表达人或人源化C3蛋白的啮齿动物的血液,血浆或血清中补体蛋白的水平与表达功能性内源C3蛋白的啮齿动物的血液,血浆或血清中补体蛋白的水平相似。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个方面,提供了自人C3基因表达C3蛋白的经遗传修饰的啮齿动物,例如小鼠或大鼠,其中所述啮齿动物在其血清中表达人或人源化C3蛋白。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,表达人或人源化C3蛋白的啮齿动物的血清具有与表达功能性内源C3蛋白的啮齿动物(例如野生型小鼠或大鼠)大约相同的C3蛋白水平。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,所述小鼠以表达功能性内源C3蛋白但不包含内源小鼠C3基因座处人C3基因对内源C3基因的替换的年龄匹配小鼠的血清中存在的C3蛋白的水平的至少约10%,20%,30%,40%,50%,60%,70%,80%,90%,100%,110%,120%,130%,140%,150%,160%,170%,180%,190%或200%的浓度在血清中表达人或人源化C3蛋白(hC3)。
在一个实施方案中,所述小鼠以表达功能性内源C3蛋白但不包含内源小鼠C3基因座处人C3基因对内源C3基因的替换的年龄匹配小鼠的血清中存在的小鼠C3蛋白水平的约10%和约200%之间,约20%和约150%之间,或约30%和约100%之间的浓度在血清中表达人或人源化C3蛋白。
在一个实施方案中,所述小鼠以约100μg/ml和约1500μg/ml之间,约200μg/ml和约1250μg/ml之间,或约300μg/ml和约1000μg/ml之间的浓度在血清中表达人或人源化C3蛋白。
在一个实施方案中,所述小鼠以至少约100,200,300,400,500,600,700,800,900,1000,1250或1500μg/ml的浓度在血清中表达人或人源化C3蛋白。
在一个方面,提供了经遗传修饰的啮齿动物,其包含内源啮齿动物C5基因座处编码人或人源化C5蛋白的人C5基因对编码C5蛋白的啮齿动物基因的替换,其中编码人或人源化C5蛋白的所述人C5基因的表达在所述内源啮齿动物C5基因座处的啮齿动物调节元件或序列的控制下,且其中所述啮齿动物进一步包含人C3基因,其包含内源啮齿动物C3基因座处编码人或人源化C3蛋白的人C3基因对编码C3蛋白的啮齿动物基因的替换,其中编码人或人源化C3蛋白的所述人C3基因的表达在所述内源啮齿动物C3基因座处的啮齿动物调节元件或序列的控制下。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,所述小鼠不能表达小鼠C5蛋白且不能表达小鼠C3蛋白。
在一个实施方案中,所述内源啮齿动物C5基因座和/或啮齿动物C3基因座处的啮齿动物调节元件或序列来自小鼠或大鼠。
在一个实施方案中,所述啮齿动物调节元件或序列是啮齿动物C5基因座和/或啮齿动物C3基因座处的内源啮齿动物调节元件或序列,来自小鼠或大鼠。
在一个方面,提供了表达人或人源化C5和/或C3蛋白的非人动物,例如啮齿动物,例如小鼠或大鼠,其中所述非人动物自内源非人C5基因座和/或内源非人C3基因座表达人或人源化C5和/或C3蛋白。在一个实施方案中,所述非人动物是啮齿动物。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个方面,提供了自内源小鼠C5基因座表达人或人源化C5蛋白的经遗传修饰的小鼠,其中内源小鼠C5基因已经整个或部分用人C5基因替换。
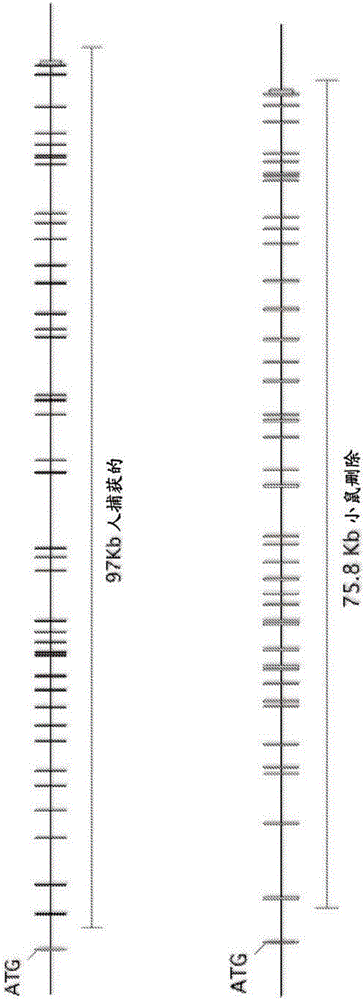
在一个实施方案中,内源小鼠C5基因座处的约75.8kb(包括外显子2到42和3’非翻译序列)删除且用包含人C5基因的外显子2到41的约97kb人C5基因序列替换。在一个具体的实施方案中,所述人C5基因包含人BAC CTD-2559I19的人C5基因的外显子2至42。在一个具体的实施方案中,所述C5基因包含小鼠C5外显子1和人C5外显子2到42。
在一个方面,提供了包含编码人或人源化C5蛋白的核苷酸序列的经遗传修饰的小鼠,其中编码人或人源化C5蛋白的所述核苷酸序列替换整个或部分编码内源小鼠C5蛋白的内源核苷酸序列。
在一个方面,提供了自内源小鼠C3基因座表达人或人源化C3蛋白的遗传修饰的小鼠,其中内源小鼠C3基因已经整个或部分用人C3基因替换。
在一个实施方案中,内源小鼠C3基因座的一部分(包括外显子1上游的5’调节元件到外显子41)删除且用包含人C3基因的外显子1上游的5’调节元件到外显子41的人C3基因序列替换。在一个具体的实施方案中,人C3基因包含整个人C3编码区。
在一个实施方案中,内源小鼠C3基因座的一部分(包括内含子1的一部分和外显子2到41)删除且用包含人C3基因的内含子1的一部分和外显子2到外显子41的人C3基因序列替换。在一个具体的实施方案中,C3基因包含小鼠C3外显子1和人C3外显子2到41。
在一个方面,提供了用于生成人源化C5啮齿动物的方法,其包括用人C5基因序列替换编码啮齿动物C5蛋白的啮齿动物C5基因序列,所述人C5基因序列包含编码人或人源化C5蛋白的人C5基因序列的一个或多个外显子。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,所述替换在内源啮齿动物C5基因座处,而且将包含编码人或人源化C5蛋白的人C5基因序列的一个或多个外显子的人C5基因序列与内源啮齿动物C5基因座处的啮齿动物调节元件或序列可操作连接。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,所述啮齿动物调节元件或序列是自小鼠衍生的。在一个实施方案中,所述啮齿动物调节元件或序列是自大鼠衍生的。
在一个实施方案中,所述啮齿动物调节元件或序列是啮齿动物C5基因座处的内源啮齿动物调节元件或序列。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,替换啮齿动物C5基因序列的人C5基因序列包含人C5基因序列的至少一个外显子。在其它实施方案中,替换啮齿动物C5基因序列的人C5基因序列包含人C5基因序列的至少2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,或40个外显子。在一个实施方案中,替换啮齿动物C5基因序列的人C5基因序列包含人C5基因序列的所有41个外显子。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,所述替换在内源啮齿动物C5基因座处,而且将包含编码人或人源化C5蛋白的人C5基因序列的一个或多个外显子的人C5基因序列与内源啮齿动物C5基因座处的内源啮齿动物调节元件或序列可操作连接。
在一个方面,提供了用于生成人源化C5小鼠的方法,其包括用编码人或人源化C5蛋白的人C5基因序列替换编码小鼠C5蛋白的小鼠C5基因序列。
在一个实施方案中,所述替换在内源小鼠C5基因座处,而且将编码人或人源化C5蛋白的人C5基因与内源小鼠C5基因座处的小鼠调节元件或序列可操作连接。
在一个实施方案中,所述替换在内源小鼠C5基因座处,而且将编码人或人源化C5蛋白的人C5基因与内源小鼠C5基因座处的内源小鼠调节元件或序列可操作连接。
在一个方面,提供了用于生成人源化C3啮齿动物的方法,其包括用人C3基因序列替换编码啮齿动物C3蛋白的啮齿动物C3基因序列,所述人C3基因序列包含编码人或人源化C3蛋白的人C3基因序列的一个或多个外显子。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,所述替换在内源啮齿动物C3基因座处,而且将包含编码人或人源化C3蛋白的人C3基因序列的一个或多个外显子的人C3基因序列与内源啮齿动物C3基因座处的啮齿动物调节元件或序列可操作连接。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,所述啮齿动物调节元件或序列是自小鼠衍生的。在一个实施方案中,所述啮齿动物调节元件或序列是自大鼠衍生的。
在一个实施方案中,所述啮齿动物调节元件或序列是啮齿动物C3基因座处的内源啮齿动物调节元件或序列。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,替换啮齿动物C3基因序列的人C3基因序列包含人C3基因序列的至少一个外显子。在其它实施方案中,替换啮齿动物C3基因序列的人C3基因序列包含人C3基因序列的至少2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,或40个外显子。在一个实施方案中,替换啮齿动物C5基因序列的人C3基因序列包含人C3基因序列的所有41个外显子。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个实施方案中,所述替换在内源啮齿动物C3基因座处,而且将包含编码人或人源化C3蛋白的人C3基因序列的一个或多个外显子的人C3基因序列与内源啮齿动物C3基因座处的内源啮齿动物调节元件或序列可操作连接。
在一个方面,提供了用于生成人源化C3小鼠的方法,其包括用编码人或人源化C3蛋白的人C3基因序列替换编码小鼠C3蛋白的小鼠C3基因序列。
在一个实施方案中,所述替换在内源小鼠C3基因座处,而且将编码人或人源化C3蛋白的人C3基因与内源小鼠C3基因座处的内源小鼠调节元件或序列可操作连接。
在一个实施方案中,所述替换在内源小鼠C3基因座处,而且将编码人或人源化C3蛋白的人C3基因与内源小鼠C3基因座处的小鼠调节元件或序列可操作连接。
在各个方面,本文中描述的经遗传修饰的非人动物(例如啮齿动物,例如小鼠或大鼠)包含其种系中的遗传修饰。
在一个方面,提供了包含如本文中描述的遗传修饰的非人动物(例如啮齿动物,例如小鼠或大鼠)胚胎。
在一个方面,提供了包含如下供体细胞的非人动物(例如啮齿动物,例如小鼠或大鼠)宿主胚胎,所述供体细胞包含如本文中描述的遗传修饰。
在一个方面,提供了包含如本文中描述的遗传修饰的多能或全能非人动物(例如啮齿动物,例如小鼠或大鼠)细胞。在一个实施方案中,所述细胞是啮齿动物细胞。在一个实施方案中,所述细胞是小鼠细胞。在一个实施方案中,所述细胞是啮齿动物ES细胞。在一个实施方案中,所述细胞是小鼠ES细胞。
在一个方面,提供了非人动物(例如啮齿动物,例如小鼠或大鼠)卵,其中所述非人动物卵包含异位非人动物染色体,其中所述异位非人动物染色体包含如本文中描述的遗传修饰。在一个实施方案中,所述非人动物是啮齿动物。在一个实施方案中,所述啮齿动物是小鼠。在一个实施方案中,所述啮齿动物是大鼠。
在一个方面,经遗传修饰以包含人C5基因或人C3基因的小鼠胚胎,卵,或细胞是选自下述各项的C57BL品系的小鼠的:C57BL/A,C57BL/An,C57BL/GrFa,C57BL/KaLwN,C57BL/6,C57BL/6J,C57BL/6ByJ,C57BL/6NJ,C57BL/10,C57BL/10ScSn,C57BL/10Cr,和C57BL/Ola。在另一个实施方案中,所述小鼠是选自由下述品系组成的组的129品系:129P1,129P2,129P3,129X1,129S1(例如,129S1/SV,129S1/Svlm),129S2,129S4,129S5,129S9/SvEvH,129S6(129/SvEvTac),129S7,129S8,129T1,129T2(见例如Festing et al.(1999)Revised nomenclature for strain 129 mice,Mammalian Genome 10:836,也见Auerbach et al.(2000)Establishment and Chimera Analysis of 129/SvEv-and C57BL/6-Derived Mouse Embryonic Stem Cell Lines)。在一个具体的实施方案中,所述经遗传修饰的小鼠是前述129品系和前述C57BL/6品系的混合物。在另一个具体的实施方案中,所述小鼠是前述129品系的混合物,或前述BL/6品系的混合物。在一个具体实施方案中,所述混合物的129品系是129S6(129/SvEvTac)品系。在另一个实施方案中,所述小鼠是BALB品系,例如BALB/c品系。在还有另一个实施方案中,所述小鼠是BALB品系和另一种前述品系的混合物。在一个实施方案中,所述小鼠是Swiss或Swiss Webster小鼠。
在又一个方面,本文中提供了用于鉴定能够调控补体活化的化合物的方法,其包括对本文中公开和描述的任何非人动物,例如啮齿动物,例如小鼠或大鼠施用所述化合物;并测定啮齿动物中的补体活化是否受到调控,由此鉴定能够调控补体活化的化合物。在一个实施方案中,所述化合物是小分子化学化合物,抗体,蛋白质,抑制性核酸,或其任何组合。在本文中公开的任何实施方案的另一个实施方案中,所述化合物通过提高补体活性来调控补体活化。在本文中公开的任何实施方案的另一个实施方案中,所述化合物通过降低补体活性来调控补体活化。在本文中公开的任何实施方案的另一个实施方案中,测定啮齿动物的血清以测定啮齿动物中的补体活化是否受到调控。在又一个实施方案中,测定法是CH50补体筛选测定法。
本文中描述的每个方面和实施方案能够一起使用,除非根据实施方案或方面的上下文明确或清楚排除。
附图说明
图1提供小鼠(顶部)和人(底部)C5基因组基因座的图示(不按比例)。标示了分别经删除和替换以产生人源化C5小鼠的小鼠和人C5基因的区域。
图2提供小鼠(mC3)和人源化(hC3)C3基因组基因座的图示(不按比例)。(A)删除跨越5’调节元件和从外显子1到外显子41的编码区的小鼠C3基因,并且用人C3基因的5’调节元件和从外显子1到外显子41的编码区和loxP位点替换,如分别以粗线和箭标示的。(B)删除跨越内含子1的一部分和从外显子2到外显子41的编码区的小鼠C3基因,并且用人C5基因的内含子1的一部分和从外显子2到外显子41的编码区和loxP位点替换,如分别以粗线和箭标示的。
图3显示小鼠补体在溶血测定法中具有比人补体要低的活性。
图4显示物种特异性抗C5单克隆抗体以物种特异性方式阻断补体溶血活性。
图5显示人源化C5小鼠是功能性小鼠C5敲除。(A)人C5或C3蛋白的添加分别重建C5或C3消减的人血清中的溶血活性。(B)小鼠(而非人)C5蛋白重建C5-/-和人源化C5小鼠血清中的溶血活性。(C)人源化C5小鼠血清中人C5蛋白的水平比人血清中低三倍。(D)人源化C5小鼠中的给药前补体C5水平在雄性和雌性之间变化。在人源化C5小鼠血清中存在20-100μg/mL的人C5范围。
图6显示人C3和C5蛋白(而非单独的人C5蛋白)的添加重建C5-/-小鼠血清中的溶血活性。
图7显示人源化C5小鼠血清需要添加人C3蛋白以实现野生型水平的小鼠溶血活性。
图8显示使用400μg/mL人C3蛋白(A)和800μg/mL人C3蛋白(B)对来自暴露于抗人C5抗体(C5Ab)的人源化C5小鼠的血清样品实施的溶血测定法的结果。
图9显示对于研究中的所有动物(A)和雌性(顶部)和雄性(底部)动物(B),测量抗人C5抗体水平作为注射后时间的函数的药动学测定法的结果。
图10A显示对野生型小鼠血清添加人C3蛋白能增强溶血功能,但没有达到在正常人血清中观察到的相同程度(对于来自小鼠的每个数据点,混合来自3只动物的血清)。图10B显示当补充人C3蛋白时,能在人源化C5hu/hu小鼠中恢复溶血功能。
图11显示对自C3敲除小鼠衍生的血清添加人C3蛋白能挽救溶血功能(对于来自小鼠的每个数据点,混合来自3只动物的血清)。
图12显示仅将人C3蛋白添加至C5敲除小鼠血清不能挽救溶血功能(对于来自小鼠的每个数据点,混合来自3只动物的血清)。
发明详述
补体系统是先天免疫系统的一个必要组分,并且作为针对侵入性病原体的防御机制起至关重要的作用,引发适应性免疫应答,并且帮助除去免疫复合物和凋亡细胞。虽然补体系统在许多保护性免疫功能中起至关重要的作用,但是补体活化是极其多种自身免疫和炎性疾病过程中的组织损伤的重要介导物。
本文中描述的发明格外提供了如下的非人动物,其在血清中以与非人动物中的内源C5和/或C3蛋白的野生型表达相似的浓度表达人或人源化C5和/或C3蛋白。能够表达人或人源化C5和/或C3蛋白的非人动物的成功工程化为在适合于大规模和高通量药物筛选测定法的实验室动物中重演人补体系统提供了一种需要且有用的工具。本文中还提供了使用本文中描述的非人动物(诸如啮齿动物)鉴定能够调控补体活化的化合物的方法。所述方法部分基于发明人的如下发现,即虽然C5蛋白的补体活性是物种特异性的(即,人C5蛋白不能替代小鼠C5蛋白),但是人C3蛋白的补体活性能够在小鼠血清补体活性中替代小鼠C3蛋白。
通用技术
除非另外指明,本发明的实践会采用本领域技术人员公知的分子生物学,微生物学,细胞生物学,生物化学,核酸化学,和免疫学的常规技术。文献中完全解释了此类技术,诸如Molecular Cloning:A Laboratory Manual,第四版(Sambrook et al.,2012)和Molecular Cloning:A Laboratory Manual,第三版(Sambrook and Russel,2001)(在本文中统称为“Sambrook”);Current Protocols in Molecular Biology(F.M.Ausubel等编,1987,包括到2014年的增补);PCR:The Polymerase Chain Reaction(Mullis等编,1994);Antibodies:A Laboratory Manual,第二版,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY(Greenfield编,2014),Beaucage等编,Current Protocols in Nucleic Acid Chemistry,John Wiley&Sons,Inc.,New York,2000(包括到2014年的增补)和Gene Transfer and Expression in Mammalian Cells(Makrides编,Elsevier Sciences B.V.,Amsterdam,2003)。
定义
如本文中使用的,术语“蛋白质”包括多肽,肽,多肽片段,和融合多肽。
如本文中使用的,“核酸”指单链或双链形式的共价连接在一起的两个或更多个脱氧核糖核苷酸和/或核糖核苷酸。
“可操作连接”表示核酸表达控制序列(诸如启动子)和第二核酸序列之间的功能性连接,其中表达控制序列指导与第二序列对应的核酸的转录。
术语“替换”在提到基因替换时指将外源遗传物质置于内源遗传基因座处,由此用直向同源或同源核酸序列替换整个或部分内源基因。在一种情况中,用相应的人基因或其片段替换内源非人基因或其片段。相应的人基因或其片段是如下的人基因或片段,其是被替换的内源非人基因或其片段的直向同系物,同系物,或者与被替换的内源非人基因或其片段在结构和/或功能方面基本上相同或相同。如下文实施例中证明的,用与人C3和/或C5基因基因座对应的核苷酸序列替换内源非人(例如啮齿动物,诸如小鼠)C3和/或C5基因基因座的核苷酸序列。在另一个实施方案中,在删除内源基因或使内源基因成为非功能性(诸如通过插入错义突变或过早终止密码子)并将相应的人基因或其片段在分开的位置处插入种系中时能发生基因替换。
如在短语“人源化C3等位基因”,或“人源化C5等位基因”,或“人源化C3基因”,或“人源化C5基因”中使用的,术语“人源化”包括但不限于其中整个或部分内源非人C3和/或C5基因或等位基因用人C3和/或C5基因或等位基因的对应部分替换的实施方案。例如,在一些实施方案中,术语“人源化”指在不替换非人动物的内源非编码区(诸如但不限于启动子,5’和/或3’非翻译区,增强子元件,等)的情况中用人C3和/或C5基因或等位基因的对应编码区完全替换内源非人C3和/或C5基因或等位基因的编码区(例如,外显子)。在一些实施方案中,所述非人动物是啮齿动物,诸如大鼠或小鼠。
“人源化蛋白质”包括但不限于其中用人C3和/或C5蛋白的对应部分替换整个或部分所编码的内源非人C3和/或C5蛋白的实施方案。在一些实施方案中,“人源化蛋白质”可以由人源化C3和/或C5基因或等位基因编码,但是仍然编码完全人的C3和/或C5蛋白(诸如但不限于,其中内源非人C3和/或C5基因或等位基因的整个编码区(例如外显子)用人C3和/或C5基因或等位基因的对应编码区替换,但是不替换非人动物的内源非编码区(诸如但不限于启动子,5’和/或3’非翻译区,增强子元件,等)。在一些实施方案中,所述非人动物是啮齿动物,诸如大鼠或小鼠。
如本文中使用的,“调控”指化合物改变补体系统的活性的能力。在一个实施方案中,化合物对补体系统的调控指降低受试者(例如啮齿动物,诸如小鼠)中的补体活化。在另一个实施方案中,化合物对补体系统的调控指提高受试者中补体介导的活性。
如本文中使用的,术语“啮齿动物”指啮齿目(Rodentia)的任何成员。啮齿动物的例子包括但不限于小鼠,大鼠,松鼠,草原土拨鼠,豪猪,河狸,豚鼠,和仓鼠。在一个实施方案中,啮齿动物是大鼠。在另一个实施方案中,啮齿动物是小鼠。
除非本文中另外定义,本文中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员的通常理解相同的含义。
如本文中使用的,单数术语“一个”,“一种”,和“该/所述”包括复数所指物,除非上下文另外明确指明。
意图是,贯穿本说明书给出的每个最大的数值限制包括每个更低的数值限制,就像在本文中明确书写此类更低的数值限制一样。贯穿本说明书给出的每个最小的数值限制会包括每个更高的数值限制,就像在本文中明确书写此类更高的数值限制一样。贯穿本说明书给出的每个数值范围会包括落入此类较宽的数值范围内的每个较窄的数值范围,就像在本文中明确书写所有此类较窄的数值范围一样。
补充系统
补体(免疫系统的一种必要组分)由超过30种血清和细胞蛋白质组成,它们牵涉两种有联系的生物化学级联,即经典途径和旁路途径。补体发挥帮助免疫系统破坏侵入性微生物及维持组织稳态的功能。
然而,过度或不受调节的补体活化促成组织损伤,并且与极其多种与补体活化有关的人疾病,病症和状况(例如眼炎症和视网膜变性疾病)有关(参见Makrides(1998)Therapeutic inhibition of the complement system,Pharmacological Reviews 50(1):59-87;及Mollnes et al.(2006)Strategies of therapeutic complement inhibition,Molecular Immunology 43;107-121)。已知与异常补体活化有关的其它疾病或状况包括但不限于变应性哮喘和伴随的气道炎症和气道高反应性(“AHR”),慢性阻塞性肺病(“COPD”),变应性支气管肺曲菌病,过敏性肺炎,嗜酸细胞性肺炎,肺气肿,支气管炎,过敏性支气管炎,支气管扩张,囊性纤维化,结核病,过敏性肺炎,职业性哮喘,结节病,反应性气道疾病综合征,间质性肺病,嗜酸细胞增多综合征,鼻炎,鼻窦炎,运动诱发性哮喘,污染诱发性哮喘,咳嗽变异性哮喘,寄生性肺病,呼吸道合胞病毒(“RSV”)感染,副流感病毒(“PIV”)感染,鼻病毒(“RV”)感染和腺病毒感染,和缺血再灌注损伤(参见例如美国专利申请公开号2005/0260198,通过援引将其收入本文)。
补体C5基因和蛋白
C5基因编码血清补体C5蛋白,其在炎性和细胞杀伤过程中起重要作用。成熟C5蛋白由通过二硫键连接的α和β链构成。C5蛋白受到转化酶切割,产生活化肽C5a(一种自α多肽衍生的过敏毒素,其在很大程度上是促炎性的)和C5b(一种自β多肽衍生的大分子裂解产物,其与其它补体成分形成复合物以形成膜攻击复合物(MAC),该膜攻击复合物牵涉靶细胞的渗透性溶解)。
人C5。官方符号:C5;NCBI基因ID:727;主要来源:HGNC:1331;RefSeq mRNA ID:NM_001735.2;UniProt ID:P01031;基因组装配:GRCh38;位置:chr9:120,952,335-121,050,275-链。
人C5基因位于染色体9上,在9q33-q34处。人C5基因具有41个外显子且编码长度为1676个氨基酸的前体多肽,其包含18个氨基酸的信号肽,655个氨基酸的β链和999个氨基酸的α链。在补体活化期间,α链受到切割,由此产生74个氨基酸的C5a,其是有力的促炎性过敏毒素。
人中的C5缺乏与对重度复发性感染的易感性增加有关。
C5基因在数种物种间是保守的,所述物种包括灵长类,例如黑猩猩,恒河猴,其它哺乳动物,例如犬,牛,啮齿动物(例如小鼠),鸡,斑马鱼和青蛙。
小鼠C5。官方符号:Hc;NCBI基因ID:15139;主要来源:MGI:96031;RefSeq mRNA ID:NM_010406.2;UniProt ID:P06684;基因组装配:GRCm38;位置:chr2:34,983,331-35,061,449-链。
小鼠C5基因位于染色体2上,在2 23.22cM处。小鼠C5基因具有42个外显子且编码长度为1680个氨基酸的前体多肽,其包含18个氨基酸的信号肽,656个氨基酸的β链和1002个氨基酸的α链。在补体活化期间,α链受到切割,由此产生77个氨基酸的C5a,其是有力的促炎性过敏毒素。
在数种常见的实验室小鼠品系中观察到C5缺陷,所述品系具有共同的cDNA 5’末端附近2个碱基对的删除,其导致不能分泌C5;因此,这些小鼠是功能上C5缺陷的,即C5敲除(6种此类品系是A/HeJ,AKR/J,DBA/2J,NZB/B1NJ,SWR/J,和B10.D2/oSnJ)(参见例如Wetzel et al.(1990)Deficiency of the murine fifth complement component(C5):a 2-base pair deletion in a 5’exon,J Biol Chem 265:2435-2440)。也可以遵循本领域中已知的标准规程产生C5敲除小鼠。
补体C3基因和蛋白
C3基因编码血清补体蛋白C3,其在经典和旁路补体活化途径的活化中起中心作用。
人C3基因位于染色体19上,在19p13.3-p13.2处。人C3基因具有41个外显子且编码1663个氨基酸的前体多肽,其包含22个氨基酸的信号肽,645个氨基酸的β链和992个氨基酸的α链。在补体活化期间,α链受到切割,由此产生9种不同的肽,包括77个氨基酸的C5a,其是有力的促炎性过敏毒素。
人中的C3缺陷与对细菌性感染的易感性增加有关。
C3基因在数种物种之间是保守的,包括灵长类,例如黑猩猩,猕猴,其它哺乳动物,例如犬,牛,啮齿动物(例如小鼠),鸡,斑马鱼和青蛙。
小鼠C3基因位于染色体17上,在17 29.72cM19处。小鼠C3基因具有41个外显子且编码1663个氨基酸的前体多肽,其包含24个氨基酸的信号肽,642个氨基酸的β链和993个氨基酸的α链。在补体活化期间,α链受到切割,由此产生9种不同的肽,包括78个氨基酸的C3a,其是有力的促炎性过敏毒素。
已经遵循本领域中已知的标准程序产生C3敲除小鼠(参见例如Drouin et al.(2001)Cutting edge:the absence of 3 demonstrates a role for complement in Th2effector functions in a murine model of pulmonary allergy,J Immunology 167:4141-4144)。
C5和C3补体蛋白的物种特异性
本文中显示了,人源化C5小鼠是功能上C5缺陷的,因为至少一些内源补体蛋白展示物种特异性,即内源小鼠补体蛋白不能与人C5蛋白在功能上相互作用。对从人源化C5小鼠或C5敲除小鼠获得的血清测试补体活性;没有观察到补体溶血活性,除非添加人C3和人C5蛋白两者。
本文中还显示,将人C3添加至自C3敲除小鼠获得的血清能够挽救溶血功能;当将人C3蛋白添加至血清时,在C3敲除小鼠中观察到补体活性。
C5蛋白的补体活性是物种特异性的,即人C5蛋白不能在小鼠血清补体活性(即溶血)测定法中替代小鼠C5蛋白。
比较而言,C3蛋白的补体活性看来不是相似地物种特异性的,即人C3蛋白能够在小鼠血清补体活性(即溶血)测定法中替代小鼠C3蛋白。
对补体系统的治疗性抑制
用于治疗性补体抑制的两种靶物是补体活化肽C5a和C3a,其在补体活化时在经典和旁路途径两者中通过酶促切割分别自补体蛋白C5和C3产生(参见Markides(1998);Mollnes et al.(2006))。
例如,通过抗体(例如美国专利No.6,355,245中公开的抗体)阻断C5切割是在与补体活化有关的疾病中用于补体抑制的一种可能的治疗性策略。
人C5和C3抑制剂的物种特异性
通常在非人动物(例如啮齿动物,例如小鼠或大鼠)中对靶向补体蛋白C5或C3的候选治疗性分子评估药动学(PK)和药效学(PK)。也在与补体活化有关的人疾病,病症和状况的非人动物(例如啮齿动物,例如小鼠或大鼠)模型中对此类治疗性分子测试体内治疗功效。
然而,在啮齿动物(特别是小鼠)中不能适当评估对人补体蛋白C5或C3特异性的治疗性分子(即人特异性C5或C3抑制剂)的PD或体内治疗功效,因为这些治疗性分子的靶物是缺失的。由于这些蛋白质的上文提到的物种特异性,使用表达人C5或C3补体蛋白的转基因非人动物(例如啮齿动物,例如小鼠或大鼠)没有克服此问题。
因而,为了在非人动物(例如啮齿动物,例如小鼠或大鼠)中评估人特异性C5或C3蛋白拮抗剂或抑制剂的PD和体内治疗性功效,期望用人C5和/或C3蛋白替换内源C5和/或C3蛋白。此外,为了避免人C5和/或C3蛋白的过表达或表达不足的潜在问题,期望在内源C5和/或C3基因基因座处将人C5和/或C3基因插入非人动物(例如啮齿动物,例如小鼠或大鼠)的基因组中,及至少部分在内源C5和/或C3调节元件的控制下在非人动物(例如啮齿动物,例如小鼠或大鼠)中表达人C5和/或C3蛋白。
人源化C3和/或C5非人动物的创建
用于产生本发明的人源化C3和/或C5动物的方法是本领域中公知的(一般参见Gene Targeting:A Practical Approach,Joyner,ed.,Oxford University Press,Inc.(2000))。在一个实施方案中,小鼠的产生可以任选地牵涉破坏鼠C3和/或C5基因及将编码人或人源化C3和/或C5的基因引入鼠基因组中。在一个实施方案中,编码人或人源化C3和/或C5的基因的引入在与内源鼠C3和/或C5基因相同的位置处。
可以通过将转基因引入动物的种系中来产生本发明的转基因非人动物。可以使用处于各种发育阶段的胚胎靶细胞来引入转基因。根据胚胎靶细胞的发育阶段,使用不同的方法。对用于实施本发明的任何动物的具体品系选择总体良好健康,良好胚胎产量,胚胎中良好的原核可见度,和良好的繁殖适度。当要产生转基因小鼠时,常常使用诸如C57BL/6或C57BL/6 x DBA/2F1,或FVB系的品系(可购自Charles River Labs,Boston,Mass.,The Jackson Laboratory,Bar Harbor,ME,或Taconic Labs.)。
可以通过本领域中已知的任何手段(诸如例如显微注射,电穿孔,或脂转染)来完成将转基因引入胚胎中。例如,可以通过将构建体显微注射入受精哺乳动物卵的原核中,以使构建体的一个或多个拷贝在发育中的哺乳动物的细胞中保留来将转基因引入哺乳动物中。在将转基因构建体引入受精卵中后,可以将卵在体外温育不同量的时间,或再植入代孕宿主中,或这两者。体外温育至成熟在本发明的范围内。一种常见的方法是在体外温育胚胎约1-7天(取决于物种),然后将它们再植入代孕宿主中。
使用标准方法完成再植入。通常,麻醉代孕宿主,并将胚胎插入输卵管中。植入特定宿主中的胚胎的数目会随物种而变化,但是通常会与该物种天然产生的后代的数目相当。
也可以使用逆转录病毒感染将转基因引入非人动物中。可以在体外培养发育中的非人胚胎至胚泡期。在此时间期间,卵裂球可以是逆转录病毒感染的靶物(Jaenich,R.(1976)PNAS 73:1260-1264)。通过酶处理除去透明带来获得卵裂球的有效感染(Manipulating the Mouse Embryo,Hogan编(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,1986)。用于引入转基因的病毒载体系统通常是携带转基因的复制缺陷型逆转录病毒(Jahner et al.(1985)PNAS 82:6927-6931;Van der Putten et al.(1985)PNAS 82:6148-6152)。
用于转基因引入的第三类靶细胞是胚胎干(ES)细胞。可以通过DNA转染或通过逆转录病毒介导的转导将转基因有效引入ES细胞中。此后,可以将此类经转化的ES细胞与来自非人动物的胚泡组合。此后,ES细胞定殖于胚胎并有助于所得嵌合动物的种系。
可以将包含人源化C3和/或C5的转基因动物与其它动物杂交。一种制备方式是产生一系列哺乳动物,每个含有期望的构建体或转基因之一。经由一系列杂交,回交和选择将此类哺乳动物一起育种,以最终产生含有所有期望构建体和/或转基因的单一哺乳动物,其中除了存在期望的构建体和/或转基因外,该哺乳动物与野生型在其它方面是同基因的(遗传上相同的)。在一个实施方案中,以此方式产生包含人或人源化C3和/或C5基因的小鼠。
典型地,根据育种过程中每个特定步骤的目标,通过将同胞或亲本品系与后代交配来实现杂交和回交。在某些情况中,可能有必要产生大量的后代,以便产生在适当的染色体位置中含有敲除构建体和/或转基因中每一种的单一后代。另外,可能有必要杂交或回交数个世代,以最终获得期望的基因型。人源化C3和/或C5非人动物用于鉴定能够调控补体系统的化合物的用途
在一些方面,本文中提供了用于鉴定能够调控补体活化的候选治疗性分子(即化合物)的方法。该方法利用本文中公开的任何人源化C3和/或C5啮齿动物(例如小鼠或大鼠)。在一些实施方案中,在实验性诱导补体活化(例如在肾缺血/再灌注模型中)后,对啮齿动物直接施用候选化合物,并就其调控补体系统的能力而言评估所述化合物的效果。在其它实施方案中,使候选化合物与自这些动物获得的血清接触,并使用任何常用的体外评估技术(例如但不限于CH50测定法)评估补体活性。
在一些实施方案中,候选化合物可以通过降低,减少或抑制补体活化来调控补体活化。与没有用候选化合物处理的对照啮齿动物相比,化合物可以将本文中公开的任何啮齿动物中的补体活化降低1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,11%,12%,13%,14%,15%,16%,17%,18%,19%,20%,21%,22%,23%,24%,25%,26%,27%,28%,29%,30%,31%,32%,33%,34%,35%,36%,37%,38%,39%,40%,41%,42%,43%,44%,45%,46%,47%,48%,49%,50%,51%,52%,53%,54%,55%,56%,57%,58%,59%,60%,61%,62%,63%,64%,65%,66%,67%,68%,69%,70%,71%,72%,73%,74%,75%,76%,77%,78%,79%,80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%之任一。
在另一个实施方案中,候选化合物可以降低,减少或抑制补体活化长达1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,11小时,12小时,18小时,24小时,30小时,36小时,42小时,48小时,54小时,60小时,66小时,72小时,4天,5天,6天,7天,8天,9天,10天,11天,12天,13天,14天或3周(包括这些值之间的任何时间段)。
在其它实施方案中,候选化合物可以通过增加,放大或活化补体活性来进一步调控补体活化。与没有用候选化合物处理的对照啮齿动物相比,化合物可以将本文中公开的任何啮齿动物中的补体活化提高1%,2%,3%,4%,5%,6%,7%,8%,9%,10%,11%,12%,13%,14%,15%,16%,17%,18%,19%,20%,21%,22%,23%,24%,25%,26%,27%,28%,29%,30%,31%,32%,33%,34%,35%,36%,37%,38%,39%,40%,41%,42%,43%,44%,45%,46%,47%,48%,49%,50%,51%,52%,53%,54%,55%,56%,57%,58%,59%,60%,61%,62%,63%,64%,65%,66%,67%,68%,69%,70%,71%,72%,73%,74%,75%,76%,77%,78%,79%,80%,81%,82%,83%,84%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,或100%之任一。
在另一个实施方案中,候选化合物可以增加,放大或活化补体活性长达1小时,2小时,3小时,4小时,5小时,6小时,7小时,8小时,9小时,10小时,11小时,12小时,18小时,24小时,30小时,36小时,42小时,48小时,54小时,60小时,66小时,72小时,4天,5天,6天,7天,8天,9天,10天,11天,12天,13天,14天或3周(包括这些值之间的任何时间段)。
候选化合物可以是但不限于小分子化学化合物,抗体,蛋白质,抑制性核酸或其任何组合。
1.抗体
在一些方面,候选化合物结合(诸如优先结合)补体蛋白(例如但不限于C5或C3(例如C3a)),并且是抗体。在一些实施方案中,抗体是C5和/或C3拮抗剂,并且可以减少补体活化。在其它实施方案中,抗体是C5和/或C3激动剂,并且可以增加补体活化。
也可以基于本领域中已知的信息在基本上不影响抗体活性的情况中生成抗体的变体。例如,抗体变体可以具有由不同残基替换的抗体分子中的至少一个氨基酸残基。对于抗体,替代诱变最感兴趣的位点通常包括高变区,但也涵盖框架区(FR)改变。
对于抗体,一类替代变体牵涉替代亲本抗体(例如人源化或人抗体)的一个或多个高变区残基。通常,选择用于进一步开发的所得变体相对于产生它们的亲本抗体具有改善的生物学性质。用于产生此类替代变体的方便的方式牵涉使用噬菌体展示的亲和力成熟。简言之,突变几个高变区位点(例如6-7个位点)以在每个位点处产生所有可能的氨基酸替代。以与在每个颗粒内包装的M13的基因III产物的融合物自丝状噬菌体颗粒展示如此产生的抗体。然后,对噬菌体展示的变体筛选其生物活性(例如结合亲和力),如本文中公开的。为了鉴定用于修饰的候选高变区位点,可以实施丙氨酸扫描诱变以鉴定显著促成抗原结合的高变区残基。
可以通过本领域中已知的多种方法制备编码抗体的氨基酸序列变体的核酸分子。这些方法包括但不限于自天然来源的分离(在天然存在的氨基酸序列变体的情况中)或通过抗体的早期制备变体或非变体型式的寡核苷酸介导的(或定点)诱变,PCR诱变和盒式诱变制备。
可以期望在本发明的免疫球蛋白多肽的Fc区中引入一处或多处氨基酸修饰,从而产生Fc区变体。Fc区变体可以包含人Fc区序列(例如,人IgG1,IgG2,IgG3或IgG4Fc区),其在一个或多个氨基酸位置(包括铰链半胱氨酸的氨基酸位置)处包含氨基酸修饰(例如替代)。
在国际专利申请公开No.:W099/51642(通过援引将其收入本文)中描述了具有改变(即改善或减少)的C1q结合和/或补体依赖性细胞毒性(CDC)的Fc区变体。此类变体可以包含在Fc区的一个或多个氨基酸位置处的氨基酸替代。也见Duncan&Winter,Nature 322:738-40(1988);美国专利No.5,648,260;美国专利No.5,624,821;和关注Fc区变体的国际专利申请公开No.:WO94/29351,通过援引将每篇的公开内容收入本文。
2.非抗体结合多肽
在一些方面,候选化合物结合(例如优先结合)补体蛋白(诸如C5或C3(例如C3a)),并且是非抗体结合多肽。在一些实施方案中,非抗体结合多肽是C5和/或C3拮抗剂,并且可以减少补体活化。在其它实施方案中,非抗体结合多肽是C5和/或C3激动剂,并且可以增加补体活化。
可以使用已知的多肽合成方法化学合成或者可以使用重组技术制备并纯化结合多肽。结合多肽的长度通常为至少约5个氨基酸,或者长度为至少约6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99,或100个氨基酸或更多,其中此类结合多肽能够结合靶物,诸如本文中讨论的任何补体蛋白(例如C5或C3)。
可以使用公知的技术在无需过度实验的情况中鉴定结合多肽。在此方面,注意到用于对多肽文库筛选能够结合多肽靶物的结合多肽的技术是本领域中公知的(见例如美国专利No.5,556,762,5,750,373,4,708,871,4,833,092,5,223,409,5,403,484,5,571,689,5,663,143;PCT申请公开文本No.WO 84/03506和WO84/03564;Geysen et al,Proc.Natl.Acad.Sci.U.S.A.,81:3998-4002(1984);Geysen et al,Proc.Natl.Acad.Sci.U.S.A.,82:178-182(1985);Geysen et al.,J.Immunol.Meth,,102:259-274(1987);Clackson,T.et al.,(1991)Nature,352:624;Kang,A.S.et al.,(1991)Proc.Natl.Acad.Sci.USA,88:8363,及Smith,G.P.(1991)Current Opin.Biotechnol,2:668,通过援引将每篇的公开内容收入本文。
也在美国专利No.5,723,286,5,432,018,5,580,717,5,427,908,5,498,530,5,770,434,5,734,018,5,698,426,5,763,192,和5,723,323中公开了用于产生肽文库和筛选这些文库的方法,通过援引将每篇的公开内容收入本文。
可以修饰结合多肽以增强它们的抑制和/或治疗效果(包括例如增强的亲和力,改善的药动学性质,诸如半衰期,稳定性和清除率,降低的毒性等)。此类修饰包括但不限于糖基化,PEG化,用非天然存在但功能等同的氨基酸替代,连接基团等。
3.小分子
在一些方面,候选化合物结合(例如优先结合)补体蛋白(例如C5或C3(例如C3a)),并且是小分子。在一些实施方案中,小分子是C5和/或C3拮抗剂并且可以减少补体活化。在其它实施方案中,小分子是C5和/或C3激动剂,并且可以增加补体活化。
优选地,小分子是与如本文中定义的结合多肽或抗体不同的有机分子。可以使用已知的方法鉴定并且化学合成有机小分子(参见例如PCT申请公开No.WO 00/00823和WO 00/39585)。有机小分子的大小通常是小于约2000道尔顿,或者大小是小于约1500,750,500,250或200道尔顿,其中可以使用公知的技术在无需过度实验的情况中鉴定能够结合如本文中描述的多肽的此类有机小分子。在此方面,注意到用于对有机小分子文库筛选能够结合多肽靶物的分子的技术是本领域中公知的(参见例如PCT申请公开文本No.WO 00/00823和WO 00/39585)。
有机小分子可以是例如醛,酮,肟,腙,缩氨基脲,碳二酰肼,伯胺,仲胺,叔胺,N-取代的肼,酰肼,醇,醚,硫醇,硫醚,二硫化物,羧酸,酯,酰胺,脲,氨基甲酸酯,碳酸酯,缩酮,硫缩酮(thioketals),缩醛,硫缩醛,芳基卤化物,磺酸芳基酯,烃基卤化物,磺酸烃基酯,芳香族化合物,杂环化合物,苯胺,烯,炔,二醇,氨基乙醇,口恶唑烷,口恶唑啉,噻唑烷,噻唑啉,烯胺,氨苯磺胺,环氧化物,氮丙啶,异氰酸酯,磺酰氯,重氮化合物,酰氯等。
在一些方面,小分子化学化合物是组合化学文库的组分。组合化学文库是由较小的亚单位或单体构成的多种化学化合物的集合。组合文库达到多种大小,范围为几百到几十万种不同种类的化学化合物。还有多种文库类型,包括由化合物,诸如碳水化合物,寡核苷酸和小有机分子等构成的寡聚和聚合文库。此类文库具有多种用途,诸如化学化合物的固定化和层析分离,以及用于鉴定和表征能够结合靶分子(例如,C5和/或C3)或介导感兴趣的生物学活性(例如但不限于补体活性的抑制或活化)的配体的用途。
用于在固相支持物上合成化合物文库的各种技术是本领域中已知的。固相支持物通常是具有经官能化以与亚单元或单体结合以形成文库化合物的表面的聚合物体。一个文库的合成通常牵涉大量的固相支持物。为了生成组合文库,在仔细控制的预定的化学反应顺序中将固相支持物与化合物的一个或多个亚单位和与一个或多个数目的试剂起反应。换言之,在固相支持物上“生长”文库亚单位。文库越大,需要的反应的数目越大,从而使追踪构成文库的多种化合物的化学组成的任务复杂化。在一些实施方案中,小分子的大小小于约2000道尔顿,或者大小是小于约1500,750,500,250或200道尔顿。
可以自可以在固体支持物上实施的任何类型的化学反应衍生本文中任何方面中描述的小分子药剂。此类化学反应包括但不限于2+2环加成,包括丁二烯的捕获;[2+3]环加成,包括异口恶唑啉,呋喃和修饰肽的合成;缩醛形成,包括二醇,醛和酮的固定化;羟醛缩合,包括醛的衍生化,丙二醇的合成;苯偶姻缩合,包括醛的衍生化;环缩合,包括苯并二氮杂和乙内酰脲,噻唑烷,转角模拟物(turn mimetics),卟啉,酞菁;Dieckmann环化,包括二酯的环化;第尔斯-阿尔德反应,包括丙烯酸的衍生化;亲电加成,包括将醇与烯烃的加成;格里尼亚(Grignard)反应,包括醛的衍生化;Heck反应,包括二取代烯的合成;亨利(Henry)反应,包括原位合成氧化腈(见2+3环加成);催化氢化,包括信息素和肽的合成(烯的氢化);迈克尔(Michael)反应,包括硫烷基酮,双环[2.2.2]辛烷的合成;Mitsunobu反应,包括芳基醚,肽基膦酸酯和硫醚的合成;亲核芳香族取代,包括喹诺酮的合成;氧化,包括醛和酮的合成;Pausen-Khand环加成,包括降冰片二烯与戊炔醇的环化;光化学环化,包括螺旋烃的合成;与有机-金属化合物的反应,包括醛和酰氯的衍生化;用复杂氢化物和锡化合物还原,包括还原羰基,羧酸,酯和硝基基团;Soai反应,包括羧基基团的还原;Stille反应,包括联苯基衍生物的合成;Stork反应,包括取代的环己酮的合成;还原性胺化,包括喹诺酮的合成;Suzuki反应,包括苯乙酸衍生物的合成;和Wittig-Horner反应,包括醛,信息素和硫烷基酮的反应。
公开化学文库的合成以及将那些文库的个别化合物解卷积至个别固相支持物上的参考文献可以参见美国专利申请No.2009/0032592;Needels et al.(1993)Proc.Natl.Acad.Sci.USA 90:10700-10704;及PCT申请公开文本No.WO 97/15390,通过援引将其公开内容收入本文。
4.抑制性核酸
在本发明的一个方面,候选补体调控性化合物是靶向补体系统的组分(例如mRNA)的一种或多种寡核苷酸。抑制性核酸可以是但不限于,反义寡核苷酸,小抑制性RNA(siRNA)或核酶中的任一种。
本发明的寡核苷酸可以是编码补体系统的蛋白质组分的mRNA。寡核苷酸会通过介导其破坏或通过阻止翻译成蛋白质而结合mRNA并干扰其功能。虽然优选,但不需要绝对互补性。如本文中援引,与RNA的一部分“互补”的寡核苷酸序列是指具有足够的互补性以能够与RNA杂交,形成稳定双链体的序列。杂交的能力会取决于互补性的程度和寡核苷酸的长度两者。通常,杂交核酸越长,其可以含有并且仍形成稳定双链体的与RNA的碱基错配越多。本领域技术人员可以通过使用标准规程测定杂交复合物的熔点来确定可容许的错配程度。
一般地,制造成与补体系统的蛋白质的mRNA杂交的互补寡核苷酸靶向mRNA的任何区域,包括靶向mRNA的5’非翻译区,靶向AUG起始密码子的互补序列,或者靶向3’非翻译区。
寡核苷酸可以具有备选的核苷间连接,例如但不限于硫代磷酸酯(Mag at al.,Nucleic Acids Res.19:1437-1441,1991;和美国专利No.5,644,048),肽核酸或PNA(Egholm,Nature,3685:566-568,1993;和美国专利No.6,656,687),磷酰胺(Beaucage,Methods Mol.Biol.20:33-61,1993),二硫代磷酸酯(Capaldi et al.,Nucleic Acids Res.,28:E40,2000)。其它寡核苷酸类似物包括诸如但不限于吗啉代(Summerton,Biochim.Biophys.Acta,1489:141-158,1999),锁定寡核苷酸(Wahlestedt wt al.,Proc.Natl.Acad.Sci.USA,97:5633-5638,2000),肽核苷酸或PNA(Nielsen et al.,1993;Hyrup and Nielsen,1996)或2-o-(2-甲氧基)乙基修饰的5’和3’端寡核苷酸(McKay et al.,J.Biol.Chem.,274:1715-1722,1999)。在此通过援引明确收录所有这些参考文献。核酸可以含有脱氧核糖核苷酸和核糖核苷酸的任何组合,和碱基的任何组合,所述碱基包括尿嘧啶,腺嘌呤,胸腺嘧啶,胞嘧啶,鸟嘌呤,肌苷,黄嘌呤,次黄嘌呤,异胞嘧啶,异鸟嘌呤等。
依照本发明的互补寡核苷酸可以包含至少一个经修饰的碱基模块,其选自下组,所述组包括但不限于5-氟尿嘧啶,5-溴尿嘧啶,5-氯尿嘧啶,5-碘尿嘧啶,次黄嘌呤,黄嘌呤,4-乙酰基胞嘧啶,5-(羧基羟甲基)尿嘧啶,5-羧甲基氨基甲基-2-硫尿苷,5-羧甲基氨基甲基尿嘧啶,二氢尿嘧啶,β-D-半乳糖基辫苷(beta-D-galactosylqueosine),肌苷,N6-异戊烯基腺嘌呤,1-甲基鸟嘌呤,1-甲基肌苷,2,2-二甲基鸟嘌呤,2-甲基腺嘌呤,2-甲基鸟嘌呤,3-甲基胞嘧啶,5-甲基胞嘧啶,N6-腺嘌呤,7-甲基鸟嘌呤,5-甲基氨基甲基尿嘧啶,5-甲氧基氨基甲基-2-硫代尿嘧啶,β-D-甘露糖基辫苷(beta-D-mannosylqueosine),5’-甲氧基羧甲基尿嘧啶,5-甲氧基尿嘧啶,2-甲硫基-N6-异戊烯腺嘌呤,尿嘧啶-5-氧乙酸(uracil-5-oxyacetic acid)(v),wybutoxosine,假尿嘧啶,辫苷(queosine),2-硫代胞嘧啶,5-甲基-2-硫尿嘧啶,2-硫尿嘧啶,4-硫尿嘧啶,5-甲基尿嘧啶,尿嘧啶-5-氧基乙酸甲酯,尿嘧啶-5-氧乙酸(v),5-甲基-2-硫尿嘧啶,3-(3-氨基-3-N2-羧基丙基)尿嘧啶,(acp3)w和2,6-二氨基嘌呤。
互补寡核苷酸还可以包含至少一个经修饰的糖模块,其选自包括但不限于阿拉伯糖,2-氟阿拉伯糖,木酮糖和己糖的组。
互补寡核苷酸的长度应当是至少10个核苷酸,并且长度范围可以是10至约50个核苷酸,诸如长度为11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,或50个核苷酸。
评估候选化合物的功效
可以依照本领域普通技术人员公知的体外补体测定法确定在给定的非人动物(诸如啮齿动物,例如小鼠或大鼠)中本发明的候选补体调控化合物,适宜的剂量,和方法的治疗性功效。补体途径在正常活化过程期间产生众多特异性产物,并且已经开发了灵敏且特异性的测定法,并且对于这些活化产物中的大多数是商品化的,包括小活化片段C3a,C4a,和C5a以及大活化片段Bb和sC5b-9。这些测定法中的大多数利用如下的单克隆抗体,所述单克隆抗体与在补体片段上,但不在形成它们的天然蛋白质上暴露的新抗原起反应,使得这些测定法变得非常简单且特异性的。ELISA技术是特别常见的,尽管放射免疫测定法(RIA)也用于检测C3a和C5a。后一类测定法测量未加工的片段及其经加工的片段(即,在循环中找到的主要形式)两者。C3a的测量提供补体活化的一种灵敏的途径非依赖性的指示物。膜攻击途径活化的流体相产物sC5b-9的检测提供补体受活完成的证据。此外,经典途径还产生C4a,其测量提供关于C3b抑制剂的活性及此类抑制剂是否活化经典途径的信息。
另外,熟练技术人员也可用数种补体活化的体内模型来评估候选化合物调控补体系统的能力。例如,补体系统牵涉在缺血事件和随后的血流恢复后遭受的缺血-再灌注损伤。能引起缺血-再灌注损伤的损伤的例子包括但不限于心肌梗死,脑缺血事件,肠缺血,及血管手术,心脏手术,创伤,和移植的许多方面。补体系统的活化在缺血-再灌注损伤的炎性事件中起作用。缺血损伤导致细胞膜的改变,影响外表面的脂质,碳水化合物,或蛋白质,使得这些暴露的表位改变且能起新抗原(经修饰的自身抗原)的作用。经典补体途径牵涉缺血-再灌注损伤由在C3或C4方面遗传缺陷的小鼠证实,所述小鼠在后肢的局部损伤和动物损伤模型中展现出相等的保护(Austen et al.(2003)Int J Immunopath Pharm 16:1)。另外,还已经显示补体活化牵涉缺血损伤的一种肾模型(Guo et al.(2005)Ann Rev Immunol 23:821)。
通过参考以下实施例可以进一步理解本发明,所述实施例作为例示提供且不意图为限制性的。
实施例
实施例1:用人C5基因替换内源小鼠C5基因
含有人C5基因的编码外显子2到42的97kb人C5基因替换跨越编码外显子2到41且包括3’非翻译区的一部分的75.8kb鼠C5基因基因座。见图1。
使用遗传工程技术(参见Valenzuela et al.(2003)High-throughput engineering of the mouse genome coupled with high-resolution expression analysis,Nature Biotech,21(6):652-659)构建用于以单个打靶步骤用人C5基因替换小鼠的打靶构建体。分别从细菌人工染色体(BAC)克隆bMQ-2277L16和CTD-2559I19获得小鼠和人C5DNA。简言之,将通过缺口修复克隆产生的线性化打靶构建体电穿孔到F1H4小鼠胚胎干(ES)细胞(C57BL/6 x 129 F1杂合物)中,所述线性化打靶构建体含有在97kb人C5序列(从刚好在编码外显子2上游的内含子1延伸到编码外显子41和3’非翻译区)(基因组坐标:GRCh38:chr9:120,952,335-121,050,276(-链))和侧翼为lox的(floxed)新霉素选择盒侧翼的小鼠C5上游和下游同源臂。用瞬时Cre表达载体进一步对正确打靶的ES细胞(MAID 7140)进行电穿孔以除去药物选择盒。通过方法(参见美国专利No.7,294,754,7,576,259,7,659,442,以及Poueymirou et al.(2007)F0generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses,Nature Biotech.25(1):91-99)将没有药物盒的靶定ES细胞克隆(MAID 7141)导入8细胞阶段SW小鼠胚胎中。通过使用等位基因测定法的修改(参见Valenzuela et al.(2003))在小鼠等位基因的丧失和人等位基因的获得方面测定基因型来鉴定携带人源化C5基因的(完全自供体ES细胞衍生的F0小鼠)。
通过天然等位基因丧失(LONA)测定法(Valenzuela et al.2003)来鉴定正确打靶的ES细胞克隆,其中通过对小鼠C5基因中的删除靶定序列特异性的两项TaqManTM定量聚合酶链式反应(qPCR)测定天然的未修饰的C5基因的拷贝数。qPCR测定法包括下述引物-探针集合(5’至3’书写):上游正向引物,CCTCCGGTTA ACTGGTTTGT GAT(SEQ ID NO:1);上游反向引物,GCAGTGAATG GTAGACTTCC CA(SEQ ID NO:2);上游探针FAM-AGTGACTTTA CTTTGGTTGT TCTGCTCACA-BHQ(SEQ ID NO:3);下游正向引物,CCGGGAAAGG AAACCAAGAC(SEQ ID NO:4);下游反向引物,CAGCACAGAC TGAGGATCCA A(SEQ ID NO:5);下游探针,FAM-AGACTGTCAT TCTGGCCCGG ACCT-BHQ(SEQ ID NO:6);其中FAM指5-羧基荧光素荧光探针,并且BHQ指黑洞猝灭剂类型的荧光猝灭剂(Biosearch Technologies)。依照制造商的建议,在384孔PCR板(MicroAmpTM光学384孔反应板,Life Technologies)中混合自已经摄取打靶载体且并入其基因组中的ES细胞克隆纯化的DNA与TaqManTM基因表达主混合物(Life Technologies),并且在Applied Biosystems Prism 7900HT中循环,其在PCR过程期间收集荧光数据并确定阈值循环(Ct),即累积荧光达到预设置的阈值时的分数(fractional)PCR循环。对于每份DNA样品,运行上游和下游C5特异性qPCR和用于非靶向参考基因的两项qPCR。计算每项C5特异性qPCR和每项参照基因qPCR之间的Ct值差(ΔCt),然后为所有测定样品计算每个ΔCt和中值ΔCt之间的差,从而为每份样品获得ΔΔCt值。自下述公式计算每份样品中C5基因的拷贝数:拷贝数=2×2-ΔΔCt。正确打靶的克隆(其已经丧失其天然拷贝之一)会具有等于1的C5基因拷贝数。通过包含下述引物-探针集合(以5’至3’书写)的TaqManTMqPCR测定法来确认人源化等位基因中人C5基因序列替换删除的小鼠C5基因序列的确认:人上游正向引物,TGCTCTTAAA GGACCATCAT CAC(SEQ ID NO:7);人上游反向引物,GTAAACGGAT AACGGAAAGG ATAGA(SEQ ID NO:8);人上游探针,FAM-CCATTTCCAA ATGCACTTCC CAGC-BHQ(SEQ ID NO:9);人下游正向引物,CCCACTGAAC TATCACAGGA AACA(SEQ ID NO:10);人下游反向引物,GGAGATGCAT TCCAGTCTCT GTTA(SEQ ID NO:11);人下游探针,FAM-TGAAGATGAC CTCCGGATGT AACGG-BHQ(SEQ ID NO:12)。
对于自靶定ES细胞衍生的小鼠,使用相同的LONA测定法测定自尾部活检纯化的DNA以测定它们的C5基因型并确认人源化C5等位基因已经经由种系传递。繁殖替换呈杂合的两只幼畜以产生人C5基因对内源小鼠C5基因的替换呈纯合的小鼠。使用替换呈纯合的幼畜进行表型测定。
鼠基因座和含有人C5基因的序列的上游接合设计为在
内,其中在人C5基因的第一个核苷酸前的最后一个小鼠C5核苷酸是CTTGT中的最后一个T,并且人C5序列的第一个核苷酸是TCTGC中的第一个T,所述TCTGC跨越AsiSI位点(在圆括号内),其中精确的接合以正斜杠标示。含有人C5基因的序列和侧翼为lox的新霉素选择盒的下游接合设计为在
内,其中人C5序列的最后一个核苷酸是AGCCT中的T,并且侧翼为lox的新霉素选择盒的第一个核苷酸是CTCGA中的第一个C,精确的接合以正斜杠标示。鼠C5基因座的序列的下游接合设计为在
内,其中侧翼为lox的新霉素选择盒的最后一个核苷酸是CTAGC中的第二个C,并且鼠C5基因座的第一个核苷酸是CAGGC中的第一个C,精确的接合以正斜杠标示。含有人C5基因的序列和鼠基因座的下游接合设计为在
内,其中人C5序列的最后一个核苷酸是AGCCT中的“T”,并且小鼠C5序列的第一个核苷酸是CAGGC中的第一个“C”;所述CAGGC跨越在除去侧翼为lox的新霉素选择盒后保留的loxP位点(在圆括号内),其中精确的接合以正斜杠标示。
实施例2:用人C3基因替换内源小鼠C3基因
型式1:用人C3启动子和编码外显子1到41进行的替换
含有人C3基因的5’调节元件和所有编码外显子1到41的人C3基因替换跨越5’调节元件和所有编码外显子2到41的鼠C5基因基因座。基本上使用上文实施例1中描述的方法用人C3基因序列替换小鼠C3基因序列。见图2A。
初步地,通过用侧翼为lox的新霉素盒替换编码外显子2到41和包括聚腺苷酸化位点3’的900bp,在小鼠ES细胞中产生25kb小鼠C3基因的靶向删除。所得小鼠ES细胞12132 ES细胞是杂合C3敲除。依照本领域中已知的规程,使用12132细胞产生C3敲除小鼠。
产生打靶构建体,并电穿孔入12132 ES细胞中,所述打靶构建体含有在人C3序列(从编码外显子1上游的5’调节元件延伸到编码外显子41和3’非翻译区)和侧翼为lox的潮霉素选择盒侧翼的小鼠C3上游和下游同源臂。用瞬时Cre表达载体进一步电穿孔正确打靶的ES细胞(MAID 6148)以除去药物选择盒。将没有药物盒的靶定ES细胞克隆(MAID 6149)引入8细胞阶段小鼠胚胎。如实施例1中描述的,通过在小鼠等位基因的丧失和人等位基因的获得方面测定基因型鉴定完全自携带人源化C3基因的供体ES细胞衍生的F0小鼠。
通过包含下述引物-探针集合(以5’至3’书写)的TaqManTMqPCR测定法来确认C3敲除12132 ES细胞中侧翼为lox的新霉素盒替换删除的小鼠C3基因序列的确认:12132TU,小鼠C3内含子1:正向引物,GGCCTGATTA CATGGACCTG TC(SEQ ID NO:17);反向引物,CCCAGGCTTG GCTGGAATG(SEQ ID NO:18);探针,FAM-TGTCCACTCT GGAAGCCCAG GC-BHQ(SEQ ID NO:19);12132TD,小鼠C3外显子41的3’:正向引物,GCCAGGAGAG GAAGCTGGAG(SEQ ID NO:20);反向引物,TGGCTCAGCA GTAAAGAACA C(SEQ ID NO:21);探针,FAM-ACAGATTGCT GTGAGCTGCC CAAA-BHQ(SEQ ID NO:22);新霉素盒:正向引物,GGTGGAGAGG CTATTCGGC(SEQ ID NO:23);反向引物,GAACACGGCG GCATCAG(SEQ ID NO:24);探针,FAM-TGGGCACAAC AGACAATCGG CTG-BHQ(SEQ ID NO:25)。
通过包含下述引物-探针集合(以5’至3’书写)的TaqManTM qPCR测定法来确认人源化等位基因中人C3基因序列替换删除的小鼠C3基因序列的确认:mC3-1,小鼠C3启动子:正向引物,GCCAGCCTAG CCTACTTCA(SEQ ID NO:26);反向引物,GCCACCCATC CCAGTTCT(SEQ ID NO:27);探针,FAM-CAGCCCAGGC CCTTTAGATT GCA-BHQ(SEQ ID NO:28);mC3-2,小鼠C3 3’非翻译区,正向引物,TACGGTGTTA GGTTCACTAT TGGT(SEQ ID NO:29);反向引物,GTCGCCAGCA GTCTCATACA G(SEQ ID NO:30);探针,CAL Orange-AGTGGGCATC CCTTGCCAGG C-BHQ(SEQ ID NO:31);潮霉素盒:正向引物,TGCGGCCGAT CTTAGCC(SEQ ID NO:32);反向引物,TTGACCGATT CCTTGCGG(SEQ ID NO:33);探针,FAM-ACGAGCGGGT TCGGCCCATT C-BHQ(SEQ ID NO:34);hC3-1,人C3启动子:正向引物,GGGCCTCCTA AGTTTGTTGA GTATC(SEQ ID NO:35);反向引物,CAGGGCTGGT TCCCTAGAAA TC(SEQ ID NO:36);探针,FAM-TACAATAGCA GGCACAGCAC CCA-BHQ(SEQ ID NO:37);hC3-2,人C3内含子1:正向引物,GGCTGAGAGT GGGAGTCATG(SEQ ID NO:38);反向引物,GCACTTGCCA ATGCCATTAT C(SEQ ID NO:39);探针,FAM-CTGCTGTCCT GCCCATGTGG TTG-BHQ(SEQ ID NO:40);hC3-3,人C3外显子41:正向引物,CGAATGCCAA GACGAAGAGA AC(SEQ ID NO:41);反向引物,GGGCACCCAA AGACAACCAT(SEQ ID NO:42);探针,CAL Orange-CAGAAACAAT GCCAGGACCT CGGC-BHQ(SEQ ID NO:43)。
对于自靶定ES细胞衍生的小鼠,使用相同的LONA测定法测定自尾部活检纯化的DNA以测定它们的C3基因型并确认人源化C3等位基因已经经由种系传递。繁殖替换呈杂合的两只幼畜以产生人C3基因对内源小鼠C3基因的替换呈纯合的小鼠。使用替换呈纯合的幼畜进行表型测定。
如上文实施例1中描述的,测定鼠C3基因座和含有人C3基因的序列的接合,含有人C3基因的序列和侧翼为lox的潮霉素选择盒的接合,及侧翼为lox的潮霉素选择盒的序列和鼠C3基因座的接合的序列。
型式2:用人C3编码外显子2到41进行的替换
含有人C3基因的编码外显子2到41的人C3基因替换跨越编码外显子2到41的鼠C5基因基因座。基本上使用上文实施例1中描述的方法用人C3基因序列替换小鼠C3基因序列。见图2B。
初步地,通过用侧翼为lox的新霉素盒替换编码外显子2到41且包括聚腺苷酸化位点3’的900bp,在小鼠ES细胞中产生25kb小鼠C3基因的靶向删除。所得小鼠ES细胞12132ES细胞是杂合C3敲除。
产生打靶构建体,并电穿孔入12132ES细胞中,所述打靶构建体含有在人C3序列(从编码外显子2上游延伸到编码外显子41和3’非翻译区)和侧翼为lox的潮霉素选择盒侧翼的小鼠C3上游和下游同源臂。用瞬时Cre表达载体进一步电穿孔正确打靶的ES细胞(MAID 6155)以除去药物选择盒。将没有药物盒的靶定ES细胞克隆(MAID 6156)引入8细胞阶段小鼠胚胎中。如实施例1中描述的,通过在小鼠等位基因的丧失和人等位基因的获得方面测定基因型鉴定完全自携带人源化C3基因的供体ES细胞衍生的F0小鼠。
通过包含与上文型式1中描述的相同的引物-探针集合(以5’至3’书写)的TaqManTMqPCR测定法确认C3敲除12132ES细胞中侧翼为lox的新霉素盒替换删除的小鼠C3基因序列,及人源化等位基因中人C3基因序列替换删除的小鼠C3基因序列的确认。
对于自靶定ES细胞衍生的小鼠,使用相同的LONA测定法测定自尾部活检纯化的DNA以测定它们的C3基因型并确认人源化C3等位基因已经经由种系传递。繁殖替换呈杂合的两只幼畜以产生人C3基因对内源小鼠C3基因的替换呈纯合的小鼠。使用替换呈纯合的幼畜进行表型测定。
如上文实施例1中描述的,测定鼠C3基因座和含有人C3基因的序列的接合,含有人C3基因的序列和侧翼为lox的潮霉素选择盒的接合,及侧翼为lox的潮霉素选择盒的序列和鼠C3基因座的接合的序列。
实施例3:小鼠血清中的补体溶血活性测定法
已经将补体与眼炎症和视网膜变性疾病联系起来(参见Mullins et al.(2000)Drusen associated with aging and age-related macular degeneration contain proteins common to extracellular deposits associated with atherosclerosis,elastosis,amyloidosis,and dense deposit disease,FASEB J,14(7):835-846)。通过单克隆抗体(单抗)阻断C5切割是用于这些病症的一种可能的治疗性策略(参见Copland et al.(2009)Systemic and local anti-C5 therapy reduces the disease severity in experimental autoimmune uveoretinitis,Clinical and Experimental Immunology,159:303-314)。为了评估针对补体的疗法,诸如C5和/或C3拮抗剂,测定法是在与补体活化有关的人疾病,病症和状况的适宜模型中在体外和在体内评估候选治疗剂的功能所必需的。
方法
使用经典补体测定法CH50(Gilcas et al.(2001)Classical pathway evaluation,Current Protocols in Immunology,Unit 13.1)评估补体溶血活性。自心脏收集小鼠血液,并在冰上在eppendorf管中凝结1小时;通过离心分离血清,并于-70℃贮存。通过于37℃与家兔抗绵羊溶血素一起温育20分钟致敏绵羊红细胞(E)。将致敏的细胞(EA)与来自小鼠或人的经过处理的血清或对照血清的倍增稀释物一起于37℃温育1小时。使完整的EA细胞形成团粒,并取出上清液以测量541nm处的吸光度,它是溶血的一项指数。与仅缓冲液(0%裂解)或ddH2O(100%裂解)一起温育的EA细胞分别充当阴性和阳性对照。相对于ddH2O对照计算每孔中的溶血百分比和CH50(Holt et al.(2001)Targeted deletion of the CD59 gene causes spontaneous intravascular hemolysis and hemoglobinuria,Blood,98(2):442-449)。如实施例1和2中描述的,用技术产生小鼠,包括C5hu/hu,C5-/-,C3hu/hu,C3-/-,和相应的对照品系。自Quidel Corp.获得正常的,C5消减的,和C3消减的人血清,并用作对照或用于比较。添加补体组分以测试是否能恢复溶血功能。将测试的血清与补体组分;人C5(Sigma-Aldrich或Quidel Corp.,50μg/ml),人C3(Sigma-Aldrich或Quidel Corp.,10,400,1200μg/ml)和鼠C5(Regeneron Pharmaceuticals,50μg/ml)一起于4℃温育40分钟。使用抗人C5单抗(100μg/ml)和抗小鼠C5单抗(Hycult Biotech,10μg/ml)来确认此系统用于未来药物发现的特异性和效用。
结果
野生型小鼠血清具有与正常人血清相比低大约10倍的补体溶血活性。如图3中显示的,如使用CH50值测定的,三批正常或野生型小鼠血清中的补体溶血活性与两批人血清相比低至少10倍。
抗C5单克隆抗体以物种特异性方式阻断溶血。如图4中显示的,抗小鼠C5单克隆抗体(msC5Ab)阻断正常小鼠血清中的补体溶血活性,并且抗人C5单抗(C5Ab)阻断正常人血清和补充有人C5蛋白的人C5消减血清中,而非正常小鼠血清中的溶血活性。
人C5和C3蛋白展现物种特异性溶血活性。如图5A中显示的,人C5和C3蛋白分别能够重建人C5和C3消减的人血清的补体溶血活性。
如图5B中显示的,来自C5-/-和C3-/-小鼠的血清显示缺乏补体活性,并且人源化C5hu/hu小鼠血清展现出无溶血活性,基本上等同于来自C5-/-和C3-/-小鼠的血清。对人源化C5hu/hu小鼠血清添加小鼠C5蛋白挽救补体溶血活性,但是对人源化C5hu/hu小鼠血清添加人C5蛋白不挽救补体活性。
如图5C中显示的,人源化C5hu/hu小鼠血清的补体溶血活性的缺乏看来不是由于缺乏人C5蛋白,因为这些小鼠的血清中存在的人C5蛋白的量是正常人血清中存在的C5蛋白的量的约三分之一。图5D显示相对于给药前补体C5水平,雄性和雌性人源化C5小鼠之间的变化。这些小鼠的血清中存在的人C5蛋白的范围为20至100μg/ml,其足以显示血清中的溶血活性。在这些实验中正常情况下添加的人C5是50μg/ml。
需要人C5和C3蛋白二者来重建小鼠C5敲除血清中的溶血活性。如图6中显示的,通过将人C5蛋白添加至C5-/-小鼠血清不能恢复补体溶血活性,而一起添加人C3和C5蛋白挽救C5-/-小鼠血清中的溶血。
人C3蛋白的添加挽救C5hu/hu小鼠血清中的溶血活性。如图7中显示的,人C3蛋白足以重建来自C5hu/hu小鼠的血清中的补体溶血活性。
基于上述结果,人源化C5hu/hu和/或C3hu/hu小鼠是用来评估人特异性C5和/或C3拮抗剂的PK和PD的适宜非人动物。基于上述结果,双重人源化C5hu/hu和C3hu/hu小鼠血清可以在不需要补充人C5和/或C3蛋白的情况下展现出补体溶血活性,由此构成用于在体内测试人特异性C5和/或C3拮抗剂的治疗功效的适宜小鼠品系。
结论
野生型小鼠血清具有与人血清相比显著更低的补体溶血活性。表达人C5的经遗传修饰的小鼠是功能性鼠C5敲除,可能是因为小鼠转化酶不能切割人C5蛋白。人源化C5小鼠血清需要添加人C3蛋白来实现野生型水平的补体溶血活性。
实施例4:人源化C5和/或C3小鼠的用途
人源化C5和/或C3小鼠对于评估人特异性C5和/或C3化合物(诸如拮抗剂,例如中和性抗C5或抗C3抗体)的药动学(PD)是有用的。
依照本领域中已知的标准规程,例如如美国专利No.6,355,245关于抗C5抗体描述的,实施人源化C5和/或C3小鼠中的药动学(PK)和PD测定法。
人源化C5和/或C3小鼠对于在多种疾病模型中测试人特异性C5或C3拮抗剂(例如中和性抗C5或抗C3抗体)的体内治疗功效是有用的,例如但不限于:干性年龄相关黄斑变性(AMD);湿性AMD;实验性自身免疫性葡萄膜视网膜炎(EAU);眼高血压;和视神经损伤(对于与补体活化有关的疾病,病症和状况的列表,参见例如Makrides(1998)和Mollnes et al.(2006))。
通过高脂肪饮食和蓝光损伤(参见例如Exp Eye Res.2002,75(5):543-553),吸烟(参见例如Invest Ophthalmol Vis Sci.2006,47(2):729-737),羧乙基吡咯(CEP)(参见例如Invest.Ophthalmol.Vis.Sci.2010,51:1276-1281;Nat Med.2012,18(5):791-798)能在人源化C5和/或C3小鼠中诱导干性AMD。
还能繁殖人源化C5和/或C3小鼠成其它转基因AMD模型,诸如例如ApoE(-/-)(参见例如Invest.Ophthalmol.Vis.Sci.2000,41:2035-2042),Mdm1(参见例如Hum.Mol.Genet.2008,17:3929-3941),Sod1(-/-)(参见例如PNAS2006;103:11282-11287),LDLR(-/-)(参见例如Br J Ophthalmol 2005,89:1627-1630),和DICER1(-/-)(参见例如Nature.2011;471(7338):325-330)。
通过激光诱导的脉络膜新血管形成(CNV)能在人源化C5和/或C3小鼠中诱导湿性AMD(参见Nat Protoc.2013,8(11):2197-2211)。
能在人源化C5和/或C3小鼠中诱导EAU(参见例如Clin Exp Immunol.2010,159(3):303-314)。
能在人源化C5和/或C3小鼠中诱导眼高血压(参见例如Experimental Eye Research 2006,83:620-628)。
能在人源化C5和/或C3小鼠中诱导视神经损伤(参见例如J Neurotrauma 2003,20(9):895-904)。
能使用人源化C5小鼠在多种疾病模型中评估人特异性C5拮抗剂,例如但不限于:阵发性夜间血尿;视神经脊髓炎(neuromyletic optica);肾移植;和肾损伤(参见例如美国专利No.6,355,245)。
依照本领域中已知的标准规程,例如美国专利No.6,355,245关于抗C5抗体描述的,使用人源化C5和/或C3小鼠实施治疗功效测定法。
实施例5:人源化C5纯合小鼠中抗C5抗体的药动学/药效学研究
此实施例利用依照先前实施例制备的雄性和雌性人源化C5纯合小鼠来测试抗C5抗体降低补体活化的能力。
方法
在研究中使用总共25只C5hu/hu小鼠(雄性和雌性)。在每个指定的时间点时从两只小鼠收集血清(20μL),其包括“给药前”时间点以及在皮下施用15mg/kg抗人C5单克隆抗体后的3h,6h,1d,2d,4d,1W,2W,4W的时间点。于-20℃贮存样品,直至测定补体活化的药动学(PK)和药效学(PD)改变。
如上文实施例3中描述的,评估补体溶血活性。如上所述,将人C3(Sigma-Aldrich或Quidel Corp.,400和800μg/ml)添加至血清以重演人补体系统。
结果
如图8中显示的,皮下注射15mg/kg抗人C5抗体在注射后降低补体活化至少一周。无论对溶血测定法添加400μg/ml(图8A)还是800μg/ml(图8B)人C3蛋白都观察到此效果。
如图9中显示的,C5单克隆抗体的PK分析揭示了此抗体随时间的清除,到第28天,5只小鼠中的2只具有检测不到的水平。
实施例6:人和小鼠补体蛋白的交叉活性
此实施例使用前述实施例中描述的工程化小鼠调查人和小鼠C3和C5蛋白的交叉活性。如实施例3中讨论的和如图6中显示的,人C5和小鼠C3蛋白不足以在缺乏内源C5的小鼠中重建溶血活性。在此研究中,观察到小鼠C5和人C3恢复C3敲除小鼠中的溶血活性的能力。
方法
如实施例3中描述的,评估补体溶血活性。
如实施例1和2中描述的,用技术产生小鼠,包括C5-/-,C3-/-,和相应的对照品系。自Quidel Corp.获得正常的,C3消减的人血清,并用作对照或用于比较。添加补体组分以测试是否能恢复溶血功能。将测试的血清与补体组分;人C3(Sigma-Aldrich或Quidel Corp.,50,100,500,1200μg/ml);和人C5(Sigma-Aldrich或Quidel Corp.,50μg/ml))一起于4℃温育40分钟。使用抗人C5单抗(100μg/ml)和抗小鼠C5单抗(Hycult Biotech,10μg/ml)来确认此系统用于未来药物发现的特异性和效用。
结果
如图10A中显示的,相对于野生型对照中观察到的溶血功能,对野生型小鼠血清添加人C3蛋白能增强溶血功能。然而,当与将人C3蛋白添加回C3消减的人血清相比时,观察到的增强小于人中显示的增强。此外,如图10B中显示的,使用补充有人C3蛋白的人源化C5hu/hu小鼠血清恢复百分比溶血。
在使用自C3敲除动物衍生的血清重复此实验时,显示对C3-/-血清添加人C3蛋白挽救溶血功能,特别是随着添加递增浓度的人C3(图11)。
比较而言,图12显示将人C3添加至C5无效动物衍生的血清不挽救溶血功能。
结论
总之,自本实施例得到的数据证明,虽然人C3能够与鼠C5起交叉反应,但是小鼠C3类似地不能与人C5起交叉反应以在体外重演补体活性。下文表1中呈现了这些结果的汇总。
表1:小鼠和人C3,C5交叉活性的汇总
- 还没有人留言评论。精彩留言会获得点赞!