一种建立湿热泄泻动物模型的方法与流程
本发明涉及中(兽)医药评价领域,具体涉及一种建立湿热泄泻动物模型的方法。
背景技术:
泄泻系因感受外邪,或饮食内伤,致脾失健运,大肠传导失司,湿盛内阻,以大便次数增多,质稀溏或完谷不化,甚如水样为主要表现的病症,在中(兽)医临床中很常见。近年来,国内外学者为研究泄泻机制、开发治疗泄泻的药物,对泄泻动物模型进行了大量研究。其造模方法主要包括:细菌、病毒、中药、西药等诱导的泄泻模型。这些模型大多忽略了与中(兽)医证型的吻合,且造模因素单一。从中(兽)医证型上来说,泄泻主要分为:湿热泄泻、寒湿泄泻、伤食泄泻、脾虚泄泻、肾阳虚泄和肝郁乘脾泄等。其中最常见的为湿热泄泻。《素问·六元正纪大论篇》曰“湿盛则濡泄,甚则水闭腑肿。”指出泄泻尤以湿邪为重。《杂病源流犀烛·泄泻源流》云:“湿盛则飧泄,乃独由于湿耳。不知风寒热虚,虽皆能为病,苟脾强无湿,四者均不得而干之,何自成泄?是泄虽有风寒热虚之不同,要未有不原于湿者也。”湿热泄泻,证见腹痛即泻,或暴注下迫,色黄而臭;或泄而不爽,粪色黄粘稠腥臭;伴见肛门灼热红肿;小便短赤,身热口渴,舌红苔黄腻,脉象滑数。
湿热泄泻多由外感六淫,或为夏令暑湿,或饥饱失常或饮食肥甘及误食不洁之物等而致邪气客于肠道,久而湿热内生,阻滞气血,肠胃黏涩,气血熏蒸,因湿热蕴蒸,大肠传导失司,清浊不分,混杂而下,并走大肠,而导致泄泻。《古今医鉴》有云:“夫泄泻者,注下之症也。盖大肠为传送之官,脾胃为水谷之海,或为饮食生冷之所伤,或为暑湿风寒之所感,脾胃停滞,以致阑门清浊不分,发注于下而为泄泻也”。无论寒邪、毒邪或暑邪等多与湿邪混杂,进一步损伤脾胃,造成湿邪内生的恶性循环,湿邪日久多化热,湿热胶结难解,致使大肠传导功能紊乱,清浊混杂而下,故见腹泻、黏液、脓血便、腹痛、里急后重等。平素暴饮暴食,或饥饱无度,或偏嗜醇酒厚味,或纵恣口腹,或误食溲腐不洁之物,或夏月恣食生冷瓜果,或过食辛辣刺激等,损伤脾胃,致中焦运化失司,湿浊内生,郁久化热,而成湿热,湿热内蕴,腑气受阻,气血凝滞,或为脓血,而成本病。
建立科学可靠的湿热泄泻动物模型是进行其机理研究的基础。为进一步深入探讨湿热泄泻的本质及探寻其有效治疗中药,很有必要进行湿热泄泻动物模型复制的研究。理想的证型动物模型复制方法要求客观、稳定、重复性好,病因、临床表现、疗效等符合中(兽)医理论的指导。
现有的表现为湿热型泄泻病证的动物模型其造模方法存在以下不足之处:(1)有些造模方法与临床实际不贴近,如高糖高脂、高温高湿+葡聚糖硫酸钠配合乙酸,高糖高脂、高温高湿+番泻叶等,能模拟出湿热泄泻的症状,但是临床上这些原因导致泄泻的情况较少;(2)模型大多采用饲喂高糖高脂饲料的方法来造“内湿”,没有把“饥饱失常”对脾胃损失的因素加入其中,这种方法对脾胃造成损伤需要的时间较长,短时间内难以积累足够“内湿”;(3)模型大多采用大肠杆菌灌胃的方法,大肠杆菌经胃的消化以及低PH环境后,其致泻能力大大减弱。
技术实现要素:
针对现有技术的不足之处,本发明提供了一种湿热泄泻动物模型的复制方法,设计饮蜂蜜水、禁食与饲喂充足饲料并灌胃猪油隔日交替进行的方法来模拟过食肥甘厚味、饥饱失常损伤脾胃造成内湿;设计高温高湿环境来模拟外在湿热环境;设计灌酒的方法,因酒既能生湿又能生热,使内湿和外湿相结合;大肠杆菌为生物致病因子,诱导泄泻。这样建立了一种湿热泄泻的动物模型,并对其进行评价。结果表明,该方法可成功复制湿热泄泻动物模型,而且复制方法稳定性、重复性好,符合中(兽)医理论的指导。
本发明是通过以下技术方案实现的:
一种建立湿热泄泻动物模型的方法,该方法具体包括以下步骤:将大鼠置于代谢笼中,自由饮用蜂蜜水;隔日禁食隔日饲喂充足饲料并灌胃猪油,连续10天;第11-15天每日灌酒并置于高温高湿环境,连续5天;第16天腹腔注射大肠杆菌,24h后再注射一次。
所述蜂蜜水浓度为30%,其各组分的百分比为:能量16%,蛋白质0%,脂肪0%,碳水化合物26%,钠5%。
所述代谢笼为单笼,笼内空间以保持大鼠基本安静、且能够转身移动为标准。
所述酒为56°红星二锅头。
所述高温高湿环境温度为33±2℃,相对湿度为93±2%。
所述大肠杆菌为侵袭性大肠杆菌,血清型为O101,培养浓度为1.6×109CFU/ml。
所用大鼠为SPF级Wistar大鼠,8周龄,体重200±20g。
为更好的实现本发明目的,本发明选用以下方法对湿热泄泻大鼠模型进行评价:大鼠的一般状况指标即精神状态、活动状态、被毛光泽、舌苔、肛周、粪便及体重、体温等;血常规、血粘度、血生化检测;血清细胞因子检测;病理组织学观察。动物模型建立后,用清热解毒、涩肠止泻方药进行干预,如能改变湿热泄泻大鼠的症状表现,以及血常规、血流变、血生化、血清细胞因子和病理组织上的损伤,则佐证了该模型的成立。为了增加以药测证的科学性和客观性,本发明设治疗湿热泄泻的代表方剂郁金散为药物对照组对动物模型进行验证。实验结束后对上述评价指标进行统计学分析,模型组和对照组大鼠相比,差异有统计学意义,且用郁金散干预后,能显著改善本发明所建立模型的湿热症状以及其他评价指标,说明造模成功。
本发明解决了目前湿热泄泻动物模型存在的不足之处,为规范、标准、科学的评价中(兽)医药提供了一种新方法,具有造模稳定性和重复性好、易于操作和控制、贴近临床等特点。
附图说明
图1为湿热泄泻大鼠模型的肛周粪便图,其中A正常对照组,B模型组。
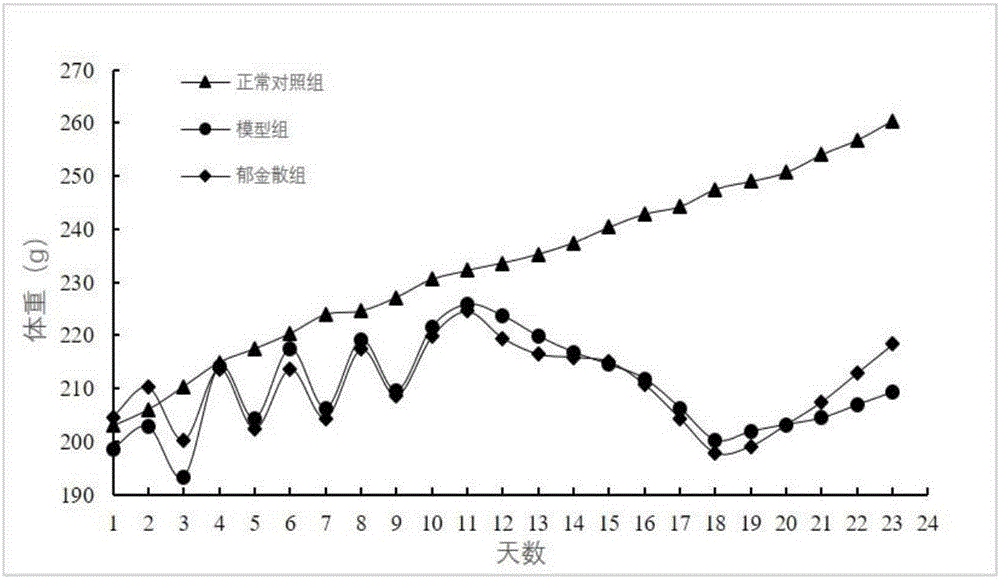
图2为湿热泄泻整个造模过程中大鼠的体重变化趋势图。
图3为湿热泄泻大鼠模型的结肠病理切片图。其中Control为正常组,Model为模型组,Treatment为郁金散组。
图4为湿热泄泻大鼠模型的回肠病理切片图。其中Control为正常组,Model为模型组,Treatment为郁金散组。
具体实施方式
下面结合实施例对本发明做进一步的说明,但本发明并不受限于此。
实施例1
1模型制备材料及方法
1.1动物:SPF级Wistar大鼠36只,雌雄各半,8周龄,体重200±20g,由兰州大学实验动物中心提供,实验动物许可证号:SCXK(甘)2013-0002。室温调整在18-25℃,湿度在50%±5%,12h光照和12h黑暗环境,标准饮食,自由给水。适应5天后,进行试验。
1.2药物:郁金散组成比例:郁金30g、诃子15g、黄芩30g、大黄60g、黄连30g、栀子30g、白芍15g、黄柏30g,均购自甘肃西域阳光大药房。首先将全部药物放入10倍水中浸泡30min,以武火煮沸,以文火煎煮30min,纱布过滤;药渣再分别加入8倍和6倍水,煎煮2次;合并3次滤液,布氏漏斗抽滤,计算大鼠给药剂量,水浴浓缩至浓度为临床等效剂量。
1.3菌种:侵袭性大肠杆菌干燥菌种O101,购自中国兽医药品监察所,菌号CVCC231。
1.4试剂:戊巴比妥钠,货号:P3761,美国Sigma公司;无水乙醇,分析纯,天津市光复科技发展有限公司;丙三醇,分析纯,批号100117,天津市富宇精细化工有限公司;磷酸二氢钠,分析纯,天津市光复精细化工研究所;磷酸氢二钠,分析纯,天津市大茂化学试剂厂;氯化钠,分析纯,批号20150410,国药集团化学试剂有限公司;胰蛋白胨,批号20140608,北京奥博星生物技术有限责任公司;牛肉膏,批号20131018,北京奥博星生物技术有限责任公司;营养琼脂,批号20140807,青岛高科园海博生物技术有限公司;甲醛,分析纯,天津市大茂化学试剂厂;大鼠IL-1β、IL-10、TNF-α、DAO、D-LA ELISA试剂盒,北京奇松生物科技有限公司。
1.5仪器:YP2002N型电子天平,上海精密科学仪器有限责任公司;Thermo SCIENTIFIC SORVALL ST 8R高速冷冻离心机,美国Thermo Scientific公司;QL-901漩涡仪,海门市其林贝尔仪器制造有限公司;TDZ5-WS台式低速自动平衡离心机,长沙湘仪离心机仪器有限公司;HH-S恒温水浴锅,金坛市恒丰仪器厂;KQ-300DE型数控超声波清洗器,昆山市超声仪器有限公司;KDM型调温电热套,山东省鄄城光明仪器有限公司;SYQ-DS-280B手提式压力蒸汽灭菌锅,上海申安医疗器械有限公司;Leica切片机,德国Leica公司;OlympusDP-71显微照相系统,日本Olympus公司;数字肛温计,四川科仪诚科技有限公司;LRH-70生化培养箱,上海一恒科学仪器有限公司;iMark型酶标仪,美国BIO-RAD公司;迈瑞BC5300Vet五分类动物血液细胞分析仪,深圳迈瑞生物医疗电子股份有限公司;LG-R-80血液粘度仪,北京中勤世帝科学仪器有限公司;德国Erba XL-640全自动生化分析仪,德国Erba公司。
2.方法
2.1动物分组及模型建立大鼠称重,随机分为正常对照组、湿热泄泻模型组、郁金散治疗组,每组12只。湿热泄泻模型组大鼠自由饮蜂蜜水(30%),单日禁食,双日喂以充足普通饲料并灌服猪油4ml/200g,共10d;然后将大鼠置于造模箱(33±2℃,相对湿度93±2%),同时每天灌酒(56°红星二锅头)2ml/200g共5d;再以产毒性大肠杆菌菌液(1.6×109CFU/ml)腹腔注射(2ml/kg),24h后再注射1次(1ml/kg)。正常对照组大鼠喂饲普通饲料、自由饮用普通水,处于自然环境(湿度控制在40%-60%,温度在22-25℃),全程灌胃、腹腔注射等体积生理盐水。郁金散治疗组前期处理同模型组,造模结束后连续灌胃郁金散(5.2g/kg)5天。模型组和正常对照组灌胃等体积生理盐水。
2.2湿热泄泻模型各项性能指标检测
2.2.1标本采集动物实验结束后,腹腔注射1%的戊巴比妥钠麻醉大鼠(30mg/kg),腹主动脉采血,1ml采集在EDTA-K2抗凝管中,1ml采集在肝素钠抗凝管中,其余血液采集在普通真空采血管中(37℃恒温箱中静置2h,3000rmp离心分离血清,-20℃下保存备用)。迅速剪取自回盲部开始的2cm回肠和2cm结肠,置于10%福尔马林溶液中室温浸泡15天。
2.2.2一般状况观察每天观察大鼠的一般状况指标,包括精神状态、活动状态、生长体态、被毛、饮食欲、粪便、肛门、尿液,并加以记录。根据表1中所列的症状积分量化各组大鼠的临床症状,各项症状正常积0分,临床病理症状越明显,积分越高,最后根据量化的症状表统计分析。
2.2.3体重及体温测试每天用电子秤秤大鼠的体重,攻毒大肠杆菌前后、治疗前后用数字体温计测定大鼠的体温。
2.2.4腹泻指数测定腹泻指数(DI)=稀便率×稀便级,稀便率=每只大鼠的稀便次数/大便的总次数。稀便级根据滤纸上污迹范围的大小分为四级:1级为污迹直径<1cm,2级为污迹直径在1-1.9cm,3级为污迹直径<2-3cm,4级为污迹直径>3cm。
2.2.5血常规检测取EDTA-K2抗凝的血液用全自动血液分析仪进行血常规检测。
2.2.6血粘度检测取肝素钠抗凝的血液用血粘度仪进行血粘度检测。
2.2.7血生化检测将采集的血清用全自动生化分析仪测定丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、γ-谷氨酰转移酶(GGT)、总胆固醇(TC)、甘油三酯(TG)。
2.2.8血清细胞因子检测取-20℃下保存的血清,室温下解冻,根据ELISA试剂盒说明进行IL-1β、TNF-α、IL-10、DAO、D-LA测定。
2.2.9组织病理学检查取福尔马林溶液中已固定的回肠和结肠,制作病理切片,并显微镜下观察病变情况。
2.3数据统计与分析数据均采用平均数±标准差表示,所用统计软件为SPSS 21.0,均值统计分析用单因素方差分析法。P<0.05被认为统计上差异显著,P<0.01被认为是差异极显著。
3.结果
3.1一般状况指标观察
实验前所有大鼠精神良好、反应灵敏,活泼好动、喜打逗,被毛柔顺洁白有光泽,饮食欲正常,大便黑硬成形,尿液淡黄。实验后,正常对照组无明显异常表现,体重日渐增加。模型组,在高糖高脂阶段,前1-5天粪便软、饱满圆润,禁食的一天饮水量、尿量增加,尿液淡黄;给食灌胃猪油的一天尿量相对较少,粪便偏白,第6-8天时有部分大鼠拉稀便,然后大便逐渐转干带黄,鼻孔有出血现象,其他无明显变化。高温高湿阶段,前期大便基本成形黏腻发黄,后期有部分出现拉稀现象,进入高温仓后,肛温有一定程度的升高,精神不振(P<0.01),身体舒展,懒动或不动(P<0.01),被毛杂乱发黄(P<0.01),食欲不振(P<0.01),阴囊松驰下垂;移出高温仓进入自然环境后,刚开始体温略低于正常体温,稍后精神状态、活动状态明显恢复。攻毒大肠杆菌4h后,精神高度沉郁、羞明、寒战、蜷缩、扎堆(P<0.01),眼睑红肿且分泌物增多,食欲减退甚至废绝(P<0.01),饮欲下降(P<0.01),4-6h出现泄泻症状,被毛杂乱发黄(P<0.01),体温升高(P<0.01),大部分肛门红肿甚至扩张(P<0.01),大便溏泄或黏腻、色黄恶臭、部分出现粘液脓血便(P<0.01),肛周及尾根浊秽粘附黄色稀便(P<0.01)(见图1),部分出现黄腻苔。郁金散治疗组前期造模症状同模型组,给药24h后精神好转(P<0.05),饮食量、活动量逐渐增加(P<0.05),3天后症状明显减轻,体温恢复到正常水平,被毛渐有光泽(P<0.05),泄泻症状减轻(P<0.05),5天后症状基本恢复正常。
表1实验大鼠生物学表征半定量评分观察表
3.2腹泻指数
表2湿热泄泻模型大鼠的腹泻指数(n=12)
注:与正常对照组相比*P<0.05;与模型组相比#P<0.05。
表2显示,第1-5天模型组和正常对照组相比,模型组的各腹泻指数显著大于正常对照组(P<0.05);第1-4天郁金散组和正常对照组相比,郁金散组的各腹泻指数显著大于正常对照组(P<0.05);第5天郁金散组和正常对照组相比,腹泻指数差异不显著(P>0.05);第3-5天郁金散组和模型组相比,郁金散组的各腹泻指数显著小于模型组(P<0.05)。
3.2体重情况变化
图2整个造模过程中的大鼠的体重变化情况
图2显示,在整个造模过程中,正常对照组的大鼠体重逐渐上升。模型组和郁金散组在第1-10天高糖高脂阶段,喂充足饲料并灌油的一天体重上升,禁食的一天体重下降,但总趋势体重逐渐上升;高温高湿阶段体重逐渐下降;攻毒大肠杆菌的两天体重下降程度大于高温高湿阶段,自然环境下时体重上升;喂药后体重逐渐上升,且郁金散组上升程度大于模型组。
3.3肛温变化
表3各组大鼠造模前后、治疗后肛温变化(℃,n=12)
注:与本组造模前比较,*P<0.05,**P<0.01;治疗后与本组造模后比较,#P<0.05,##P<0.01。相同时期,与正常对照组相比,☆P<0.05,☆☆P<0.01;郁金散组与模型组相比,ΔP<0.05。
表3显示,大鼠体温在造模前后、治疗前后发生了很大变化:整个实验过程正常对照组大鼠肛温正常无明显变化。在造模前,各组大鼠体温均正常,造模后模型组和郁金散组体温极显著升高(P<0.01);郁金散组灌服郁金散后体温极显著下降(P<0.01),基本达到正常,而模型组没有郁金散组下降明显(P<0.05)。
3.4血常规指标
表4各组大鼠的血常规指标(n=12)
注:同列肩标不同字母者差异显著(P<0.05)
表4显示,血常规中的白细胞数、中性细胞数、红细胞数、红细胞压积、血红蛋白浓度均为模型组显著大于正常对照组(P<0.05),而郁金散组显著小于模型组(P<0.05),说明湿热泄泻模型动物机体有炎症反应和脱水现象,而郁金散治疗后得以显著缓解。
3.5血粘度指标
表5各组大鼠的血粘度(n=12)
注:模型组与正常对照组相比,**P<0.01;郁金散组与模型组比较,#P<0.05,##P<0.01。
表5显示,200s-1、30s-1、5s-1、1s-1几个切变率下,模型组的血粘度均极显著大于正常对照组(P<0.01);200s-1、30s-1、1s-1三个切变率下,郁金散组均极显著小于模型组(P<0.01),5s-1切变率下郁金散组显著小于模型组(P<0.05)。说明湿热泄泻模型动物的血粘度升高,郁金散具有显著地缓解湿热泄泻模型动物的血粘度作用。
3.6血生化指标
表6各组大鼠的血生化指标(n=12)
注:模型组与正常对照组相比,*P<0.05,**P<0.01;郁金散组与模型组比较,#P<0.05,##P<0.01。
表6显示,模型组的ALT和AST极显著大于正常对照组(P<0.01),郁金散组显著小于模型组(P<0.05)。说明湿热泄泻模型动物的血液转氨酶活性升高,郁金散能够降低转氨酶活性。模型组的GGT显著大于正常对照组(P<0.05),郁金散组显著小于模型组(P<0.05)。说明湿热泄泻模型动物的血液GGT活性升高,郁金散能降低其活性。模型组的TG极显著大于正常对照组(P<0.01),郁金散组极显著小于模型组(P<0.01);模型组的TCH显著大于正常对照组(P<0.05),郁金散组显著小于模型组(P<0.05)。说明湿热泄泻模型动物的血脂升高,郁金散能够降低其血脂。
3.7血清细胞因子指标
表7各组大鼠的血清细胞因子(n=12)
注:模型组与正常对照组相比,**P<0.01;郁金散组与模型组比较,#P<0.05,##P<0.01。
表7显示,模型组的IL-1β极显著高于正常对照组(P<0.01),郁金散组极显著低于模型组(P<0.01);模型组的IL-10极显著低于正常对照组(P<0.01),郁金散组显著高于模型组(P<0.05);模型组的TNF-α极显著高于正常对照组(P<0.01),郁金散组显著低于模型组(P<0.05)。说明湿热泄泻模型动物的炎症反应升高,经郁金散治疗后炎症反应下降。模型组的DAO极显著高于正常对照组(P<0.01),郁金散组极显著低于模型组(P<0.01);模型组的D-LA极显著高于正常对照组(P<0.01),郁金散组显著低于模型组(P<0.05)。说明湿热泄泻模型动物的肠道屏障收到破坏,经郁金散治疗后得到恢复。
3.8组织病理变化
3.8.1结肠组织的病理变化正常对照组的结肠上皮完整,刷状缘清晰可见,固有层内的静脉血管有少量红细胞,但血管形态正常。模型组结肠上皮坏死脱落,完整性被破坏;结肠肠腺周围固有层内有大量的中性粒细胞浸润,可见固有层动脉静脉内有大量的红细胞堆积,呈较严重的充血淤血状态。治疗组,上皮再生,完整性得以恢复,中性粒细胞减少,充血淤血情况有效缓解(见图3)。
3.8.2回肠组织的病理变化正常对照组,回肠绒毛上皮完整,固有层内的静脉血管未见淤血,形态正常。模型组,肠绒毛上皮完整性被破坏,部分上皮脱落;肠绒毛固有层内有中性粒细胞浸润;回肠隐窝周围也可见少量中性粒细胞浸润;可见绒毛上皮变形坏死,固有层有中性粒细胞浸润。治疗组,肠绒毛上皮再生,完整性得到恢复,中性粒细胞浸润减少(见图4)。
由上述结果得知,模型组大鼠的一般状况指标可以体现湿热泄泻动物被毛杂乱,体温升高,肛门扩张,大便溏泄黏腻、色黄恶臭,肛周污秽的表现;同时,腹泻指数、血常规指标、血粘度指标、血生化指标、血清细胞因子指标及病理组织变化更客观的表明模型动物湿热泄泻时血液粘稠、机体炎症程度升高、肠道完整性受到破坏的情况。
其次,治疗作用的反证也是衡量模型建立是否成功的一个重要标志。郁金散是中(兽)医中典型的清热解毒、涩肠止泻的方剂之一,本发明将郁金散用于湿热泄泻证候模型的治疗,结果显示其可显著改善模型大鼠的一般状况、腹泻情况、炎症情况,降低血液粘稠度,促进肠道完整性的修复,从而反证了湿热泄泻动物模型成功建立。
- 还没有人留言评论。精彩留言会获得点赞!