一种基于愈伤组织分化的香椿再生体系的制作方法
本发明涉及植物的再生体系,具体地涉及一种基于愈伤组织分化的香椿再生体系。
背景技术:
香椿 (Toona sinensis Roem) 属楝科香椿属多年生高大落叶乔木,原产于我国,在我国栽培历史悠久,具有较高的经济价值,自古为我国人民所喜爱。香椿的嫩芽、幼叶,以其独特的风味和丰富的营养被人们视为风味佳品。香椿芽可鲜食或作为加工原料,香椿籽油的加工和利用也在研究中。由于香椿具有重要的经济价值,我国很多地方已开始大面积栽培。香椿是一个高度杂合体,优质香椿种子数量有限、种子繁殖后代单株之间出现严重的性状分离,后代通过扦插育苗、埋根、分蘖等方法繁殖系数低、速度慢,这些繁殖方法不利于快速繁殖、推广栽培优良品种。采用无性快速繁殖,能保持原优质品种全部的遗传特性,实现该品种种质的一致性。
为了从根本上解决香椿的无性快繁技术难题,以优质红香椿为对象,对香椿组织培养技术进行系统的比较研究,研究多种不同因素对香椿愈伤组织诱导、分化的影响,建立香椿胚愈伤组织的诱导再生、生根培养和炼苗移栽等植株高效快速再生体系关键问题,为香椿的生物技术改良和优良品系的快速繁殖奠定基础。本技术为快繁名贵优良香椿品种,实现良种规模化生产,满足大棚或温室栽培需要,加快优质香椿品种的应用提供了技术支撑。
技术实现要素:
本发明的目的是解决现有技术中香椿繁殖系数低、速度慢的技术问题,提供一种繁殖系数高、速度快、有利于推广栽培优良品种的基于愈伤组织分化的香椿再生体系。
为实现上述目的,本发明提供了一种基于愈伤组织分化的香椿再生体系,其特征在于包括如下步骤:
1)、香椿无菌外植体的获得;
2)、愈伤组织诱导:将步骤1)所述外植体置于诱导培养基中培养,诱导形成愈伤组织;
3)、愈伤组织分化:将步骤2)所述的愈伤组织转移至基本培养基中培养,在湿度70 %,培养温度23℃,黑暗条件下连续培养1-2周后,移植至分化培养基中,培养、继代形成芽;
4)、幼苗生根培养:将步骤3)所述的芽在所述分化培养基中,湿度70 %,温度为光照25℃/黑暗23℃,光照强度为30-50 μmol photons m-2 s-1,光周期13 h/11h,生长3-4周,长成有4-6片以上子叶后,清除茎部愈伤组织,将茎叶部分继代至所述基本培养基中培养2周后移植到生根培养基中培养,至开始生根形成幼苗;
5)、移栽
将步骤4)所述幼苗移入三角瓶中封上封口膜,在生根培养基中生长4-5周后,选择2条根以上,株高3-4cm,展开叶3-5片的植株,揭开三角瓶封口膜,练苗4-6天后,自来水冲洗去苗基部的培养基,移栽到蛭石、泥炭、珍珠岩以质量比为3:1:1混合的基质中,用薄膜罩遮阴并保持湿度在70-80%,15天后去掉薄膜罩,定期喷洒40 %多菌灵800倍液杀菌,一周一次,共计2-3次;
其中,所述基本培养基包括大量元素、微量元素、铁盐和有机物,所述大量元素含有2100mg/L的KNO3、1430mg/L的NH4NO3、270mg/L的MgSO4·7H2O、150mg/L的KH2PO4、320mg/L的CaCl2·2H2O;所述微量元素含有12mg/L的MnSO4·4H2O、5.7mg/L的ZnSO4·7H2O、4.2mg/L的H3BO3、0.50mg/L的KI、0.20mg/L的Na2MoO4·7H2O、0.025mg/L的CuSO4·5H2O、0.025mg/L的CoCl2·6H2O;所述、铁盐含有37.3mg/L的Na2-EDTA、27.8mg/L的FeSO4·4H2O;所述有机物含有1.5mg/L的甘氨酸、0.5mg/L的盐酸吡哆醇、0.15mg/L的盐酸硫铵素、0.6mg/L的烟酸、80mg/L的肌酸;
所述诱导培养基为基本培养基+1.0 mg /L6-BA+0.5 mg/L 2,4-D+0.1 mg/L TDZ +质量百分比0.8%的琼脂;
所述分化培养基为基本培养基+0.8 mg/ L 6-BA+0.2 mg/L 2,4-D+0.2 mg/L TDZ+质量百分比0.8%的琼脂;
所述生根培养基为基本培养基+0.01 mg/L NAA+0.05 /Lmg ZT+质量百分比0.8%的琼脂;
步骤5)中所述基质在使用前用质量百分比浓度为0.1%的高锰酸钾均匀喷施,以基质透水为一次,处理三次。
优选地,步骤1)所述的香椿无菌外植体的获得方式为:香椿种子去种皮后在无菌水中浸泡6-12 h后,无菌条件下用体积百分比为70 %酒精处理3 min,再用无菌水清洗4~5次,接种到基本培养基中,培养条件为:湿度70 %,培养温度光照25℃/黑暗23℃,光照强度为30-50 μmol photons m-2 s-1,光周期13 h/11h的条件下,7 d后,香椿无菌苗开始形成,20 d后的香椿无菌植株的叶片切为1.5毫米的方块作为愈伤组织诱导的外植体;
或者,步骤1)所述的香椿无菌外植体的获得方式为:挑选自然状态下生长的健壮香椿幼叶,用清水冲洗30分钟后,质量百分比浓度为1%次氯酸钠处理1.5分钟,后用体积百分比为70 %酒精处理3 min,再用无菌水清洗4 ~5次后,切成1.5毫米见方的小块,作为外植体,置于诱导培养基中。
优选地,步骤2)所述的将外植体置于诱导培养基中培养的条件为:湿度70 %,培养温度光照25℃/黑暗23℃,光照强度为30-50 μmol photons m-2 s-1,光周期13 h/11h的条件下,1-2周后,愈伤组织开始形成。
优选地,步骤3)所述的在分化培养基中,培养、继代形成芽的条件为:培养温度光照25℃/黑暗23℃,光照强度为40-60 μmol photons m-2 s-1,光周期13 h/11h的条件下,每隔2-3周继代一次,连续继代2-3次后芽开始形成。
优选地,步骤4)所述的在生根培养基中培养,至开始生根形成幼苗的条件为:湿度70 %,培养温度光照25℃/黑暗23℃,光照强度为30-50 μmol photons m-2 s-1,光周期13 h/11h的条件下,2-3周后开始生根。
本发明的有益效果是:
1.建立了基于愈伤组织分化的无性快繁体系,克服了以顶芽或腋芽进行微繁快繁和扦插等繁殖技术外植体数量有限的问题;
2.在研究了多种不同因素对香椿愈伤组织诱导、分化的影响的基础上,解决了建立香椿胚愈伤组织的诱导再生、生根培养和炼苗移栽等植株高效快速再生体系的关键问题;愈伤诱导培养基、愈伤分化培养基、生根培养基及其条件均为首创;
3.本发明中的基本培养基,是在MS培养基的基础上,对其中的大量元素、微量元素和有机物均做了切合实践的改进。
附图说明
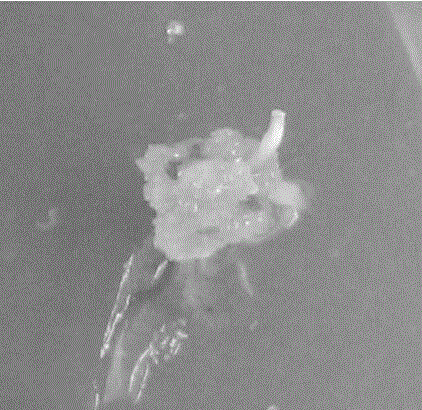
图1为外植体诱导30天形成的香椿愈伤组织;
图2为愈伤组织在分化培养基中培养30天分化出的芽;
图3为在生根培养基中培养25天形成的幼苗;
图4为在生根培养基中培养45天形成的幼苗;
图5为香椿再生植株。
具体实施方式
现结合附图和实施例详细说明本发明的技术方案。应理解,以下实施例仅用于说明本发明而不用于限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明步骤或条件所作的修改或替换,均属于本发明的范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
在下列实施例中,所用到的培养基成分如下:
A、基本培养基包括大量元素、微量元素、铁盐和有机物,所述大量元素含有2100mg/L的KNO3、1430mg/L的NH4NO3、270mg/L的MgSO4·7H2O、150mg/L的KH2PO4、320mg/L的CaCl2·2H2O;所述微量元素含有12mg/L的MnSO4·4H2O、5.7mg/L的ZnSO4·7H2O、4.2mg/L的H3BO3、0.50mg/L的KI、0.20mg/L的Na2MoO4·7H2O、0.025mg/L的CuSO4·5H2O、0.025mg/L的CoCl2·6H2O;所述、铁盐含有37.3mg/L的Na2-EDTA、27.8mg/L的FeSO4·4H2O;所述有机物含有1.5mg/L的甘氨酸、0.5mg/L的盐酸吡哆醇、0.15mg/L的盐酸硫铵素、0.6mg/L的烟酸、80mg/L的肌酸;
所述诱导培养基为基本培养基+1.0 mg /L6-BA+0.5 mg/L 2,4-D+0.1 mg/L TDZ +质量百分比0.8%的琼脂;
所述分化培养基为基本培养基+0.8 mg/ L 6-BA+0.2 mg/L 2,4-D+0.2 mg/L TDZ+质量百分比0.8%的琼脂;
所述生根培养基为基本培养基+0.01 mg/L NAA+0.05 /Lmg ZT+质量百分比0.8%的琼脂。
实施例一
1、配制基本培养基50 L,诱导培养基、分化培养基、生根培养基各10L。
2、香椿无菌外植体的获得
香椿种子去种皮后在无菌水中浸泡6后,无菌条件下用体积百分比为70 %酒精处理3 min,再用无菌水清洗4次,接种到基本培养基中,培养条件为:湿度70 %,培养温度光照25℃/黑暗23℃,光照强度为30 μmol photons m-2 s-1,光周期13 h/11h的条件下,7 d后,香椿无菌苗开始形成,20 d后的香椿无菌植株的叶片切为1.5毫米的方块作为愈伤组织诱导的外植体。
3、愈伤组织诱导
将香椿外植体置于诱导培养基,在湿度70 %,培养温度25/23℃,光照强度为30 μmol photons m-2 s-1,光周期13 h/11h的条件下,1周后,愈伤组织开始形成,2周后愈伤组织诱导率均为100 %,如图1所示。
4、愈伤组织分化
将在诱导培养基中形成的愈伤组织转移至基本培养基中,在湿度70 %,培养温度23℃,黑暗条件下连续培养培养1周后,移植至分化培养基中,培养温度25 /23℃,光照强度为40 μmol photons m-2 s-1,光周期13 h/11h的条件下,每隔2周继代一次,连续继代2次后芽开始形成,如图2所示。
5、幼苗生根培养
将芽在分化培养基中,湿度70 %,温度为光照25℃/黑暗23℃,光照强度为30 μmol photons m-2 s-1,光周期13 h/11h,生长3周,长成有4片以上子叶后,清除茎部愈伤组织,将茎叶部分继代至基本培养基中培养2周后移植生根培养基中,在湿度70 %,培养温度25/23℃,光照强度为30 μmol photons m-2 s-1,光周期13 h/11h的条件下,2周后开始生根形成幼苗,如图3、4所示。
6、移栽
将幼苗移入三角瓶中封上封口膜,在生根培养基中生长4周后,选择2条根以上,株高3-4cm,展开叶3-5片的植株,揭开三角瓶封口膜,练苗4天后,自来水冲洗去苗基部的培养基,移栽到蛭石、泥炭、珍珠岩以质量比为3:1:1混合的基质(基质在使用前用质量百分比浓度为0.1%的高锰酸钾均匀喷施,以基质透水为一次,处理三次)中,用薄膜罩遮阴并保持湿度在70%,15天后去掉薄膜罩,定期喷洒40%多菌灵800倍液杀菌,一周一次,共计2次,生根苗长成再生植株,成活率达96.2%,如图5所示。
实施例二
1、配置基本培养基50 L,诱导培养基、分化培养基、生根培养基各10L。
2、香椿无菌外植体的获得
香椿种子去种皮后在无菌水中浸泡12 h后,无菌条件下用体积百分比为70 %酒精处理3 min,再用无菌水清洗5次,接种到基本培养基中,培养条件为:湿度70 %,培养温度光照25℃/黑暗23℃,光照强度为50 μmol photons m-2 s-1,光周期13 h/11h的条件下,7 d后,香椿无菌苗开始形成,20 d后的香椿无菌植株的叶片切为1.5毫米的方块作为愈伤组织诱导的外植体。
3、愈伤组织诱导
将香椿外植体置于诱导培养基,在湿度70 %,培养温度25/23℃,光照强度为50 μmol photons m-2 s-1,光周期13 h/11h的条件下,2周后,愈伤组织开始形成, 3周后愈伤组织诱导率均为100%。
4、愈伤组织分化
将在诱导培养基中形成的愈伤组织转移至基本培养基中,在湿度70 %,培养温度23℃,黑暗条件下连续培养培养2周后,移植至分化培养基中,培养温度25 /23℃,光照强度为60 μmol photons m-2 s-1,光周期13 h/11h的条件下,每隔3周继代一次,连续继代3次后芽形成。
5、幼苗生根培养
将芽在分化培养基中,湿度70 %,温度为光照25℃/黑暗23℃,光照强度为50 μmol photons m-2 s-1,光周期13 h/11h,生长4周,长成有6片以上子叶后,清除茎部愈伤组织,将茎叶部分继代至基本培养基中培养2周后移植生根培养基中,在湿度70 %,培养温度25/23℃,光照强度为50 μmol photons m-2 s-1,光周期13 h/11h的条件下,3周后开始生根形成幼苗。
6、移栽
将幼苗移入三角瓶中封上封口膜,在生根培养基中生长5周后,选择4条根以上,株高3-4cm,展开叶3-5片的植株,揭开三角瓶封口膜,练苗6天后,自来水冲洗去苗基部的培养基,移栽到蛭石、泥炭、珍珠岩以质量比为3:1:1混合的基质(基质在使用前用质量百分比浓度为0.1%的高锰酸钾均匀喷施,以基质透水为一次,处理三次)中,用薄膜罩遮阴并保持湿度在80%,15天后去掉薄膜罩,定期喷洒40%多菌灵800倍液杀菌,一周一次,共计3次,生根苗长成再生植株,成活率达97.4%。
实施例三
1、配置基本培养基50 L,诱导培养基、分化培养基、生根培养基各10L。
2、香椿无菌外植体的获得
香椿种子去种皮后在无菌水中浸泡8 h后,无菌条件下用体积百分比为70 %酒精处理3 min,再用无菌水清洗5次,接种到基本培养基中,培养条件为:湿度70 %,培养温度光照25℃/黑暗23℃,光照强度为40 μmol photons m-2 s-1,光周期13 h/11h的条件下,7 d后,香椿无菌苗开始形成,20 d后的香椿无菌植株的叶片切为1.5毫米的方块作为愈伤组织诱导的外植体。
3、愈伤组织诱导
将香椿外植体置于诱导培养基,在湿度70 %,培养温度25/23℃,光照强度为40 μmol photons m-2 s-1,光周期13 h/11h的条件下,10天后,愈伤组织开始形成,15天后愈伤组织诱导率均为100%。
4、愈伤组织分化
将在诱导培养基中形成的愈伤组织转移至基本培养基中,在湿度70 %,培养温度23℃,黑暗条件下连续培养培养1周后,移植至分化培养基中,培养温度25 /23℃,光照强度为50 μmol photons m-2 s-1,光周期13 h/11h的条件下,每隔15天继代一次,连续继代2次后芽开始形成。
5、幼苗生根培养
将芽在分化培养基中,湿度70 %,温度为光照25℃/黑暗23℃,光照强度为40 μmol photons m-2 s-1,光周期13 h/11h,生长3周,长成有4片以上子叶后,清除茎部愈伤组织,将茎叶部分继代至基本培养基中培养2周后移植生根培养基中,在湿度70 %,培养温度25/23℃,光照强度为40 μmol photons m-2 s-1,光周期13 h/11h的条件下,2周后开始生根形成幼苗。
6、移栽
将幼苗移入三角瓶中封上封口膜,在生根培养基中生长4周后,选择4条根以上,株高3-4cm,展开叶3-5片的植株,揭开三角瓶封口膜,练苗5天后,自来水冲洗去苗基部的培养基,移栽到蛭石、泥炭、珍珠岩以质量比为3:1:1混合的基质(基质在使用前用质量百分比浓度为0.1%的高锰酸钾均匀喷施,以基质透水为一次,处理三次)中,用薄膜罩遮阴并保持湿度在75%,15天后去掉薄膜罩,定期喷洒40%多菌灵800倍液杀菌,一周一次,共计2次,生根苗长成再生植株,成活率达96.8%。
实施例四
1、配置基本培养基50 L,诱导培养基、分化培养基、生根培养基各10L。
2、香椿无菌外植体的获得
挑选自然状态下生长的健壮香椿幼叶,用清水冲洗30分钟后,质量百分比浓度为1%次氯酸钠处理1.5分钟,后用体积百分比为70 %酒精处理3 min,再用无菌水清洗4次后,切成1.5毫米见方的小块,作为外植体。
3、愈伤组织诱导
将香椿外植体置于诱导培养基,在湿度70 %,培养温度25/23℃,光照强度为50 μmol photons m-2 s-1,光周期13 h/11h的条件下,1周后,愈伤组织开始形成,3周后愈伤组织诱导率均为100%。
4、愈伤组织分化
将在诱导培养基中形成的愈伤组织转移至基本培养基中,在湿度70 %,培养温度23℃,黑暗条件下连续培养培养1周后,移植至分化培养基中,培养温度25 /23℃,光照强度为60 μmol photons m-2 s-1,光周期13 h/11h的条件下,每隔2周继代一次,连续继代3次后芽开始形成。
5、幼苗生根培养
将芽在分化培养基中,湿度70 %,温度为光照25℃/黑暗23℃,光照强度为30 μmol photons m-2 s-1,光周期13 h/11h,生长4周,长成有4-6片以上子叶后,清除茎部愈伤组织,将茎叶部分继代至基本培养基中培养2周后移植生根培养基中,在湿度70 %,培养温度25/23℃,光照强度为30 μmol photons m-2 s-1,光周期13 h/11h的条件下,3周后开始生根形成幼苗。
6、移栽
将幼苗移入三角瓶中封上封口膜,在生根培养基中生长4周后,选择2条根以上,株高3-4cm,展开叶3-5片的植株,揭开三角瓶封口膜,练苗6天后,自来水冲洗去苗基部的培养基,移栽到蛭石、泥炭、珍珠岩以质量比为3:1:1混合的基质(基质在使用前用质量百分比浓度为0.1%的高锰酸钾均匀喷施,以基质透水为一次,处理三次)中,用薄膜罩遮阴并保持湿度在70%,15天后去掉薄膜罩,定期喷洒40%多菌灵800倍液杀菌,一周一次,共计3次,生根苗长成再生植株,成活率达96.5%。
- 还没有人留言评论。精彩留言会获得点赞!