一种快速创制加工型辣椒雄性不育育性恢复新种质的方法与流程
本发明属于花药培养技术领域,尤其涉及一种快速创制加工型辣椒雄性不育育性恢复新种质的方法。
背景技术:
目前花药培养已成为辣椒育种的主要技术。近二十年来已经育成了一些优良的辣椒花培品种,如海花三号(李春玲等,1990)、海丰12号(刑永萍等,2002)、海丰26号(刑永萍等,2003)、海丰14号(张树根等,2003)、海丰25号(张树根等,2008)、海丰16号(刑永萍等,2014)、海丰1052(张树根等,2015)和海丰391(张树根等,2015)等。通过花药培养技术1~2年即可获得纯合的二倍体材料,可以加快育种进程,缩短育种所需年限(陈晓等,2003;袁丽等,2011)。分子标记辅助选择(molecular assisted selection,MAS)的准确性高、不受辣椒生育期等的影响,在辣椒育种中得到了广泛应用。近年来,研究人员利用MAS和花药培养技术相结合的方法在水稻中制备了一些优良育种材料(王兴春等,2004;于凤池等,2010;袁丽等,2011;宋丁丁,2011)。育种实践中加工型辣椒CMS优良恢复系较少,传统育种选育加工型辣椒CMS恢复系费时费工。因此利用花药培养和MAS相结合的方法快速创制加工型辣CMS育性恢复材料成为育种工作者需要亟待解决的首要问题,但该方法在加工型辣椒材料创制中尚未相关报道。
综上所述,育种实践中加工型辣椒CMS优良恢复系较少,传统育种选育加工型辣椒CMS恢复系费时费工。
技术实现要素:
本发明的目的在于提供一种快速创制加工型辣椒雄性不育育性恢复新种质的方法,旨在解决育种实践中加工型辣椒CMS优良恢复系较少,传统育种选育加工型辣椒CMS恢复系费时费工的问题。
本发明是这样实现的,一种加工型辣椒花药培养的方法,所述加工型辣椒花药的培养方法包括以下步骤:
步骤一,辣椒植株在26.4±0.4℃温度条件下,进行辣椒花药培养;
步骤二,辣椒单倍体培养选择处于单核靠边期的小孢子用于诱导胚状体发生;
步骤三,花蕾在4℃冰箱中低温预处理1-3d;之后在无菌条件下将供试花蕾在70%酒精中浸泡30s后再0.1%升汞中浸泡7min,用无菌水冲洗3-4次,接种到MS+BA 0.5mg/L+2,4-D 0.5mg/L+3%蔗糖+琼脂7g/L+AgNO34mg/L+活性炭0.4%的培养基上,pH 5.8;接种密度为直径100mm培养皿接种8个花蕾;
步骤四,接种花药到将接种好的花药置于35℃恒温培养箱中处理7d;然后在白天温度28℃,夜晚温度为20℃的组培室中继续培养;
步骤五,选择根尖生长旺盛的植株,从每株取小于2cm的根5-6条,蒸馏水漂洗后,饱和对二氯苯溶液中处理3.5h,卡诺氏固定液固定2h,蒸馏水冲洗3-4次,0.2M盐酸处理5min,蒸馏水冲洗3-4次,45%冰乙酸溶液处理5min,卡宝染色20min,制片,显微镜下观察,寻找处于细胞分裂中期,染色体分散的细胞,计数;
步骤六,胚状体在培养基中成苗约4-5cm高时,需要进行移栽,移栽前需对花培植株试管苗进行炼苗。
进一步,所述诱导培养基为:MS+BA 0.5mg/L+2,4-D 0.5mg/L+3%蔗糖+7g/L琼脂+AgNO34mg/L+活性炭0.4%的培养基上,pH5.8;生根培养基为:MS+0.2mg/L NAA+蔗糖3%+琼脂0.7%的培养基上,pH5.8。
进一步,所述炼苗包括:
(1)闭瓶强光炼苗:将花培植株试管苗的培养瓶移到室外进行强光闭瓶炼苗7d;
(2)开瓶强光炼苗:将培养瓶封口膜打开,在自然光下开瓶炼苗5-7d;
(3)花培植株试管苗的移栽:试管苗要用镊子小心的从培养基中移出,洗干净根部后移入基质中;盖上塑料薄膜保持湿度;花培植株先移至自然光下光照,再开瓶适应湿度;
(4)露地条件炼苗:幼苗长出新叶、新根后即可移至露地条件下,进行定植前的适应性锻炼;长出2-3片新叶时,即可定植。
进一步,所述移栽的基质按照体积比为腐殖质:蛭石=4:1。
本发明的另一目的在于提供一种利用所述加工型辣椒花药培养方法进行辣椒单倍体培养。
本发明的另一目的在于提供一种利用所述加工型辣椒花药培养技术创制加工型辣椒CMS恢复系材料。
进一步,所述加工型辣椒细胞质雄性不育恢复系的构建方法包括以下步骤:
(1)F2群体由恢复系812和优良亲本940杂交配制而成;用分子标记辅助选择在F2群体中筛选含有恢复基因Rf的单株进行花药培养;
(2)利用筛选到的CRF-SCAR标记筛选F2群体中含恢复基因的单株进行花药培养,进而用该标记鉴定花培再生株DH系是否含有恢复基因Rf,CRF-SCAR上游引物序列为:5′-GTACACACCACTCGTCGCTCCT-3′,下游引物序列为:5′-TTCTTGGGTCCCTTTCTTCCAA-3′;
(3)辣椒叶片DNA采用CTAB法进行提取;含5×PCR缓冲液4μL、25mmol/LMgCl2溶液1.2μL、dNTP溶液1.6μL、33ng/μL上下游引物各2.0μL、2U/μLTaq聚合酶0.5μL、ddH2O 7μL和模板DNA 1.0μL;
(4)在工作台上用70%酒精浸泡30s,之后用0.1%HgCL2消毒7min,无菌水漂洗4次,然后放在无菌滤纸上沥干水;在无菌条件下接种于胚状体诱导培养基,9mm×9mm培养皿接6个花蕾的花药,37℃高温预处理5d。
进一步,所述胚状体诱导培养基为MS+BA 0.5mg/L+2,4-D 0.5mg/L+3%蔗糖+琼脂7g/L+AgNO34mg/L+活性炭0.4%。
本发明提供的快速创制加工型辣椒雄性不育育性恢复新种质的方法,创制加工型辣椒(CMS)恢复系材料,采用优势性状互补,恢复基因供体加工型辣椒恢复系812和重庆市农科院近年选育的优良自交系940作亲本,对其F2进行花药培养;通过分子标记辅助选择对花培再生株系进行恢复基因Rf的筛选,利用花药培养与分子标记辅助选择将Rf快速导入到自交系940中,加速制备加工型辣椒CMS育性恢复资源;便于辣椒科研工作者更有效地展开辣椒花药培养工作,掌握取材花蕾形态指标,减少操作环节,保证花药培养效率。本发明为快速制备加工型辣椒胞质雄性不育(CMS)恢复系材料,利用分子标记辅助选择和花药培养相结合的方法将完全恢复的恢复系812的恢复基因Rf导入自交系940,制备含恢复基因的新种质;对其中含Rf的5个花培二代苗系(DH)与不育系83-3A进行测交,结果表明,测交株系均表现恢复,且测交株系的恢复株率均为100%。本发明结合花药培养和分子标记辅助育种可以达到快速有效育种的目的;为快速制备加工型辣椒CMS恢复系材料,利用分子标记辅助选择和花药培养相结合的方法将完全恢复的恢复系812的恢复基因Rf导入自交系940,制备含恢复基因的新种质;对其中含Rf的5个花培二代苗系(DH)与不育系83-3A进行测交,结果表明,测交株系均表现恢复,且测交株系的恢复株率均为100%。本发明说明结合花药培养和分子标记辅助育种可以达到快速有效地为育种实践创制优异育种资源的目的。
附图说明
图1是本发明实施例提供的加工型辣椒花药培养方法流程图。
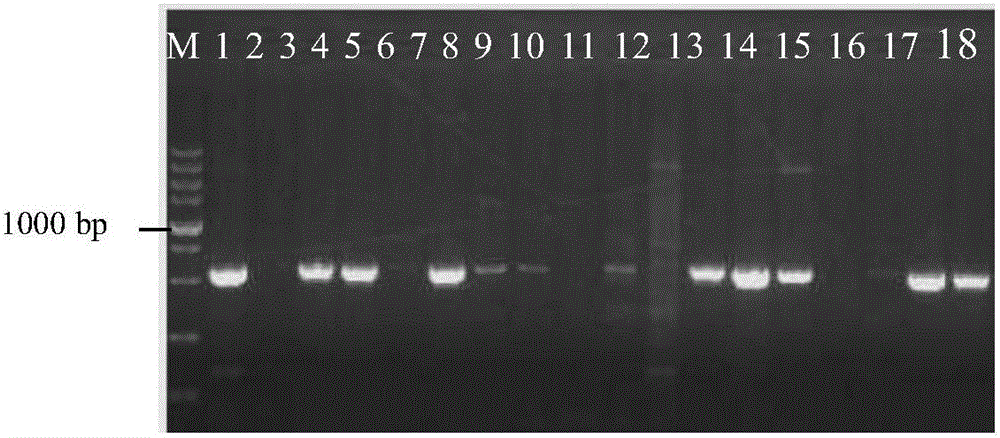
图2是本发明实施例提供的加工型辣椒F2群体的分子标记检测示意图;
图中:M:DL5000;1:恢复系812;2:不育系83-3A;3~18:加工型辣椒F2单株。
图3是本发明实施例提供的CRF-SCAR标记在加工型辣椒DH系中的扩增示意图;
图中:M:DM2000;1:不育系83-3A;2:恢复系812;3~8:DH系编号。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图对本发明的应用原理作详细的描述。
如图1所示,本发明实施例提供的加工型辣椒花药的培养方法包括以下步骤:
S101:辣椒植株在26.4±0.4℃温度条件下,进行辣椒花药培养;
S102:辣椒单倍体培养选择处于单核靠边期的小孢子用于诱导胚状体发生;
S103:花蕾在4℃冰箱中低温预处理1-3d;之后在无菌条件下将供试花蕾在70%酒精中浸泡30s后再0.1%升汞中浸泡7min,用无菌水冲洗3-4次,接种到MS+BA0.5mg/L+2,4-D 0.5mg/L+3%蔗糖+琼脂7g/L+AgNO34mg/L+活性炭0.4%,pH5.8;接种密度为直径100mm培养皿接种8个花蕾;
S104:接种花药到将接种好的花药置于35℃恒温培养箱中处理7d;然后在白天温度28℃,夜晚温度为20℃的组培室中继续培养;
S105,选择根尖生长旺盛的植株,从每株取小于2cm的根5-6条,蒸馏水漂洗后,饱和对二氯苯溶液中处理3.5h,卡诺氏固定液固定2h,蒸馏水冲洗3-4次,0.2M盐酸处理5min,蒸馏水冲洗3-4次,45%冰乙酸溶液处理5min,卡宝染色20min,制片,显微镜下观察,寻找处于细胞分裂中期,染色体分散的细胞,计数;
S106:胚状体在培养基中成苗约4-5cm高时,需要进行移栽,移栽前需对花培植株试管苗进行炼苗。
在步骤S106中:
炼苗可分为4歩进行:(1)闭瓶强光炼苗:将花培植株试管苗的培养瓶移到室外进行强光闭瓶炼苗7d;(2)开瓶强光炼苗:将培养瓶封口膜打开,在自然光下开瓶炼苗5-7d。(3)花培植株试管苗的移栽:试管苗要用镊子小心的从培养基中移出,洗干净根部后移入基质中。盖上塑料薄膜保持湿度。花培植株先移至自然光下一段时间适应光照,再开瓶适应湿度,可使幼苗根系发达,移栽成活率达90%以上。(4)露地条件炼苗:幼苗长出新叶、新根后即可移至露地条件下,进行定植前的适应性锻炼。长出2-3片新叶时,即可定植。
移栽基质为腐殖质:蛭石=4:1(体积比),移栽前先将花培植株移至自然光下一段时间适应光照,再开瓶盖适应湿度,避免在移栽过程中出现萎蔫现象,使其逐步长出适应自然环境的表皮结构、新叶与新根。在温水中洗净培养基,移入基质后,浇足定根水。
下面结合具体实施例对本发明的应用效果作详细的描述。
实施例1
1结果与分析
1.1花药培养供体植株的筛选
以加工型辣椒恢复系812为父本,优良自交系940为母本,利用分子标记辅助选择和杂交技术构建F2群体,然后用分子标记CRF-SCAR筛选含有恢复基因Rf的单株,本试验共筛选出16个单株含Rf,用其作为花药培养的供试材料(图2)。
1.2花培再生植株的获得与鉴定
2014年5-7月在重庆市农科院生物技术研究中心逆境农业研究重庆市重点实验室对含恢复基因Rf的16个单株共接种130皿,约3200枚花药,获得胚状体34个,诱导率1.06%。其中成苗21株,成苗率为61.76%,但是当年加倍后仅有6份收到种子,暂定名为DH-1、DH-2、DH-3、DH-4、DH-5、DH-6,次年按照苗系在重庆市农科院基地种植。
用CRF-SCAR标记对6个DH系植株基因组DNA进行PCR扩增鉴定,除DH-1没有扩增出特异条带,表现为条带缺失,不含恢复基因Rf,其余5个DH系均能扩增出条带大小为870bp的特异条带,与恢复系812带型一致(图3)。
1.3花培再生植株对83-3A的恢复性
2015年用83-3A不育系作母本,用6个DH系作父本,测交了各组合花培DH系的恢复性。2016年夏季将所得到的测交一代种子种于重庆市农科院基地种植,调查其花粉育性(表1)。除了83-3A×DH-1杂交组合测交株系没有恢复株系,其余杂交组合的花培后代测交株系均有可恢复株,且测交株系的恢复株率均为100%(表1)。其与分子标记辅助选择结果一致。
表1测交花培后代对83-3A的恢复性
1.4利用花药培养技术选育的3个优良恢复系
种植于基地的5个花培植株DH系,株系田间表现农艺性状一致,表明这5份材料已纯合稳定。进行田间农艺性状调查和成熟后取样考种(表2)。综合田间农艺性状和分子标记辅助选择,选育出3个农艺性状好的DH系恢复材料,均为完全恢复的恢复系。其中DH-3植株的株型紧凑,果面光滑,中早熟;DH-5果实直,果面光滑,抗性强;DH-6植株挂多,果面光滑,较早熟。
表25个恢复系的农艺性状性状表现
2在过去的二十多年,花药培养在辣椒育种中得到较为广泛的应用。用花药培养技术制备加工型辣椒优良恢复系,可以在2~3年内选育出恢复系,相比较常规方法的5-7年,节省了筛选恢复系需要的人力、物力和财力。这与在小麦K型雄性不育恢复系选育上的结果一致。大部分研究中花药培养供体亲本都是选择F1代。经花药培养获得的再生苗系差异较大,这与需要培育性状稳定的育种目标不符。
在本试验中,用于构建花培供体亲本的F2群体恢复系亲本812为完全恢复的恢复系,且用CRF-SCAR分子标记辅助选择的方法提前对花培供体亲本F2群体进行恢复基因筛选,所用花培供体亲本均为含Rf的植株,分子标记辅助选择和6个DH系与83-3A的测交后代育性均表明,选育的6个DH系选中有5个DH系为恢复系。结合田间农艺性状,认为选育出了3个DH系性状比较优良,可以作为育种材料,用于新组合配制。可见,通过分子标记辅助选择与花药培养相结合的方法,可以高效地制备新的加工型辣椒恢复系材料。
因此,本发明认为利用分子标记辅助选择与花药培养相结合的方法,既能快速筛选目的基因,又可以使选育的苗系更加符合育种目标。育种工作者可将其作为制备特殊优异育种材料的一个重要手段。
3材料与方法
3.1材料与设计
所用F2群体由恢复系812和优良亲本940杂交配制而成。812是由重庆市农业科学院蔬菜花卉研究所辣椒室多年来制备的优良恢复系,果形为长牛角形;940为本发明室多年选育的优良自交系,果形为细牛角形。用分子标记辅助选择在F2群体中筛选含有恢复基因Rf的单株进行花药培养。
3.2分子标记
利用已筛选到的CRF-SCAR标记筛选F2群体中含恢复基因的单株进行花药培养,进而用该标记鉴定花培再生株DH系是否含有恢复基因Rf,CRF-SCAR上游引物序列为:5′-GTACACACCACTCGTCGCTCCT-3′,下游引物序列为:5′-TTCTTGGGTCCCTTTCTTCCAA-3′。
3.3分子标记检测
本发明中,辣椒叶片DNA采用CTAB法进行提取。含5×PCR缓冲液4μL、25mmol/LMgCl2溶液1.2μL、dNTP溶液1.6μL、33ng/μL上下游引物各2.0μL、2U/μLTaq聚合酶(鼎国生物)0.5μL、ddH2O 7μL和模板DNA 1.0μL。
3.4花药培养方法
2014年春季在重庆市农业科学院试验基地,上午9点前在目标单株上取处于单核靠边期的花蕾置于冰盒中,带回实验室。在超净工作台上用70%酒精浸泡30s,之后用0.1%HgCL2消毒7min,无菌水漂洗4次,然后放在无菌滤纸上沥干水。在无菌条件下接种于胚状体诱导培养基(MS+BA 0.5mg/L+2,4-D 0.5mg/L+3%蔗糖+琼脂7g/L+AgNO34mg/L+活性炭0.4%),9mm×9mm培养皿接6个花蕾的花药,37℃高温预处理5d。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!