一种以子叶为外植体的红椿再生方法与流程
本发明属于植物组织培养技术领域,具体涉及一种以子叶为外植体的红椿再生方法。
背景技术:
红椿(Toona ciliata Roem.),又名红楝子,隶属楝科(Meliaceae)香椿属(Toona)。在我国,红椿主要分布在广东、广西、云南、贵州、四川、江西、安徽、湖南、湖北、福建和浙江等地,天然居群具有零星分布特点。在国外的分布主要集中在印度、老挝、缅甸、巴基斯坦、澳大利亚东海岸。红椿材质细密,纹理通直,花纹美丽,芯材呈深红褐色,素有“中国桃花心木”之称。它具有早期速生性状明显、生长快等特点,在我国南方地区已成为重点开发利用的优质速生用材树种。由于环境的变化、天然更新能力较差及过度的采伐破坏,红椿目前已成为濒危树种,是1999年经国务院批准的国家Ⅱ级重点保护野生植物,并列入《中国主要栽培珍贵树种参考名录》。红椿不但是珍贵的用材树种,也是近年来得到普遍关注的药用植物,并且该树种主干通直,树姿挺秀,枝繁叶茂,花香并富有蜜源,分枝点较高,树冠下光线充足,可用于园林绿化,栽种于庭院、住宅周围或公路两旁,可供观赏。
目前红椿多采用种子繁殖。红椿树形高大通直,成年大树进行种子采集较为困难,其种子仅能在短期内进行有效保存。为了解决红椿高效繁育难题,目前普遍采用扦插及组织培养等技术手段。通过扦插育苗繁殖系数较低,生产速度较慢,与该技术相比,组织培养技术可快速获得优质种苗,实现良种规模化生产,满足市场生产需求。同时,红椿在前期生长过程中极易遭到蛀干害虫的啃食,直接导致其形成多头树无法成材,甚至死亡。深入研究红椿高效再生方法,是进行遗传转化体系的基础和前提。
红椿组织培养目前的研究仍然处于探索阶段,且相关文献报道较少。据报道来看,研究人员多采用成年大树或短期生长幼苗采集茎段等作为外植体进行离体繁殖。但由于红椿内生菌导致的外植体污染一直没有突破,即便使用了青霉素和链霉素进行抗菌,效果依旧不明显。致使增殖效果不佳,获得的腋芽诱导率较低,且生根较为困难。
技术实现要素:
本发明的目的是提供一种以红椿子叶为外植体的操作更简便、取材更广泛的高效的红椿再生方法,利用该方法能够在短期内快速获得大量优质的红椿种苗。本发明以红椿无菌苗子叶为外植体诱导愈伤组织,并获得再生植株,旨在解决红椿子叶再生问题,提高红椿再生能力,为红椿基因遗传转化及种质资源保护研究提供有效的参考价值。
本发明的以子叶为外植体的红椿再生方法,其特征在于,包括以下步骤:
A、外植体的获得:将红椿种子去掉双侧翅,在水中浸泡3~5h,经消毒后将种子播种于固体MS培养基上培养得到无菌苗,切取无菌苗的子叶作为外植体;培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d;
B、芽的诱导及伸长:将子叶接种到芽诱导培养基上培养诱导愈伤组织,接种时子叶远轴面朝上;培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d;培养至外植体上分化出芽团时,将长芽的外植体转移到芽伸长培养基上在相同培养条件下培养诱导不定芽伸长;
所述的芽诱导培养基:每升含有6-BA 0.4~0.8mg、KT 0.5~1.0mg、NAA0.03~0.08mg、蔗糖30g和琼脂5g,余量为MS培养基,pH 5.8~6.0;
所述的芽伸长培养基:每升含有6-BA0.02~0.2mg、NAA 0.1~0.3mg、蔗糖30g和琼脂5g,余量为MS培养基,pH 5.8~6.0;
C、生根培养:待不定芽伸长到3~5cm时,切取不定芽,接种于生根培养基上培养诱导生根,得到生根苗;培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d;所述的生根培养基:每升含有NAA0.1~0.3mg、蔗糖15g和琼脂5g,余量为MS培养基,pH 5.8~6.0;
D、炼苗及移栽:将生根苗炼苗后从培养瓶中挖出,洗净根上的培养基,将生根苗在自来水中浸泡1h,移栽到泥炭土上,进行栽培管理,得到红椿植株。
优选,所述的步骤A的消毒是将红椿种子用体积分数75%乙醇水溶液灭菌1min,无菌水冲洗1次,质量分数10%次氯酸钠水溶液灭菌15~20min,无菌水冲洗3~5次。
优选,所述的步骤D的炼苗是打开培养瓶盖让生根苗适应2d。
优选,所述的步骤D的泥炭土是高温灭菌过的泥炭土。
所述的步骤A的固体MS培养基每升含有蔗糖30g和琼脂5g,余量为MS培养基,pH 5.8~6.0。
所述的MS培养基为国际通用的培养基,其成份和配置方法见Murashige T,Skoog F(1962)A revised medium for rapid growth and bioassay with tobacco tissue cultures.Physiol Plant 15:473–497。
本发明的以子叶为外植体的红椿高效组织培养和植株再生方法,可摆脱外界条件的影响,规模化和工厂化生产出健壮、整齐一致的红椿组培幼苗;与已经报道的以红椿大树茎段及种子作为外植体构建再生体系相比,具有操作方便、取材广泛、可重复性强及效率高等优势。该方法可满足市场对大量优质红椿种苗的需求,为红椿优质种质资源可持续利用及基因工程研究奠定基础。
附图说明
图1为种子培养15d得到的无菌苗,用于切取子叶。
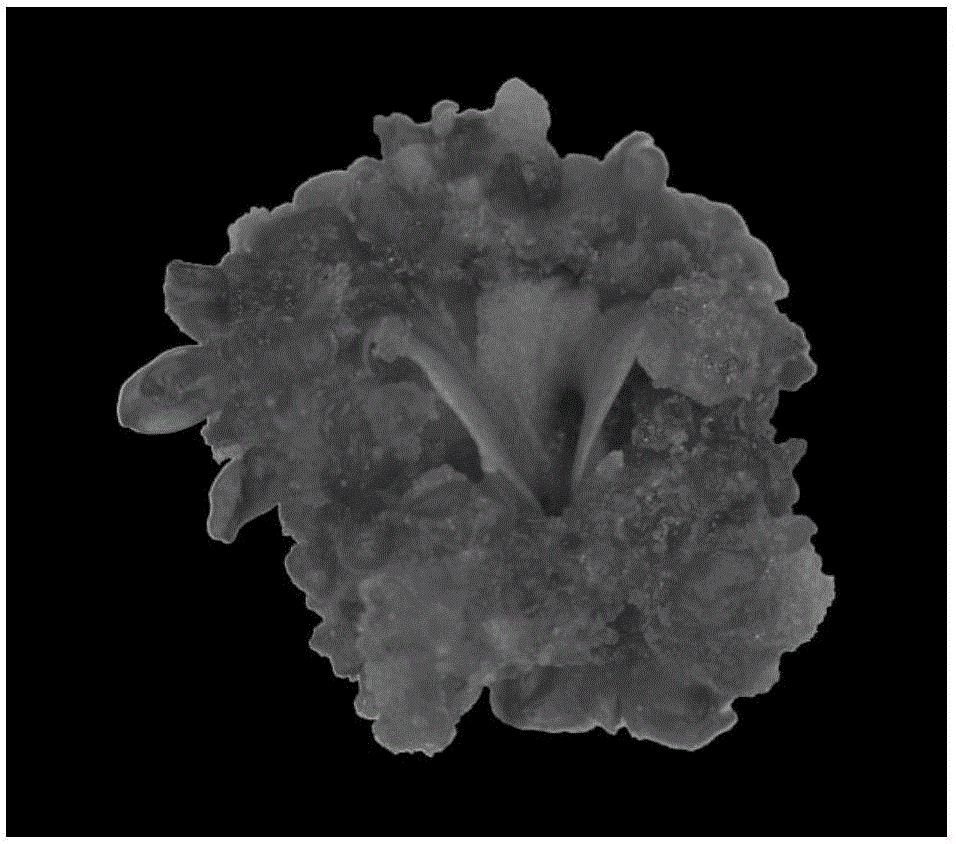
图2为在芽诱导培养基上培养30d的子叶外植体上的芽团。
图3为在芽伸长培养基上培养30d伸长的不定芽。
图4为不定芽在生根培养基上培养诱导出的根。
图5为移栽成活的红椿植株。
具体实施方式
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1
A、外植体的获得:将红椿种子去掉双侧翅,在水中浸泡3h;在无菌超净台上,体积分数75%乙醇水溶液灭菌1min,无菌水冲洗1次,质量分数10%次氯酸钠水溶液灭菌15min,无菌水彻底冲洗3次,然后将种子播种于固体MS培养基上培养,培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d。种子培养3d左右开始萌芽,培养15d后,无菌苗(如图1所示)子叶伸展,切取子叶作为外植体。所述固体MS培养基每升含有蔗糖30g和琼脂5g,余量为MS培养基,pH 5.8;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。
B、芽的诱导及伸长:将子叶接种到芽诱导培养基上培养诱导愈伤组织,接种时子叶远轴面朝上;培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d。培养30d,当子叶愈伤组织出现清晰芽团(如图2所示),即将外植体转移到芽伸长培养基上在相同培养条件下培养诱导不定芽伸长。培养30d伸长的不定芽如图3所示。所述的芽诱导培养基:每升含有6-BA 0.6mg、KT 0.8mg、NAA0.03mg、蔗糖30g和琼脂5g,余量为MS培养基,pH5.8;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。所述的芽伸长培养基:每升含有6-BA0.1mg、NAA 0.2mg、蔗糖30g和琼脂5g,余量为MS培养基,pH 5.8;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。
C、生根培养:待不定芽伸长到3cm时,切取不定芽,接种于生根培养基上培养诱导生根,培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d。生根培养30d后,不定芽长出多条根,由此得到生根苗,生根情况如图4所示。所述的生根培养基:每升含有NAA0.2mg、蔗糖15g和琼脂5g,余量为MS培养基,pH 5.8;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。
D、炼苗及移栽:打开培养瓶盖让生根苗适应2d,然后小心将生根苗从培养瓶中挖出,洗净根上的培养基,将生根苗在自来水中浸泡1h,移栽到装在营养杯中的高温灭菌过的泥炭土上,在营养杯上套上塑料袋保湿,3d后慢慢地移开塑料袋,按生长需求浇水。得到移栽成活的红椿植株如图5所示。
实施例2
A、外植体的获得:将红椿种子去掉双侧翅,在水中浸泡3h;在无菌超净台上,体积分数75%乙醇水溶液灭菌1min,无菌水冲洗1次,质量分数10%次氯酸钠水溶液灭菌15min,无菌水彻底冲洗3次,然后将种子播种于固体MS培养基上培养,培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d。种子培养3d左右开始萌芽,培养10d后,无菌苗子叶伸展,切取子叶作为外植体。所述固体MS培养基每升含有蔗糖30g和琼脂5g,余量为MS培养基,pH 5.8;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。
B、芽的诱导及伸长:将子叶接种到芽诱导培养基上培养诱导愈伤组织,接种时子叶远轴面朝上;培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d。培养30d,当子叶愈伤组织出现清晰芽团,即将外植体转移到芽伸长培养基上在相同培养条件下培养诱导不定芽伸长。所述的芽诱导培养基:每升含有6-BA 0.4mg、KT 0.5mg、NAA0.05mg、蔗糖30g和琼脂5g,余量为MS培养基,pH5.8;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。所述的芽伸长培养基:每升含有6-BA0.02mg、NAA 0.1mg、蔗糖30g和琼脂5g,余量为MS培养基,pH 5.8;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。
C、生根培养:待不定芽伸长到3cm时,切取不定芽,接种于生根培养基上培养诱导生根,培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d。生根培养30d后,不定芽长出多条根,由此得到生根苗。所述的生根培养基:每升含有NAA0.1mg、蔗糖15g和琼脂5g,余量为MS培养基,pH 5.8;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。
D、炼苗及移栽:打开培养瓶盖让生根苗适应2d,然后小心将生根苗从培养瓶中挖出,洗净根上的培养基,将生根苗在自来水中浸泡1h,移栽到装在营养杯中的高温灭菌过的泥炭土上,在营养杯上套上塑料袋保湿,3d后慢慢地移开塑料袋,按生长需求浇水。由此得到移栽成活的红椿植株。
实施例3
A、外植体的获得:将红椿种子去掉双侧翅,在水中浸泡5h;在无菌超净台上,体积分数75%乙醇水溶液灭菌1min,无菌水冲洗1次,质量分数10%次氯酸钠水溶液灭菌20min,无菌水彻底冲洗5次,然后将种子播种于固体MS培养基上培养,培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d。种子培养3d左右开始萌芽,培养20d后,无菌苗子叶伸展,切取子叶作为外植体。所述固体MS培养基每升含有蔗糖30g和琼脂5g,余量为MS培养基,pH6.0;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。
B、芽的诱导及伸长:将子叶接种到芽诱导培养基上培养诱导愈伤组织,接种时子叶远轴面朝上;培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d。培养40d,当子叶愈伤组织出现清晰芽团,即将外植体转移到芽伸长培养基上在相同培养条件下培养诱导不定芽伸长。所述的芽诱导培养基:每升含有6-BA 0.8mg、KT 1.0mg、NAA0.08mg、蔗糖30g和琼脂5g,余量为MS培养基,pH6.0;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。所述的芽伸长培养基:每升含有6-BA0.2 mg、NAA 0.3mg、蔗糖30g和琼脂5g,余量为MS培养基,pH6.0;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。
C、生根培养:待不定芽伸长到5cm时,切取不定芽,接种于生根培养基上培养诱导生根,培养条件为温度25±2℃,光照强度2500lx,光照时间12h/d。生根培养30d后,不定芽长出多条根,由此得到生根苗。所述的生根培养基:每升含有NAA0.3mg、蔗糖15g和琼脂5g,余量为MS培养基,pH6.0;配制方法是将上述成份混合均匀,调pH,然后灭菌备用。
D、炼苗及移栽:打开培养瓶盖让生根苗适应2d,然后小心将生根苗从培养瓶中挖出,洗净根上的培养基,将生根苗在自来水中浸泡1h,移栽到装在营养杯中的高温灭菌过的泥炭土上,在营养杯上套上塑料袋保湿,3d后慢慢地移开塑料袋,按生长需求浇水。由此得到移栽成活的红椿植株。
- 还没有人留言评论。精彩留言会获得点赞!