一种野生蕉离体培养增殖方式的制作方法
本发明是一种野生蕉离体培养增殖方式,属于植物组织培养离体增殖领域,主要应用于三明野生蕉离体增殖及种质资源离体保存以及转基因。
背景技术:
野生蕉相对于栽培蕉具有大量的抗逆基因,研究发现三明野生蕉具有抗寒、抗病等重要的抗逆基因,是进行基础研究的宝贵种质资源,是香蕉生物工程研究中重要的研究材料。传统意义上的香蕉离体繁殖技术,一般选用香蕉的吸芽为外植体,建立离体繁殖的无菌体系,然后使吸芽在增殖培养基上诱导其增殖,但此种方法增殖速度较慢。本发明使用三明野生蕉离体培养过程中特有的块状组织,使用筛选出的增殖培养基:ms+6-ba4.0mg/l,可使三明野生蕉块状组织大量增殖,增殖系数达到8.5。且没有出现分化情况。然后利用筛选的分化培养基:ms+naa2.0mg/l,使块状组织分化出大量的芽点进而长出小苗,分化系数达到7.2。可大大提高三明野生蕉的增殖速度,降低成本。这两种培养基可分别有效的控制块状组织的增殖和分化,且相对于前人研究的培养基简单方便,只需一种生长调节剂即可。在离体培养块状组织过程中未出现污染现象。目前这两种增殖和分化培养基在野生蕉的离体培养上还未见报道。
技术实现要素:
本发明的目的在于提供一种野生蕉离体培养增殖方式,野生蕉离体培养过程的增殖及分化的新材料块状组织,且提供了两种有效控制块状组织增殖及分化的培养基。能高效、快速、简便、低成本的进行三明野生蕉离体培养。
为实现上述目的,采用以下技术方案:
一种野生蕉离体培养增殖方式,将野生蕉的块状组织,在超净工作台上切成黄豆大小,分别通过增殖培养基和分化培养基进行培养,块状组织增殖培养基中的块状组织长至直径3cm大小后转移至分化培养基中;培养期间培养温度为25℃,光照强度为2000lx,光照时间为12h/d。
所述的增殖培养基为ms+6-ba4.0mg/l。
所述的分化培养基为ms+naa2.0mg/l。
本发明的优点在于:
1.运用三明野生蕉中的新型块状组织进行离体增殖,并分化成芽点及小苗。这种块状组织在三明野生蕉离体培养过程中能大量生成,这种块状组织在栽培蕉的离体培养中是没有的。因此,利用是三明野生蕉离体培养中独特的组织进行增殖和分化成小苗是非常有前景的,并有望做为种质资源保存的重要外植体。
2.筛选出用于块状组织快速增殖的培养基:ms+6-ba4.0mg/l。利用这种培养基培养块状组织的过程中,块状组织增殖系数达到8.5,且没有分化、污染现象发生。
3.筛选出使块状组织能分化出大量芽点及小苗的培养基:ms+naa2.0mg/l。利用这种培养基培养块状组织的过程中,块状组织能分化出大量的芽点,分化系数达到7.2。这种培养基培养培养的小苗增殖速度远快于传统的培养基。
4.这两种培养基可以很有效的控制块状组织的生长状态,且效果明显。这两种培养基相对于传统的培养基更简便,只用一种生长调节剂即可。
5.两种培养基搭配使用,将会使三明野生蕉块状组织分化出小苗的速率大大增加。
6.这种块状组织组织培养过程中容易操作,且增殖快,不容易污染,可用于保存种质资源。
附图说明
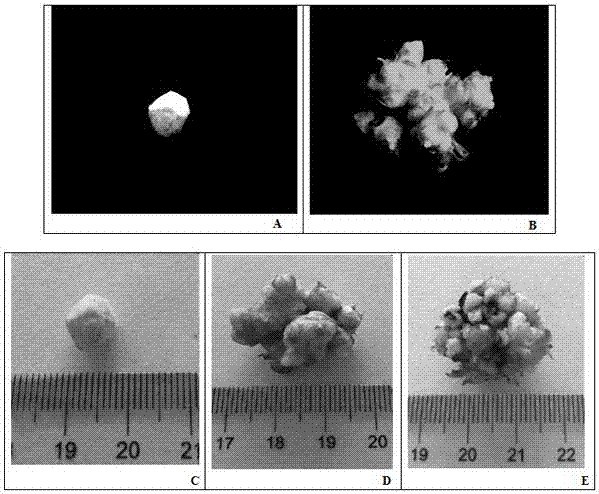
图1是本专利中使用的材料三明野生蕉块状组织示意图。其中,a和c是接种的三明野生蕉块状组织,及其大小示意图;b、d、e是三明野生蕉块状组织增殖的示意图及其大小。
图2是本专利中接种到培养基中的三明野生蕉块状组织分化成芽点及小苗的示意图。其中,f为单个芽点分化出的小苗;g、h、i、j为不同大小的块状组织从不同方向分化出的芽点。
图3是本专利中三明野生蕉块状组织分化出的芽点进而长成小苗的示意图。其中,k为长出的较小的小苗,且已生根;l为长出的较大的小苗。
图4是本专利中的三明野生蕉块状组织增殖、分化成芽点、分化成小苗及小苗生根的示意图。其中,m为块状组织不断增殖的过程;n为块状组织分化出芽点、分化长出小苗的过程;o为块状组织增殖、分化的总图。
图5是本专利中经三明野生蕉块状组织分化长成小苗并生根长成大苗的示意图。其中,p为小苗生根的示意图;q为生根的三明野生蕉瓶苗示意图。
具体实施方式
将三明野生蕉的块状组织(如图1-b),在超净工作台上切成黄豆大小(如图1-a),分别接种到不同浓度生长调节剂的增殖培养基和分化培养基上,每瓶培养基接种4个块状组织,每种培养基接种30瓶。然后放进培养室进行培养,培养期间培养温度为25℃左右,光照强度为2000lx,光照时间为12h/d。30天后块状组织增殖培养基中的块状组织长至直径约3cm大小(如图1-d、e),然后进行统计其增殖系数及污染率。30天后块状组织分化培养基中的块状组织分化出了大量的芽点(如图2),然后统计其分化系数和污染率。继续培养会长成带根的三明野生蕉小苗及壮大的瓶苗(如图3、5)。图4可清晰的看出三明野生蕉块状组织增殖、分化的过程。
实施例1
1.接种前准备工作。
将接种用到的接种刀、镊子、滤纸、接种盘,进行高压灭菌备用。将高压好的接种刀、镊子、滤纸、接种盘、培养基,以及酒精灯、打火机、记号笔、工业酒精和废液缸放进超净工作台,紫外灭菌20min。增殖培养基和分化培养基采用单因素四水平或三水平实验进行生长调节剂浓度筛选。筛选培养基分别为:l1:ms+6-ba1.0mg/l;l2:ms+6-ba2.5mg/l;l3:ms+6-ba4.0mg/l;l4:ms+6-ba5.5mg/l。l5:ms+naa1.0mg/l;l6:ms+naa2.0mg/l;l7:ms+naa3.0mg/l。蔗糖30g/升,琼脂6g/升,ph调至5.8,每种培养基各配制30瓶,高压后备用。
2.接种。
用75%酒精擦拭双手及手臂,晾干后进入工作台操作。将接种刀和镊子插入工业酒精中数秒,然后在酒精灯上灼烧灭菌,等温度冷却至室温时备用。将接种盘边缘及盘底放酒精灯上灼烧灭菌。将高压的滤纸在酒精灯上缓慢灼烧至微泛黄,放进接种盘备用。
用镊子将三明野生蕉块状组织夹出来放到滤纸上并轻按住块状组织,用接种刀将其切分成黄豆大小。将镊子再放入酒精里数秒后在酒精灯上灼烧灭菌,并冷却备用。然后将培养基打开,将瓶口在酒精灯上灼烧灭菌。用镊子将切分好的块状组织接种到培养基中,每瓶培养基接种4个块状组织,然后再将瓶口放酒精灯上灼烧灭菌后盖上盖子。增殖培养基和分化培养基各接种30瓶。
3.无菌培养。
将接种后的培养基放进无菌培养室,室温25℃,光照强度为2000lx,光照时间为12h。培养至30d后,进行统计。
4.数据统计。
块状组织增殖系数统计:按上述操作将增殖后的块状组织切至黄豆大小(尽量与刚接种时候的大小一致),接种至培养基,每瓶培养基和之前接种时数量一致,即每瓶接种4个。然后统计最终的接种瓶数。块状组织增殖系数=统计后接种瓶数/原始接种瓶数。
块状组织污染率统计:接种过程中观察其污染情况,统计污染的块状组织数量。污染率=污染的块状组织数量/块状组织总接种数量*100%。
块状组织分化系数统计:将每个块状组织分化出的小芽数量统计后继代接种。块状组织分化系数=统计时分化小芽总数量/接种时块状组织总数量。
块状组织分化的小苗污染率统计:继代过程中观察污染情况,统计污染的块状组织数量。污染率=污染的块状组织数量/块状组织总接种数量*100%。
5.数据统计与结果分析。
块状组织增殖系数统计结果表明,在块状组织增殖离体培养过程中,l1、l2、l3、l4培养基中的块状组织的增殖系数分别为5.4、6.1、8.5、7.2。l3培养基中的块状组织增殖系数最大,且在增殖过程中几乎没有分化成苗。l1培养基中的块状组织有增殖,但分化程度较高。l2培养基中的块状组织有增殖也存在一定程度的分化现象,但分化现象没有l1程度高。l4培养基中的块状组织增殖系数略小于l3培养基,且发现有少量分化现象。
块状组织污染率统计结果表明,在块状组织离体培养过程中,l1、l2、l3、l4培养基中的块状组织均没有发生污染现象。
块状组织分化系数统计结果表明,在块状组织分化离体培养过程中,l5、l6、l7培养基中的块状组织分化系数分别为5.1、7.2、6.4。l5和l7培养基中的块状组织分化系数都低于l6培养基中的块状组织。
块状组织污染率统计结果表明,l5、l6、l7培养基中的块状组织在分化离体培养过程中,均没有发生污染现象。
总之,块状组织的增殖和分化结果表明,块状组织是三明野生蕉离体培养过程中增殖及分化小苗较为理想的材料。且l3(ms+6-ba4.0mg/l)和l6(ms+naa2.0mg/l)培养基是块状组织增殖和分化效果最理想的培养基。
- 还没有人留言评论。精彩留言会获得点赞!