表达外源末端脱氧核苷酸转移酶的非人动物的制作方法
本申请要求2016年6月3日提交的美国临时专利申请序列号62/345,524的优先权,其全部内容通过引用并入本文。
背景技术:
已经证明非人动物,特别是小鼠和大鼠是治疗性抗体的有价值来源,并且可能作为其他抗原结合分子的来源。这种非人动物中高水平的抗原受体多样性增加了免疫后产生具有所需治疗特性的抗原结合分子的可能性。因此,需要具有增加的抗原受体多样性的基因工程非人动物,以改善治疗性抗原结合分子的产生。
技术实现要素:
在某些方面,本文提供了遗传修饰的非人动物,其在其基因组中包含编码末端脱氧核苷酸转移酶(tdt)的外源核酸,以及制备和使用此类非人动物的方法。在一些实施方案中,外源性tdt是人tdt。在一些实施方案中,外源性tdt是内源性物种来源的(例如,在小鼠中,外源性tdt具有小鼠序列)。在一些实施方案中,本文提供的非人动物在b细胞发育期间表达由外源核酸编码的tdt,例如,在pro-b细胞和/或pre-b细胞中。在一些实施方案中,本文提供的非人动物在t细胞发育期间表达由外源核酸编码的tdt,例如,在双阴性(dn)胸腺细胞和/或双阳性(dp)胸腺细胞中。在一些实施方案中,遗传修饰的非人动物包含编码tdt的多拷贝的外源核酸(例如,至少2、3、4、5、6、7或8个拷贝)。在一些实施方案中,遗传修饰的非人动物是哺乳动物,例如啮齿动物(例如小鼠或大鼠)。
在一些实施方案中,遗传修饰的非人动物在其基因组中包含免疫球蛋白可变区,其包含与免疫球蛋白恒定区基因(例如重链恒定区基因、κ链恒定区基因、λ链恒定区基因)可操作地连接的未经重排的人免疫球蛋白可变区基因区段(例如重链基因区段、κ链基因区段、λ链基因区段)。在一些实施方案中,恒定区基因是人恒定区基因、小鼠恒定区基因或大鼠恒定区基因。在一些实施方案中,恒定区基因是内源物种来源。在一些实施方案中,可变区和恒定区基因位于内源免疫球蛋白基因座(例如,重链基因座、κ基因座、λ基因座)中。在一些实施方案中,遗传修饰的非人生物表达包含衍生自免疫球蛋白可变区的人免疫球蛋白可变结构域和由免疫球蛋白恒定区基因编码的免疫球蛋白恒定结构域的抗体。在一些实施方案中,本文提供了使用这种遗传修饰的非人动物产生抗体、b细胞、杂交瘤或编码人免疫球蛋白可变结构域的核酸的方法。
在某些实施方案中,遗传修饰的非人动物在其基因组中包含t细胞受体(tcr)可变区,其包含未重排的人tcr可变区基因区段(例如,tcrα基因区段、tcrβ基因区段、tcrγ基因区段、tcrδ基因),其可操作地连接tcr恒定区基因(例如,tcrα恒定区基因、tcrβ恒定区基因、tcrγ恒定区基因、tcrδ恒定区基因)。在一些实施方案中,恒定区基因是人恒定区基因、小鼠恒定区基因或大鼠恒定区基因。在一些实施方案中,恒定区基因是内源物种来源。在一些实施方案中,可变区和恒定区基因位于内源tcr基因座(例如tcrα基因座、tcrβ基因座、tcrγ基因座、tcrδ基因座)。在一些实施方案中,遗传修饰的非人生物表达tcr,其包含衍生自tcr可变区的人tcr可变结构域和由tcr恒定区基因编码的tcr恒定结构域。在一些实施方案中,本文提供了使用这种遗传修饰的非人动物产生tcr、t细胞、t细胞杂交瘤或编码人tcr可变结构域的核酸的方法。
在一些实施方案中,遗传修饰的非人动物在其基因组中包含免疫球蛋白可变区,其包含与tcr恒定区基因(例如,tcrα恒定区基因、tcrβ恒定区基因、tcrγ恒定区基因、tcrδ恒定区基因)可操作地连接的未经重排的人免疫球蛋白可变区基因区段(例如,重链基因区段、κ链基因区段、λ链基因区段)。在一些实施方案中,恒定区基因是人恒定区基因、小鼠恒定区基因或大鼠恒定区基因。在一些实施方案中,恒定区基因是内源物种来源。在一些实施方案中,可变区和恒定区基因位于内源tcr基因座(例如tcrα基因座、tcrβ基因座、tcrγ基因座、tcrδ基因座)。在一些实施方案中,遗传修饰的非人生物表达嵌合抗原受体(car),其包含衍生自免疫球蛋白可变区的人免疫球蛋白可变结构域和由tcr恒定区基因编码的tcr恒定结构域。在一些实施方案中,本文提供了使用这种遗传修饰的非人动物产生car、t细胞、t细胞杂交瘤或编码人免疫球蛋白可变结构域的核酸的方法。
在一些实施方案中,本文提供了制备本文公开的非人动物的方法,包括改造非人动物以在其种系中包含本文所述的遗传修饰。在一些实施方案中,本文提供了包含本文所述遗传修饰的非人es细胞。
附图说明
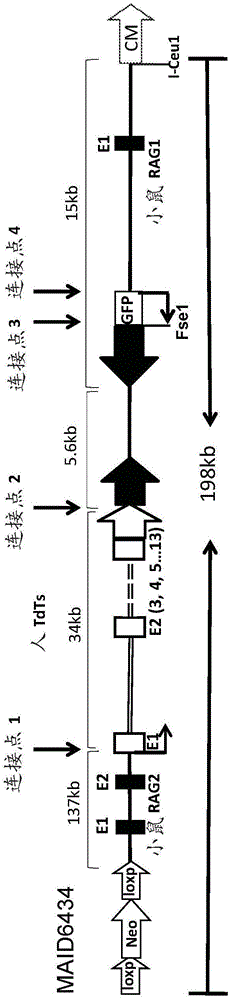
图1描绘了示例性靶向载体(未按比例)的图,其中小鼠rag2基因的一部分被编码短同种型人tdt(htdt)的dna序列替换。在示例性实施方案中,载体随机整合到基因组中。除非图中的标记另有说明(例如,对于选择盒、loxp位点等),填充的形状和单行代表小鼠序列,空的形状和双线代表人序列。e1、e2等代表特定图解基因的外显子,gfp是绿色荧光蛋白,cm是氯霉素抗性基因,neo是新霉素抗性基因。连接点1-4对应于表1中所示的连接点。
图2描绘了示例性靶向载体(未按比例)的图,其中小鼠rag2基因的一部分被编码短同种型人tdt(htdt)的dna序列替换。在所描绘的实施方案中,载体用于将由小鼠rag2启动子驱动的htdt插入igκ基因座。除非图中的标记另有说明(例如,对于选择盒、loxp位点等),填充的形状和单行代表小鼠序列,空的形状和双线代表人序列。e1、e2等代表特定图解基因的外显子,gfp是绿色荧光蛋白,cm是氯霉素抗性基因,hyg是潮霉素抗性基因。连接点1-7对应于表2中的连接点。
图3描绘了用于将由vh1-72启动子和eμ+增强子驱动的编码人tdt(htdt)的dna序列插入免疫球蛋白κ基因座的示例性靶向载体(未按比例)的图。除非图中的标记另有说明(例如,对于选择盒、loxp位点等),填充的形状和单行代表小鼠序列,空的形状和双线代表人序列。e1、e2等代表特定图解基因的外显子,gfp是绿色荧光蛋白,cm是氯霉素抗性基因,hyg是潮霉素抗性基因。连接点1-4对应于表3中的连接点。
图4描绘了与
图5描绘了显示与
图6描绘了显示与
图7有两个图板。图板(a)描绘了显示与
图8有两个图板。图板(a)描绘了显示与
图9描绘了显示与
图10描绘了显示与
图11描绘了显示与
图12描绘了显示与
图13描绘了显示表达htdt的双轻链小鼠(dlc;包含两个未经重排的人vk基因区段和五个未重排的人jk基因区段以及多种库的未重排的人重链v、d和j基因区段的小鼠)中的higκ序列多样性(每10,000个igκ测序读数的独特轻链cdr3序列的数量)的图(右图;htdt基因如所示呈现),其与表达htdt的
图14描绘了显示与不表达htdt的dlc对照小鼠(dlc)相比,表达htdt的小鼠中higκ非模板添加物的分布的图。het表示htdt的杂合小鼠,ho表示htdt的纯合小鼠。“nt”代表核苷酸。
图15描绘了显示与不表达htdt的dlc对照小鼠相比,表达htdt的dlc小鼠中higκcdr3长度的分布的图。het表示htdt的杂合小鼠,ho表示htdt的纯合小鼠。
图16描绘了显示与不表达htdt的dlc对照小鼠相比,表达htdt的dlc小鼠中vκ使用和jκ使用的图。het表示htdt的杂合小鼠,ho表示htdt的纯合小鼠。仅使用两种不同的ragtdttg(ho)dlc小鼠,其分别描述。
具体实施方式
概述
本文提供了与非人动物相关的方法和组合物,其在其基因组中包含编码tdt(例如,人、小鼠或大鼠tdt)的外源核酸。在一些实施方案中,遗传修饰的非人动物是哺乳动物,例如啮齿动物(例如小鼠或大鼠)。在某些实施方案中,非人动物的基因组包含进一步的修饰,使得其表达具有人可变结构域的抗原结合分子(例如,抗体、tcr和/或car)。
tdt是dna聚合酶,其在v(d)j重组中在连接点形成期间催化模板非依赖性添加核苷酸(n-添加),这导致b和t淋巴细胞中抗原-受体多样性的增加。在一些实施方案中,与在其基因组中不包括编码tdt的外源核酸的相应的非人动物(即,相同物种和品系的非人动物)相比,本文提供的非人动物在b细胞发育和/或t细胞发育期间表达增加的tdt水平。在一些实施方案中,本文提供的非人动物在b细胞发育和/或t细胞发育的阶段期间表达tdt,在此期间,在其基因组中不包括编码tdt的外源核酸的相应非人动物不表达tdt(例如,在前b细胞阶段期间)。在一些实施方案中,与在其基因组中不包括编码tdt的外源核酸的相应非人动物相比,本文所述的经遗传修饰的非人动物具有增加的抗原-受体多样性(例如,抗体多样性、tcr多样性和/或car多样性)。
定义
冠词“一”和“一个”在本文中用于指代冠词的一个或多于一个(即至少一个)语法对象。举例来说,“一个元素”表示一个元素或多于一个元素。
术语“氨基酸”旨在包括所有的包括氨基官能团和酸官能团并且能够包括在天然存在的氨基酸的聚合物中的分子,无论是天然的还是合成的。示例性氨基酸包括天然存在的氨基酸;其类似物、衍生物和同类物;具有变体侧链的氨基酸类似物;和任何前述的所有立体异构体。
如本文所用,术语“抗体”可以指完整抗体及其抗原结合片段。完整抗体是糖蛋白,其包括通过二硫键相互连接的至少两条重(h)链和两条轻(l)链。每条重链包含重链可变区(本文缩写为vh)和重链恒定区。每条轻链包括轻链可变区(本文中缩写为vl)和轻链恒定区。vh和vl区可以进一步细分为高变区,称为互补决定区(cdr),散布有更保守的区域,称为框架区(fr)。每个vh和vl由三个cdr和四个fr组成,按照以下顺序从氨基末端到羧基末端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。术语“抗体”还包括单结构域抗体、仅重链抗体、重链上具有轻链可变基因区段的抗体,等等。
如本文所用,抗原结合分子(例如,抗体、t细胞受体(tcr)、嵌合抗原受体(car))的术语“抗原结合片段”和“抗原结合部分”是指保留了与抗原结合的能力的一个或更多的抗原结合分子片段。抗原结合片段可包括保留完整抗原结合分子的至少一部分可变区并能够结合抗原的任何抗体、tcr或car片段。包含在术语“抗原结合片段”内的结合片段的实例包括但不限于fab、fab'、f(ab')2、fv、scfv、二硫键连接的fv、fd、单链抗体、可溶性tcr、单链tcr、可溶性car、单链car、分离的cdrh3(抗体或tcr)和保留完整抗原结合分子的至少一部分可变区的其他抗原结合片段。这些抗原结合片段可以使用常规的重组和/或酶技术获得,并且可以以与完整抗体相同的方式筛选抗原结合。
关于非人类动物的术语“相应的”用于描述相同物种的对照非人动物的特征,并且包括与非人类受试者相同的遗传修饰,除了非人类受试者动物表达外源性tdt,而相应的非人类动物则不表达外源性tdt。
如本文所用,“嵌合抗原受体”或“car”是指一种抗原结合蛋白,其包括免疫球蛋白抗原结合结构域(例如,免疫球蛋白可变结构域)和t细胞受体(tcr)恒定结构域或其部分。。如本文所用,tcr多肽的“恒定结构域”包括膜近端tcr恒定结构域,并且还可包括tcr跨膜结构域和/或tcr胞质尾部。例如,在一些实施方案中,car是二聚体,其包括第一多肽,其包含与tcrβ恒定结构域连接的免疫球蛋白重链可变结构域,和第二多肽,其包含与tcrα恒定结构域连接的免疫球蛋白轻链可变结构域(例如κ或λ可变结构域)。例如,在一些实施方案中,car是二聚体,其包括第一多肽,其包含与tcrα恒定结构域连接的免疫球蛋白重链可变结构域,和第二多肽,其包含与tcrβ恒定结构域连接的免疫球蛋白轻链可变结构域(例如κ或λ可变结构域)。
当关于重排的可变区基因或“衍生自”未重排的可变区和/或未重排的可变区基因区段的可变结构域使用时的短语“衍生自”是指追踪重排的可变区基因或可变结构域的序列回到一组未重排的可变区基因区段的能力,该一组未重排的可变区基因区段被重排以形成表达可变结构域的重排可变区基因(在适用的情况下考虑剪接差异和体细胞突变)。例如,经历过体细胞突变的重排可变区基因不会改变它衍生自未重排的可变区基因区段的事实。
如本文所用,术语“基因座”是指染色体上包含一组相关遗传元件(例如,基因、基因区段、调节元件)的区域。例如,未经重排的免疫球蛋白基因座可包括免疫球蛋白可变区基因区段、一个或多个免疫球蛋白恒定区基因和指导v(d)j重组和免疫球蛋白表达的相关调节元件(例如,启动子、增强子、开关元件等),而未重排的tcr基因座可包括tcr可变区基因区段、tcr恒定区基因和指导v(d)j重组和tcr表达的相关调节元件(例如,启动子、增强子等)。类似地,未重排的car基因座可包括免疫球蛋白可变区基因区段、tcr恒定区基因和指导v(d)j重组和car表达的相关调节元件(例如,启动子、增强子等)。基因座可以是内源的或非内源的。术语“内源基因座”是指染色体上天然存在特定遗传元件的位置。
如果未重排的可变区基因区段能够重排以形成重排的可变区基因,其与作为抗原结合蛋白的多肽链的恒定区基因一起表达,则未重排的可变区基因区段与连续的恒定区基因“可操作地连接”。
术语“多核苷酸”和“核酸”可互换使用。它们是指任何长度的聚合形式的核苷酸,脱氧核糖核苷酸或核糖核苷酸,或其类似物。多核苷酸可以具有任何三维结构,并且可以执行任何功能。以下是多核苷酸的非限制性实例:基因或基因片段的编码或非编码区、由连锁分析定义的基因座(loci)(基因座(locus))、外显子、内含子、信使rna(mrna)、转移rna、核糖体rna、核酶、cdna、重组多核苷酸、分支多核苷酸、质粒、载体、任何序列的分离的dna、任何序列的分离的rna、核酸探针和引物。多核苷酸可包含修饰的核苷酸,例如甲基化的核苷酸,和核苷酸类似物。如果存在,可以在聚合物组装之前或之后赋予对核苷酸结构的修饰。可以进一步修饰多核苷酸,例如通过与标记组分缀合。在本文提供的所有核酸序列中,u核苷酸可与t核苷酸互换。
如本文所用,“特异性结合”和“抗原特异性”是指抗原结合分子(例如,抗体、tcr、car)结合预定靶标(例如预定抗原)的能力。通常,抗原结合分子以对应于约10-7m或更低的kd的亲和力特异性结合其预定靶标,并以对应于kd的亲和力结合预定靶标,所述kd与其对于非特异性和不相关的靶标(例如bsa、酪蛋白)的kd相比小至少10倍、小至少100倍或小至少1000倍。在一些实施方案中,抗原结合分子以对应于约10-8m或更低、10-9m或更低或10-10m或更低的kd的亲和力特异性结合其预定靶标。
如本文所用,“t细胞受体”或“tcr”是指抗原结合蛋白,其包括tcr抗原结合结构域(例如,tcr可变结构域)和至少一部分tcr恒定结构域。如本文所用,tcr多肽的“恒定结构域”包括膜近端tcr恒定结构域,并且还可包括tcr跨膜结构域和/或tcr胞质尾部。在某些实施方案中,tcr是可溶性tcr,并且不包括tcr跨膜结构域或tcr胞质尾部。例如,在一些实施方案中,tcr是二聚体,其包括第一多肽和第二多肽,所述第一多肽包含与tcrβ恒定结构域(或其片段)连接的tcrβ可变结构域,所述第二多肽包含与tcrα恒定结构域(或其片段)连接的tcrα。
术语“未经重排”包括免疫球蛋白、tcr或car可变区基因座或可变区基因区段的状态,其中v基因区段和j基因区段(对于重链或tcrβ可变区,d基因区段也是)分开维持的但是能够连接形成重排的v(d)j基因(“可变区基因”),其包含v(d)j库的单个v、(d)、j。
遗传修饰的非人动物和es细胞
在某些方面,本文提供了非人动物和es细胞,其在其基因组中包含编码tdt的外源核酸(例如,人、小鼠或大鼠tdt)。在某些实施方案中,非人动物和es细胞的基因组包含进一步的修饰,包括例如导致具有人可变结构域(例如抗体、tcr和/或car)的抗原结合分子表达的修饰。
本文提供的遗传修饰的非人动物和es细胞可以使用本领域已知的任何合适的方法产生。例如,可以使用
然后可以使用本领域已知的方法将本文所述的es细胞用于产生非人动物。例如,本文所述的小鼠非人动物es细胞可用于使用
在一些实施方案中,非人动物可以是任何非人动物。在一些实施方案中,非人动物是脊椎动物。在一些实施方案中,非人动物是哺乳动物。在一些实施方案中,本文所述的经遗传修饰的非人动物可选自小鼠、大鼠、兔、猪、牛(例如奶牛、公牛、水牛)、鹿、绵羊、山羊、美洲驼、鸡、猫、狗、雪貂、灵长类动物(例如绒猴、恒河猴)。对于不容易获得合适的可遗传修饰的es细胞的非人动物,可以采用其他方法制备包含本文所述遗传修饰的非人动物。这些方法包括例如修饰非es细胞基因组(例如成纤维细胞或诱导的多能细胞)并使用核转移将修饰的基因组转移至合适的细胞,例如卵母细胞,并在非人动物中在适当条件下妊娠修饰的细胞(例如修饰的卵母细胞)以形成胚胎。
在一些实施方案中,非人动物是哺乳动物。在一些实施方案中,非人动物是小型哺乳动物,例如跳鼠总科(dipodoidea)或鼠总科(muroidea)的小型哺乳动物。在一些实施方案中,非人动物是啮齿动物。在某些实施方案中,啮齿动物是小鼠、大鼠或仓鼠。在一些实施方案中,啮齿动物选自鼠总科。在一些实施方案中,非人动物来自选自以下的科:仓鼠科(calomyscidae)(例如小鼠样仓鼠),鼠科(cricetidae)(例如仓鼠、newworld大鼠和小鼠、田鼠),跳鼠科(muridae)(例如,真正的小鼠和大鼠、沙鼠、多刺的小鼠、冠鼠),马岛鼠科(例如,爬行鼠、岩鼠、白尾大鼠、马达加斯加大鼠和小鼠),刺山鼠科(例如多刺睡鼠)和鼹形鼠科(例如瞎鼠、竹鼠和鼢鼠)。在一些实施方案中,啮齿动物选自真正的小鼠或大鼠(鼠科)、沙鼠、多刺小鼠和冠鼠。在一些实施方案中,小鼠来自鼠科(muridae)的成员。在一些实施方案中,非人动物是啮齿动物。在一些实施方案中,啮齿动物选自小鼠和大鼠。在一些实施方案中,非人动物是小鼠。
在一些实施方案中,非人动物是c57bl品系的小鼠。在一些实施方案中,c57bl品系选自c57bl/a、c57bl/an、c57bl/grfa、c57bl/kalwn、c57bl/6、c57bl/6j、c57bl/6byj、c57bl/6nj、c57bl/10、c57bl/10scsn、c57bl/10cr和c57bl/ola。在一些实施方案中,非人动物是129品系的小鼠。在一些实施方案中,129品系选自129p1、129p2、129p3、129x1、129s1(例如129s1/sv、129s1/svim)、129s2、129s4、129s5、129s9/svevh、129s6(129/svevtac)、129s7、129s8、129t1、129t2。在一些实施方案中,遗传修饰的小鼠是129品系和c57bl品系的混合物。在一些实施方案中,小鼠是129品系的混合物和/或c57bl/6品系的混合物。在一些实施方案中,混合物的129品系是129s6(129/svevtac)品系。在一些实施方案中,小鼠是balb品系(例如balb/c)。在一些实施方案中,小鼠是balb品系和另一品系(例如,c57bl品系和/或129品系)的混合物。在一些实施方案中,本文提供的非人动物可以是衍生自前述品系的任何组合的小鼠。
在一些实施方案中,本文提供的非人动物是大鼠。在一些实施方案中,大鼠选自wistar大鼠、lea品系、spraguedawley品系、fischer品系、f344、f6和darkagouti。在一些实施方案中,大鼠品系是选自wistar、lea、spraguedawley、fischer、f344、f6和darkagouti的两种或更多种品系的混合物。
表达外源性tdt的非人动物
在某些方面,本文提供了遗传修饰的非人动物和es细胞,其在其种系和/或基因组中包含编码外源末端脱氧核苷酸转移酶(tdt)的核酸序列。脱氧核苷酸转移酶(tdt)是dna聚合酶,其在v(d)j重组中在连接点形成期间催化模板非依赖性添加核苷酸(np-添加),这导致b和t淋巴细胞中抗原-受体多样性的增加。模板非依赖性添加、非模板添加和非种系添加都是指由tdt催化的核苷酸添加,并且这些术语在本文中可互换使用。
在某些实施方案中,遗传修饰的非人动物的基因组中的外源tdt的序列可以来自编码tdt或tdt直向同源物的任何动物。在一些实施方案中,tdt是脊椎动物tdt。在一些实施方案中,tdt是哺乳动物tdt。在一些实施方案中,tdt来自选自以下的的哺乳动物:小鼠、大鼠、兔、猪、牛(例如奶牛、公牛、水牛)、鹿、绵羊、山羊、美洲驼、鸡、猫、狗、雪貂、灵长类动物(例如绒猴、恒河猴)或人类。在一些实施方案中,tdt是内源物种来源的(即,tdt序列是与遗传修饰的非人动物相同物种的序列)。在一些实施方案中,tdt是人tdt、小鼠tdt或大鼠tdt。在一些实施方案中,核酸序列是基因组tdt序列(即,包括外显子和内含子)。在一些实施方案中,核酸序列编码tdtmrna/cdna(即,一种或多种tdt同种型的外显子)。
人tdt(htdt)由dntt基因编码,其位于人10号染色体上。htdt的示例性基因组dna序列可以在ncbi登录号nc_000010.11的96304328至96338564位置找到,其通过引用并入本文。htdt同种型的示例性mrna序列由ncbi登录号nm_001017520.1和nm_004088.3提供,其各自通过引用并入本文。由这些同种型编码的蛋白质序列分别由ncbi登录号np_001017520.1和np_004079.3提供,其各自通过引用并入本文。tdt同种型中有短同种型(htdts)和两种长同种型(htdtl1和htdtl2)。三种同种型的序列例如在thai和kearney,adv.immunol.86:113-36(2005)中提供,在此通过引用并入。在某些实施方案中,外源核酸序列编码htdts。在一些实施方案中,外源核酸序列编码htdtl1。在一些实施方案中,外源核酸序列编码htdtl2。在某些实施方案中,非人生物包含编码多种同种型(例如,htdts和htdtl2)的外源核酸序列。在某些实施方案中,非人生物包含编码所有三种人同种型(例如,htdts和htdtl2)的外源核酸序列。
小鼠tdt(mtdt)由dntt基因编码,该基因位于小鼠19号染色体上。mtdt的示例性基因组dna序列可以在ncbi登录号nc_000085.6的41029275至41059525位置找到,其通过引用并入本文。mtdt同种型的示例性mrna序列由ncbi登录号nm_001043228.1和nm_009345.2提供,其各自通过引用并入本文。由这些同种型编码的蛋白质序列分别由ncbi登录号np_001036693.1和np_033371.2提供,其各自通过引用并入本文。
大鼠tdt(rtdt)由dntt基因编码,其位于大鼠染色体1上。rtdt的示例性基因组dna序列可以在ncbi登录号nc_005100.4的260289626至260321174位置找到,其通过引用并入本文。rtdt的示例性mrna序列由ncbi登录号nm_001012461.1提供,其通过引用并入本文。由该mrna编码的蛋白质序列由ncbi登录号np_001012479.1提供,其通过引用并入本文。
在一些实施方案中,遗传修饰的非人动物的基因组含有编码外源tdt的核酸序列的多个拷贝。在一些实施方案中,经遗传修饰的非人动物含有编码外源性tdt的核酸序列的2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个拷贝。在一些实施方案中,经遗传修饰的非人动物含有编码外源性tdt的核酸序列的至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个拷贝。
在一些实施方案中,编码外源tdt的核酸序列与一种或多种转录控制元件(例如,启动子和/或增强子)可操作地连接。在一些实施方案中,转录控制元件是组成型(即普遍存在的)启动子。组成型启动子的实例包括但不限于sv40、cmv启动子、腺病毒启动子、ef1启动子、β-肌动蛋白启动子、egr1启动子、eif4a1启动子、ferh启动子、ferl启动子、gapdh启动子、grp78启动子、grp94启动子、hsp70启动子、β-kin启动子、pgk-1启动子、rosa启动子和遍在蛋白b启动子。在一些实施方案中,核酸序列不与组成型启动子可操作地连接。
在一些实施方案中,转录控制元件在b细胞发育期间诱导编码的tdt的表达。在一些实施方案中,转录控制元件诱导pro-b细胞和/或pre-b细胞中tdt的表达。在一些实施方案中,转录控制元件是在b细胞发育期间,在pro-b细胞和/或pre-b细胞中表达的基因的转录控制元件(例如启动子和/或增强子)。在一些实施方案中,转录控制元件是rag1转录控制元件、rag2转录控制元件、免疫球蛋白重链转录控制元件、免疫球蛋白κ轻链转录控制元件和/或免疫球蛋白λ轻链转录控制元件。在一些实施方案中,转录控制元件来源于内源物种。在一些实施方案中,转录控制元件是小鼠转录控制元件、大鼠转录控制元件或人转录控制元件。在一些实施方案中,转录控制元件是内源转录控制元件(例如编码外源tdt的核苷酸序列插入到非人动物基因组中的位置,使得外源tdt的表达至少部分地由内源性转录控制元件控制)。在一些实施方案中,转录控制元件可包括调节以下的转录的那些:rag1、rag2、λ5、vpreb、cd34、cd45、aa4.1、cd45r、il-7r、mhcii类、cd10、cd19、cd38、cd20、cd40、各种免疫球蛋白轻链和重链v基因区段启动子和增强子(见,例如internationalimmunogeneticsinformation
在一些实施方案中,转录控制元件在t细胞发育期间诱导编码的tdt的表达。在一些实施方案中,转录控制元件诱导cd4/cd8双阴性(dn)胸腺细胞和/或cd4/cd8双阳性(dp)胸腺细胞中tdt的表达。在一些实施方案中,转录控制元件是在t细胞发育期间,在dn胸腺细胞和/或dp胸腺细胞中表达的基因的转录控制元件(例如,启动子和/或增强子)。在一些实施方案中,转录控制元件是rag1转录控制元件、rag2转录控制元件、tcrα转录控制元件、tcrβ转录控制元件、tcrγ转录控制元件和/或tcrδ转录控制元件。在一些实施方案中,转录控制元件来源于内源物种。在一些实施方案中,转录控制元件是小鼠转录控制元件、大鼠转录控制元件或人转录控制元件。在一些实施方案中,转录控制元件是内源转录控制元件(例如编码外源tdt的核苷酸序列插入到非人动物基因组中的位置,使得外源tdt的表达至少部分地由内源性转录控制元件控制)。在一些实施方案中,转录控制元件可包括调节以下的转录的那些:rag1、rag2、lck、zap-70、cd34、cd2、hsa、cd44、cd25、αpt、cd4、cd8、cd69、各种tcrα、tcrβ、tcrδ和tcrγv基因区段启动子和增强(见,例如internationalimmunogeneticsinformation
在一些实施方案中,编码tdt的核酸位于非人动物的基因组中,在或接近(例如在1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90或100kb之内)在b细胞发育期间,在pro-b细胞和/或pre-b细胞中表达的基因的基因组基因座。在一些实施方案中,编码tdt的核酸序列位于或接近免疫球蛋白κ轻链基因座、免疫球蛋白λ轻链基因座、免疫球蛋白重链基因座、rag1基因座或rag2基因座。
在一些实施方案中,编码tdt的核酸位于非人动物的基因组中,在或接近(例如在1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90或100kb之内)在t细胞发育期间,在dn胸腺细胞和/或dp胸腺细胞中表达的基因的基因组基因座。在一些实施方案中,编码tdt的核酸序列位于或接近tcrα链基因座、tcrβ链基因座、tcrγ链基因座、tcrδ链基因座、rag1基因座或rag2基因座。
在一些实施方案中,与在其基因组中不具有编码外源tdt的核酸的相应的非人动物相比,本文提供的非人动物在t细胞和/或b细胞发育的一个或多个阶段期间表达升高的tdt表达水平(例如,在pro-b细胞中,在pre-b细胞中,在dn胸腺细胞中和/或在dp胸腺细胞中)。在一些实施方案中,与相应的非人动物相比,在t细胞和/或b细胞发育的一个或多个阶段中,本文提供的经遗传修饰的非人动物表达多至少10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、250%、300%、350%、400%、450%或500%tdt。
在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-j免疫球蛋白κ链连接的百分比小于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-j免疫球蛋白κ链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特免疫球蛋白κ链cdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。在一些实施方案中,本文提供的非人动物每10,000个免疫球蛋白κ链cdr3序列具有至少900、1000、1100、1200、1300、1400、1500或1700个独特免疫球蛋白κ链cdr3序列。
在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-j免疫球蛋白λ链连接的百分比小于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-j免疫球蛋白λ链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特免疫球蛋白λ链cdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。在一些实施方案中,本文提供的非人动物具有每10,000个免疫球蛋白λ链cdr3序列至少150、160、170、180、190、200、210、220、230、240、250、260、270、280、290或300个独特免疫球蛋白λ链cdr3序列。
在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-d免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-d免疫球蛋白重链连接的百分比大于相应的非人动物中v-d免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-d免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-d免疫球蛋白重链连接的百分比小于相应的非人动物中v-d免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-d免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-d免疫球蛋白重链连接的百分比大于相应的非人动物中v-d免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-d免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-d免疫球蛋白重链连接的百分比大于相应的非人动物中v-d免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-d免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-d免疫球蛋白重链连接的百分比大于相应的非人动物中v-d免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-d免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-d免疫球蛋白重链连接的百分比大于相应的非人动物中v-d免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-d免疫球蛋白重链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特免疫球蛋白重链cdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。
在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的d-j免疫球蛋白重链连接的百分比大于相应的非人动物中d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的d-j免疫球蛋白重链连接的百分比小于相应的非人动物中d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少一个n-添加物的d-j免疫球蛋白重链连接的百分比大于相应的非人动物中d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的d-j免疫球蛋白重链连接的百分比大于相应的非人动物中d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的d-j免疫球蛋白重链连接的百分比大于相应的非人动物中d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的d-j免疫球蛋白重链连接的百分比大于相应的非人动物中d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中d-j免疫球蛋白重链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。
在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-jtcrα链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-jtcrα链连接的百分比大于相应的非人动物中v-jtcrα链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-jtcrα链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-jtcrα链连接的百分比小于相应的非人动物中v-jtcrα链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-jtcrα链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-jtcrα链连接的百分比大于相应的非人动物中v-jtcrα链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-jtcrα链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-jtcrα链连接的百分比大于相应的非人动物中v-jtcrα链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-jtcrα链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-jtcrα链连接的百分比大于相应的非人动物中v-jtcrα链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-jtcrα链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-jtcrα链连接的百分比大于相应的非人动物中v-jtcrα链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-jtcrα链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特tcrαcdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。
在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-dtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-dtcrβ链连接的百分比大于相应的非人动物中v-dtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-dtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-dtcrβ链连接的百分比小于相应的非人动物中v-dtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-dtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-dtcrβ链连接的百分比大于相应的非人动物中v-dtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-dtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-dtcrβ链连接的百分比大于相应的非人动物中v-dtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-dtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-dtcrβ链连接的百分比大于相应的非人动物中v-dtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-dtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-dtcrβ链连接的百分比大于相应的非人动物中v-dtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-dtcrβ链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特tcrβcdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。
在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的d-jtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的d-jtcrβ链连接的百分比大于相应的非人动物中d-jtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的d-jtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的d-jtcrβ链连接的百分比小于相应的非人动物中d-jtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的d-jtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的d-jtcrβ链连接的百分比大于相应的非人动物中d-jtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的d-jtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的d-jtcrβ链连接的百分比大于相应的非人动物中d-jtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的d-jtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的d-jtcrβ链连接的百分比大于相应的非人动物中d-jtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的d-jtcrβ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的d-jtcrβ链连接的百分比大于相应的非人动物中d-jtcrβ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中d-jtcrβ链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。
在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-jtcrγ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-jtcrγ链连接的百分比大于相应的非人动物中v-jtcrγ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-jtcrγ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-jtcrγ链连接的百分比小于相应的非人动物中v-jtcrγ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-jtcrγ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-jtcrγ链连接的百分比大于相应的非人动物中v-jtcrγ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-jtcrγ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-jtcrγ链连接的百分比大于相应的非人动物中v-jtcrγ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-jtcrγ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-jtcrγ链连接的百分比大于相应的非人动物中v-jtcrγ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-jtcrγ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-jtcrγ链连接的百分比大于相应的非人动物中v-jtcrγ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-jtcrγ链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特tcrγcdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。
在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-dtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-dtcrδ链连接的百分比大于相应的非人动物中v-dtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-dtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-dtcrδ链连接的百分比小于相应的非人动物中v-dtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-dtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-dtcrδ链连接的百分比大于相应的非人动物中v-dtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-dtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-dtcrδ链连接的百分比大于相应的非人动物中v-dtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-dtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-dtcrδ链连接的百分比大于相应的非人动物中v-dtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-dtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-dtcrδ链连接的百分比大于相应的非人动物中v-dtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-dtcrδ链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特tcrδcdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。
在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的d-jtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的d-jtcrδ链连接的百分比大于相应的非人动物中d-jtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的d-jtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的d-jtcrδ链连接的百分比小于相应的非人动物中d-jtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的d-jtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的d-jtcrδ链连接的百分比大于相应的非人动物中d-jtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的d-jtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的d-jtcrδ链连接的百分比大于相应的非人动物中d-jtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的d-jtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的d-jtcrδ链连接的百分比大于相应的非人动物中d-jtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的d-jtcrδ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的d-jtcrδ链连接的百分比大于相应的非人动物中d-jtcrδ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中d-jtcrδ链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。
在一些实施方案中,非人生物体中的内源性tdt基因座是完整的。在一些实施方案中,内源性tdt基因座是灭活的。例如,在一些实施方案中,内源性tdt基因座全部或部分缺失,使得非人生物体不表达内源性tdt。
表达人可变结构域抗体和外源性tdt的非人动物
在某些实施方案中,包含如本文所述的外源性tdt的遗传修饰的非人动物和非人动物es细胞还在其种系和/或基因组中包含免疫球蛋白基因座(外源或内源),其含有包含未经重排的人免疫球蛋白可变区基因区段的免疫球蛋白可变区和包含免疫球蛋白恒定区基因的免疫球蛋白恒定区,其中未重排的人免疫球蛋白可变区基因区段与免疫球蛋白恒定区基因可操作地连接。在一些实施方案中,非人动物和非人es细胞在其种系和/或基因组中包含多个此类免疫球蛋白基因座。例如,在一些实施方案中,遗传修饰的非人动物和非人动物es细胞在其种系和/或基因组中包括包含未重排的人重链可变区基因区段的至少一个免疫球蛋白基因座和包含未重排的人轻链可变区基因区段(例如κ链基因区段和/或λ链基因区段)的至少一个免疫球蛋白基因座。在一些实施方案中,遗传修饰的非人动物和非人动物es细胞在其种系和/或基因组中包括包含未重排的人重链可变区基因区段的至少一个免疫球蛋白基因座、包含未重排的人κ链可变区基因区段的至少一个免疫球蛋白基因座和包含未重排的人λ链可变区基因区段的至少一个免疫球蛋白基因座。在一些实施方案中,遗传修饰的非人动物,例如遗传修饰的小鼠或大鼠,在其种系和/或基因组中包含遗传修饰的免疫球蛋白基因座(遗传修饰的重排或未重排的免疫球蛋白基因座),使得小鼠制造人、人源化、部分人、反向嵌合(人可变和非人恒定区)抗体。
包含人可变区基因区段的免疫球蛋白基因座是本领域已知的,并且可以在例如以下中找到:美国专利5,633,425、5,770,429、5,814,318、6,075,181、6,114,598、6,150,584、6,998,514、7,795,494、7,910,798、8,232,449、8,502,018、8,697,940、8,703,485、8,754,287、8,791,323、8,907,157、9,035,128、9,145,588和9,206,263(各自通过引用整体并入本文),以及美国专利公布号2008/0098490、2010/0146647、2011/0195454、2012/0167237、2013/0145484、2013/0167256、2013/0219535、2013/0326647、2013/0096287、2014/013275、2014/093908和2015/0113668(其全部内容通过引用并入本文),以及pct公布号wo2007117410、wo2008151081、wo2009157771、wo2010039900、wo2011004192、wo2011123708和wo2014093908(其各自通过引用整体并入本文)。
在一些实施方案中,人未重排的免疫球蛋白可变区基因区段是重链基因区段,免疫球蛋白恒定区基因是重链恒定区基因。在一些实施方案中,人未重排的免疫球蛋白可变区基因区段是轻链例如κ链基因区段,并且免疫球蛋白恒定区基因是重链恒定区基因。
在一些实施方案中,人未重排的免疫球蛋白可变区基因区段是重链基因区段,免疫球蛋白恒定区基因是κ链恒定区基因。在一些实施方案中,人未重排的免疫球蛋白可变区基因区段是κ链基因区段,免疫球蛋白恒定区基因是κ链恒定区基因。在一些实施方案中,人未重排的免疫球蛋白可变区基因区段是λ链基因区段,免疫球蛋白恒定区基因是κ链恒定区基因。在一些实施方案中,人未重排的免疫球蛋白可变区基因区段是λ链基因区段,免疫球蛋白恒定区基因是λ链恒定区基因。
在某些实施方案中,免疫球蛋白可变区含有未重排的人ig重链可变区基因区段。在一些实施方案中,未经重排的人ig可变区基因区段包括多个人vh区段、一个或多个人dh区段和一个或多个人jh区段。在一些实施方案中,未经重排的人ig可变区基因区段包含至少3个vh基因区段、至少18个vh基因区段、至少20个vh基因区段、至少30个vh基因区段、至少40个vh基因区段、至少50个vh基因区段、至少60个vh基因区段、至少70个vh基因区段、或至少80个vh基因区段。在一些实施方案中,未重排的人ig基因区段包括所有的人dh基因区段。在一些实施方案中,未重排的人ig基因区段包括所有的人jh基因区段。包含ig重链基因区段的示例性可变区提供在例如macdonald等人,proc.natl.acad.sci.usa111:5147-52和补充信息中,在此通过引用将其并入。在一些实施方案中,本文提供的非人动物具有受限的免疫球蛋白重链基因座,其特征在于单个多态性人vh基因区段,多个dh基因区段和多个jh基因区段(例如,描述于美国专利公布2013/0096287中,在此通过引用将其并入)。在一些实施方案中vh基因区段是vh1-2或vh1-69。
在各种实施方案中,本文所述的免疫球蛋白基因座修饰不影响非人动物的生育力。在一些实施方案中,重链基因座包含内源性adam6a基因、adam6b基因或两者,并且遗传修饰不影响内源性adam6a基因、adam6b基因或两者的表达和/或功能。在一些实施方案中,遗传修饰的非人动物的基因组包含异位定位的adam6a基因、adam6b基因或两者。表达外源adam6a和/或adam6b的示例性非人动物描述于美国专利号8,642,835和8,697,940中,其每一个都通过引用整体并入本文。
在一些实施方案中,人免疫球蛋白重链可变区基因区段在b细胞发育期间重排以在非人生物的b细胞中产生重排的人重链可变区基因。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-d和/或d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-d和/d-j免疫球蛋白重链连接的百分比大于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-d免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-d和/d-j免疫球蛋白重链连接的百分比小于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-d和/d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-d和/d-j免疫球蛋白重链连接的百分比大于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-d和/d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-d和/d-j免疫球蛋白重链连接的百分比大于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-d和/d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-d和/d-j免疫球蛋白重链连接的百分比大于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-d和/d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-d和/d-j免疫球蛋白重链连接的百分比大于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-d和/或d-j免疫球蛋白重链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特免疫球蛋白重链cdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。
在某些实施方案中,免疫球蛋白可变区含有未重排的人igκ可变区基因区段。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含多个人vκ区段和一个或多个人jκ区段。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含所有的人jκ区段。在一些实施方案中,免疫球蛋白可变区基因区段包含四个功能性vκ区段和所有的人jκ区段。在一些实施方案中,免疫球蛋白可变区基因区段包含16个功能性vκ区段和所有的人jκ区段(例如所有功能性人vκ区段和jκ区段)。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含所有的人vκ区段和所有的人jκ区段。包含igκ基因区段的示例性可变区提供于例如macdonald等人,proc.natl.acad.sci.usa111:5147-52和补充信息中,在此通过引用将其并入。在一些实施方案中,本文提供的非人动物具有受限的免疫球蛋白轻链基因座,其特征在于不超过两个人vl基因区段和多个jl基因区段(例如,双轻链小鼠,或dlc,如描述于美国专利公布号2013/0198880中,在此通过引用将其并入本文)。在一些实施方案中,vl基因区段是vκ基因区段。在一些实施方案中,vl基因区段是vλ基因区段。在一些实施例中在vκ基因区段是igkv3-20和igkv1-39。
在一些实施方案中,人免疫球蛋白κ可变区基因区段在b细胞发育期间重排以在非人生物的b细胞中产生重排的人κ可变区基因。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-j免疫球蛋白κ链连接的百分比小于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-j免疫球蛋白κ链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特免疫球蛋白κ链cdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。在一些实施方案中,本文提供的非人动物每10,000个免疫球蛋白κ链cdr3序列具有至少900、1000、1100、1200、1300、1400、1500或1700个独特免疫球蛋白κ链cdr3序列。
在某些实施方案中,免疫球蛋白可变区含有未重排的人igλ可变区基因区段。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含多个人vλ区段和一个或多个人jλ区段。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含所有的人vλ区段。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含所有的人jλ区段。包含igλ基因区段的示例性可变区提供在例如美国专利公布号2012/0073004和2002/0088016中,其中的每一篇均通过引用并入本文。
在一些实施方案中,人免疫球蛋白λ可变区基因区段在b细胞发育期间重排以在非人生物的b细胞中产生重排的人λ可变区基因。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-j免疫球蛋白λ链连接的百分比小于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-j免疫球蛋白λ链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特免疫球蛋白λ链cdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。在一些实施方案中,本文提供的非人动物具有每10,000个免疫球蛋白λ链cdr3序列至少150、160、170、180、190、200、210、220、230、240、250、260、270、280、290或300个独特免疫球蛋白λ链cdr3序列。
在一些实施方案中,包含未经重排的人免疫球蛋白可变区基因区段的免疫球蛋白可变区还包括人免疫球蛋白可变区基因间序列。在一些实施方案中,免疫球蛋白可变区包括非人(例如啮齿动物、大鼠、小鼠)ig可变区基因间序列。在一些实施方案中,基因间序列是内源物种起源的。
在一些实施方案中,非人生物在其种系和/或基因组中包括包含重排的重链可变区(通用重链可变区)的免疫球蛋白基因座。在一些实施方案中,重排的ig重链可变区基因是人重排的ig重链可变区基因。示例性重排的ig重链可变区提供在美国专利公布号2014/0245468中,其通过引用并入本文。在一些实施方案中,包含通用重链可变区的非人生物用于产生双特异性抗体。
在一些实施方案中,非人生物在其种系和/或基因组中包括包含重排的轻可变区(通用轻链可变区)的免疫球蛋白基因座。在一些实施方案中,重排的ig轻链可变区基因是人重排的ig轻链可变区基因。示例性重排的ig轻链可变区提供于例如美国专利公布号2011/0195454、2012/0021409、2012/0192300、2013/0045492、2013/0185821、2013/0302836、2015/0313193、2015/0059009、和2013/0198879中,其通过引用并入本文。在一些实施方案中,包含通用轻链可变区的非人生物(“通用轻链”生物)用于产生双特异性抗体。
在一些实施方案中,非人生物在其种系和/或基因组中包括轻链免疫球蛋白基因座,其包含有限的轻链可变基因区段库(例如包含两个轻链可变基因区段的双轻链可变区)。在一些实施方案中,有限的轻链基因区段库中的轻链可变基因区段是人轻链基因区段。示例性双轻链可变区提供在美国专利公布2013/0198880中,其通过引用并入本文。在一些实施方案中,包含双轻链可变区的非人生物用于产生双特异性抗体。
在其他实施方案中,非人生物可以在其种系和/或基因组中包含轻链和/或重链免疫球蛋白基因座,其包括组氨酸密码子的插入和/或替换,其设计用于引入ph依赖性结合特性至在这种非人生物中产生的抗体。在一些这样的实施方案中,组氨酸密码子在编码cdr3的核酸序列中插入和/或替换。各种这样的轻和/或重免疫球蛋白基因座提供在美国专利9,301,510、9,334,334,美国专利申请公开号2013/0247236、20140013456中,通过引用将其并入本文。
在一些实施方案中,免疫球蛋白恒定区包含重链恒定区基因。在一些实施方案中,重链恒定区基因是人重链恒定区基因。在一些实施方案中,重链恒定区基因来源于内源物种。在一些实施方案中,重链恒定区基因是小鼠恒定区基因或大鼠恒定区基因。在一些实施方案中,恒定区基因是人和非人序列的混合物。例如,在一些实施方案中,恒定区基因编码人ch1区和非人(例如内源物种源、小鼠、大鼠)ch2和/或ch3区。在一些实施方案中,重链恒定区基因是cμ、cδ、cγ(cγ1、cγ2、cγ3、cγ4)、cα或cε恒定区基因。在一些实施方案中,恒定区基因是内源恒定区基因。在一些实施方案中,恒定区基因编码突变的ch1区,使得非人动物仅表达重链抗体(参见例如美国专利8,754,287、美国专利申请公开号2015/0289489,通过引用并入本文)。在一些实施方案中,例如,其中目标是产生重链以制备双特异性抗体(例如在通用或双轻链生物体中),重链的fc结构域包含促进重链异二聚体形成和/或抑制重链同源二聚体形成的修饰。这样的修改例如提供在美国专利号5,731,168、5,807,706、5,821,333、7,642,228和8,679,785以及美国专利公布2013/0195849中,其各自通过引用并入本文。
在一些实施方案中,免疫球蛋白恒定区包含轻链恒定区基因。在一些实施方案中,轻链恒定区基因是κ恒定区基因。在一些实施方案中,轻链恒定区基因是λ恒定区基因。在一些实施方案中,轻链恒定区基因是内源物种起源。在一些实施方案中,轻链恒定区基因是小鼠恒定区基因或大鼠恒定区基因。在一些实施方案中,轻链恒定区基因是人和非人序列的混合物。
在一些实施方案中,包含人可变区基因区段和可变区基因区段可操作地连接的免疫球蛋白恒定区基因的免疫球蛋白可变区位于内源免疫球蛋白基因座。在一些实施方案中,内源免疫球蛋白基因座是内源性重链基因座。在一些实施方案中,内源免疫球蛋白基因座是内源κ基因座。在一些实施方案中,内源免疫球蛋白基因座是内源λ基因座。在一些实施方案中,人可变区基因区段可操作地连接的恒定区基因是内源恒定区基因。
在一些实施方案中,使本文提供的非人动物的基因组中的一个或多个内源免疫球蛋白基因座或一个或多个内源基因座的一部分(例如,可变区和/或恒定区)灭活。内源性免疫球蛋白可变区基因座及其部分可以使用本领域已知的任何方法灭活,包括但不限于从生物体基因组中删除基因座或其部分、以不同的核酸序列替换基因座或其部分、倒位基因座的一部分和/或替换基因座的一部分至非人生物的基因组中的另一个位置换。在一些实施方案中,基因座的灭活仅是部分灭活。在一些实施方案中,基因座的可变区是灭活的,但恒定区保持功能(例如,因为它与非内源可变区基因区段可操作地连接)。
在一些实施方案中,遗传修饰的非人动物包括灭活的内源免疫球蛋白重链基因座。在一些实施方案中,内源免疫球蛋白重链基因座或其部分通过内源重链基因座的至少部分内源可变区的缺失、替换、置换和/或倒位而灭活。在一些实施方案中,缺失、替换、置换和/或倒位的内源重链基因座的可变区的至少一部分包含可变区的j区段。在一些实施方案中,内源免疫球蛋白重链基因座或其部分通过内源重链基因座的至少部分内源恒定区的缺失、替换、置换和/或倒位而灭活。在一些实施方案中,缺失、替换、置换和/或倒位的内源重链基因座的恒定区的至少一部分包含内源恒定区的cμ基因。
在一些实施方案中,遗传修饰的非人动物包括灭活的内源免疫球蛋白κ链基因座。在一些实施方案中,内源免疫球蛋白κ链基因座或其部分通过内源κ链基因座的至少部分内源可变区的缺失、替换、置换和/或倒位而灭活。在一些实施方案中,缺失、替换、置换和/或倒位的内源κ链基因座的可变区的至少一部分包含可变区的j区段。在一些实施方案中,内源免疫球蛋白κ链基因座或其部分通过内源κ链基因座的至少部分内源恒定区的缺失、替换、置换和/或倒位而灭活。在一些实施方案中,缺失、替换、置换和/或倒位的内源κ链基因座的恒定区的至少一部分包含内源恒定区的cκ基因。
在一些实施方案中,遗传修饰的非人动物包括灭活的内源免疫球蛋白λ链基因座。在一些实施方案中,内源免疫球蛋白λ链基因座或其部分通过内源λ链基因座的至少部分内源可变区的缺失、替换、置换和/或倒位而灭活。在一些实施方案中,内源λ链基因座中的至少一个v-j-c基因簇的至少一部分被缺失、替换、置换和/或倒位。在一些实施方案中,内源免疫球蛋白λ链基因座或其部分通过内源λ链基因座的至少部分内源恒定区的缺失、替换、置换和/或倒位而灭活。在一些实施方案中,缺失、替换、置换和/或倒位的内源λ链基因座的恒定区的至少一部分包含内源恒定区的cλ基因。
在一些实施方案中,本文提供的遗传修饰的非人动物表达具有人可变结构域的抗体(例如,衍生自本文所述的未重排的人可变区基因区段的人可变结构域)。在一些实施方案中,人可变结构域是人重链可变结构域。在一些实施方案中,抗体是仅有重链的抗体。在一些实施方案中,人可变结构域是人轻链可变结构域。在一些实施方案中,由非人动物产生的抗体具有人重链可变结构域和人轻链可变结构域。在一些实施方案中,抗体具有人重链恒定结构域。在一些实施方案中,抗体具有人轻链恒定结构域。在一些实施方案中,重链和/或轻链恒定结构域是非人源的。例如,在一些实施方案中,重链恒定结构域是内源物种来源。在一些实施方案中,重链恒定结构域是小鼠或大鼠来源的。在一些实施方案中,轻链恒定结构域是内源物种来源。在一些实施方案中,轻链恒定结构域是大鼠或小鼠来源的。
表达人可变结构域t细胞受体和外源性tdt的非人动物
在某些实施方案中,包含如本文所述的外源性tdt的遗传修饰的非人动物和非人动物es细胞还在其种系和/或基因组中包含tcr基因座(外源或内源),其含有包含未经重排的人tcr可变区基因区段的tcr可变区和包含tcr恒定区基因的tcr恒定区,其中未重排的人tcr可变区基因区段与tcr恒定区基因可操作地连接。在一些实施方案中,各种遗传修饰的非人动物,例如遗传修饰的小鼠,在其种系和/或基因组中包含遗传修饰的t细胞受体基因座(遗传修饰的tcrα、β、γ和/或δ基因座),使得小鼠表达人、人源化、部分人、反向嵌合(人可变和非人恒定区)t细胞受体。在一个实施方案中,示例性的非人动物提供在美国专利9,113,616和国际公开号wo2016/164492中,通过引用并入本文。
在一些实施方案中,tcr恒定区基因是非人tcr恒定区基因。在一些实施方案中,tcr恒定区基因是啮齿动物恒定区基因,例如大鼠恒定区基因或小鼠恒定区基因。在一些实施方案中,恒定区基因是内源物种来源。在一些实施方案中,tcr恒定区基因是人恒定区基因。
在一些实施方案中,非人动物和非人es细胞在其种系和/或基因组中包含多个这样的tcr基因座。例如,在一些实施方案中,遗传修饰的非人动物和非人动物es细胞在其种系和/或基因组中包括包含未重排的tcrα可变区基因区段的至少一个tcr基因座和包含未重排的tcrβ可变区基因片段的至少一个tcr基因座。在一些实施方案中,遗传修饰的非人动物和非人动物es细胞在其种系和/或基因组中包括包含未重排的人tcrγ可变区基因区段的至少一个tcr基因座和包含未重排的人tcrδ可变区基因片段的至少一个tcr基因座。
在一些实施方案中,人未重排的tcr可变区基因区段是tcrα基因区段,tcr恒定区基因是tcrα恒定区基因。在一些实施方案中,人未重排的tcr可变区基因区段是tcrβ链基因区段,tcr恒定区基因是tcrβ恒定区基因。在一些实施方案中,人未重排的tcr可变区基因区段是tcrγ链基因区段,tcr恒定区基因是tcrγ恒定区基因。在一些实施方案中,人未重排的tcr可变区基因区段是tcrδ链基因区段,tcr恒定区基因是tcrδ恒定区基因。包含人tcr基因区段的示例性可变区例如提供在美国专利9,113,616和li等人,naturemedicine16:1029-1035(2010)中,其各自通过引用并入本文。
在一些实施方案中,tcr可变区含有未重排的人tcrβ可变区基因区段。在一些实施方案中,人tcrβ可变区基因区段在t细胞发育期间重排,以在非人生物的t细胞中产生重排的人tcrβ可变区基因。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-d和/或d-jtcrβ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-d和/d-jtcrβ连接的百分比大于相应的非人动物中v-d和/d-jtcrβ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-dtcrβ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-d和/d-jtcrβ连接的百分比小于相应的非人动物中v-d和/d-jtcrβ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-d和/d-jtcrβ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-d和/d-jtcrβ连接的百分比大于相应的非人动物中v-d和/d-jtcrβ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-d和/d-jtcrβ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-d和/d-jtcrβ连接的百分比大于相应的非人动物中v-d和/d-jtcrβ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-d和/d-jtcrβ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-d和/d-jtcrβ连接的百分比大于相应的非人动物中v-d和/d-jtcrβ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-d和/d-jtcrβ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-d和/d-jtcrβ连接的百分比大于相应的非人动物中v-d和/d-jtcrβ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-d和/或d-jtcrβ连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特tcrβcdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。
在一些实施方案中,tcr可变区含有未重排的人tcrα可变区基因区段。在一些实施方案中,人tcrα可变区基因区段在t细胞发育期间重排以在非人生物的t细胞中产生重排的人tcrα可变区基因。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-jtcrα连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-jtcrα连接的百分比大于相应的非人动物中v-jtcrα连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-dtcrα连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-jtcrα连接的百分比小于相应的非人动物中v-jtcrα连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-jtcrα连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-jtcrα连接的百分比大于相应的非人动物中v-jtcrα连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-jtcrα连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-jtcrα连接的百分比大于相应的非人动物中v-jtcrα连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-jtcrα连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-jtcrα连接的百分比大于相应的非人动物中v-jtcrα连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-jtcrα连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-jtcrα连接的百分比大于相应的非人动物中v-jtcrα连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-jtcrα连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特tcrαcdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。
在一些实施方案中,tcr可变区含有未经重排的人tcrδ可变区基因区段。在一些实施方案中,人tcrδ可变区基因区段在t细胞发育期间重排,以在非人生物的t细胞中产生重排的人tcrδ可变区基因。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-d和/或d-jtcrδ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-d和/d-jtcrδ连接的百分比大于相应的非人动物中v-d和/d-jtcrδ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-dtcrδ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-d和/d-jtcrδ连接的百分比小于相应的非人动物中v-d和/d-jtcrδ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-d和/d-jtcrδ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少一个1n-添加物的v-d和/d-jtcrδ连接的百分比大于相应的非人动物中v-d和/d-jtcrδ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-d和/d-jtcrδ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-d和/d-jtcrδ连接的百分比大于相应的非人动物中v-d和/d-jtcrδ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-d和/d-jtcrδ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-d和/d-jtcrδ连接的百分比大于相应的非人动物中v-d和/d-jtcrδ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-d和/d-jtcrδ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-d和/d-jtcrδ连接的百分比大于相应的非人动物中v-d和/d-jtcrδ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-d和/或d-jtcrδ连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特tcrδcdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。
在一些实施方案中,tcr可变区含有未经重排的人tcrγ可变区基因区段。在一些实施方案中,人tcrγ可变区基因区段在t细胞发育期间重排,以在非人生物的t细胞中产生重排的人tcrγ可变区基因。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-jtcrγ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-jtcrγ连接的百分比大于相应的非人动物中v-jtcrγ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-dtcrγ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-jtcrγ连接的百分比小于相应的非人动物中v-jtcrγ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-jtcrγ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-jtcrγ连接的百分比大于相应的非人动物中v-jtcrγ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-jtcrγ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-jtcrγ连接的百分比大于相应的非人动物中v-jtcrγ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-jtcrγ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-jtcrγ连接的百分比大于相应的非人动物中v-jtcrγ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-jtcrγ连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-jtcrγ连接的百分比大于相应的非人动物中v-jtcrγ连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-jtcrγ连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特tcrγcdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。
在一些实施方案中,包含未重排的人tcr可变区基因区段的tcr可变区还包括人tcr可变区基因间序列。在一些实施方案中,tcr可变区包括非人(例如,啮齿动物、大鼠、小鼠)tcr可变区基因间序列。在一些实施方案中,基因间序列是内源物种来源。
在一些实施方案中,包含人可变区基因区段的tcr可变区和可变区基因区段可操作地连接的tcr恒定区基因位于内源性tcr基因座。在一些实施方案中,内源性tcr基因座是内源性tcrα基因座。在一些实施方案中,内源性tcr基因座是内源性tcrβ基因座。在一些实施方案中,内源性tcr基因座是内源性tcrγ基因座。在一些实施方案中,内源性tcr基因座是内源性tcrδ基因座。在一些实施方案中,人可变区基因区段可操作地连接的恒定区基因是内源恒定区基因,例如相应的内源恒定区。
在一些实施方案中,使本文提供的非人动物的基因组中的一个或多个内源tcr基因座或一个或多个内源基因座的一部分(例如,可变区和/或恒定区)灭活。内源性tcr可变区基因座及其部分可以使用本领域已知的任何方法灭活,包括但不限于从生物体基因组中删除基因座或其部分、以不同的核酸序列替换基因座或其部分、倒位基因座的一部分和/或替换基因座的一部分至非人生物的基因组中的另一个位置换。在一些实施方案中,基因座的灭活仅是部分灭活。在一些实施方案中,基因座的可变区是灭活的,但恒定区保持功能(例如,因为它与非内源可变区基因区段可操作地连接)。灭活的tcr基因座的实例描述于例如mombaerts等人,proc.natl.acad.sci.usa88:3084-3087(1991)和mombaerts等人,nature390:225-231(1992)中,其中的每一篇均通过引用并入本文。
在一些实施方案中,本文提供的遗传修饰的非人动物表达具有人可变结构域的tcr(例如,衍生自本文所述的未重排的人可变区基因区段的人可变结构域)。在一些实施方案中,人可变结构域是人tcrα可变结构域。在一些实施方案中,人可变结构域是人tcrβ可变结构域。在一些实施方案中,人可变结构域是人tcrγ可变结构域。在一些实施方案中,人可变结构域是人tcrδ可变结构域。在一些实施方案中,由非人动物产生的tcr具有人tcrα可变结构域和人tcrβ可变结构域。在一些实施方案中,由非人动物产生的tcr具有人tcrγ可变结构域和人tcrδ可变结构域。在一些实施方案中,由非人动物产生的tcr具有人tcrα可变结构域和人tcrβ可变结构域,以及人tcrγ可变结构域和人tcrδ可变结构域。在一些实施方案中,tcr具有人恒定结构域。在一些实施方案中,恒定结构域是非人源的。例如,在一些实施方案中,恒定结构域结构是内源物种来源。在一些实施方案中,恒定结构域是小鼠或大鼠来源的。
表达嵌合抗原受体(car)和外源性tdt的非人动物
在某些方面,本文提供了遗传修饰的非人动物和非人动物es细胞,其包含如本文所述的外源性tdt,其还包含嵌合抗原受体(car)基因座。这种car基因座通常包含可变区和恒定区。可变区包括未重排的人ig可变区基因区段,而恒定区基因座包括tcr恒定区基因,其中ig可变区基因区段与恒定区基因可操作地连接。在一些实施方案中,tcr恒定区基因是非人tcr恒定区基因。在一些实施方案中,tcr恒定区基因是啮齿动物恒定区基因,例如大鼠恒定区基因或小鼠恒定区基因。在一些实施方案中,恒定区基因是内源物种来源。在一些实施方案中,tcr恒定区基因是人恒定区基因。
在一些实施方案中,本文描述的car基因座位于内源tcr基因座。例如,在一些实施方案中,包含tcrα恒定区基因的car基因座位于内源tcrα恒定区基因座。在一些实施方案中,通过用未重排的ig可变区替换部分或全部tcrα未重排的可变区来产生这样的基因座。在一些实施方案中,包含tcrβ恒定区基因的car基因座位于内源tcrβ恒定区基因座。在一些实施方案中,通过用未重排的ig可变区替换部分或全部tcrβ未重排的可变区来产生这样的基因座。
在某些实施方案中,car可变区基因座将含有未重排的人ig可变区基因区段。本领域已经描述了包含人可变区基因区段的示例性可变区基因座。例如,这样的基因座描述于美国专利号5,633,425、5,770,429、5,814,318、6,075,181、6,114,598、6,150,584、6,998,514、7,795,494、7,910,798、8,232,449、8,502,018、8,697,940、8,703,485、8,754,287、8,791,323、8,907,157、9,035,128、9,145,588和9,206,263(各自通过引用整体并入本文),以及美国专利公布号2008/0098490、2010/0146647、2011/0195454、2012/0167237、2013/0145484、2013/0167256、2013/0219535、2013/0326647、2014/013275、2014/093908、2015/0113668和2016/0081314(其全部内容通过引用并入本文),以及pct公布号wo2007117410、wo2008151081、wo2009157771、wo2010039900、wo2011004192、wo2011123708、wo2014093908和wo2016/044745(其各自通过引用整体并入本文)。
在某些实施方案中,car可变区基因座含有未重排的人ig重链可变区基因区段。在一些实施方案中,未经重排的人ig可变区基因区段包括多个人vh区段、一个或多个人dh区段和一个或多个人jh区段。在一些实施方案中,未经重排的人ig可变区基因区段包含至少3个vh基因区段、至少18个vh基因区段、至少20个vh基因区段、至少30个vh基因区段、至少40个vh基因区段、至少50个vh基因区段、至少60个vh基因区段、至少70个vh基因区段、或至少80个vh基因区段。在一些实施方案中,未重排的人ig基因区段包括所有的人dh基因区段。在一些实施方案中,car可变区还包含tcrβ可变区基因区段(例如v、d和/或j基因区段)。在一个实施方案中,car可变区还包含远端tcrvβ基因区段,例如tcrvβ31基因区段。在另一个实施方案中,远端tcrvβ基因区段,例如tcrvβ31基因区段,已在功能上灭活或缺失。在一些实施方案中,未重排的人ig基因区段包括所有的人jh基因区段。包含ig重链基因区段的示例性可变区提供在例如macdonald等人,proc.natl.acad.sci.usa111:5147-52和补充信息中,在此通过引用将其并入。
在一些实施方案中,人免疫球蛋白重链可变区基因区段在t细胞发育期间重排以在非人生物的t细胞中产生重排的人重链可变区基因。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-d和/或d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-d和/d-j免疫球蛋白重链连接的百分比大于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-d免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-d和/d-j免疫球蛋白重链连接的百分比小于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-d和/d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-d和/d-j免疫球蛋白重链连接的百分比大于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-d和/d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-d和/d-j免疫球蛋白重链连接的百分比大于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-d和/d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-d和/d-j免疫球蛋白重链连接的百分比大于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-d和/d-j免疫球蛋白重链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-d和/d-j免疫球蛋白重链连接的百分比大于相应的非人动物中v-d和/d-j免疫球蛋白重链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-d和/或d-j免疫球蛋白重链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特免疫球蛋白重链cdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。
在一些实施方案中,包含未重排的人ig重链可变区基因区段的car可变基因基因座还包括人ig重链可变区基因间序列。在一些实施方案中,car可变基因基因座包括非人(例如啮齿动物、大鼠、小鼠)ig重链可变区基因间序列。在一些实施方案中,car可变基因基因座包括人或非人(例如啮齿动物、大鼠、小鼠)tcrβ可变区基因间序列。例如,在一些实施方案中,car基因座的未重排的可变区包含一个或多个(例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20)胰蛋白酶原(try)基因(例如,通常存在于tcrβ可变区基因座中的try基因和/或假基因)。在一些实施方案中,try基因是非人的,例如小鼠try基因。在一些实施方案中,小鼠try基因选自try1、try2、try3、try4、try5、try6、try7、try8、try9、try10、try11、try12、try13、try14、try15、try16、try17、try18、try19和try20。在一些实施方案中,一个或多个try基因位于未重排可变区的vh区段的上游。在一些实施方案中,一个或多个try基因位于vh区段的下游和未重排的可变区的dh区段的上游。在一些实施方案中,try1-7位于未经重排的可变区中的vh区段的上游,try8-20位于未经重排的可变区的vh区段的下游和dh区段的上游。关于位于人和/或小鼠tcrβ基因座中的try基因的其他信息提供在glusman等人,immunity15:337-349(2001)和skok等人,natureimmunology8:378-387(2007)中,每个都通过引用并入。在一些实施方案中,car基因座包含非人调节元件(例如非人启动子和/或增强子)。在一些实施方案中,非人调节元件是啮齿动物调节元件(例如大鼠或小鼠启动子或增强子)。在一些实施方案中,car基因座包含igm增强子(eμ)。在一些实施方案中,igm增强子是非人eμ(例如,啮齿动物eμ,例如小鼠或大鼠eμ)。
在某些实施方案中,car可变区基因座含有未重排的人igκ可变区基因区段。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含多个人vκ区段和一个或多个人jκ区段。在一些实施方案中,免疫球蛋白可变区基因区段包含四个功能性vκ区段和所有的人jκ区段。在一些实施方案中,免疫球蛋白可变区基因区段包含16个功能性vκ区段和所有的人jκ区段。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含所有人vκ区段和所有人jκ区段(例如,所有功能性人vκ区段和jκ区段)。包含igκ基因区段的示例性可变区提供于例如macdonald等人,proc.natl.acad.sci.usa111:5147-52和补充信息中,在此通过引用将其并入。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含所有的人jκ区段。在一些实施方案中,car可变区还包含tcrα可变区基因区段(例如v和/或j基因区段)。
在一些实施方案中,人免疫球蛋白κ可变区基因区段在t细胞发育期间重排以在非人生物的t细胞中产生重排的人κ可变区基因。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-j免疫球蛋白κ链连接的百分比小于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-j免疫球蛋白κ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-j免疫球蛋白κ链连接的百分比大于相应的非人动物中v-j免疫球蛋白κ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-j免疫球蛋白κ链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特免疫球蛋白κ链cdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。在一些实施方案中,本文提供的非人动物每10,000个免疫球蛋白κ链cdr3序列具有至少900、1000、1100、1200、1300、1400、1500或1700个独特免疫球蛋白κ链cdr3序列。
在某些实施方案中,car可变区基因座含有未经重排的人igλ可变区基因区段。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含多个人vλ区段和一个或多个人jλ区段。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含所有人vλ区段(例如所有功能性人vλ区段)。在一些实施方案中,未重排的人免疫球蛋白可变区基因区段包含所有的人jλ区段。在一些实施方案中,car可变区还包含tcrα可变区基因区段(例如v和/或j基因区段)。包含igλ基因区段的示例性可变区提供在例如美国专利公布号2012/0073004和2002/0088016中,其中的每一篇均通过引用并入本文。
在一些实施方案中,人免疫球蛋白λ可变区基因区段在t细胞发育期间重排,以在非人生物的t细胞中产生重排的人λ可变区基因。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有非模板添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有非模板添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更低百分比的不含非模板添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中不含非模板添加物的v-j免疫球蛋白λ链连接的百分比小于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少1个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少1个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少2个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少2个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少3个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少3个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,本文提供的非人动物具有比在其基因组中不具有编码外源tdt的核酸的相应非人动物更高百分比的含有至少4个n-添加物的v-j免疫球蛋白λ链连接。在一些实施方案中,本文提供的遗传修饰的非人动物中含有至少4个n-添加物的v-j免疫球蛋白λ链连接的百分比大于相应的非人动物中v-j免疫球蛋白λ链连接的百分比至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、30%或40%。在一些实施方案中,动物中v-j免疫球蛋白λ链连接的至少10%、15%、20%、25%、30%、35%或40%包含非模板添加物。在一些实施方案中,所述非人动物比相应的非人动物具有更高频率的独特免疫球蛋白λ链cdr3序列,高至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、40%、45%、50%、60%、70%、80%、90%或100%。在一些实施方案中,本文提供的非人动物具有每10,000个免疫球蛋白λ链cdr3序列至少150、160、170、180、190、200、210、220、230、240、250、260、270、280、290或300个独特免疫球蛋白λ链cdr3序列。
在一些实施方案中,含有未重排的人ig轻链可变区基因区段的car可变基因基因座还包括人ig轻链可变区基因间序列(例如κ可变区基因间序列和/或λ可变区基因间序列)。在一些实施方案中,car可变基因基因座包括非人(例如啮齿动物、大鼠、小鼠)ig轻链可变区基因间序列(例如κ可变区基因间序列和/或λ可变区基因间序列)。在一些实施方案中,car可变基因基因座包括人或非人(例如啮齿动物、大鼠、小鼠)tcrα可变区基因间序列。在一些实施方案中,car基因座包含非人调节元件(例如非人启动子和/或增强子)。在一些实施方案中,非人调节元件是啮齿动物调节元件(例如大鼠或小鼠启动子或增强子)。
在一些实施方案中,car可变区基因座是重排的可变区基因座,其包含ig重链可变区基因(通用重链可变区)。在一些实施方案中,重排的ig重链可变区基因是人重排的ig重链可变区基因。通用重链可变区的使用促进双特异性抗体的产生,其中至少一个抗原结合结构域对肽/mhc复合物具有特异性。示例性重排的ig重链可变区提供在美国专利公布号2014/0245468中,其通过引用并入本文。
在一些实施方案中,car可变区基因座是重排的可变区基因座,其包含ig轻链可变区基因(通用轻链可变区)。在一些实施方案中,重排的ig轻链可变区基因是人重排的ig轻链可变区基因。通用轻链可变区的使用促进双特异性抗体的产生,其中至少一个抗原结合结构域对肽/mhc复合物具有结合特异性。示例性重排的ig重链可变区提供在美国专利公布2013/0185821中,其通过引用并入本文。
其他遗传修饰
在一些实施方案中,本文所述的表达外源tdt、人源化tcr或car的遗传修饰的非人动物和es细胞也在其基因组中表达和/或包含编码人源化mhci类α链多肽(例如人源化hla-a、hla-b、hla-c、hla-e、hla-f、hla-g、hla-k和/或hla-l)的基因座。在一些实施方案中,人源化mhci类α链多肽是完全人的。在一些实施方案中,人源化mhci类α链多肽包含人细胞外结构域(例如人α1、α2和α3结构域)和内源物种来源的细胞质结构域。人源化mhci类α链多肽、编码人源化mhci类α链多肽的基因座和表达人源化mhci类α链多肽的非人动物描述于美国专利公布号2013/0111617、2013/0185819和2014/0245467,其各自通过引用并入本文。
在一些实施方案中,本文所述的表达外源tdt、人源化tcr或car的遗传修饰的非人动物和es细胞还在其基因组中表达和/或包含编码人源化β-2-微球蛋白多肽的基因座。人源化β-2-微球蛋白多肽、编码人源化β-2-微球蛋白多肽的基因座和表达人源化β-2-微球蛋白多肽的非人动物描述于美国专利公布号2013/0111617和2013/0185819中,其各自通过引用并入本文。
在一些实施方案中,本文所述的表达外源tdt、人源化tcr或car的遗传修饰的非人动物和es细胞还在其基因组中表达和/或包含编码人源化mhcii类α链多肽(例如人源化hla-dma、hla-doa、hla-dpa、hla-dqa和/或hla-dra)的基因座。在一些实施方案中,人源化mhcii类α链多肽是完全人的。在一些实施方案中,人源化mhcii类α链多肽包含人细胞外结构域和内源物种来源的细胞质结构域。人源化mhcii类α链多肽、编码人源化mhcii类α链多肽的基因座和表达人源化mhcii类α链多肽的非人动物描述于美国专利8,847,005和9,043,996以及美国专利公布2014/0245467中,其各自通过引用并入本文。
在一些实施方案中,本文所述的表达外源tdt、人源化tcr或car的遗传修饰的非人动物和es细胞还在其基因组中表达和/或包含编码人源化mhcii类β链多肽(例如人源化hla-dmb、hla-dob、hla-dpb、hla-dqb和/或hla-drb)的基因座。在一些实施方案中,人源化mhcii类β链多肽是完全人的。在一些实施方案中,人源化mhcii类β链多肽包含人细胞外结构域和内源物种来源的细胞质结构域。人源化mhcii类β链多肽、编码人源化mhcii类β链多肽的基因座和表达人源化mhcii类β链多肽的非人动物描述于美国专利8,847,005和9,043,996以及美国专利公布2014/0245467中,其各自通过引用并入本文。
包含外源tdt、人源化tcr基因座和人源化mhci和/或mhcii(mhciiα/iiβ)基因座的遗传修饰的非人动物可以通过使用常规方法养殖来产生;或者,它们可以通过已经包含一个或多个遗传修饰的基因座(例如人源化tcr基因座)的es细胞中的同源重组并从所述es细胞产生非人动物而产生。
包含外源tdt、人源化car基因座和人源化mhci和/或mhcii(mhciiα/iiβ)基因座的遗传修饰的非人动物可以通过使用常规方法养殖来产生;或者,它们可以通过已经包含一个或多个遗传修饰的基因座(例如人源化car基因座)的es细胞中的同源重组并从所述es细胞产生非人动物而产生。
在一些实施方案中,本文所述的表达外源tdt、人源化tcr或car的遗传修饰的非人动物和es细胞还在其基因组中表达和/或包含编码人源化cd8α链多肽的基因座。在一些实施方案中,人源化cd8α链多肽是完全人的。在一些实施方案中,人源化cd8α链多肽包含人细胞外免疫球蛋白结构域和内源物种来源的细胞质结构域。人源化cd8α链多肽、编码人源化cd8α链多肽的基因座和表达人源化cd8α链多肽的非人动物描述于美国专利公布号2014/0245466,其通过引用并入本文。
在一些实施方案中,本文所述的表达外源tdt、人源化tcr或car的遗传修饰的非人动物和es细胞还在其基因组中表达和/或包含编码人源化cd8β链多肽的基因座。在一些实施方案中,人源化cd8β链多肽是完全人的。在一些实施方案中,人源化cd8β链多肽包含人细胞外免疫球蛋白结构域和内源物种来源的细胞质结构域。人源化cd8β链多肽、编码人源化cd8β链多肽的基因座和表达人源化cd8β链多肽的非人动物描述于美国专利公布号2014/0245466,其通过引用并入本文。
在一些实施方案中,本文所述的表达外源tdt、人源化tcr或car的遗传修饰的非人动物和es细胞还在其基因组中表达和/或包含编码人源化cd4多肽的基因座。在一些实施方案中,人源化cd4多肽是完全人的。在一些实施方案中,人源化cd4多肽包含至少一个人细胞外免疫球蛋白结构域和内源物种来源的细胞质结构域。在一些实施方案中,人源化cd4多肽包含至少人d1免疫球蛋白结构域、人d2免疫球蛋白结构域和人d3免疫球蛋白结构域,以及内源物种来源的细胞质结构域。在一些实施方案中,人源化cd4多肽包含人d1免疫球蛋白结构域、人d2免疫球蛋白结构域、人d3免疫球蛋白结构域、内源物种起源的d4免疫球蛋白结构域和内源物种起源的细胞质结构域。人源化cd4多肽、编码人源化cd4多肽的基因座和表达人源化cd4多肽的非人动物描述于美国专利公布号2014/0245466,其通过引用并入本文。
包含外源tdt、人源化tcr基因座和人源化cd4和/或cd8(cd8α/cd8β)基因座的遗传修饰的非人动物可以通过使用常规方法养殖来产生;或者,它们可以通过已经包含一个或多个遗传修饰的基因座(例如人源化tcr基因座)的es细胞中的同源重组并从所述es细胞产生非人动物而产生。
包含外源tdt、人源化car基因座和人源化cd4和/或cd8(cd8α/cd8β)基因座的遗传修饰的非人动物可以通过使用常规方法养殖来产生;或者,它们可以通过已经包含一个或多个遗传修饰的基因座(例如人源化car基因座)的es细胞中的同源重组并从所述es细胞产生非人动物而产生。
使用遗传修饰的非人动物的方法
在某些方面,本文提供了使用本文所述的遗传修饰的非人动物产生抗原结合蛋白(例如抗体、car、tcr)、表达此类抗原结合蛋白的细胞(例如b细胞、t细胞、b细胞杂交瘤、t细胞杂交瘤)和编码这种抗原结合蛋白或其部分(例如可变结构域)的核酸的方法。在一些实施方案中,本文提供了制备更多样化的抗原结合蛋白(例如抗体、car、tcr)的方法。在一些实施方案中,本文提供了制备具有增加数量的核苷酸添加的抗原结合蛋白(例如抗体、car、tcr)的重排可变区的方法。
在某些实施方案中,该方法包括将本文所述的经修饰以表达外源性tdt和具有人可变结构域的抗体或其抗原结合片段的遗传修饰的非人动物暴露于抗原,使得经遗传修饰的非人动物产生抗体或其抗原结合片段,其包含对抗原特异的人可变结构域。
在一些实施方案中,该方法包括将本文所述的经修饰以表达外源性tdt和具有人可变结构域的抗体或其抗原结合片段的遗传修饰的非人动物暴露于抗原,并从非人动物获得表达抗体或其抗原结合片段的b细胞,其包含对抗原特异的人可变结构域。
在一些实施方案中,该方法包括将本文所述的经修饰以表达外源性tdt和具有人可变结构域的抗体或其抗原结合片段的遗传修饰的非人动物暴露于抗原;和从非人动物获得表达抗体或其抗原结合片段的b细胞,其包含对抗原特异的人可变结构域;并从b细胞制造杂交瘤。
在一些实施方案中,该方法包括将本文所述的经修饰以表达外源性tdt和具有人可变结构域的抗体或其抗原结合片段的遗传修饰的非人动物暴露于抗原;并从非人动物获得编码对抗原特异的人免疫球蛋白可变结构域的核酸。
在某些实施方案中,该方法包括将本文所述的经修饰以表达外源性tdt和具有人可变结构域的抗体或其抗原结合片段的遗传修饰的非人动物暴露于抗原;和从非人动物获得表达抗体或其抗原结合片段的b细胞,其包含对抗原特异的人可变结构域;以及任选地从b细胞制备杂交瘤;和从b细胞或杂交瘤获得编码对抗原特异的人免疫球蛋白可变结构域的核酸。
在一些实施方案中,该方法包括将本文所述的经修饰以表达外源性tdt和具有人可变结构域的抗体或其抗原结合片段的非人动物暴露于抗原;和从非人动物获得表达抗体或其抗原结合片段的b细胞,其包含对抗原特异的人可变结构域;以及任选地从b细胞制备杂交瘤;从b细胞或杂交瘤获得编码对抗原特异的人免疫球蛋白可变结构域的核酸;将编码免疫球蛋白可变结构域的核酸与编码人免疫球蛋白恒定结构域的核酸在宿主细胞中可操作地连接;在宿主细胞表达包含免疫球蛋白可变结构域和免疫球蛋白恒定结构域的人抗体的条件下培养宿主细胞。
在一些实施方案中,该方法包括将本文所述的经修饰以表达具有人可变结构域的外源性tdt和tcr的遗传修饰的非人动物暴露于包含肽的抗体或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;和从遗传修饰的非人动物获得表达对mhc上呈递的肽具有特异性的tcr的t细胞。
在一些实施方案中,该方法包括将本文所述的经修饰以表达具有人可变结构域的外源性tdt和tcr的遗传修饰的非人动物暴露于包含肽的抗体或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;从遗传修饰的非人动物获得表达对mhc上呈递的肽具有特异性的tcr的t细胞;和从t细胞制备t细胞杂交瘤。
在一些实施方案中,该方法包括将本文所述的经修饰以表达具有人可变结构域的外源性tdt和tcr的非人动物暴露于包含肽的抗体或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;从遗传修饰的非人动物获得表达对mhc上呈递的肽具有特异性的tcr的t细胞;和从t细胞中分离编码tcr的人tcr可变结构域的核酸。
在一些实施方案中,该方法包括将本文所述的经修饰以表达具有人可变结构域的外源性tdt和tcr的非人动物暴露于包含肽的抗体或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;从遗传修饰的非人动物获得表达对mhc上呈递的肽具有特异性的tcr的t细胞;从t细胞中分离编码tcr的tcr可变结构域的核酸;和将编码tcr可变结构域的核酸与细胞中的tcr恒定结构域可操作地连接,使得细胞表达包含tcr可变结构域和tcr恒定结构域的tcr。
在一些实施方案中,该方法包括将本文所述的经修饰以表达具有人可变结构域的外源性tdt和car的遗传修饰的非人动物暴露于包含肽的抗体或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;和从遗传修饰的非人动物获得表达对mhc上呈递的肽具有特异性的car的t细胞。
在一些实施方案中,该方法包括将本文所述的经修饰以表达具有人可变结构域的外源性tdt和car的遗传修饰的非人动物暴露于包含肽的抗体或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;从遗传修饰的非人动物获得表达对mhc上呈递的肽具有特异性的car的t细胞;和从t细胞制备t细胞杂交瘤。
在一些实施方案中,该方法包括将本文所述的经修饰以表达具有人可变结构域的外源性tdt和car的非人动物暴露于包含肽的抗体或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;从遗传修饰的非人动物获得表达对mhc上呈递的肽具有特异性的嵌合抗原受体(car)的t细胞;和从t细胞中分离编码car的人tcr可变结构域的核酸。
在一些实施方案中,该方法包括将本文所述的经修饰以表达具有人可变结构域的外源性tdt和car的非人动物暴露于包含肽的抗体或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;从遗传修饰的非人动物获得表达对mhc上呈递的肽具有特异性的嵌合抗原受体(car)的t细胞;从t细胞中分离编码car的人免疫球蛋白可变结构域的核酸;和将编码人免疫球蛋白可变结构域的核酸与细胞中的人免疫球蛋白恒定结构域可操作地连接,使得细胞表达包含人免疫球蛋白可变结构域和人免疫球蛋白恒定结构域的抗体。
在某些实施方案中,本文所述的方法包括其中将本文所述的非人动物暴露于抗原(免疫)以诱导免疫应答(例如b细胞免疫应答和/或t细胞免疫应答)的步骤。在一些实施方案中,用完整蛋白质抗原或其片段免疫遗传修饰的非人动物。啮齿动物可以通过本领域已知的任何方法免疫(参见,例如,harlow和lane(1988)antibodies:alaboratorymanual1988coldspringharborlaboratory;malik和lillehoj(1994)antibodytechniques,academicpress,ca)。
在一些实施方案中,通过向非人动物施用包含编码抗原的核酸序列的病毒(例如逆转录病毒、腺病毒、痘苗病毒或慢病毒),将遗传修饰的非人动物暴露于抗原。用于病毒疫苗接种的方法提供于例如美国专利号6,001,349、8,663,622、8,691,502、8,377,688以及precopio等人,jem204:1405-1416(2007)中,其每一篇通过引用整体并入本文。在一些实施方案中,直接向非人动物施用病毒。在一些实施方案中,细胞(例如抗原呈递细胞,例如树突细胞)在体外或离体被病毒感染,然后施用于非人动物。在一些实施方案中,病毒编码肽/mhc复合物(例如单链肽/mhc复合物)。基于单链肽/mhc的疫苗的实例提供在truscott等人,j.immunol.178:6280-6289(2007),ep1773383,kim等人vaccine30:2178-2186(2012),kim等人,j.immunol.184:4423-4430(2010)中,其中的每一篇都通过引用结合到本文中。
在一些实施方案中,通过向动物施用编码抗原的核酸,使遗传修饰的非人动物暴露于抗原。在一些实施方案中,向非人动物施用编码单链肽/mhc复合物的核酸。基于单链肽/mhc的疫苗的实例提供在truscott等人,j.immunol.178:6280-6289(2007),ep1773383,kim等人vaccine30:2178-2186(2012),kim等人,j.immunol.184:4423-4430(2010)中,其中的每一篇都通过引用结合到本文中。在某些实施方案中,核酸是dna载体。核酸的递送可以通过本领域已知的任何技术进行,包括病毒介导的基因转移和脂质体介导的基因转移。感兴趣的多核苷酸与脂质体结合以形成基因递送载体,如描述于例如美国专利号6,770,291、7,001,614、6,749,863、5,512,295和7,112,338中,其中的每一篇都通过引用结合到本文中。在一些实施方案中,核酸是mrna载体。用于产生和施用mrna载体的示例性方法描述于例如美国专利8,278,036和美国专利公布号2013/151736和2012/135805中,其中的每一篇均通过引用并入本文。
在一些实施方案中,抗原是癌症相关抗原。癌症相关抗原的实例包括但不限于亲脂素(adipophilin),aim-2,aldh1a1,α-辅肌动蛋白-4,甲胎蛋白(“afp”),alk,ankrd30a,artc1,b-raf,bage-1,bclx(l),bcr-abl融合蛋白b3a2,β-连环蛋白,bing-4,birc7,ca-125,ca9,calca,癌胚抗原(“cea”),calr,casp-5,casp-8,ccr5,cd19,cd20,cd22,cd27,cd274,cd30,cd33,cd38,cd40,cd44,cd45,cd52,cd56,cd79,cdc27,cdk12,cdk4,cdkn2a,cea,clec12a,clpp,coa-1,cpsf,csnk1a1,ctag1,ctag2,细胞周期蛋白d1,细胞周期蛋白a1,dek-can融合蛋白,dkk1,eftud2,egfr,egfr变体iii,伸长因子2,enah(hmena),ep-cam,epcam,epha2,epha3,上皮肿瘤抗原(“eta”),erbb3,erbb4,etv6-aml1融合蛋白,ezh2,fcrl3,fgf5,flt3-itd,fn1,folr1,g250/mn/caix,gage-1、2、8,gage-3、4、5、6、7,gas7,磷脂酰肌醇蛋白聚糖-3,gntv,gp100/pmel17,gpnmb,gm3,gpr112,il3ra,haus3,hepsin,her-2/neu,herv-k-mel,hla-a11,hla-a2,hla-dob,hsp70-2,ido1,igf2b3,il13ralpha2,肠羧基酯酶,k-ras,激肽释放酶4,kif20a,kit,kk-lc-1,kklc1,km-hn-1,kmhn1也称为ccdc110,kras,lage-1,ldlr-岩藻糖基转移酶as融合蛋白,lengsin,lgr5,lmp2,m-csf,mage-a1,mage-a10,mage-a12,mage-a2,mage-a3,mage-a4,mage-a6,mage-a9,mage-c1,mage-c2,苹果酸酶,乳房珠蛋白-a,mart2,matn,mc1r,mcsp,mdm-2,me1,melan-a/mart-1,meloe,midkine,mmp-2,mmp-7,muc1,muc2,muc3,muc4,muc5,muc5ac,muc16,粘蛋白,mum-1,mum-2,mum-3,肌球蛋白,i-肌球蛋白,n-raw,na88-a,neo-pap,nfyc,ny-br-1,ny-eso-1/lage-2,oa1,ogt,os-9,ox40,p多肽,p53,pap,pax3,pax5,pbf,plac1,pmel,pml-rarα融合蛋白,多态性上皮粘蛋白(“pem”),ppp1r3b,prame,prdx5,prlr,psa,psma,ptprk,rab38/ny-mel-1,rage-1,rbaf600,ret,rgs5,rhoc,rnf43,ror1,ru2as,sage,sart1,sart3,secernin1,sirt2,slamf7,slc39a6,snrpd1,sox10,sp17,spa17,ssx-2,ssx-4,steap1,steap2,存活素(survivin),syt-ssx1或-ssx2融合蛋白,tag-1,tag-2,端粒酶,tert,tgf-betarii,thompson-nouvelle抗原,tmprss2,tnfrsf17,tpbg,trag-3,磷酸丙糖异构酶,trp-1/gp75,trp-2,trp2-int2,酪氨酸酶,酪氨酸酶(“tyr”),upk3a,vegf,vtcn1,wt1,xage-1b/gaged2a。在一些实施方案中,抗原是新抗原。
在一些实施方案中,抗原是由感染性病原体表达的抗原。在一些实施方案中,病原体是病毒、细菌、真菌、蠕虫或原生动物。病毒的非限制性实例包括hiv,甲型肝炎,乙型肝炎,丙型肝炎,疱疹病毒(例如hsv-1、hsv-2、cmv、hav-6、vzv、epsteinbarr病毒),腺病毒,流感病毒,黄病毒,埃可病毒,鼻病毒,柯萨奇病毒,冠状病毒,呼吸道合胞病毒,腮腺炎病毒,轮状病毒,麻疹病毒,风疹病毒,细小病毒,痘苗病毒,htlv,登革热病毒,乳头瘤病毒,软体动物病毒,脊髓灰质炎病毒,狂犬病毒,jc病毒,埃博拉病毒,和虫媒病毒性脑炎病毒抗原。在一些实施方案中,寄生虫是疟疾。在一些实施方案中,病原体是曲霉菌,布鲁丝虫,假丝酵母,衣原体,球虫,隐球菌,恶丝虫,淋球菌,组织胞浆菌,克雷伯氏菌,军团菌,利什曼原虫,脑膜炎球菌,分枝杆菌,支原体,草履虫,百日咳,疟原虫,肺炎球菌,肺孢子虫,假单胞菌,立克次氏体,沙门氏菌,志贺氏菌,葡萄球菌,链球菌,弓形虫和虎列拉菌。示例性种包括淋病奈瑟氏球菌,结核分枝杆菌,白色念珠菌,热带假丝酵母,阴道毛滴虫,阴道嗜血杆菌,b组链球菌属,人支原体(microplasmahominis),杜氏血吸虫,肉芽肿,沙滴氏淋巴,梅毒螺旋体,流产布鲁氏菌,马尔他布鲁氏杆菌,猪布鲁氏杆菌,犬布鲁氏菌,胎儿弯曲杆菌,肠球菌弯曲杆菌,钩端螺旋体,单核细胞增生李斯特菌,羊布氏杆菌,鹦鹉热衣原体,胎儿毛滴虫,弓形虫,大肠杆菌,马齿苋,产气螨沙门氏菌,产气嗜血杆菌,铜绿假单胞菌,马棒状杆菌,化脓棒状杆菌,精子放线杆菌,mycoplasmabovigenitalium,烟曲霉菌,犁头霉菌,马媾疫锥虫,驽巴贝斯虫,破伤风杆菌,肉毒杆菌;或者,真菌,例如巴西副球孢子菌;或其他病原体,例如恶性疟原虫(plasmodiumfalciparum)。
在本文所述方法的一些实施方案中,该方法包括从遗传修饰的非人动物获得t细胞和/或b细胞的步骤。在某些实施方案中,可以使用本领域已知的任何方法来获得这样的细胞。例如,这种t细胞和/或b细胞可以从动物的脾、淋巴结和/或外周血中获得。可以使用本领域可获得的方法筛选这种t细胞和/或b细胞的结合特异性。
在一些实施方案中,本文描述的方法包括由b细胞制备b细胞杂交瘤的步骤。可用于制备b细胞杂交瘤的方法是本领域已知的,并描述于例如harlow和lane(1988)antibodies:alaboratorymanual1988coldspringharborlaboratory;malik和lillehoj(1994)antibodytechniques,academicpress,ca,在此通过引用并入。
在一些实施方案中,本文描述的方法包括从t细胞制备t细胞杂交瘤的步骤。可用于制备t细胞杂交瘤的方法是本领域已知的,并描述于例如hedrick等人,cell30:141-152(1982)和kruisbeekcurr.protoc.immunol.第3章(2001)和white等人,methodsinmolecularbiology134:185-193(2000),其各自通过引用并入本文。
在一些实施方案中,本文提供的方法包括分离编码ig或tcr可变区的核酸的步骤。在本文所述方法的一些实施方案中,任何方法可用于分离编码ig或tcr可变区的核酸。
在一些实施方案中,分离核酸的步骤包括分别从b细胞或t细胞制备b细胞或t细胞杂交瘤,并从杂交瘤中分离核酸。在一些实施方案中,使用核酸扩增方法分离核酸。例如,在一些实施方案中,核酸扩增方法是聚合酶链反应(pcr)、连接酶链反应(lcr)、链置换扩增(sda)、转录介导的扩增(tma)、自持序列复制(3sr)、基于qβ复制酶的扩增、基于核酸序列的扩增(nasba)、修复链反应(rcr)、回旋镖dna扩增(bda)或滚环扩增(rca)。
在一些实施方案中,通过测序b细胞、t细胞、b细胞杂交瘤或t细胞杂交瘤中的重排的ig或tcr可变区基因并合成包含重排的ig或tcr可变区基因的核酸序列来分离核酸。示例性核酸测序方法包括但不限于链终止测序、通过连接测序、通过合成测序、焦磷酸测序、离子半导体测序、单分子实时测序、454测序和/或dilute-‘n’-go测序。
当获得编码重链和/或轻链ig可变区的dna片段时,可以通过标准重组dna技术进一步操作这些dna片段,例如将可变区基因转化为全长抗体链基因、fab片段基因或scfv基因。在这些操作中,编码可变区的dna片段与编码另一种蛋白质的另一种dna片段可操作地连接,例如抗体恒定区或柔性接头。在本文中使用的术语“可操作地连接”旨在表示两个dna片段连接使得由两个dna片段编码的氨基酸序列保持符合读框。
通过将编码可变区的dna与编码重链恒定结构域(ch1、ch2和ch3)的另一dna分子可操作地连接,可以将编码重链可变区的分离的dna转化为全长重链基因。人重链恒定区基因的序列是本领域已知的(参见例如kabat,e.a.等人,(1991)sequencesofproteinsofimmunologicalinterest,fifthedition,u.s.departmentofhealthandhumanservices,nihpublicationno.91-3242,或lefranc,theimmunoglobulinhandbook,london:academicpress2001)和包含这些区域的dna片段可以是通过标准pcr扩增获得。重链恒定结构域可以是例如igg1、igg2、igg3、igg4、iga、ige、igm或igd恒定结构域。对于fab片段重链基因,vh编码dna可以与仅编码重链ch1恒定区的另一dna分子可操作地连接。
因此,在一些实施方案中,本文描述的方法包括将编码重链ig可变结构域的核酸序列与编码重链ig恒定结构域的核酸序列在宿主细胞中可操作地连接的步骤,使得宿主细胞表达包含ig重链可变结构域和ig重链恒定结构域的ig重链多肽。在一些实施方案中,该方法包括将编码轻链ig可变结构域的核酸序列与编码轻链ig恒定结构域的核酸序列在宿主细胞中可操作地连接的步骤,使得宿主细胞表达包含ig轻链可变结构域和ig重链恒定结构域的ig轻链多肽。在一些实施方案中,该方法包括将编码重链ig可变结构域的核酸序列与编码重链ig恒定结构域的核酸序列在宿主细胞中可操作地连接并将编码轻链ig可变结构域的核酸序列与编码轻链ig恒定结构域的核酸序列在宿主细胞中可操作地连接的步骤,使得宿主细胞表达具有包含重链ig可变结构域和重链ig恒定结构域的重链和包含轻链ig可变结构域和轻链ig恒定结构域的轻链的抗体。可以使用本领域熟知的标准分子生物学技术将ig可变区与ig恒定区连接。在一些实施方案中,可以使用任何能够表达免疫球蛋白多肽的宿主细胞。在一些实施方案中,细胞是cho细胞、hek-293细胞、bhk细胞、ns0细胞、sp2/0细胞或vero细胞或表达病毒核酸序列的视网膜细胞(例如perc.6tm细胞)。
在一些实施方案中,编码重链恒定结构域的核酸编码包含修饰的fc结构域的恒定结构域(例如,改变fc和fc受体之间相互作用的突变)。例如,在一些实施方案中,恒定结构域包括在235、236、237、239、265、267、268、269、270、298、326、327、330、332、350、351、366、392、394、405和/或407位置(使用eu编号系统)对其fc结构域的修饰。在一些实施方案中,修饰选自l235a、g236e、g237f、s239e、s239d、d265e、d265s、s267e、s267d、s267g、h268e、h268d、e269l、d270n、d270e、s298a、k326a、k326d、a327h、a327v、a327l、a330i、a330s、i332e、t350v、l351y、t366l、k392m、k392l、t394w、f405a和/或y407v(使用eu编号系统)。在一些实施方案中,恒定结构域包含对其fc结构域的多个修饰。在一些实施方案中,多个修饰选自d270n/k326d、s239e/s298a/k326a/a327h、l235a/s239e/d265e/a327h、g236e/g237f/s239e、g237f/s239e/d265e、g327f/s239e/h268d、g236e/d270n/a327v/i332e、g237f/s239e/a327h、g237f/a327l/a330i、s239d/d265s/s298a/i332e、s239e/d265s/h268d/i332e、s239e/d265s/i332e、s239e/s267e/h268d、s239e/a327l/a330i、d265e/s267d/a330s、s267g/h268e/d270e、h268d/e269l/s298a/k326a/a327h、h268d//k326a/a327h。另外的fc修饰和fc修饰的组合提供于美国专利5,624,821、5,648,260、6,528,624、6,737,056、7,122,637、7,183,387、7,297,775、7,317,091、7,332,581、7,632,497、7,662,925、7,695,936、8,093,359、8,216,805、8,218,805、8,388,955和8,937,158以及美国专利公开2005/0054832、2006/0222653、2006/0275282、2006/0275283、2007/0190063、2008/0154025、2009/0042291、2013/0108623和2013/0089541中,其各自通过引用并入本文。
抗原结合蛋白
在某些方面,本文提供了根据本文描述的方法可获得和/或获得的抗原结合蛋白(例如抗体、tcr、car及其抗原结合片段)(例如使用本文所述的非人动物)。
在某些实施方案中,本文提供的抗原结合分子能够特异性结合靶抗原,其解离常数不大于10-6、10-7、10-8或10-9m。在一些实施方案中,抗原结合蛋白与抗原的结合亲和力(由kd表示)比抗原结合蛋白对无关抗原的亲和力低至少10倍、低至少100倍或低至少1000倍。在一些实施方案中,抗原结合蛋白结合肽/mhc复合物,其解离常数不大于10-6、10-7、10-8或10-9m。在一些实施方案中,抗原结合蛋白与肽/mhc复合物的结合亲和力(由kd表示)比抗原结合蛋白对于呈递无关肽的相同mhc蛋白的肽的亲和力小至少10倍、小至少100倍或小至少1000倍。用于评估抗原结合蛋白的结合能力的标准测定法是本领域已知的,包括例如elisa、western印迹法和ria。抗原结合蛋白的结合动力学(例如结合亲和力)也可以通过本领域已知的标准测定来评估,例如通过biacore分析。
在一些实施方案中,抗原包含癌症相关抗原的表位和/或是癌症相关抗原。癌症相关抗原的实例包括但不限于亲脂素(adipophilin),aim-2,aldh1a1,α-辅肌动蛋白-4,甲胎蛋白(“afp”),artc1,b-raf,bage-1,bclx(l),bcr-abl融合蛋白b3a2,β-连环蛋白,bing-4,ca-125,calca,癌胚抗原(“cea”),casp-5,casp-8,cd274,cd45,cdc27,cdk12,cdk4,cdkn2a,cea,clpp,coa-1,cpsf,csnk1a1,ctag1,ctag2,细胞周期蛋白d1,细胞周期蛋白a1,dek-can融合蛋白,dkk1,eftud2,伸长因子2,enah(hmena),ep-cam,epcam,epha3,上皮肿瘤抗原(“eta”),etv6-aml1融合蛋白,ezh2,fgf5,flt3-itd,fn1,g250/mn/caix,gage-1、2、8,gage-3、4、5、6、7,gas7,磷脂酰肌醇蛋白聚糖-3,gntv,gp100/pmel17,gpnmb,haus3,hepsin,her-2/neu,herv-k-mel,hla-a11,hla-a2,hla-dob,hsp70-2,ido1,igf2b3,il13ralpha2,肠羧基酯酶,k-ras,激肽释放酶4,kif20a,kk-lc-1,kklc1,km-hn-1,kmhn1也称为ccdc110,lage-1,ldlr-岩藻糖基转移酶as融合蛋白,lengsin,m-csf,mage-a1,mage-a10,mage-a12,mage-a2,mage-a3,mage-a4,mage-a6,mage-a9,mage-c1,mage-c2,苹果酸酶,乳房珠蛋白-a,mart2,matn,mc1r,mcsp,mdm-2,me1,melan-a/mart-1,meloe,midkine,mmp-2,mmp-7,muc1,muc5ac,粘蛋白,mum-1,mum-2,mum-3,肌球蛋白,i-肌球蛋白,n-raw,na88-a,neo-pap,nfyc,ny-br-1,ny-eso-1/lage-2,oa1,ogt,os-9,p多肽,p53,pap,pax5,pbf,pml-rarα融合蛋白,多态性上皮粘蛋白(“pem”),ppp1r3b,prame,prdx5,psa,psma,ptprk,rab38/ny-mel-1,rage-1,rbaf600,rgs5,rhoc,rnf43,ru2as,sage,secernin1,sirt2,snrpd1,sox10,sp17,spa17,ssx-2,ssx-4,steap1,存活素(survivin),syt-ssx1或-ssx2融合蛋白,tag-1,tag-2,端粒酶,tgf-betarii,tpbg,trag-3,磷酸丙糖异构酶,trp-1/gp75,trp-2,trp2-int2,酪氨酸酶,酪氨酸酶(“tyr”),vegf,wt1,xage-1b/gaged2a。在一些实施方案中,抗原是新抗原。
在一些实施方案中,抗原包含由感染性病原体表达的抗原的表位和/或是由感染性病原体表达的抗原。在一些实施方案中,病原体是病毒、细菌、真菌、蠕虫或原生动物。病毒的一些非限制性实例包括hpv、hbv、丙型肝炎病毒(hcv)、逆转录病毒如人免疫缺陷病毒(hiv-1和hiv-2)、疱疹病毒如epsteinbarr病毒(ebv)、巨细胞病毒(cmv)、hsv-1和hsv-2以及流感病毒。在一些实施方案中,寄生虫是疟疾。在一些实施方案中,病原体是曲霉菌,布鲁丝虫,假丝酵母,衣原体,球虫,隐球菌,恶丝虫,淋球菌,组织胞浆菌,利什曼原虫,分枝杆菌,支原体,草履虫,百日咳,疟原虫,肺炎球菌,肺孢子虫,立克次氏体,沙门氏菌,志贺氏菌,葡萄球菌,链球菌,弓形虫和虎列拉菌。示例性种包括淋病奈瑟氏球菌,结核分枝杆菌,白色念珠菌,热带假丝酵母,阴道毛滴虫,阴道嗜血杆菌,b组链球菌属,人支原体(microplasmahominis),杜氏血吸虫,肉芽肿,沙滴氏淋巴,梅毒螺旋体,流产布鲁氏菌,马尔他布鲁氏杆菌,猪布鲁氏杆菌,犬布鲁氏菌,胎儿弯曲杆菌,肠球菌弯曲杆菌,钩端螺旋体,单核细胞增生李斯特菌,羊布氏杆菌,鹦鹉热衣原体,胎儿毛滴虫,弓形虫,大肠杆菌,马齿苋,产气螨沙门氏菌,产气嗜血杆菌,铜绿假单胞菌,马棒状杆菌,化脓棒状杆菌,精子放线杆菌,mycoplasmabovigenitalium,烟曲霉菌,犁头霉菌,马媾疫锥虫,驽巴贝斯虫,破伤风杆菌,肉毒杆菌;或者,真菌,例如巴西副球孢子菌;或其他病原体,例如恶性疟原虫(plasmodiumfalciparum)。
在一些实施方案中,抗原包含为炎性疾病、皮肤或器官移植排斥、移植物抗宿主病(gvhd)或自身免疫疾病中的自身反应性t细胞的靶标的蛋白质的表位和/或是这样的蛋白质自身免疫疾病的实例包括,例如,肾小球肾炎,关节炎,扩张性心肌病样疾病,溃疡性结肠炎,干燥综合征,克罗恩病,全身性红斑,慢性类风湿性关节炎,多发性硬化,牛皮癣,过敏性接触性皮炎,多发性肌炎,厚皮病,结节性动脉周围炎,风湿热,寻常性白癜风,胰岛素依赖型糖尿病,behcet病,桥本病,艾迪生病,皮肌炎,重症肌无力,reiter综合征,格雷夫斯病,贫血症,goodpasture综合征,不孕症,慢性活动性肝炎,天疱疮,自身免疫血小板减少性紫癜,自身免疫性溶血性贫血,活动性慢性肝炎,艾迪生病,抗磷脂综合征,特应性过敏,自身免疫性萎缩性胃炎,甲醇自身免疫,乳糜泻,库欣综合征,皮肌炎,盘状狼疮,红斑,goodpasture综合征,桥本氏甲状腺炎,特发性肾上腺萎缩,身份顺势疗法血小板减少症,胰岛素依赖型糖尿病,lambert-eaton综合征,狼疮性肝炎,某些淋巴细胞减少症,混合性结缔组织病,类天疱疮,寻常性天疱疮,恶性贫血,致癌性葡萄膜炎,结节性多动脉炎,多发性自发性肾炎,原发性胆汁性肝硬化,原发性硬化性胆管炎,雷诺综合征,复发性多软骨炎,施密特综合征,有限硬皮病(或嵴综合征),交感性眼炎,系统性红斑狼疮,大动脉炎,颞动脉炎,甲状腺毒症,b型胰岛素抵抗,溃疡性结肠炎和韦格纳肉芽肿病。自身反应性t细胞靶向的示例性蛋白质包括例如p205、胰岛素、促甲状腺激素、酪氨酸酶、trp1和髓磷脂。
在一些实施方案中,抗原结合蛋白是抗体。在一些实施方案中,本文提供的抗体包含人重链可变结构域。在一些实施方案中,抗体包含人重链恒定结构域。在一些实施方案中,本文提供的抗体包含igg1、igg2、igg3、igg4、iga、ige、igm或igd恒定结构域。人重链恒定结构域的序列是本领域已知的(参见例如kabat,e.a.等人,(1991)sequencesofproteinsofimmunologicalinterest,fifthedition,u.s.departmentofhealthandhumanservices,nihpublicationno.91-3242,或lefranc,theimmunoglobulinhandbook,london:academicpress2001)。在一些实施方案中,本文提供的抗体缺乏重链恒定结构域或其部分。
在一些实施方案中,本文提供的抗体包含修饰的fc结构域(例如,改变fc和fc受体之间相互作用的突变)。例如,在一些实施方案中,本文提供的抗体包含在235、236、237、239、265、267、268、269、270、298、326、327、330、332、350、351、366、392、394、405和/或407位置(使用eu编号系统)对其fc结构域的修饰。在一些实施方案中,修饰选自l235a、g236e、g237f、s239e、s239d、d265e、d265s、s267e、s267d、s267g、h268e、h268d、e269l、d270n、d270e、s298a、k326a、k326d、a327h、a327v、a327l、a330i、a330s、i332e、t350v、l351y、t366l、k392m、k392l、t394w、f405a和/或y407v(使用eu编号系统)。在一些实施方案中,抗体包含对其fc结构域的多个修饰。在一些实施方案中,多个修饰选自d270n/k326d、s239e/s298a/k326a/a327h、l235a/s239e/d265e/a327h、g236e/g237f/s239e、g237f/s239e/d265e、g327f/s239e/h268d、g236e/d270n/a327v/i332e、g237f/s239e/a327h、g237f/a327l/a330i、s239d/d265s/s298a/i332e、s239e/d265s/h268d/i332e、s239e/d265s/i332e、s239e/s267e/h268d、s239e/a327l/a330i、d265e/s267d/a330s、s267g/h268e/d270e、h268d/e269l/s298a/k326a/a327h、h268d//k326a/a327h。另外的fc修饰和fc修饰的组合提供于美国专利5,624,821、5,648,260、6,528,624、6,737,056、7,122,637、7,183,387、7,297,775、7,317,091、7,332,581、7,632,497、7,662,925、7,695,936、8,093,359、8,216,805、8,218,805、8,388,955和8,937,158以及美国专利公开2005/0054832、2006/0222653、2006/0275282、2006/0275283、2007/0190063、2008/0154025、2009/0042291、2013/0108623和2013/0089541中,其各自通过引用并入本文。
在一些实施方案中,抗体是双特异性抗体。在一些实施方案中,双特异性抗体的两个抗原结合结构域具有不同的重链可变结构域,但具有相同的轻链可变结构域。在一些实施方案中,重链的fc结构域包含促进重链异二聚体形成和/或抑制重链同二聚体形成的修饰。这样的修改例如提供在美国专利号5,731,168、5,807,706、5,821,333、7,642,228和8,679,785以及美国专利公布2013/0195849中,其各自通过引用并入本文。
在一些实施方案中,本文提供的抗体具有人轻链可变结构域。在一些实施方案中,轻链可变结构域是λ轻链可变结构域。在一些实施方案中,轻链可变结构域是κ轻链可变结构域。在一些实施方案中,抗体具有人轻链恒定结构域。在一些实施方案中,轻链恒定结构域是λ轻链恒定结构域。在一些实施方案中,轻链恒定结构域是κ轻链恒定结构域。人轻链恒定结构域的序列是本领域已知的(参见例如kabat,e.a.等人,(1991)sequencesofproteinsofimmunologicalinterest,fifthedition,u.s.departmentofhealthandhumanservices,nihpublicationno.91-3242,或lefranc,theimmunoglobulinhandbook,london:academicpress2001)。
在一些实施方案中,本文描述的抗体是完整抗体。在一些实施方案中,本文描述的抗体是保留抗原结合的抗体片段。在一些实施方案中,抗体片段是fab、fab'、f(ab')2、fv、scfv、二硫键连接的fv、fd、单链抗体、分离的cdrh3或保留完整抗体的可变结构域的至少一部分的另一抗体片段。
在某些实施方案中,抗原结合蛋白是car。在一些实施方案中,car是膜结合的。在一些实施方案中,car是可溶性car(例如,缺乏跨膜或细胞质结构域)。在一些实施方案中,此类car包括包含ig重链可变结构域和tcrβ恒定结构域的第一car多肽和包含ig轻链可变结构域(例如igκ可变结构域或igλ可变结构域)和tcrα恒定结构域的第二car多肽。在一些实施方案中,ig重链可变结构域和/或ig轻链可变结构域是人ig可变结构域。在一些实施方案中,tcrβ恒定结构域和/或tcrα恒定结构域是非人恒定结构域(例如,大鼠或小鼠恒定结构域)。在一些实施方案中,tcrβ恒定结构域和/或tcrα恒定结构域是人恒定结构域。
在某些实施方案中,抗原结合蛋白是tcr。在一些实施方案中,tcr是膜结合的。在一些实施方案中,tcr是可溶性tcr(例如,缺乏跨膜或细胞质结构域)。在一些实施方案中,此类tcr包含第一tcr多肽和第二tcr多肽,所述第一tcr多肽包含tcrβ可变结构域和tcrβ恒定结构域,所述第二tcr多肽包含tcrα可变结构域和tcrα恒定结构域。在一些实施方案中,tcrα可变结构域和/或tcrβ可变结构域是人tcr可变结构域。在一些实施方案中,tcrβ恒定结构域和/或tcrα恒定结构域是非人恒定结构域(例如,大鼠或小鼠恒定结构域)。在一些实施方案中,tcrβ恒定结构域和/或tcrα恒定结构域是人恒定结构域。
药物组合物
在某些实施方案中,本文提供了组合物,例如药物组合物,其含有与药学上可接受的载体一起配制的至少一种本文所述的药剂(例如本文所述的抗原结合分子,例如本文所述的抗体,car或tcr,获自非本文所述的人动物)。
本文提供的药物组合物可以特别配制用于以固体或液体形式给药,包括适于以下的那些:(1)口服给药,例如,浸液(水性或非水性溶液或悬浮液),片剂,例如那些针对口腔、舌下和全身吸收,大丸剂,粉末,颗粒,用于舌头的糊剂;或(2)肠胃外给药,例如通过皮下、肌肉内、静脉内或硬膜外注射,例如无菌溶液或悬浮液,或缓释制剂。
本文提供的适用于肠胃外给药的药物组合物包含一种或多种本文所述的药剂与一种或多种药学上可接受的无菌等渗水性或非水性溶液、分散液、悬浮液或乳液、或仅在使用之前可重构成无菌可注射溶液或分散液的无菌粉末组合,其可含有糖、醇、抗氧化剂、缓冲剂、抑菌剂、使制剂与预期接受者的血液等渗的溶质、或悬浮剂或增稠剂。
可用于本文提供的药物组合物中的合适的水性和非水性载体的实例包括水、乙醇、多元醇(例如甘油、丙二醇、聚乙二醇等)及其合适的混合物、植物油例如橄榄油、和可注射的有机酯,如油酸乙酯。例如,通过使用包衣材料如卵磷脂,通过在分散体的情况下保持所需的粒度,以及通过使用表面活性剂,可以保持适当的流动性。
在某些实施方案中,组合物包含本文所述的抗体、tcr和/或car,其浓度导致适合所需剂量的w/v。抗体、tcr和/或car可以以至少1mg/ml、至少5mg/ml、至少10mg/ml、至少15mg/ml、至少20mg/ml、至少25mg/ml、至少30mg/ml、至少35mg/ml、至少40mg/ml、至少45mg/ml、至少50mg/ml、至少55mg/ml、至少60mg/ml、至少65mg/ml、至少70mg/ml、至少75mg/ml、至少80mg/ml、至少85mg/ml、至少90mg/ml、至少95mg/ml、至少100mg/ml、至少105mg/ml、至少110mg/ml、至少115mg/ml、至少120mg/ml、至少125mg/ml、至少130mg/ml、至少135mg/ml、至少140mg/ml、至少150mg/ml、至少200mg/ml、至少250mg/ml、或至少300mg/ml的浓度存在于组合物中。
在一些实施方案中,所述组合物包含一种或多种活性化合物,所述活性化合物是所治疗的具体适应症所必需的,通常是具有彼此不产生不利影响的互补活性的那些。这些另外的活性化合物合适地以对预期目的有效的量组合存在。
在一些实施方案中,通过将本文所述的抗体、tcr和/或car与任选的生理学上可接受的载体、赋形剂或稳定剂混合来制备组合物,包括但不限于缓冲剂、糖类、盐、表面活性剂、增溶剂、多元醇、稀释剂、粘合剂、稳定剂、盐、亲脂性溶剂、氨基酸、螯合剂、防腐剂等(goodman和gilman的thepharmacologicalbasisoftherapeutics,第12版,l.brunton等人和remington'spharmaceuticalsciences,第16版,osol,a.编辑(1999)),其以所需最终浓度的冻干组合物或水溶液的形式。可接受的载体、赋形剂或稳定剂在所用剂量和浓度下对接受者无毒,并且包括缓冲剂,如组氨酸、磷酸盐、柠檬酸盐、甘氨酸、乙酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和蛋氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;六甲基氯化铵;苯扎氯铵,苄索氯铵;苯酚,丁醇或苄醇;对羟基苯甲酸烷基酯,如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括海藻糖、葡萄糖、甘露糖或糊精;螯合剂如edta;糖类,如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐抗衡离子如钠;金属配合物(如zn-蛋白质配合物);和/或非离子表面活性剂,例如tween、聚山梨醇酯80、
在一些实施方案中,缓冲剂是组氨酸、柠檬酸盐、磷酸盐、甘氨酸或乙酸盐。糖类赋形剂可以是海藻糖、蔗糖、甘露糖醇、麦芽糖或棉子糖。表面活性剂可以是聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯80或pluronicf68。盐可以是nacl、kcl、mgcl2或cacl2。
在一些实施方案中,组合物包含缓冲剂或ph调节剂以提供改善的ph控制。这种组合物的ph可以为约3.0至约9.0、约4.0至约8.0、约5.0至约8.0、约5.0至约7.0、约5.0至约6.5、约5.5至约8.0、约5.5至约7.0、或约5.5至约6.5。在另一个实施方案中,这种组合物的ph为约3.0、约3.5、约4.0、约4.5、约5.0、约5.1、约5.2、约5.3、约5.4、约5.5、约5.6、约5.7、约5.8、约5.9、约6.0、约6.1、约6.2、约6.3、约6.4、约6.5、约6.6、约6.7、约6.8、约6.9、约7.0、约7.5、约8.0、约8.5或约9.0。在一个具体实施方案中,组合物的ph为约6.0。本领域技术人员理解组合物的ph通常不应等于组合物中使用的特定抗体、tcr或car的等电点。通常,缓冲剂是由有机或无机酸或碱制备的盐。代表性的缓冲剂包括但不限于有机酸盐,例如柠檬酸、抗坏血酸、葡糖酸、碳酸、酒石酸,琥珀酸、乙酸或邻苯二甲酸的盐;tris、盐酸氨丁三醇或磷酸盐缓冲液。此外,氨基酸组分还可以起缓冲能力。可在组合物中用作缓冲剂的代表性氨基酸组分包括但不限于甘氨酸和组氨酸。在某些实施方案中,缓冲剂选自组氨酸、柠檬酸盐、磷酸盐、甘氨酸和乙酸盐。在一个具体实施方案中,缓冲剂是组氨酸。在另一具体实施方案中,缓冲剂是柠檬酸盐。在另一个具体实施方案中,缓冲剂是甘氨酸。缓冲剂的纯度应为至少98%,或至少99%,或至少99.5%。如本文所用,在组氨酸和甘氨酸的上下文中的术语“纯度”是指本领域中所理解的组氨酸或甘氨酸的化学纯度,例如,如描述于themerckindex,第13版,o'neil等人编辑(merck&co.,2001)中。
在某些实施方案中,组合物包含组氨酸作为缓冲剂。在某些实施方案中,组氨酸以至少约1mm、至少约5mm、至少约10mm、至少约20mm、至少约30mm、至少约40mm、至少约50mm、至少约75mm、至少约100mm、至少约150mm、或至少约200mm组氨酸的浓度存在于组合物中。在另一个实施方案中,组合物包含约1mm至约200mm、约1mm至约150mm、约1mm至约100mm、约1mm至约75mm、约10mm至约200mm、约10mm至约150mm、约10mm至约100mm、约10mm至约75mm、约10mm至约50mm、约10mm至约40mm、约10mm至约30mm、约20mm和约75mm、约20mm和约50mm、约20mm和约40mm、或约20mm至约30mm的组氨酸。在进一步的实施方案中,组合物包含约1mm、约5mm、约10mm、约20mm、约25mm、约30mm、约35mm、约40mm、约45mm、约50mm、约60mm、约70mm、约80mm、约90mm、约100mm、约150mm或约200mm组氨酸。在一个具体实施方案中,组合物可包含约10mm、约25mm或不含组氨酸。
在一些实施方案中,组合物包含碳水化合物赋形剂。碳水化合物赋形剂可以用作例如粘度增强剂、稳定剂、填充剂、增溶剂和/或类似物。碳水化合物赋形剂通常以按重量或体积计约1%至约99%存在,例如约0.1%至约20%、约0.1%至约15%、约0.1%至约5%、1%至约20%、约5%至约15%、约8%至约10%、约10%至约15%、约15%至约20%、0.1%至20%、5%至15%、8%至10%、10%至15%、15%至20%、约0.1%至约5%、约5%至约10%、或约15%至约20%。在其他具体实施方案中,碳水化合物赋形剂以1%、或1.5%、或2%、或2.5%、或3%、或4%、或5%、或10%、或15%、或20%存在。
在一些实施方案中,组合物包含碳水化合物赋形剂。适用于组合物的碳水化合物赋形剂包括但不限于单糖,例如果糖、麦芽糖、半乳糖、葡萄糖、d-甘露糖、山梨糖等;二糖,如乳糖、蔗糖、海藻糖、纤维二糖等;多糖,如棉子糖、松三糖、麦芽糖糊精、葡聚糖、淀粉等;和醛糖醇,如甘露醇、木糖醇、麦芽糖醇、乳糖醇、木糖醇山梨糖醇(葡萄糖醇)等。在某些实施方案中,用于本文提供的组合物的碳水化合物赋形剂选自蔗糖、海藻糖、乳糖、甘露糖醇和棉子糖。在一个具体实施方案中,碳水化合物赋形剂是海藻糖。在另一个具体的实施方案中,碳水化合物赋形剂是甘露醇。在另一个具体实施方案中,碳水化合物赋形剂是蔗糖。在另一个具体实施方案中,碳水化合物赋形剂是棉子糖。碳水化合物赋形剂的纯度应为至少98%,或至少99%,或至少99.5%。
在一些实施方案中,组合物包含海藻糖。在某些实施方案中,组合物包含至少约1%、至少约2%、至少约4%、至少约8%、至少约20%、至少约30%或至少约40%的海藻糖。在另一个实施方案中,组合物包含约1%至约40%、约1%至约30%、约1%至约20%、约2%至约40%、约2%至约30%、约2%至约20%、约4%至约40%、约4%至约30%、或约4%至约20%的海藻糖。在进一步的实施方案中,组合物包含约1%、约2%、约4%、约6%、约8%、约15%、约20%、约30%或约40%的海藻糖。在一个具体实施方案中,组合物包含约4%、约6%或约15%的海藻糖。
在某些实施方案中,组合物包含赋形剂。在一个具体实施方案中,组合物包含至少一种选自以下的赋形剂:糖、盐、表面活性剂、氨基酸、多元醇、螯合剂、乳化剂和防腐剂。在某些实施方案中,组合物包含盐,例如选自nacl、kcl、cacl2和mgcl2的盐。在一个具体实施方案中,该组合物包含nacl。
在一些实施方案中,组合物包含氨基酸,例如赖氨酸、精氨酸、甘氨酸、组氨酸或氨基酸盐。该组合物可包含至少约1mm,至少约10mm、至少约25mm、至少约50mm、至少约100mm、至少约150mm、至少约200mm、至少约250mm、至少约300mm、至少约350mm、或至少约400mm的氨基酸。在另一个实施方案中,组合物可包含约1mm至约100mm、约10mm至约150mm、约25mm至约250mm、约25mm至约300mm、约25mm至350mm、约25mm至约400mm、约50mm至约250mm、约50mm至约300mm、约50mm至约350mm、约50mm至约400mm、100mm至约250mm、约100mm至约300mm、约100mm至约400mm、约150mm至约250mm、约150mm至约300mm、或约150mm至400mm的氨基酸。在进一步的实施方案中,组合物包含约1mm、1.6mm、25mm、约50mm、约100mm、约150mm、约200mm、约250mm、约300mm、约350mm或约400mm的氨基酸。
在一些实施方案中,组合物包含表面活性剂。本文所用的术语“表面活性剂”是指具有两亲结构的有机物质;即,它们由相反溶解倾向的基团组成,通常是油溶性烃链和水溶性离子基团。取决于表面活性部分的电荷,表面活性剂可分为阴离子、阳离子和非离子表面活性剂。表面活性剂通常用作各种药物组合物和生物材料制剂的润湿剂、乳化剂、增溶剂和分散剂。药学上可接受的表面活性剂如聚山梨醇酯(例如聚山梨醇酯20或80);泊洛沙姆(例如泊洛沙姆188);triton;辛基糖苷钠;十二烷基-、肉豆蔻基-、亚油基-或硬脂基-磺基甜菜碱;十二烷基-、肉豆蔻基-、亚油酰基-或硬脂基-肌氨酸;亚油酸-、肉豆蔻基-或十六烷基-甜菜碱;月桂酰胺丙基-、椰油酰胺丙基-、亚油酰胺基丙基-、肉豆蔻基丙基-、棕榈酰胺丙基-或异硬脂酰胺丙基-甜菜碱(例如月桂酰胺丙基);肉豆蔻酰胺丙基-、棕榈酰胺丙基-或异硬脂酰胺丙基-二甲基胺;甲基椰油酰基钠,或甲基油基-牛磺酸二钠;和
在一些实施方案中,组合物包含其他赋形剂和/或添加剂,包括但不限于稀释剂、粘合剂、稳定剂、亲脂性溶剂、防腐剂、佐剂等。药学上可接受的赋形剂和/或添加剂可用于本文提供的组合物中。可任选地将常用的赋形剂/添加剂,例如药学上可接受的螯合剂(例如但不限于edta、dtpa或egta)加入组合物中以减少聚集。如果使用泵或塑料容器来施用组合物,这些添加剂特别有用。
在一些实施方案中,组合物包含防腐剂。防腐剂,如苯酚、间甲酚、对甲酚、邻甲酚、氯甲酚、苯甲醇,亚硝酸苯基汞、苯氧基乙醇、甲醛、氯丁醇、氯化镁(例如但不限于六水合物)、对羟基苯甲酸烷基酯(甲酯、乙酯、丙酯、丁酯等)、苯扎氯铵、苄索氯铵、脱氢乙酸钠和硫柳汞或其混合物可任选地以任何合适的浓度加入组合物中,例如约0.001%至约5%,或其中的任何范围或值。组合物中使用的防腐剂浓度是足以产生微生物效果的浓度。这样的浓度取决于所选择的防腐剂,并且容易由技术人员确定。
在一些实施方案中,组合物与人血液等渗,其中组合物具有与人血液基本相同的渗透压。这种等渗组合物通常具有约250mosm至约350mosm的渗透压。等渗性可以通过例如使用蒸气压或冰冻型渗透压计来测量。通过使用张力调节剂调节组合物的张力。“张力调节剂”是那些药学上可接受的惰性物质,其可以加入到组合物中以提供组合物的等渗性。适用于本文提供的组合物的张力调节剂包括但不限于糖类、盐和氨基酸。
在某些实施方案中,该组合物是无热原的组合物,其基本上不含内毒素和/或相关的热原物质。内毒素包括限制在微生物内且仅在微生物分解或死亡时释放的毒素。热原物质还包括来自细菌和其他微生物外膜的发热诱导的热稳定物质。如果给予人类,这两种物质都会引起发烧、低血压和休克。由于潜在的有害作用,必须从静脉内施用的药物溶液中除去即使少量的内毒素。食品和药物管理局(“fda”)在静脉注射药物应用的单一一小时内设定了每剂量每千克体重5个内毒素单位(eu)的上限(theunitedstatespharmacopeialconvention,pharmacopeialforum26(1):223(2000))。当治疗性蛋白质以每千克体重数百或数千毫克的量施用时,如感兴趣的蛋白质(例如抗体)的情况,必须除去甚至痕量的有害和危险的内毒素。在一些实施方案中,组合物中的内毒素和热原水平小于10eu/mg,或小于5eu/mg,或小于1eu/mg,或小于0.1eu/mg,或小于0.01eu/mg,或小于0.001eu/mg。
当用于体内施用时,本文所述的组合物应是无菌的。组合物可以通过各种灭菌方法灭菌,包括无菌过滤、辐射等。在某些实施方案中,用预先灭菌的0.22微米过滤器对组合物进行过滤灭菌。用于注射的无菌组合物可根据如“remington:thescience&practiceofpharmacy”,第21版,lippincottwilliams&wilkins,(2005)中所述的常规药学实践来配制。包含目标蛋白质(例如抗体或tcr或car)的组合物,例如本文公开的那些,通常将以冻干形式或溶液形式储存。考虑将包含目标蛋白质(例如抗体、tcr或car)的无菌组合物置于具有无菌进入口的容器中,例如具有允许取出组合物的适配器的静脉内溶液袋或小瓶,该适配器例如作为皮下注射针可刺穿的塞子。在某些实施方案中,提供组合物作为预填充注射器。
在某些实施方案中,该组合物是冻干制剂。术语“冻干的”或“冷冻干燥的”包括已经过干燥程序例如冻干的物质的状态,其中至少50%的水分已被除去。
无论选择何种给药途径,本文提供的可以合适的水合形式使用的药剂和/或本文提供的药物组合物通过本领域技术人员已知的常规方法配制成药学上可接受的剂型。
治疗方法
在某些方面,本文提供了治疗疾病或病症的方法,包括向受试者施用抗原结合蛋白(例如本文所述的抗体、tcr和/或car,例如完全人抗体、tcr或car)。在一些实施方案中,抗体、tcr和/或car是使用本文描述的方法获得或可获得的抗体、tcr和/或car(例如使用本文所述的非人动物)。
在某些实施方案中,本文提供治疗受试者的癌症的方法,包括向受试者施用本文所述的药物组合物(例如,包含本文所述的抗体的药物组合物,例如本文所述的完全人抗体、tcr或car,其获得自如本文所述的非人动物)。在一些实施方案中,本文描述的方法可用于治疗任何癌性或癌前肿瘤。可通过本文所述的方法和组合物治疗的癌症包括但不限于来自膀胱、血液、骨、骨髓、脑、乳腺、结肠、食道、胃肠、牙龈、头、肾、肝、肺、鼻咽、颈部、卵巢、前列腺、皮肤、胃、睾丸、舌头或子宫的癌细胞。各种组织学类型的癌症的非限制性实例包括:恶性肿瘤;癌;未分化癌;巨细胞和梭形细胞癌;小细胞癌;乳头状癌;鳞状细胞癌;淋巴上皮癌;基底细胞癌;毛细胞癌;移行细胞癌;乳头状移行细胞癌;腺癌;恶性胃泌素瘤;胆管癌;肝细胞癌;合并肝细胞癌和胆管癌;小梁腺癌;腺样囊性癌;腺瘤性息肉中的腺癌;腺癌,家族性结肠息肉;实体癌;类癌,恶性;支气管肺泡腺癌;乳头状腺癌;嫌色细胞癌;嗜酸性粒细胞癌;嗜酸性腺癌;嗜碱性粒细胞癌;透明细胞腺癌;颗粒细胞癌;滤泡性腺癌;乳头状和滤泡状腺癌;非包膜性硬化癌;肾上腺皮质癌;子宫内膜样癌;皮肤附属癌;大汗腺癌;皮脂腺癌;琥珀酸腺癌;粘液表皮样癌;囊腺癌;乳头状囊腺癌;乳头状浆液性囊腺癌;粘液性囊腺癌;粘液腺癌;印戒细胞癌;浸润性导管癌;髓样癌;小叶癌;炎性癌;佩吉特病,乳腺癌;腺泡细胞癌;腺鳞癌;腺癌伴鳞状化生;胸腺瘤,恶性;卵巢间质瘤,恶性;肉瘤,恶性;颗粒细胞瘤,恶性;和roblastoma,恶性;支持细胞癌;睾丸间质细胞瘤,恶性;脂质细胞瘤,恶性;副神经节瘤,恶性;乳腺外副神经节瘤,恶性;嗜铬细胞瘤;血管球肉瘤;恶性黑色素瘤;无黑色素瘤;浅表性黑色素瘤;巨大色素痣中的恶性黑色素瘤;上皮样细胞黑色素瘤;蓝色痣,恶性;肉瘤;纤维肉瘤;纤维组织细胞瘤,恶性;粘液肉瘤;脂肪肉瘤;平滑肌肉瘤;横纹肌肉瘤;胚胎性横纹肌肉瘤;肺泡横纹肌肉瘤;间质肉瘤;混合瘤,恶性;mullerian混合瘤;肾母细胞瘤;肝母细胞瘤;肉瘤;间质瘤,恶性;勃勒纳肿瘤,恶性;叶状肿瘤,恶性;滑膜肉瘤;间皮瘤,恶性;无性细胞瘤;胚胎癌;畸胎瘤,恶性;卵巢肿瘤,恶性;绒毛膜癌;中肾瘤,恶性;血管肉瘤;血管内皮瘤,恶性;卡波西肉瘤;血管外皮细胞瘤,恶性;淋巴管;骨肉瘤;皮质骨肉瘤;软骨肉瘤;软骨母细胞瘤,恶性;间充质软骨肉瘤;骨巨细胞瘤;尤因的肉瘤;牙源性肿瘤,恶性;成釉细胞牙肉瘤;成釉细胞瘤,恶性;成釉细胞纤维肉瘤;松果体,恶性;脊索瘤;胶质瘤,恶性;室管膜瘤;星形细胞瘤;原生质星形细胞瘤;原纤维星形细胞瘤;星形母细胞瘤;胶质母细胞瘤;少突胶质细胞;成少突神经胶质细胞瘤;原始神经外胚层;小脑肉瘤;神经节;神经母细胞瘤;视网膜母细胞瘤;嗅神经源性肿瘤;脑膜瘤,恶性;神经纤维;神经鞘瘤,恶性;颗粒细胞瘤,恶性;恶性淋巴瘤;霍奇金病;霍奇金淋巴瘤;副肉芽肿;恶性淋巴瘤,小淋巴细胞;恶性淋巴瘤,大细胞,弥漫性;恶性淋巴瘤,滤泡;蕈样真菌病;其他指定的非霍奇金淋巴瘤;恶性组织细胞病;多发性骨髓瘤;肥大细胞肉瘤;免疫增殖性小肠疾病;白血病;淋巴白血病;浆细胞白血病;红;淋巴肉瘤细胞白血病;髓样白血病;嗜碱性白血病;嗜酸粒细胞白血病;单核细胞白血病;肥大细胞白血病;巨核细胞白血病;骨髓肉瘤;和毛细胞白血病。
在某些实施方案中,施用于受试者的药物组合物中的抗体、tcr或car对癌症相关抗原的表位(例如由待治疗的癌症表达的表位)具有结合特异性。癌症相关抗原的实例包括但不限于亲脂素(adipophilin),aim-2,aldh1a1,α-辅肌动蛋白-4,甲胎蛋白(“afp”),artc1,b-raf,bage-1,bclx(l),bcr-abl融合蛋白b3a2,β-连环蛋白,bing-4,ca-125,calca,癌胚抗原(“cea”),casp-5,casp-8,cd274,cd45,cdc27,cdk12,cdk4,cdkn2a,cea,clpp,coa-1,cpsf,csnk1a1,ctag1,ctag2,细胞周期蛋白d1,细胞周期蛋白a1,dek-can融合蛋白,dkk1,eftud2,伸长因子2,enah(hmena),ep-cam,epcam,epha3,上皮肿瘤抗原(“eta”),etv6-aml1融合蛋白,ezh2,fgf5,flt3-itd,fn1,g250/mn/caix,gage-1、2、8,gage-3、4、5、6、7,gas7,磷脂酰肌醇蛋白聚糖-3,gntv,gp100/pmel17,gpnmb,haus3,hepsin,her-2/neu,herv-k-mel,hla-a11,hla-a2,hla-dob,hsp70-2,ido1,igf2b3,il13ralpha2,肠羧基酯酶,k-ras,激肽释放酶4,kif20a,kk-lc-1,kklc1,km-hn-1,kmhn1也称为ccdc110,lage-1,ldlr-岩藻糖基转移酶as融合蛋白,lengsin,m-csf,mage-a1,mage-a10,mage-a12,mage-a2,mage-a3,mage-a4,mage-a6,mage-a9,mage-c1,mage-c2,苹果酸酶,乳房珠蛋白-a,mart2,matn,mc1r,mcsp,mdm-2,me1,melan-a/mart-1,meloe,midkine,mmp-2,mmp-7,muc1,muc5ac,粘蛋白,mum-1,mum-2,mum-3,肌球蛋白,i-肌球蛋白,n-raw,na88-a,neo-pap,nfyc,ny-br-1,ny-eso-1/lage-2,oa1,ogt,os-9,p多肽,p53,pap,pax5,pbf,pml-rarα融合蛋白,多态性上皮粘蛋白(“pem”),ppp1r3b,prame,prdx5,psa,psma,ptprk,rab38/ny-mel-1,rage-1,rbaf600,rgs5,rhoc,rnf43,ru2as,sage,secernin1,sirt2,snrpd1,sox10,sp17,spa17,ssx-2,ssx-4,steap1,存活素(survivin),syt-ssx1或-ssx2融合蛋白,tag-1,tag-2,端粒酶,tgf-betarii,tpbg,trag-3,磷酸丙糖异构酶,trp-1/gp75,trp-2,trp2-int2,酪氨酸酶,酪氨酸酶(“tyr”),vegf,wt1,xage-1b/gaged2a。在一些实施方案中,抗原是新抗原。
在某些实施方案中,本文提供治疗患有感染的受试者的方法,包括病毒感染、真菌感染、细菌感染、蠕虫感染或原生动物感染,包括向所述受试者施用本文所述的药物组合物(例如包含本文所述的抗体、tcr或car的药物组合物,其获自本文所述的非人动物)。病毒感染性疾病的非限制性实例包括hpv、hbv、丙型肝炎病毒(hcv)、逆转录病毒如人免疫缺陷病毒(hiv-1和hiv-2)、疱疹病毒如epsteinbarr病毒(ebv)、巨细胞病毒(cmv)、hsv-1和hsv-2以及流感病毒。寄生虫感染的非限制性实例是疟疾。细菌、真菌和其他致病性疾病的非限制性实例包括曲霉菌,布鲁丝虫,假丝酵母,衣原体,球虫,隐球菌,恶丝虫,淋球菌,组织胞浆菌,利什曼原虫,分枝杆菌,支原体,草履虫,百日咳,疟原虫,肺炎球菌,肺孢子虫,立克次氏体,沙门氏菌,志贺氏菌,葡萄球菌,链球菌,弓形虫和虎列拉菌。示例性种包括淋病奈瑟氏球菌,结核分枝杆菌,白色念珠菌,热带假丝酵母,阴道毛滴虫,阴道嗜血杆菌,b组链球菌属,人支原体(microplasmahominis),杜氏血吸虫,肉芽肿,沙滴氏淋巴,梅毒螺旋体,流产布鲁氏菌,马尔他布鲁氏杆菌,猪布鲁氏杆菌,犬布鲁氏菌,胎儿弯曲杆菌,肠球菌弯曲杆菌,钩端螺旋体,单核细胞增生李斯特菌,羊布氏杆菌,鹦鹉热衣原体,胎儿毛滴虫,弓形虫,大肠杆菌,马齿苋,产气螨沙门氏菌,产气嗜血杆菌,铜绿假单胞菌,马棒状杆菌,化脓棒状杆菌,精子放线杆菌,mycoplasmabovigenitalium,烟曲霉菌,犁头霉菌,马媾疫锥虫,驽巴贝斯虫,破伤风杆菌,肉毒杆菌;或者,真菌,例如巴西副球孢子菌;或其他病原体,例如恶性疟原虫(plasmodiumfalciparum)。
在某些实施方案中,施用于受试者的药物组合物中的抗体、tcr或car对由感染性病原体表达的抗原的表位(例如由待治疗的感染性病原体表达的表位)具有结合特异性。
在一些实施方案中,本文提供治疗炎性疾病、皮肤或器官移植排斥、移植物抗宿主病(gvhd)或自身免疫疾病的方法,其包括向受试者施用本文所述的药物组合物(例如包含本文所述的抗体、tcr或car的药物组合物,其获自本文所述的非人动物)。自身免疫疾病的实例包括,例如,肾小球肾炎,关节炎,扩张性心肌病样疾病,溃疡性结肠炎,干燥综合征,克罗恩病,全身性红斑,慢性类风湿性关节炎,多发性硬化,牛皮癣,过敏性接触性皮炎,多发性肌炎,厚皮病,结节性动脉周围炎,风湿热,寻常性白癜风,胰岛素依赖型糖尿病,behcet病,桥本病,艾迪生病,皮肌炎,重症肌无力,reiter综合征,格雷夫斯病,贫血症,goodpasture综合征,不孕症,慢性活动性肝炎,天疱疮,自身免疫血小板减少性紫癜,自身免疫性溶血性贫血,活动性慢性肝炎,艾迪生病,抗磷脂综合征,特应性过敏,自身免疫性萎缩性胃炎,甲醇自身免疫,乳糜泻,库欣综合征,皮肌炎,盘状狼疮,红斑,goodpasture综合征,桥本氏甲状腺炎,特发性肾上腺萎缩,身份顺势疗法血小板减少症,胰岛素依赖型糖尿病,lambert-eaton综合征,狼疮性肝炎,某些淋巴细胞减少症,混合性结缔组织病,类天疱疮,寻常性天疱疮,恶性贫血,致癌性葡萄膜炎,结节性多动脉炎,多发性自发性肾炎,原发性胆汁性肝硬化,原发性硬化性胆管炎,雷诺综合征,复发性多软骨炎,施密特综合征,有限硬皮病(或嵴综合征),交感性眼炎,系统性红斑狼疮,大动脉炎,颞动脉炎,甲状腺毒症,b型胰岛素抵抗,溃疡性结肠炎和韦格纳肉芽肿病。
在某些实施方案中,施用于受试者的药物组合物中的抗体、tcr或car对待治疗疾病中的自身反应性t细胞的靶标(例如自身免疫疾病中自身反应性t细胞靶向的表位)具有结合特异性。自身反应性t细胞靶向的示例性蛋白质包括例如p205、胰岛素、促甲状腺激素、酪氨酸酶、trp1和髓磷脂。
本文所述的药物组合物可通过任何合适的给药途径递送,包括口服,鼻腔给药,例如通过喷雾,直肠,阴道内,肠胃外,脑池内和局部给药,如通过粉末、软膏或滴剂,包括口腔和舌下含服。在某些实施方案中,通常(例如,通过口服或肠胃外给药)递送药物组合物。
可改变本文所述药物组合物中活性成分的实际剂量水平,以获得对于特定患者、组合物和给药方式实现期望治疗反应有效的活性成分的量,而对患者无毒性。
所选择的剂量水平取决于多种因素,包括所用特定药剂的活性、给药途径、给药时间、所用特定化合物的排泄或代谢速率、治疗持续时间、与所用特定化合物组合使用的其他药物、化合物和/或材料、所治疗患者的年龄、性别、体重、状况、一般健康状况和既往病史,以及医学领域中众所周知的类似因素。
在一些实施方案中,本文描述的car和/或tcr用于基于t细胞的疗法。例如,在某些实施方案中,将表达本文所述的car和/或tcr的t细胞施用于受试者以在受试者中诱导基于t细胞的免疫应答。可用于基于t细胞的疗法的方法描述于例如schumachernat.rev.immunol.2:512-519(2002)和bitton等人,frontiersinbioscience4:d386-393(1999),其各自通过引用结合到本文中。
在一些方面,本文提供了在受试者中诱导免疫应答(例如基于t细胞的免疫应答)的方法。在一些实施方案中,该方法包括向受试者施用表达本文所述的car或tcr的细胞(例如人t细胞,例如cd4t细胞或cd8t细胞)。
在一些实施方案中,受试者是有此需要的受试者。在一些实施方案中,受试者是患有癌症的受试者或感染病原体的受试者。在此类实施方案中,car或tcr识别的肽/mhc复合物中的肽是癌抗原的肽或来自由感染性病原体表达的抗原的肽。
在一些方面,本文提供了抑制受试者中的免疫应答的方法。在一些实施方案中,该方法包括向受试者施用表达所述car或tcr的调节性t细胞(例如cd4+、cd-25+和foxp3+调节性t细胞或treg17t细胞)。
在一些实施方案中,受试者是有此需要的受试者,例如患有自身免疫疾病的受试者。在此类实施方案中,t细胞是调节性t细胞(即抑制性t细胞),并且由tcr或car识别的肽/mhc复合物中的肽是受试者正经历自身免疫应答的自身抗原。
核酸分子
本文提供了编码本文所述的抗体、tcr或car和/或本文所述的抗体、tcr和car的部分的核酸分子。在一些实施方案中,核酸编码本文所述的抗体、tcr或car的可变结构域。核酸分子可以存在为例如全细胞、细胞裂解物或部分纯化或基本纯的形式。
在某些方面,本文提供了编码本文所述的抗体、tcr和/或car多肽或其部分的核酸。核酸可以存在为例如全细胞、细胞裂解物或部分纯化或基本纯的形式。本文描述的核酸可使用标准分子生物学技术获得。例如,可以使用标准pcr技术克隆本文所述的核酸分子,或化学合成。对于编码由杂交瘤表达的car、tcr或抗体的核酸,可以通过标准pcr扩增或cdna克隆技术获得编码由杂交瘤制备的抗体、tcr或car的每条链的cdna。
在某些实施方案中,本文提供了含有本文所述核酸分子的载体。如本文所用,术语“载体”是指能够转运与其连接的另一核酸的核酸分子。一种类型的载体是“质粒”,其是指环状双链dna环,其中可以连接额外的dna区段。另一种类型的载体是病毒载体,其中额外的dna区段可以连接到病毒基因组中。某些载体能够在引入它们的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体和附加型哺乳动物载体)。其他载体(例如,非附加型哺乳动物载体)可以在引入宿主细胞后整合到宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些载体能够指导基因的表达。此类载体在本文中称为“重组表达载体”(或简称为“表达载体”)。
在某些实施方案中,本文提供了含有本文所述核酸(例如,编码本文所述抗体、tcr或car的核酸或其部分)的细胞。细胞可以是例如原核的、真核的、哺乳动物的、禽类的、鼠类和/或人的。在某些实施方案中,本文描述的核酸与转录控制元件(例如启动子)可操作地连接。在一些实施方案中,细胞转录本文所述的核酸,从而表达本文所述的抗体、其抗原结合片段或多肽。核酸分子可以整合到细胞的基因组中,或者它可以是染色体外的。
本文提供的核酸分子可使用标准分子生物学技术获得。例如,可以使用标准pcr技术克隆本文所述的核酸分子,或化学合成。
对于本文所述的抗体和car核酸,一旦获得编码vh和vl区段的dna片段,可以通过标准重组dna技术进一步操作这些dna片段,例如将可变区基因转换为全长抗体链基因、fab片段基因或scfv基因。在这些操作中,编码vl或vh的dna片段与编码另一种蛋白质的另一种dna片段可操作地连接,例如抗体恒定区或柔性接头。在本文中使用的术语“可操作地连接”旨在表示两个dna片段连接使得由两个dna片段编码的氨基酸序列保持符合读框。
通过将重链可变区dna与编码重链恒定区(例如ch1、ch2和ch3)的另一dna分子可操作地连接,可以将编码重链可变区的分离的dna转化为全长重链基因。人重链恒定区基因的序列是本领域已知的(参见例如kabat,e.a.等人,(1991)sequencesofproteinsofimmunologicalinterest,fifthedition,u.s.departmentofhealthandhumanservices,nihpublicationno.91-3242,或lefranc,theimmunoglobulinhandbook,london:academicpress2001)和包含这些区域的dna片段可以是通过标准pcr扩增获得。重链恒定区可以是igg1、igg2、igg3、igg4、iga、ige、igm或igd恒定区。对于fab片段重链基因,vh编码dna可以与仅编码重链ch1恒定区的另一dna分子可操作地连接。
通过将编码轻链可变区的dna与编码轻链恒定区的另一dna分子可操作地连接,可以将编码轻链可变区的分离的dna转化为全长轻链基因(以及fab轻链基因)。人轻链恒定区基因的序列是本领域已知的(参见例如kabat,e.a.等人,(1991)sequencesofproteinsofimmunologicalinterest,fifthedition,u.s.departmentofhealthandhumanservices,nihpublicationno.91-3242,或lefranc,theimmunoglobulinhandbook,london:academicpress2001)和包含这些区域的dna片段可以是通过标准pcr扩增获得。轻链恒定区可以是κ或λ恒定区。
其他示例性实施方案
在示例性实施方案1中,本文提供了遗传修饰的非人动物,其在其基因组中包含编码人末端脱氧核苷酸转移酶(htdt)的核酸序列。
在示例性实施方案2中,本文提供了实施方案1的遗传修饰的非人动物,其中编码htdt的核酸序列与转录控制元件可操作地连接。
在示例性实施方案3中,本文提供了实施方案2的遗传修饰的非人动物,其中转录控制元件驱动编码htdt的核酸序列在pro-b细胞和/或pre-b细胞中的表达。
在示例性实施方案4中,本文提供了实施方案2的遗传修饰的非人动物,其中转录控制元件选自rag1转录控制元件、rag2转录控制元件、免疫球蛋白重链转录控制元件、免疫球蛋白κ轻链转录控制元件和/或免疫球蛋白λ轻链转录控制元件。
在示例性实施方案5中,本文提供了实施方案1至4中任一个的遗传修饰的非人动物,其中所述非人动物在pro-b细胞和/或pre-b细胞中表达htdt。
在示例性实施方案6中,本文提供了实施方案2的遗传修饰的非人动物,其中转录控制元件驱动编码htdt的核酸序列在cd4/cd8双阴性(dn)胸腺细胞和/或cd4/cd8双阳性(dp)胸腺细胞中的表达。。
在示例性实施方案7中,本文提供了实施方案2的遗传修饰的非人动物,其中转录控制元件是rag1转录控制元件、rag2转录控制元件、tcrα转录控制元件、tcrβ转录控制元件、tcrγ转录控制元件和/或tcrδ转录控制元件。
在示例性实施方案8中,本文提供了实施方案1至7中任一个的遗传修饰的非人动物,其中所述非人动物在dn胸腺细胞和/或dp胸腺细胞中表达htdt。
在示例性实施方案9中,本文提供了实施方案1至8中任一个的遗传修饰的非人动物,其中编码htdt的核酸序列位于免疫球蛋白κ轻链基因座、免疫球蛋白λ轻链基因座、免疫球蛋白重链基因座、rag1基因座、rag2基因座、tcrα链基因座、tcrβ链基因座、tcrγ链基因座和/或tcrδ链基因座。
在示例性实施方案10中,本文提供了实施方案1至9中任一个的遗传修饰的非人动物,其中编码htdt的核酸序列不与组成型转录控制元件可操作地连接。
在示例性实施方案11中,本文提供了实施方案1至10中任一个的遗传修饰的非人动物,其中htdt不是组成型表达的。
在示例性实施方案12中,本文提供了实施方案1至11中任一个的遗传修饰的非人动物,其中动物中至少10%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案13中,本文提供了实施方案12的遗传修饰的非人动物,其中动物中至少20%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案14中,本文提供了实施方案12的遗传修饰的非人动物,其中动物中至少40%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案15中,本文提供了遗传修饰的非人动物,其在其基因组中包含:编码外源末端脱氧核苷酸转移酶(tdt)的核酸序列;和免疫球蛋白可变区,其包含与免疫球蛋白恒定区基因可操作连接的未经重排的人免疫球蛋白可变区基因区段。
在示例性实施方案16中,本文提供了实施方案15的遗传修饰的非人动物,其中外源tdt是人tdt。
在示例性实施方案17中,本文提供了实施方案15或16的遗传修饰的非人动物,其中编码外源tdt的核酸序列与转录控制元件可操作地连接。
在示例性实施方案18中,本文提供了实施方案17的遗传修饰的非人动物,其中转录控制元件驱动编码外源性tdt的核酸序列在pro-b细胞和/或前b细胞中的表达。
在示例性实施方案19中,本文提供了实施方案17的遗传修饰的非人动物,其中转录控制元件选自rag1转录控制元件、rag2转录控制元件、免疫球蛋白重链转录控制元件、免疫球蛋白κ轻链转录控制元件和/或免疫球蛋白λ轻链转录控制元件。
在示例性实施方案20中,本文提供了实施方案15-19中任一个的经遗传修饰的非人动物,其中所述非人动物在pro-b细胞和/或pre-b细胞中表达外源性tdt。
在示例性实施方案21中,本文提供了实施方案17的遗传修饰的非人动物,其中转录控制元件驱动编码cd4/cd8双阴性(dn)胸腺细胞和/或cd4/cd8双阳性(dp)胸腺细胞中的外源性tdt的核酸序列的表达。
在示例性实施方案22中,本文提供了实施方案17的遗传修饰的非人动物,其中转录控制元件是rag1转录控制元件或rag2转录控制元件。
在示例性实施方式23中,本文提供了实施方案15至22中任一个的遗传修饰的非人动物,其中所述非人动物在dn胸腺细胞和/或dp胸腺细胞中表达外源性tdt。
在示例性实施方案24中,本文提供了实施方案15至23中任一个的遗传修饰的非人动物,其中编码外源性tdt的核酸序列位于免疫球蛋白κ轻链基因座、免疫球蛋白λ轻链基因座、免疫球蛋白重链基因座、rag1基因座、rag2基因座、tcrα链基因座、tcrβ链基因座、tcrγ链基因座和/或tcrδ链基因座。
在示例性实施方案25中,本文提供了实施方案15至24中任一个的遗传修饰的非人动物,其中编码外源tdt的核酸序列不与组成型转录控制元件可操作地连接。
在示例性实施方案26中,本文提供了实施方案15至25中任一个的经遗传修饰的非人动物,其中外源性tdt不是组成型表达的。
在示例性实施方式27中,本文提供了实施方案15至26中任一个的遗传修饰的非人动物,其中动物中至少10%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案28中,本文提供了实施方案27的遗传修饰的非人动物,其中动物中至少20%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案29中,本文提供了实施方案27的遗传修饰的非人动物,其中动物中至少40%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案30中,本文提供了实施方案15-26中任一个的经遗传修饰的非人动物,其中人免疫球蛋白可变区基因区段是人重链可变区基因区段。
在示例性实施方式31中,本文提供了实施方案30的遗传修饰的非人动物,其中恒定区基因是重链恒定区基因。
在示例性实施方式32中,本文提供了实施方案31的遗传修饰的非人动物,其中重链恒定区基因是cμ基因、cδ基因、cγ基因、cε基因或cα基因。
在示例性实施方案33中,本文提供了实施方案31或32的遗传修饰的非人动物,其中重链恒定区基因来源于内源物种。
在示例性实施方案34中,本文提供了实施方案31或32的遗传修饰的非人动物,其中重链恒定区基因是小鼠恒定区基因。
在示例性实施方案35中,本文提供了实施方案31或32的遗传修饰的非人动物,其中重链恒定区基因是大鼠恒定区基因。
在示例性实施方案36中,本文提供了实施方案31或32的遗传修饰的非人动物,其中重链恒定区基因是人恒定区基因。
在示例性实施方案37中,本文提供了实施方案31或32的遗传修饰的非人动物,其中重链恒定区基因具有人ch1结构域和非人ch2和ch3结构域。
在示例性实施方案38中,本文提供了实施方案37的遗传修饰的非人动物,其中非人ch2和ch3结构域来源于内源物种。
在示例性实施方式39中,本文提供了实施方式37的遗传修饰的非人动物,其中非人ch2和ch3结构域是小鼠ch2和ch3结构域。
在示例性实施方案40中,本文提供了实施方案37的遗传修饰的非人动物,其中非人ch2和ch3结构域是大鼠ch2和ch3结构域。
在示例性实施方案10中,本文提供了实施方案15-40的遗传修饰的非人动物,其中所述动物在选自igg、iga、ige、igd或其组合的免疫球蛋白重链恒定区中缺乏功能性ch1结构域。
在示例性实施方案20中,本文提供了实施方案31至41中任一个的遗传修饰的非人动物,其中免疫球蛋白可变区和免疫球蛋白恒定区基因位于内源免疫球蛋白重链基因座。
在示例性实施方案43中,本文提供了实施方案30至42中任一个的遗传修饰的非人动物,其在其基因组中还包含免疫球蛋白可变区,其包含与第二免疫球蛋白恒定区基因可操作地连接的未重排的人轻链可变区基因区段。
在示例性实施方案44中,本文提供了实施方案43的遗传修饰的非人动物,其中与第二免疫球蛋白恒定区基因可操作地连接的人免疫球蛋白可变区基因区段是人κ链可变区基因区段。
在示例性实施方案45中,本文提供了实施方案43的遗传修饰的非人动物,其中与第二免疫球蛋白恒定区基因可操作地连接的人免疫球蛋白可变区基因区段是人λ链可变区基因区段。
在示例性实施方案46中,本文提供了实施方案43至45中任一个的遗传修饰的非人动物,其中第二恒定区基因是轻链恒定区基因。
在示例性实施方式47中,本文提供了实施方式46的遗传修饰的非人动物,其中第二恒定区基因是κ恒定区基因。
在示例性实施方案48中,本文提供了实施方案46的遗传修饰的非人动物,其中第二恒定区基因是λ恒定区基因。
在示例性实施方案49中,本文提供了实施方案43至48中任一个的遗传修饰的非人动物,其中第二恒定区基因是内源物种来源。
在示例性实施方案50中,本文提供了实施方案43至48中任一个的遗传修饰的非人动物,其中第二恒定区基因是小鼠恒定区基因。
在示例性实施方案51中,本文提供了实施方案43至48中任一个的遗传修饰的非人动物,其中第二恒定区基因是大鼠恒定区基因。
在示例性实施方案52中,本文提供了实施方案43至48中任一个的遗传修饰的非人动物,其中第二恒定区基因是人恒定区基因。
在示例性实施方案53中,本文提供了实施方案43至52中任一个的遗传修饰的非人动物,其中与第二免疫球蛋白恒定区基因可操作地连接的免疫球蛋白可变区位于内源免疫球蛋白轻链基因座。
在示例性实施方案54中,本文提供了实施方案53的遗传修饰的非人动物,其中第二恒定区基因是κ恒定区基因,并且内源免疫球蛋白轻链基因座是免疫球蛋白κ基因座。
在示例性实施方案55中,本文提供了实施方案53的遗传修饰的非人动物,其中第二恒定区基因是λ恒定区基因,并且内源免疫球蛋白轻链基因座是免疫球蛋白λ基因座。
在示例性实施方案56中,本文提供了实施方案30至42中任一个的遗传修饰的非人动物,其在其基因组中还包含免疫球蛋白可变区,其包含可操作地连接至第二个免疫球蛋白恒定区基因的重排的人轻链可变区(v/j)基因区段。
在示例性实施方案57中,本文提供了实施方案56的遗传修饰的非人动物,其中与第二免疫球蛋白恒定区基因可操作地连接的重排的人轻链可变区(v/j)基因区段包含选自vκ1-39和vκ3-20的重排为jκ基因区段的vκ基因区段。
在示例性实施方案58中,本文提供了实施方案57的遗传修饰的非人动物,其中动物在其基因组中包含免疫球蛋白轻链可变区,其包含vκ1-39/jκ5或vκ3-20/jκ1序列。
在示例性实施方案59中,本文提供了实施方案30至42中任一个的遗传修饰的非人动物,其在其基因组中还包含免疫球蛋白可变区,其包含可操作地连接第二免疫球蛋白恒定区基因的人轻链可变区(v和j)基因区段的有限库。
在示例性实施方案60中,本文提供了实施方案59的遗传修饰的非人动物,其中与第二免疫球蛋白恒定区基因可操作地连接的人轻链可变区(v和j)基因区段的有限库包含两个v基因区段和至少两个、优选五个j基因区段。
在示例性实施方案61中,本文提供了实施方案60的遗传修饰的非人动物,其中两个v基因区段是vk1-39和vk3-20基因区段。
在示例性实施方案62中,本文提供了实施方案15至29中任一个的遗传修饰的非人动物,其中人免疫球蛋白可变区基因区段是人轻链可变区基因区段。
在示例性实施方案63中,本文提供了实施方案62的遗传修饰的非人动物,其中人免疫球蛋白可变区基因区段是人κ链可变区基因区段。
在示例性实施方案64中,本文提供了实施方案63的遗传修饰的非人动物,其中人免疫球蛋白可变区基因区段是人λ链可变区基因区段。
在示例性实施方案65中,本文提供了实施方案62至64中任一个的遗传修饰的非人动物,其中恒定区基因是轻链恒定区基因。
在示例性实施方案66中,本文提供了实施方案65的遗传修饰的非人动物,其中恒定区基因是κ恒定区基因。
在示例性实施方案67中,本文提供了实施方案65的遗传修饰的非人动物,其中恒定区基因是λ恒定区基因。
在示例性实施方案68中,本文提供了实施方案62至64中任一个的遗传修饰的非人动物,其中恒定区基因是重链恒定区基因。
在示例性实施方案69中,本文提供了实施方案62至68中任一个的遗传修饰的非人动物,其中恒定区基因是内源物种来源。
在示例性实施方案70中,本文提供了实施方案62至68中任一个的遗传修饰的非人动物,其中恒定区基因是小鼠恒定区基因。
在示例性实施方案71中,本文提供了实施方案62至68中任一个的遗传修饰的非人动物,其中恒定区基因是大鼠恒定区基因。
在示例性实施方案72中,本文提供了实施方案62至68中任一个的遗传修饰的非人动物,其中恒定区基因是人恒定区基因。
在示例性实施方案73中,本文提供了实施方案62至72中任一个的遗传修饰的非人动物,其中免疫球蛋白可变区和免疫球蛋白恒定区基因位于内源免疫球蛋白轻链基因座。
在示例性实施方案74中,本文提供了实施方案73的遗传修饰的非人动物,其中恒定区基因是κ恒定区基因,并且内源免疫球蛋白轻链基因座是免疫球蛋白κ基因座。
在示例性实施方案75中,本文提供了实施方案73的遗传修饰的非人动物,其中恒定区基因是λ恒定区基因,内源免疫球蛋白轻链基因座是免疫球蛋白λ基因座。
在示例性实施方案76中,本文提供了实施方案15至75中任一个的遗传修饰的非人动物,其中免疫球蛋白可变区包含人源的免疫球蛋白可变区基因间序列。
在示例性实施方案77中,本文提供了实施方案15至75中任一个的遗传修饰的非人动物,其中免疫球蛋白可变区包含内源物种来源的免疫球蛋白可变区基因间序列。
在示例性实施方案78中,本文提供了实施方案15至75中任一个的遗传修饰的非人动物,其中免疫球蛋白可变区包含小鼠来源的免疫球蛋白可变区基因间序列。
在示例性实施方案79中,本文提供了实施方案15至75中任一个的遗传修饰的非人动物,其中免疫球蛋白可变区包含大鼠来源的免疫球蛋白可变区基因间序列。
在示例性实施方案80中,本文提供了实施方案15至79中任一个的遗传修饰的非人动物,其在其基因组中还包含灭活的内源免疫球蛋白基因座。
在示例性实施方案81中,本文提供了实施方案80的遗传修饰的非人动物,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白重链基因座。
在示例性实施方案82中,本文提供了实施方案81的遗传修饰的非人动物,其中通过缺失内源重链基因座的至少部分可变区来灭活内源免疫球蛋白重链基因座。
在示例性实施方式83中,本文提供了实施方式82的遗传修饰的非人动物,其中至少部分可变区的缺失包括缺失可变区的j基因区段。
在示例性实施方案84中,本文提供了实施方案81的遗传修饰的非人动物,其中通过缺失内源重链基因座的至少部分恒定区来使内源免疫球蛋白重链基因座灭活。
在示例性实施方案85中,本文提供了实施方案84的遗传修饰的非人动物,其中至少部分恒定区的缺失包括缺失恒定区的cμ基因。
在示例性实施方案86中,本文提供了实施方案80的遗传修饰的非人动物,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白κ链基因座。
在示例性实施方案87中,本文提供了实施方案86的遗传修饰的非人动物,其中通过缺失内源κ链基因座的至少部分可变区来使内源免疫球蛋白κ链基因座灭活。
在示例性实施方案88中,本文提供了实施方案87的遗传修饰的非人动物,其中至少部分可变区的缺失包括缺失可变区的j基因区段。
在示例性实施方案89中,本文提供了实施方案86的遗传修饰的非人动物,其中通过缺失内源κ链基因座的至少部分恒定区来使内源免疫球蛋白κ基因座灭活。
在示例性实施方案90中,本文提供了实施方案89的遗传修饰的非人动物,其中至少部分恒定区的缺失包括缺失恒定区的cκ基因。
在示例性实施方案91中,本文提供了实施方案80的遗传修饰的非人动物,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白λ链基因座。
在示例性实施方案92中,本文提供了实施方案91的遗传修饰的非人动物,其中内源免疫球蛋白λ链基因座通过缺失内源λ链基因座的v-j-c簇的至少一部分而灭活。
在示例性实施方案93中,本文提供了实施方案15至92中任一个的遗传修饰的非人动物,其中未重排的人免疫球蛋白可变区基因区段在b细胞发育期间经历重排以在非人动物的b细胞中产生重排的可变区基因。
在示例性实施方案94中,本文提供了实施方案93的遗传修饰的非人动物,其中至少10%的重排可变区基因包含非模板添加物。
在示例性实施方案95中,本文提供了实施方案93的遗传修饰的非人动物,其中至少20%的重排可变区基因包含非模板添加物。
在示例性实施方案96中,本文提供了实施方案93的遗传修饰的非人动物,其中至少40%的重排可变区基因包含非模板添加物。
在示例性实施方案97中,本文提供了实施方案93至96中任一个的遗传修饰的非人动物,其中所述动物表达包含由重排的可变区基因编码的可变结构域和由恒定区基因编码的恒定结构域的抗体。。
在示例性实施方案98中,本文提供了实施方案15至97中任一个的遗传修饰的非人动物,其进一步包含功能性异位小鼠adam6基因。
在示例性实施方案99中,本文提供了遗传修饰的非人动物,其在其基因组中包含:编码外源末端脱氧核苷酸转移酶(tdt)的核酸序列;和t细胞受体(tcr)可变区,其包含与tcr恒定区基因可操作连接的未重排的人tcr可变区基因区段。
在示例性实施方案100中,本文提供了实施方案99的遗传修饰的非人动物,其中外源tdt是人tdt。
在示例性实施方案101中,本文提供了实施方案99或100的遗传修饰的非人动物,其中编码外源tdt的核酸序列与转录控制元件可操作地连接。
在示例性实施方案102中,本文提供了实施方案101的遗传修饰的非人动物,其中转录控制元件驱动编码cd4/cd8双阴性(dn)胸腺细胞和/或cd4/cd8双阳性(dp)胸腺细胞中的外源性tdt的核酸序列的表达。
在示例性实施方案103中,本文提供了实施方案101的遗传修饰的非人动物,其中转录控制元件是rag1转录控制元件、rag2转录控制元件、tcrα转录控制元件、tcrβ转录控制元件、tcrγ转录控制元件和/或tcrδ转录控制元件。
在示例性实施方案104中,本文提供了实施方案99至103中任一个的遗传修饰的非人动物,其中所述非人动物在dn胸腺细胞和/或dp胸腺细胞中表达外源性tdt。
在示例性实施方案105中,本文提供了实施方案99至104中任一个的遗传修饰的非人动物,其中编码外源tdt的核酸序列位于rag1基因座、rag2基因座、tcrα链基因座、tcrβ链基因座、tcrγ链基因座和/或tcrδ链基因座。
在示例性实施方案106中,本文提供了实施方案99至105中任一个的遗传修饰的非人动物,其中编码外源性tdt的核酸序列不与组成型转录控制元件可操作地连接。
在示例性实施方案107中,本文提供了实施方案99至106中任一个的遗传修饰的非人动物,其中外源性tdt不是组成型表达的。
在示例性实施方案108中,本文提供了实施方案99至107中任一个的遗传修饰的非人动物,其中人tcr可变区基因区段是人tcrα可变区基因区段。
在示例性实施方案109中,本文提供了实施方案99至107中任一个的遗传修饰的非人动物,其中人tcr可变区基因区段是人tcrβ可变区基因区段。
在示例性实施方案110中,本文提供了实施方案99至108中任一个的遗传修饰的非人动物,其中tcr恒定区基因是tcrα恒定区基因。
在示例性实施方案111中,本文提供了实施方案99至107和109中任一个的遗传修饰的非人动物,其中tcr恒定区基因是tcrβ恒定区基因。
在示例性实施方案112中,本文提供了实施方案99至111中任一个的遗传修饰的非人动物,其中tcr恒定区基因是内源物种来源。
在示例性实施方案113中,本文提供了实施方案99至111中任一个的遗传修饰的非人动物,其中tcr恒定区基因是小鼠恒定区基因。
在示例性实施方案114中,本文提供了实施方案99至111中任一个的遗传修饰的非人动物,其中tcr恒定区基因是大鼠恒定区基因。
在示例性实施方案115中,本文提供了实施方案99至111中任一个的遗传修饰的非人动物,其中tcr恒定区基因是人恒定区基因。
在示例性实施方案116中,本文提供了实施方案99至115中任一个的遗传修饰的非人动物,其中tcr可变区和tcr恒定区基因位于内源性tcr基因座。
在示例性实施方案117中,本文提供了实施方案99至108、110、112-115中任一个的遗传修饰的非人动物,其中内源性tcr基因座是内源性tcrα基因座。
在示例性实施方案118中,本文提供了实施方案99-107、109、111-115中任一个的遗传修饰的非人动物,其中内源tcr基因座是内源性tcrβ基因座。
在示例性实施方案119中,本文提供了实施方案99至118中任一个的遗传修饰的非人动物,其中tcr可变区包含人源的tcr可变区基因间序列。
在示例性实施方案120中,本文提供了实施方案99至118中任一个的遗传修饰的非人动物,其中tcr可变区包含内源物种来源的tcr可变区基因间序列。
在示例性实施方案121中,本文提供了实施方案99至120中任一个的遗传修饰的非人动物,其在其基因组中还包含灭活的内源性tcr基因座。
在示例性实施方案122中,本文提供了实施方案121的遗传修饰的非人动物,其中灭活的内源tcr基因座是tcrα基因座。
在示例性实施方案123中,本文提供了实施方案121的遗传修饰的非人动物,其中灭活的内源tcr基因座是tcrβ基因座。
在示例性实施方案124中,本文提供了实施方案99至123中任一个的遗传修饰的非人动物,其中未重排的人tcr可变区基因区段在t细胞发育期间经历重排以在非人动物的t细胞中产生重排的tcr可变区基因。
在示例性实施方案125中,本文提供了实施方案124的遗传修饰的非人动物,其中至少10%的重排的可变区基因包含非模板添加物。
在示例性实施方案126中,本文提供了实施方案124的遗传修饰的非人动物,其中至少20%的重排可变区基因包含非模板添加物。
在示例性实施方式127中,本文提供了实施方案124的遗传修饰的非人动物,其中至少40%的重排可变区基因包含非模板添加物。
在示例性实施方案128中,本文提供了实施方案124至127中任一个的遗传修饰的非人动物,其中所述动物表达包含由重排的tcr可变区基因编码的可变结构域和由tcr恒定区基因编码的恒定结构域的tcr。
在示例性实施方案129中,本文提供了遗传修饰的非人动物,其在其基因组中包含:编码外源末端脱氧核苷酸转移酶(tdt)的核酸序列;和免疫球蛋白可变区,其包含与tcr恒定区基因可操作连接的未经重排的人免疫球蛋白可变区基因区段。
在示例性实施方案130中,本文提供了实施方案129的遗传修饰的非人动物,其中外源性tdt是人tdt。
在示例性实施方案131中,本文提供了实施方案129或130的遗传修饰的非人动物,其中编码外源tdt的核酸序列与转录控制元件可操作地连接。
在示例性实施方案132中,本文提供了实施方案131的遗传修饰的非人动物,其中转录控制元件驱动编码cd4/cd8双阴性(dn)胸腺细胞和/或cd4/cd8双阳性(dp)胸腺细胞中的外源性tdt的核酸序列的表达。
在示例性实施方案133中,本文提供了实施方案131的遗传修饰的非人动物,其中转录控制元件是rag1转录控制元件、rag2转录控制元件、tcrα转录控制元件、tcrβ转录控制元件、tcrγ转录控制元件和/或tcrδ转录控制元件。
在示例性实施方案134中,本文提供了实施方案131至132中任一个的遗传修饰的非人动物,其中所述非人动物在dn胸腺细胞和/或dp胸腺细胞中表达外源性tdt。
在示例性实施方案135中,本文提供了实施方案129至134中任一个的遗传修饰的非人动物,其中编码外源tdt的核酸序列位于rag1基因座、rag2基因座、tcrα链基因座、tcrβ链基因座、tcrγ链基因座和/或tcrδ链基因座。
在示例性实施方案136中,本文提供了实施方案129至135中任一个的遗传修饰的非人动物,其中编码外源性tdt的核酸序列不与组成型转录控制元件可操作地连接。
在示例性实施方案137中,本文提供了实施方案129至136中任一个的遗传修饰的非人动物,其中外源性tdt不是组成型表达的。
在示例性实施方案138中,本文提供了实施方案129至137中任一个的遗传修饰的非人动物,其中人免疫球蛋白可变区基因区段是人轻链可变区基因区段。
在示例性实施方案139中,本文提供了实施方案138的遗传修饰的非人动物,其中人轻链可变区基因区段是κ基因区段。
在示例性实施方案140中,本文提供了实施方案138的遗传修饰的非人动物,其中人轻链可变区基因区段是λ基因区段。
在示例性实施方案141中,本文提供了实施方案138至140中任一个的遗传修饰的非人动物,其中动物中至少10%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案142中,本文提供了实施方案141的遗传修饰的非人动物,其中动物中至少20%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案143中,本文提供了实施方案141的遗传修饰的非人动物,其中动物中至少40%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案144中,本文提供了实施方案129至137中任一个的遗传修饰的非人动物,其中人免疫球蛋白可变区基因区段是人重链可变区基因区段。
在示例性实施方案145中,本文提供了实施方案129至143中任一个的遗传修饰的非人动物,其中tcr恒定区基因是tcrα恒定区基因。
在示例性实施方案146中,本文提供了实施方案145的遗传修饰的非人动物,其中免疫球蛋白可变区和tcrα恒定区基因位于内源tcrα基因座。
在示例性实施方案147中,本文提供了实施方案144的遗传修饰的非人动物,其中tcr恒定区基因是tcrβ恒定区基因。
在示例性实施方案148中,本文提供了实施方案147的遗传修饰的非人动物,其中免疫球蛋白可变区和tcrβ恒定区基因位于内源性tcrβ基因座。
在示例性实施方案149中,本文提供了实施方案129至148中任一个的遗传修饰的非人动物,其中tcr恒定区基因是内源物种来源。
在示例性实施方案150中,本文提供了实施方案129至148中任一个的遗传修饰的非人动物,其中tcr恒定区基因是小鼠恒定区基因。
在示例性实施方案151中,本文提供了实施方案129至148中任一个的遗传修饰的非人动物,其中tcr恒定区基因是大鼠恒定区基因。
在示例性实施方案152中,本文提供了实施方案129至148中任一个的遗传修饰的非人动物,其中tcr恒定区基因是人恒定区基因。
在示例性实施方案153中,本文提供了实施方案129至152中任一个的遗传修饰的非人动物,其中免疫球蛋白可变区包含人源的免疫球蛋白可变区基因间序列。
在示例性实施方案154中,本文提供了实施方案141-152中任一个的遗传修饰的非人动物,其中免疫球蛋白可变区包含内源物种来源的免疫球蛋白可变区基因间序列。
在示例性实施方案155中,本文提供了实施方案141-152中任一个的遗传修饰的非人动物,其中免疫球蛋白可变区包含小鼠来源的免疫球蛋白可变区基因间序列。
在示例性实施方案156中,本文提供了实施方案141-152中任一个的遗传修饰的非人动物,其中免疫球蛋白可变区包含大鼠来源的免疫球蛋白可变区基因间序列。
在示例性实施方案157中,本文提供了实施方案141-155中任一个的遗传修饰的非人动物,其在其基因组中还包含灭活的内源免疫球蛋白基因座。
在示例性实施方案158中,本文提供了实施方案157的遗传修饰的非人动物,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白重链基因座。
在示例性实施方案159中,本文提供了实施方案158的遗传修饰的非人动物,其中通过缺失内源重链基因座的至少部分可变区来灭活内源免疫球蛋白重链基因座。
在示例性实施方案160中,本文提供了实施方案159的遗传修饰的非人动物,其中至少部分可变区的缺失包括缺失可变区的j基因区段。
在示例性实施方案161中,本文提供了实施方案158的遗传修饰的非人动物,其中通过缺失内源重链基因座的至少部分恒定区来使内源免疫球蛋白重链基因座灭活。
在示例性实施方案162中,本文提供了实施方案161的遗传修饰的非人动物,其中至少部分恒定区的缺失包括缺失恒定区的cμ基因。
在示例性实施方案163中,本文提供了实施方案157的遗传修饰的非人动物,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白κ链基因座。
在示例性实施方案164中,本文提供了实施方案163的遗传修饰的非人动物,其中通过缺失内源κ链基因座的至少部分可变区来使内源免疫球蛋白κ链基因座灭活。
在示例性实施方案165中,本文提供了实施方案164的遗传修饰的非人动物,其中至少部分可变区的缺失包括缺失可变区的j基因区段。
在示例性实施方案166中,本文提供了实施方案163的遗传修饰的非人动物,其中通过缺失内源κ链基因座的至少部分恒定区来使内源免疫球蛋白κ基因座灭活。
在示例性实施方案167中,本文提供了实施方案164的遗传修饰的非人动物,其中至少部分恒定区的缺失包括缺失恒定区的cκ基因。
在示例性实施方案168中,本文提供了实施方案157的遗传修饰的非人动物,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白λ链基因座。
在示例性实施方案169中,本文提供了实施方案168的遗传修饰的非人动物,其中内源免疫球蛋白λ链基因座通过缺失内源λ链基因座的v-j-c簇的至少一部分而灭活。
在示例性实施方案170中,本文提供了实施方案129-169中任一个的遗传修饰的非人动物,其中未重排的人免疫球蛋白可变区基因区段在t细胞发育期间经历重排以在非人动物的t细胞中产生重排的免疫球蛋白可变区基因。
在示例性实施方式171中,本文提供了实施方式170的遗传修饰的非人动物,其中至少10%的重排可变区基因包含非模板添加物。
在示例性实施方式172中,本文提供了实施方式170的遗传修饰的非人动物,其中至少20%的重排可变区基因包含非模板添加物。
在示例性实施方案173中,本文提供了实施方案170的遗传修饰的非人动物,其中至少40%的重排可变区基因包含非模板添加物。
在示例性实施方案174中,本文提供了实施方案170-173中任一个的遗传修饰的非人动物,其中所述动物表达嵌合抗原受体,其包含由重排的可变区基因编码的可变结构域和由tcr恒定区基因编码的恒定结构域。
在示例性实施方案175中,本文提供了实施方案1至174中任一项的遗传修饰的非人动物,其中所述非人动物是哺乳动物。
在示例性实施方案176中,本文提供了实施方案175的遗传修饰的非人动物,其中哺乳动物是啮齿动物。
在示例性实施方案177中,本文提供了实施方案176的遗传修饰的非人动物,其中啮齿动物是大鼠或小鼠。
在示例性实施方案178中,本文提供了实施方案176的遗传修饰的非人动物,其中啮齿动物是小鼠。
在示例性实施方案179中,本文提供了实施方案176的遗传修饰的非人动物,其中啮齿动物是大鼠。
在示例性实施方式180中,本文提供了诱导包含人可变结构域的抗体表达的方法,该方法包括将实施方案97的遗传修饰的非人动物暴露于抗原,使得所述遗传修饰的非人动物产生抗体,其包含对抗原特异的人可变结构域。
在示例性实施方案181中,本文提供了制备表达包含人可变结构域的抗体的b细胞的方法,该方法包括:(a)将实施方案97的遗传修饰的非人动物暴露于抗原;和(b)从非人动物获得表达抗体的b细胞,所述抗体包含对所述抗原具有特异性的人可变结构域。
在示例性实施方案182中,本文提供了制备表达包含人可变结构域的抗体的杂交瘤的方法,该方法包括:(a)将实施方案97的遗传修饰的非人动物暴露于抗原;(b)从非人动物获得表达抗体的b细胞,所述抗体包含对所述抗原特异的人可变结构域;和(c)从步骤(b)的b细胞制备杂交瘤。
在示例性实施方案183中,本文提供了制备编码人免疫球蛋白可变结构域的核酸的方法,该方法包括:(a)将实施方案97的遗传修饰的非人动物暴露于抗原;和(b)从非人动物中获得编码对抗原特异的人免疫球蛋白可变结构域的核酸。
在示例性实施方案184中,本文提供了制备编码人免疫球蛋白可变结构域的核酸的方法,该方法包括:(a)将实施方案97的遗传修饰的非人动物暴露于抗原;(b)从非人动物获得表达抗体的b细胞,所述抗体包含对抗原特异的人可变结构域;(c)从步骤(b)的b细胞制备杂交瘤;和(d)从杂交瘤中获得编码对抗原特异的人免疫球蛋白可变结构域的核酸。
在示例性实施方案185中,本文提供了制备包含人可变结构域和人恒定结构域的抗体的方法,该方法包括:(a)将实施方案97的遗传修饰的非人动物暴露于抗原;(b)从非人动物中获得编码对抗原特异的人免疫球蛋白可变结构域的核酸;(c)将编码免疫球蛋白可变结构域的核酸与编码人免疫球蛋白恒定结构域的核酸在宿主细胞中可操作地连接;和(d)在宿主细胞表达包含免疫球蛋白可变结构域和免疫球蛋白恒定结构域的人抗体的条件下培养宿主细胞。
在示例性实施方案186中,本文提供了制备抗体的方法,所述抗体包含对抗原特异的人可变结构域和人恒定结构域,所述方法包括:(a)将实施方案97的非人动物暴露于抗原;(b)从非人动物获得表达抗体的b细胞,所述抗体包含对抗原特异的人可变结构域;(c)从步骤(b)的b细胞制备杂交瘤;(d)从杂交瘤中获得编码对抗原特异的人免疫球蛋白可变结构域的核酸;(e)将编码免疫球蛋白可变结构域的核酸与编码人免疫球蛋白恒定结构域的核酸在宿主细胞中可操作地连接;和(f)在宿主细胞表达包含免疫球蛋白可变结构域和免疫球蛋白恒定结构域的人抗体的条件下培养宿主细胞。
在示例性实施方案187中,本文提供了制备表达t细胞受体(tcr)的t细胞的方法,所述t细胞受体包含对mhc上呈递的肽特异的人可变结构域,所述方法包括:(a)将实施方案128的遗传修饰的非人动物暴露于包含肽的抗原或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;和(b)从(a)的遗传修饰的非人动物中获得表达对mhc上呈递的肽具有特异性的tcr的t细胞。
在示例性实施方案188中,本文提供了制备表达t细胞受体(tcr)的t细胞杂交瘤的方法,所述t细胞受体包含对mhc上呈递的肽特异的人可变结构域,所述方法包括:(a)将实施方案128的遗传修饰的非人动物暴露于包含肽的抗原或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;(b)从(a)的遗传修饰的非人动物中获得表达对mhc上呈递的肽具有特异性的tcr的t细胞;和(c)从步骤(b)的t细胞制备t细胞杂交瘤。
在示例性实施方案189中,本文提供了制备编码对mhc上呈递的肽特异的人t细胞受体(tcr)可变结构域的核酸的方法,该方法包括:(a)将实施方案128的非人动物暴露于包含肽的抗原或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;(b)从(a)的遗传修饰的非人动物中获得表达对mhc上呈递的肽具有特异性的tcr的t细胞;和(c)从t细胞中分离编码tcr的人tcr可变结构域的核酸。
在示例性实施方案190中,本文提供了制备t细胞受体(tcr)的方法,所述t细胞受体具有对mhc上呈递的肽特异的人可变结构域和人恒定结构域,该方法包括:(a)将实施方案128的非人动物暴露于包含肽的抗原或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;(b)从(a)的遗传修饰的非人动物中获得表达对mhc上呈递的肽具有特异性的tcr的t细胞;(c)从t细胞中分离编码tcr的tcr可变结构域的核酸;和(d)将编码tcr可变结构域的核酸与tcr恒定结构域在细胞中可操作地连接,使得细胞表达包含tcr可变结构域和tcr恒定结构域的tcr。
在示例性实施方案191中,本文提供了制备表达嵌合抗原受体(car)的t细胞的方法,所述嵌合抗原受体包含对mhc上呈递的肽特异的人免疫球蛋白可变结构域和免疫球蛋白恒定结构域,该方法包括:(a)将实施方案174的遗传修饰的非人动物暴露于包含肽的抗原或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;和(b)从(a)的遗传修饰的非人动物中获得表达对mhc上呈递的肽具有特异性的car的t细胞。
在示例性实施方案192中,本文提供了制备表达嵌合抗原受体(car)的t细胞杂交瘤的方法,所述嵌合抗原受体包含对mhc上呈递的肽特异的人mht可变结构域和免疫球蛋白恒定结构域,该方法包括:(a)将实施方案174的遗传修饰的非人动物暴露于包含肽的抗原或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;(b)从(a)的遗传修饰的非人动物中获得表达对mhc上呈递的肽具有特异性的car的t细胞;和(c)从步骤(b)的t细胞制备t细胞杂交瘤。
在示例性实施方案193中,本文提供了制备编码对mhc上呈递的肽特异的人免疫球蛋白可变结构域的核酸的方法,该方法包括:(a)将实施方案174的非人动物暴露于包含肽的抗原或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;(b)从(a)的遗传修饰的非人动物中获得表达对mhc上呈递的肽具有特异性的嵌合抗原受体(car)的t细胞;和(c)从t细胞中分离编码car的人tcr可变结构域的核酸。
在示例性实施方案194中,本文提供了制备抗体的方法,所述抗体具有对mhc上呈递的肽特异的人可变结构域和人恒定结构域,该方法包括:(a)将实施方案174的非人动物暴露于包含肽的抗原或编码包含肽的抗原的核酸,使得肽存在于非人动物的mhc上;(b)从(a)的遗传修饰的非人动物中获得表达对mhc上呈递的肽具有特异性的嵌合抗原受体(car)的t细胞;(c)从t细胞中分离编码car的人免疫球蛋白可变结构域的核酸;和(d)将编码人免疫球蛋白可变结构域的核酸与人免疫球蛋白恒定结构域在细胞中可操作地连接,使得细胞表达包含人免疫球蛋白可变结构域和人免疫球蛋白恒定结构域的抗体。
在示例性实施方案195中,本文提供了实施方案180至194中任一项的方法,其中非人动物是哺乳动物。
在示例性实施方案196中,本文提供了实施方案195的方法,其中哺乳动物是啮齿动物。
在示例性实施方式197中,本文提供了实施方案196的方法,其中啮齿动物是大鼠或小鼠。
在示例性实施方案198中,本文提供了根据实施方案180、185、186或194的方法产生的抗体。
在示例性实施例199中,本文提供了根据实施例181、187或191的方法生成的细胞。
在示例性实施方案200中,本文提供了根据实施方案182、188或192的方法产生的杂交瘤。
在示例性实施方案201中,本文提供了根据实施方案183、184、189或193的方法产生的核酸。
在示例性实施方案202中,本文提供了遗传修饰的非人动物es细胞,其在其基因组中包含编码人末端脱氧核苷酸转移酶(htdt)的核酸序列。
在示例性实施方案203中,本文提供了实施方案202的遗传修饰的非人动物es细胞,其中编码htdt的核酸序列与转录控制元件可操作地连接。
在示例性实施方案204中,本文提供了实施方案203的遗传修饰的非人动物es细胞,其中转录控制元件驱动编码htdt的核酸序列在pro-b细胞和/或pre-b细胞中的表达。
在示例性实施方案205中,本文提供了实施方案203的遗传修饰的非人动物es细胞,其中转录控制元件选自rag1转录控制元件、rag2转录控制元件、免疫球蛋白重链转录控制元件、免疫球蛋白κ轻链转录控制元件和/或免疫球蛋白λ轻链转录控制元件。
在示例性实施方案206中,本文提供了实施方案202至204中任一个的遗传修饰的非人动物es细胞,其中所述非人动物在pro-b细胞和/或pre-b细胞中表达htdt。
在示例性实施方案207中,本文提供了实施方案203的遗传修饰的非人动物es细胞,其中转录控制元件驱动编码cd4/cd8双阴性(dn)胸腺细胞和/或cd4/cd8双阳性(dp)胸腺细胞中的htdt的核酸序列的表达。
在示例性实施方案208中,本文提供了实施方案203的遗传修饰的非人动物es细胞,其中转录控制元件是rag1转录控制元件、rag2转录控制元件、tcrα转录控制元件、tcrβ转录控制元件、tcrγ转录控制元件和/或tcrδ转录控制元件。
在示例性实施方案209中,本文提供了实施方案202至207中任一个的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物在dn胸腺细胞和/或dp胸腺细胞中表达htdt。
在示例性实施方案210中,本文提供了实施方案202至209中任一个的遗传修饰的非人动物es细胞,其中编码htdt的核酸序列位于免疫球蛋白κ轻链基因座、免疫球蛋白λ轻链基因座、免疫球蛋白重链基因座、rag1基因座、rag2基因座、tcrα链基因座、tcrβ链基因座、tcrγ链基因座和/或tcrδ链基因座。
在示例性实施方案211中,本文提供了实施方案202至210中任一个的遗传修饰的非人动物es细胞,其中编码htdt的核酸序列不与组成型转录控制元件可操作地连接。
在示例性实施方案212中,本文提供了实施方案202至211中任一个的遗传修饰的非人动物es细胞,其中htdt不在衍生自非人动物es细胞的非人动物中组成型表达。
在示例性实施方案213中,本文提供了实施方案202至212中任一个的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物中至少10%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案214中,本文提供了实施方案213的遗传修饰的非人动物es细胞,其中衍生自es细胞的动物中至少20%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案215中,本文提供了实施方案213的遗传修饰的非人动物es细胞,其中衍生自es细胞的动物中至少40%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案216中,本文提供了遗传修饰的非人动物es细胞,其在其基因组中包含:编码外源末端脱氧核苷酸转移酶(tdt)的核酸序列;和免疫球蛋白可变区,其包含与免疫球蛋白恒定区基因可操作连接的未经重排的人免疫球蛋白可变区基因区段。
在示例性实施方案217中,本文提供了实施方案216的遗传修饰的非人动物es细胞,其中外源性tdt是人tdt。
在示例性实施方案218中,本文提供了实施方案216或217的遗传修饰的非人动物es细胞,其中编码外源tdt的核酸序列与转录控制元件可操作地连接。
在示例性实施方案219中,本文提供了实施方案218的遗传修饰的非人动物es细胞,其中转录控制元件驱动编码外源性tdt的核酸序列在pro-b细胞和/或pre-b细胞中的表达。
在示例性实施方案220中,本文提供了实施方案218的遗传修饰的非人动物es细胞,其中转录控制元件选自rag1转录控制元件、rag2转录控制元件、免疫球蛋白重链转录控制元件、免疫球蛋白κ轻链转录控制元件和/或免疫球蛋白λ轻链转录控制元件。
在示例性实施方案221中,本文提供了实施方案216至220中任一个的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物在pro-b细胞和/或pre-b细胞中表达外源性tdt。
在示例性实施方案222中,本文提供了实施方案218的遗传修饰的非人动物es细胞,其中转录控制元件驱动编码cd4/cd8双阴性(dn)胸腺细胞和/或cd4/cd8双阳性(dp)胸腺细胞中的外源性tdt的核酸序列的表达。
在示例性实施方案223中,本文提供了实施方案218的遗传修饰的非人动物es细胞,其中转录控制元件是rag1转录控制元件或rag2转录控制元件。
在示例性实施方案224中,本文提供了实施方案216至223中任一个的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物在dn胸腺细胞和/或dp胸腺细胞中表达外源性tdt。
在示例性实施方案225中,本文提供了实施方案216-224中任一个的遗传修饰的非人动物es细胞,其中编码外源性tdt的核酸序列位于免疫球蛋白κ轻链基因座、免疫球蛋白λ轻链基因座、免疫球蛋白重链基因座、rag1基因座、rag2基因座、tcrα链基因座、tcrβ链基因座、tcrγ链基因座和/或tcrδ链基因座。
在示例性实施方案226中,本文提供了实施方案216-225中任一个的遗传修饰的非人动物es细胞,其中编码外源性tdt的核酸序列不与组成型转录控制元件可操作地连接。
在示例性实施方式227中,本文提供了实施方案216至226中任一个的遗传修饰的非人动物es细胞,其中外源tdt在衍生自es细胞的非人动物中不组成型表达。
在示例性实施方案228中,本文提供了实施方案216至227中任一个的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物中至少10%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案229中,本文提供了实施方案228的遗传修饰的非人动物es细胞,其中动物中至少20%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案230中,本文提供了实施方案228的遗传修饰的非人动物es细胞,其中动物中至少40%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案231中,本文提供了实施方案216至227中任一个的遗传修饰的非人动物es细胞,其中人免疫球蛋白可变区基因区段是人重链可变区基因区段。
在示例性实施方案232中,本文提供了实施方案231的遗传修饰的非人动物es细胞,其中恒定区基因是重链恒定区基因。
在示例性实施方式233中,本文提供了实施方式232的遗传修饰的非人动物es细胞,其中重链恒定区基因是cμ基因、cδ基因、cγ基因、cε基因或cα基因。
在示例性实施方案234中,本文提供了实施方案232或233的遗传修饰的非人动物es细胞,其中重链恒定区基因来源于内源物种。
在示例性实施方式235中,本文提供了实施方式232或233的遗传修饰的非人动物es细胞,其中重链恒定区基因是小鼠恒定区基因。
在示例性实施方案236中,本文提供了实施方案232或233的遗传修饰的非人动物es细胞,其中重链恒定区基因是大鼠恒定区基因。
在示例性实施方式237中,本文提供了实施方式232或233的遗传修饰的非人动物es细胞,其中重链恒定区基因是人恒定区基因。
在示例性实施方案238中,本文提供了实施方案232或233的遗传修饰的非人动物es细胞,其中重链恒定区基因具有人ch1结构域和非人ch2和ch3结构域。
在示例性实施方案239中,本文提供了实施方案238的遗传修饰的非人动物es细胞,其中非人ch2和ch3结构域是内源物种来源。
在示例性实施方案240中,本文提供了实施方案238的遗传修饰的非人动物es细胞,其中非人ch2和ch3结构域是小鼠ch2和ch3结构域。
在示例性实施方案241中,本文提供了实施方案238的遗传修饰的非人动物es细胞,其中非人ch2和ch3结构域是大鼠ch2和ch3结构域。
在示例性实施方案242中,本文提供了实施方案216-241的经遗传修饰的非人动物es细胞,其中所述动物在选自igg、iga、ige、igd或其组合的免疫球蛋白重链恒定区中缺乏功能性ch1结构域。
在示例性实施方案243中,本文提供了实施方案232至242中任一个的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区和免疫球蛋白恒定区基因位于内源免疫球蛋白重链基因座。
在示例性实施方案244中,本文提供了实施方案231至243中任一个的遗传修饰的非人动物es细胞,其在其基因组中还包含免疫球蛋白可变区,其包含与第二免疫球蛋白恒定区基因可操作地连接的未重排的人轻链可变区基因区段。
在示例性实施方案245中,本文提供了实施方案244的遗传修饰的非人动物es细胞,其中与第二免疫球蛋白恒定区基因可操作地连接的人免疫球蛋白可变区基因区段是人κ链可变区基因区段。
在示例性实施方案246中,本文提供了实施方案244的遗传修饰的非人动物es细胞,其中与第二免疫球蛋白恒定区基因可操作地连接的人免疫球蛋白可变区基因区段是人λ链可变区基因区段。
在示例性实施方式247中,本文提供了实施方案244至246中任一个的遗传修饰的非人动物es细胞,其中第二恒定区基因是轻链恒定区基因。
在示例性实施方式248中,本文提供了实施方式247的遗传修饰的非人动物es细胞,其中第二恒定区基因是κ恒定区基因。
在示例性实施方案249中,本文提供了实施方案247的遗传修饰的非人动物es细胞,其中第二恒定区基因是λ恒定区基因。
在示例性实施方案250中,本文提供了实施方案244至249中任一个的遗传修饰的非人动物es细胞,其中第二恒定区基因是内源物种来源。
在示例性实施方案251中,本文提供了实施方案244至249中任一个的遗传修饰的非人动物es细胞,其中第二恒定区基因是小鼠恒定区基因。
在示例性实施方案252中,本文提供了实施方案244至249中任一个的遗传修饰的非人动物es细胞,其中第二恒定区基因是大鼠恒定区基因。
在示例性实施方式253中,本文提供了实施方案244至249中任一个的遗传修饰的非人动物es细胞,其中第二恒定区基因是人恒定区基因。
在示例性实施方案254中,本文提供了实施方案244至253中任一个的遗传修饰的非人动物es细胞,其中与第二免疫球蛋白恒定区基因可操作地连接的免疫球蛋白可变区和第二免疫球蛋白恒定区基因位于内源性免疫球蛋白轻链基因座。
在示例性实施方案255中,本文提供了实施方案254的遗传修饰的非人动物es细胞,其中第二恒定区基因是κ恒定区基因,并且内源免疫球蛋白轻链基因座是免疫球蛋白κ基因座。
在示例性实施方案256中,本文提供了实施方案254的遗传修饰的非人动物es细胞,其中第二恒定区基因是λ恒定区基因,内源免疫球蛋白轻链基因座是免疫球蛋白λ基因座。
在示例性实施方案257中,本文提供了实施方案231至243中任一个的遗传修饰的非人动物es细胞,其在其基因组中还包含免疫球蛋白可变区,其包含与第二免疫球蛋白恒定区基因可操作地连接的重排的人轻链可变区(v/j)基因区段。
在示例性实施方案258中,本文提供了实施方案257的遗传修饰的非人动物es细胞,其中与第二免疫球蛋白恒定区基因可操作地连接的重排的人轻链可变区(v/j)基因区段包含选自vκ1-39和vκ3-20的重排为jκ基因区段的vκ基因区段。
在示例性实施方案259中,本文提供了实施方案258的遗传修饰的非人动物es细胞,其中动物在其基因组中包含免疫球蛋白轻链可变区,其包含vκ1-39/jκ5或vκ3-20/jκ1序列。
在示例性实施方案260中,本文提供了实施方案231至243中任一个的遗传修饰的非人动物es细胞,其在其基因组中还包含免疫球蛋白可变区,其包含与第二免疫球蛋白恒定区基因可操作地连接的人轻链可变区(v和j)基因区段的有限库。
在示例性实施方案261中,本文提供了实施方案260的遗传修饰的非人动物es细胞,其中与第二免疫球蛋白恒定区基因可操作地连接的人轻链可变区(v和j)基因区段的有限库包含两个v基因区段和至少两个、优选五个j基因区段。
在示例性实施方案262中,本文提供了实施方案261的遗传修饰的非人动物es细胞,其中两个v基因区段是vk1-39和vk3-20基因区段。
在示例性实施方案263中,本文提供了实施方案216至230中任一个的遗传修饰的非人动物es细胞,其中人免疫球蛋白可变区基因区段是人轻链可变区基因区段。
在示例性实施方式264中,本文提供了实施方式263的遗传修饰的非人动物es细胞,其中人免疫球蛋白可变区基因区段是人κ链可变区基因区段。
在示例性实施方案265中,本文提供了实施方案263的遗传修饰的非人动物es细胞,其中人免疫球蛋白可变区基因区段是人λ链可变区基因区段。
在示例性实施方案266中,本文提供了实施方案263至265中任一个的遗传修饰的非人动物es细胞,其中恒定区基因是轻链恒定区基因。
在示例性实施方式267中,本文提供了实施方式266的遗传修饰的非人动物es细胞,其中恒定区基因是κ恒定区基因。
在示例性实施方案268中,本文提供了实施方案266的遗传修饰的非人动物es细胞,其中恒定区基因是λ恒定区基因。
在示例性实施方案269中,本文提供了实施方案263至265中任一个的遗传修饰的非人动物es细胞,其中恒定区基因是重链恒定区基因。
在示例性实施方案270中,本文提供了实施方案263至269中任一个的遗传修饰的非人动物es细胞,其中恒定区基因是内源物种来源。
在示例性实施方式271中,本文提供了实施方式263至269中任一个的遗传修饰的非人动物es细胞,其中恒定区基因是小鼠恒定区基因。
在示例性实施方式272中,本文提供了实施方式263至269中任一个的遗传修饰的非人动物es细胞,其中恒定区基因是大鼠恒定区基因。
在示例性实施方式273中,本文提供了实施方式263至269中任一个的遗传修饰的非人动物es细胞,其中恒定区基因是人恒定区基因。
在示例性实施方式274中,本文提供了实施方式263至273中任一个的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区和免疫球蛋白恒定区基因位于内源免疫球蛋白轻链基因座。
在示例性实施方式275中,本文提供了实施方式274的遗传修饰的非人动物es细胞,其中恒定区基因是κ恒定区基因,内源免疫球蛋白轻链基因座是免疫球蛋白κ基因座。
在示例性实施方式276中,本文提供了实施方式274的遗传修饰的非人动物es细胞,其中恒定区基因是λ恒定区基因,并且内源免疫球蛋白轻链基因座是免疫球蛋白λ基因座。
在示例性实施方式277中,本文提供了实施方案216至276中任一个的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区包含人源的免疫球蛋白可变区基因间序列。
在示例性实施方案278中,本文提供了实施方案216至276中任一个的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区包含内源物种来源的免疫球蛋白可变区基因间序列。
在示例性实施方案279中,本文提供了实施方案216至276中任一个的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区包含小鼠来源的免疫球蛋白可变区基因间序列。
在示例性实施方案280中,本文提供了实施方案216至276中任一个的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区包含大鼠来源的免疫球蛋白可变区基因间序列。
在示例性实施方案281中,本文提供了实施方案216至280中任一个的遗传修饰的非人动物es细胞,其在其基因组中还包含灭活的内源免疫球蛋白基因座。
在示例性实施方案282中,本文提供了实施方案281的遗传修饰的非人动物es细胞,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白重链基因座。
在示例性实施方案283中,本文提供了实施方案282的遗传修饰的非人动物es细胞,其中通过缺失内源性重链基因座的至少部分可变区来使内源免疫球蛋白重链基因座灭活。
在示例性实施方式284中,本文提供了实施方式283的遗传修饰的非人动物es细胞,其中至少部分可变区的缺失包括缺失可变区的j基因区段。
在示例性实施方式285中,本文提供了实施方式282的遗传修饰的非人动物es细胞,其中通过缺失内源重链基因座的至少部分恒定区来使内源免疫球蛋白重链基因座灭活。
在示例性实施方式286中,本文提供了实施方式285的遗传修饰的非人动物es细胞,其中至少部分恒定区的缺失包括缺失恒定区的cμ基因。
在示例性实施方案287中,本文提供了实施方案281的遗传修饰的非人动物es细胞,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白κ链基因座。
在示例性实施方案288中,本文提供了实施方案287的遗传修饰的非人动物es细胞,其中内源免疫球蛋白κ链基因座通过缺失内源κ链基因座的至少部分可变区而灭活。
在示例性实施方式289中,本文提供了实施方式288的遗传修饰的非人动物es细胞,其中至少部分可变区的缺失包括缺失可变区的j基因区段。
在示例性实施方式290中,本文提供了实施方式287的遗传修饰的非人动物es细胞,其中通过缺失内源κ链基因座的至少部分恒定区来使内源免疫球蛋白κ基因座灭活。
在示例性实施方案291中,本文提供了实施方案290的遗传修饰的非人动物es细胞,其中至少部分恒定区的缺失包括缺失恒定区的cκ基因。
在示例性实施方案292中,本文提供了实施方案281的遗传修饰的非人动物es细胞,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白λ链基因座。
在示例性实施方案293中,本文提供了实施方案292的遗传修饰的非人动物es细胞,其中通过缺失内源λ链基因座的v-j-c簇的至少一部分来灭活内源免疫球蛋白λ链基因座。
在示例性实施方案294中,本文提供了实施方案216至293中任一个的遗传修饰的非人动物es细胞,其中未重排的人免疫球蛋白可变区基因区段在b细胞发育期间经历重排以在衍生自es细胞的非人动物的b细胞中产生重排的可变区基因。
在示例性实施方式295中,本文提供了实施方案294的遗传修饰的非人动物es细胞,其中在非人动物中至少10%的重排可变区基因包含非模板添加物。
在示例性实施方式296中,本文提供了实施方案294的遗传修饰的非人动物es细胞,其中在非人动物中至少20%的重排可变区基因包含非模板添加物。
在示例性实施方式297中,本文提供了实施方案294的遗传修饰的非人动物es细胞,其中在非人动物中至少40%的重排可变区基因包含非模板添加物。
在示例性实施方案298中,本文提供了实施方案294至297中任一个的遗传修饰的非人动物es细胞,其中衍生自es细胞的动物表达包含由重排的可变区基因编码的可变结构域和由恒定区基因编码的恒定结构域的抗体。
在示例性实施方案299中,本文提供了遗传修饰的非人动物es细胞,其在其基因组中包含:编码外源末端脱氧核苷酸转移酶(tdt)的核酸序列;和t细胞受体(tcr)可变区,其包含与tcr恒定区基因可操作连接的未重排的人tcr可变区基因区段。
在示例性实施方案300中,本文提供了实施方案299的遗传修饰的非人动物es细胞,其中外源性tdt是人tdt。
在示例性实施方案301中,本文提供了实施方案299或300的遗传修饰的非人动物es细胞,其中编码外源tdt的核酸序列与转录控制元件可操作地连接。
在示例性实施方案302中,本文提供了实施方案301的基因修饰的非人动物es细胞,其中转录控制元件驱动编码cd4/cd8双阴性(dn)胸腺细胞和/或cd4/cd8双阳性(dp)胸腺细胞中的外源性tdt的核酸序列的表达。
在示例性实施方案303中,本文提供了实施方案301的遗传修饰的非人动物es细胞,其中转录控制元件是rag1转录控制元件、rag2转录控制元件、tcrα转录控制元件、tcrβ转录控制元件、tcrγ转录控制元件和/或tcrδ转录控制元件。
在示例性实施方案304中,本文提供了实施方案299至303中任一个的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物在dn胸腺细胞和/或dp胸腺细胞中表达外源性tdt。
在示例性实施方案305中,本文提供了实施方案299至304中任一个的遗传修饰的非人动物es细胞,其中编码外源tdt的核酸序列位于rag1基因座、rag2基因座、tcrα链基因座、tcrβ链基因座、tcrγ链基因座和/或tcrδ链基因座。
在示例性实施方案306中,本文提供了实施方案299-305中任一个的遗传修饰的非人动物es细胞,其中编码外源性tdt的核酸序列不与组成型转录控制元件可操作地连接。
在示例性实施方式307中,本文提供了实施方案299至306中任一个的遗传修饰的非人动物es细胞,其中外源tdt不被衍生自es细胞的非人动物组成型表达。
在示例性实施方案308中,本文提供了实施方案299至307中任一个的遗传修饰的非人动物es细胞,其中人tcr可变区基因区段是人tcrα可变区基因区段。
在示例性实施方案309中,本文提供了实施方案299至307中任一个的遗传修饰的非人动物es细胞,其中人tcr可变区基因区段是人tcrβ可变区基因区段。
在示例性实施方案310中,本文提供了实施方案299至308中任一个的遗传修饰的非人动物es细胞,其中tcr恒定区基因是tcrα恒定区基因。
在示例性实施方案311中,本文提供了实施方案299至307和309中任一个的遗传修饰的非人动物es细胞,其中tcr恒定区基因是tcrβ恒定区基因。
在示例性实施方案312中,本文提供了实施方案299至311中任一个的遗传修饰的非人动物es细胞,其中tcr恒定区基因是内源物种来源。
在示例性实施方案313中,本文提供了实施方案299至311中任一个的遗传修饰的非人动物es细胞,其中tcr恒定区基因是小鼠恒定区基因。
在示例性实施方案314中,本文提供了实施方案299至311中任一个的遗传修饰的非人动物es细胞,其中tcr恒定区基因是大鼠恒定区基因。
在示例性实施方案315中,本文提供了实施方案299至311中任一个的遗传修饰的非人动物es细胞,其中tcr恒定区基因是人恒定区基因。
在示例性实施方案316中,本文提供了实施方案299至315中任一个的遗传修饰的非人动物es细胞,其中tcr可变区和tcr恒定区基因位于内源性tcr基因座。
在示例性实施方案317中,本文提供了实施方案299至308、310、313-315中任一个的遗传修饰的非人动物es细胞,其中内源性tcr基因座是内源性tcrα基因座。
在示例性实施方案318中,本文提供了实施方案299-307、309、311-315中任一个的遗传修饰的非人动物es细胞,其中内源性tcr基因座是内源性tcrβ基因座。
在示例性实施方案319中,本文提供了实施方案299至318中任一个的遗传修饰的非人动物es细胞,其中tcr可变区包含人源的tcr可变区基因间序列。
在示例性实施方案320中,本文提供了实施方案299至318中任一个的遗传修饰的非人动物es细胞,其中tcr可变区包含内源物种来源的tcr可变区基因间序列。
在示例性实施方案321中,本文提供了实施方案299至320中任一个的遗传修饰的非人动物es细胞,其在其基因组中还包含灭活的内源性tcr基因座。
在示例性实施方式322中,本文提供了实施方式321的遗传修饰的非人动物es细胞,其中灭活的内源tcr基因座是tcrα基因座。
在示例性实施方案323中,本文提供了实施方案321的遗传修饰的非人动物es细胞,其中灭活的内源tcr基因座是tcrβ基因座。
在示例性实施方案324中,本文提供了实施方案299至323中任一个的遗传修饰的非人动物es细胞,其中未重排的人tcr可变区基因区段在t细胞发育期间经历重排以在衍生自es细胞的非人动物的t细胞中产生重排的tcr可变区基因。
在示例性实施方案325中,本文提供了实施方案324的遗传修饰的非人动物es细胞,其中至少10%的重排可变区基因在衍生自es细胞的非人动物中包含非模板添加物。
在示例性实施方案326中,本文提供了实施方案324的遗传修饰的非人动物es细胞,其中至少20%的重排可变区基因在衍生自es细胞的非人动物中包含非模板添加物。
在示例性实施方案327中,本文提供了实施方案324的遗传修饰的非人动物es细胞,其中至少40%的重排可变区基因在衍生自es细胞的非人动物中包含非模板添加物。
在示例性实施方案328中,本文提供了实施方案324至327中任一个的遗传修饰的非人动物es细胞,其中衍生自es细胞的动物表达包含由重排的tcr可变区基因编码的可变结构域和由tcr恒定区基因编码的恒定结构域的tcr。
在示例性实施方案329中,本文提供了遗传修饰的非人动物,其在其基因组中包含:编码外源末端脱氧核苷酸转移酶(tdt)的核酸序列;和免疫球蛋白可变区,其包含与tcr恒定区基因可操作连接的未经重排的人免疫球蛋白可变区基因区段。
在示例性实施方案330中,本文提供了实施方案329的遗传修饰的非人动物es细胞,其中外源性tdt是人tdt。
在示例性实施方案331中,本文提供了实施方案329或330的遗传修饰的非人动物es细胞,其中编码外源tdt的核酸序列与转录控制元件可操作地连接。
在示例性实施方案332中,本文提供了实施方案331的基因修饰的非人动物es细胞,其中转录控制元件驱动编码cd4/cd8双阴性(dn)胸腺细胞和/或cd4/cd8双阳性(dp)胸腺细胞中的外源性tdt的核酸序列的表达。
在示例性实施方案333中,本文提供了实施方案331的遗传修饰的非人动物es细胞,其中转录控制元件是rag1转录控制元件、rag2转录控制元件、tcrα转录控制元件、tcrβ转录控制元件、tcrγ转录控制元件和/或tcrδ转录控制元件。
在示例性实施方案334中,本文提供了实施方案331至333中任一个的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物在dn胸腺细胞和/或dp胸腺细胞中表达外源性tdt。
在示例性实施方案335中,本文提供了实施方案331至334中任一个的遗传修饰的非人动物es细胞,其中编码外源tdt的核酸序列位于rag1基因座、rag2基因座、tcrα链基因座、tcrβ链基因座、tcrγ链基因座和/或tcrδ链基因座。
在示例性实施方案336中,本文提供了实施方案331-335中任一个的遗传修饰的非人动物es细胞,其中编码外源性tdt的核酸序列不与组成型转录控制元件可操作地连接。
在示例性实施方案337中,本文提供了实施方案331至336中任一个的遗传修饰的非人动物es细胞,其中外源性tdt在衍生自es细胞的非人动物中不组成型表达。
在示例性实施方案338中,本文提供了实施方案331至337中任一个的遗传修饰的非人动物es细胞,其中人免疫球蛋白可变区基因区段是人轻链可变区基因区段。
在示例性实施方案339中,本文提供了实施方案338的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物中至少10%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案340中,本文提供了实施方案339的遗传修饰的非人动物es细胞,其中动物中至少20%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案341中,本文提供了实施方案339的遗传修饰的非人动物es细胞,其中动物中至少40%的v-j免疫球蛋白轻链连接包含非模板添加。
在示例性实施方案342中,本文提供了实施方案338至341中任一个的遗传修饰的非人动物es细胞,其中人轻链可变区基因区段是κ基因区段。
在示例性实施方案343中,本文提供了实施方案338至341中任一个的遗传修饰的非人动物es细胞,其中人轻链可变区基因区段是λ基因区段。
在示例性实施方案344中,本文提供了实施方案331至337中任一个的遗传修饰的非人动物es细胞,其中人免疫球蛋白可变区基因区段是人重链可变区基因区段。
在示例性实施方案345中,本文提供了实施方案331至343中任一个的遗传修饰的非人动物es细胞,其中tcr恒定区基因是tcrα恒定区基因。
在示例性实施方式346中,本文提供了实施方式345的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区和tcrα恒定区基因位于内源性tcrα基因座。
在示例性实施方案347中,本文提供了实施方案344的遗传修饰的非人动物es细胞,其中tcr恒定区基因是tcrβ恒定区基因。
在示例性实施方式348中,本文提供了实施方式347的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区和tcrβ恒定区基因位于内源性tcrβ基因座。
在示例性实施方案349中,本文提供了实施方案331至344中任一个的遗传修饰的非人动物es细胞,其中tcr恒定区基因是内源物种来源。
在示例性实施方案350中,本文提供了实施方案331至348中任一个的遗传修饰的非人动物es细胞,其中tcr恒定区基因是小鼠恒定区基因。
在示例性实施方案351中,本文提供了实施方案331至348中任一个的遗传修饰的非人动物es细胞,其中tcr恒定区基因是大鼠恒定区基因。
在示例性实施方案352中,本文提供了实施方案331至348中任一个的遗传修饰的非人动物es细胞,其中tcr恒定区基因是人恒定区基因。
在示例性实施方案353中,本文提供了实施方案331至352中任一个的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区包含人源的免疫球蛋白可变区基因间序列。
在示例性实施方式354中,本文提供了实施方式340至352中任一个的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区包含内源物种来源的免疫球蛋白可变区基因间序列。
在示例性实施方案355中,本文提供了实施方案341至352中任一个的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区包含小鼠来源的免疫球蛋白可变区基因间序列。
在示例性实施方案356中,本文提供了实施方案341至352中任一个的遗传修饰的非人动物es细胞,其中免疫球蛋白可变区包含大鼠来源的免疫球蛋白可变区基因间序列。
在示例性实施方案357中,本文提供了实施方案341至356中任一个的遗传修饰的非人动物es细胞,其在其基因组中还包含灭活的内源免疫球蛋白基因座。
在示例性实施方案358中,本文提供了实施方案357的遗传修饰的非人动物es细胞,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白重链基因座。
在示例性实施方案359中,本文提供了实施方案358的遗传修饰的非人动物es细胞,其中内源免疫球蛋白重链基因座通过缺失内源重链基因座的至少部分可变区而灭活。
在示例性实施方式360中,本文提供了实施方式359的遗传修饰的非人动物es细胞,其中至少部分可变区的缺失包括缺失可变区的j基因区段。
在示例性实施方案361中,本文提供了实施方案358的遗传修饰的非人动物es细胞,其中通过缺失内源性重链基因座的至少部分恒定区来使内源免疫球蛋白重链基因座灭活。
在示例性实施方式362中,本文提供了实施方式361的遗传修饰的非人动物es细胞,其中至少部分恒定区的缺失包括缺失恒定区的cμ基因。
在示例性实施方案363中,本文提供了实施方案357的遗传修饰的非人动物es细胞,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白κ链基因座。
在示例性实施方案364中,本文提供了实施方案363的遗传修饰的非人动物es细胞,其中内源免疫球蛋白κ链基因座通过缺失内源κ链基因座的至少部分可变区而灭活。
在示例性实施方式365中,本文提供了实施方式364的遗传修饰的非人动物es细胞,其中至少部分可变区的缺失包括缺失可变区的j基因区段。
在示例性实施方式366中,本文提供了实施方案365的遗传修饰的非人动物es细胞,其中通过缺失内源κ链基因座的至少部分恒定区来使内源免疫球蛋白κ基因座灭活。
在示例性实施方式367中,本文提供了实施方式366的遗传修饰的非人动物es细胞,其中至少部分恒定区的缺失包括缺失恒定区的cκ基因。
在示例性实施方案368中,本文提供了实施方案357的遗传修饰的非人动物es细胞,其中灭活的内源免疫球蛋白基因座是内源免疫球蛋白λ链基因座。
在示例性实施方案369中,本文提供了实施方案368的遗传修饰的非人动物es细胞,其中通过缺失内源λ链基因座的v-j-c簇的至少一部分来灭活内源免疫球蛋白λ链基因座。
在示例性实施方案370中,本文提供了实施方案331至369中任一个的遗传修饰的非人动物es细胞,其中未重排的人免疫球蛋白可变区基因区段在t细胞发育期间经历重排以在衍生自es细胞的非人动物的t细胞中产生重排的免疫球蛋白可变区基因。
在示例性实施方式371中,本文提供了实施方案370的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物中至少10%的重排可变区基因包含非模板添加物。
在示例性实施方式372中,本文提供了实施方案370的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物中至少20%的重排可变区基因包含非模板添加物。
在示例性实施方式373中,本文提供了实施方案370的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物中至少40%的重排可变区基因包含非模板添加物。
在示例性实施方式374中,本文提供了实施方案370至372中任一个的遗传修饰的非人动物es细胞,其中衍生自es细胞的非人动物表达嵌合抗原受体,其包含由重排可变区基因编码的可变结构域和由tcr恒定区基因编码的恒定结构域。
在示例性实施方式375中,本文提供了实施方式202至374中任一个的遗传修饰的es细胞,其进一步包含功能性异位小鼠adam6基因。
在示例性实施方式376中,本文提供了实施方式202至375中任一个的遗传修饰的非人动物es细胞,其中所述非人动物是哺乳动物。
在示例性实施方式377中,本文提供了实施方案376的遗传修饰的非人动物es细胞,其中哺乳动物是啮齿动物。
在示例性实施方案378中,本文提供了实施方案377的遗传修饰的非人动物es细胞,其中啮齿动物是大鼠或小鼠。
在示例性实施方式379中,本文提供了实施方式377的遗传修饰的非人动物es细胞,其中啮齿动物是小鼠。
在示例性实施方案380中,本文提供了实施方案377的遗传修饰的非人动物es细胞,其中啮齿动物是大鼠。
在示例性实施方案381中,本文提供了制备遗传修饰的非人动物的方法,其包括使用实施方案202至380中任一个的遗传修饰的非人动物es细胞。
在示例性实施方案382中,本文提供了制备包含遗传修饰的非人动物的方法,其包括改造非人动物以在其种系中包含编码人末端脱氧核苷酸转移酶(htdt)的核酸序列。
在示例性实施方案383中,本文提供了制备包含遗传修饰的非人动物的方法,其包括改造非人动物以在其种系中包含:编码外源末端脱氧核苷酸转移酶(tdt)的核酸序列;和免疫球蛋白可变区,其包含与免疫球蛋白恒定区基因可操作连接的未经重排的人免疫球蛋白可变区基因区段。
在示例性实施方案385中,本文提供了制备包含遗传修饰的非人动物的方法,其包括改造非人动物以在其种系中包含:编码外源末端脱氧核苷酸转移酶(tdt)的核酸序列;和t细胞受体(tcr)可变区,其包含与tcr恒定区基因可操作连接的未重排的人tcr可变区基因区段。
在示例性实施方案386中,本文提供了制备包含遗传修饰的非人动物的方法,其包括改造非人动物以在其种系中包含:编码外源末端脱氧核苷酸转移酶(tdt)的核酸序列;和免疫球蛋白可变区,其包含与tcr恒定区基因可操作连接的未经重排的人免疫球蛋白可变区基因区段。
在示例性实施方案387中,本文提供了实施方案382至385中任一项的方法,其中非人动物是哺乳动物。
在示例性实施方案388中,本文提供了实施方案386的方法,其中哺乳动物是啮齿动物。
在示例性实施方案389中,本文提供了实施方案387的方法,其中啮齿动物是大鼠或小鼠。
在示例性实施方式390中,本文提供了实施方式387的方法,其中啮齿动物是小鼠。
实施例
通过以下非限制性实施例进一步说明本发明。列出这些实施例是为了帮助理解本发明,但并不意图也不应该解释为以任何方式限制其范围。实施例不包括本领域普通技术人员熟知的常规方法的详细描述(分子克隆技术等)。除非另有说明,份数是重量份,分子量是平均分子量,温度以摄氏度表示,压力是大气压或接近大气压。
实施例1:表达人tdt的小鼠的产生
包含人tdt基因的小鼠,作为随机转基因或靶向免疫球蛋白κ基因座,使用
或者,从头合成短的同种型人tdt(tdts)cdna(blueheronbio),并将其掺入靶向以引入es细胞,如上所述。
通过
实施例1.1.在小鼠rag调节元件(rag-tdttg)控制下产生表达人tdt(tdts)短亚型的转基因
简而言之,在图1中详细示出了大的靶向载体(ltvec),图1是由小鼠和人bac克隆构建的,其中小鼠rag2基因(来自外显子3中的atg起始密码子至外显子3中的tga终止密码子被仅编码短同种型tdts(来自外显子1中的atg起始密码子至外显子13中polya信号的~0.5kb3′)的人末端脱氧核苷酸转移酶(tdt或dntt)基因取代。突变tdt外显子7和12的rna剪接位点以防止长同种型(tdtl1和l2)的表达。在相同的ltvec中,来自外显子2中atg起始密码子至外显子2中taa终止密码子的小鼠rag1基因被增强型绿色荧光蛋白(egfp)和lacz3'utr-polya信号的编码序列取代。ltvec含有130kb的小鼠rag2基因的上游调节序列5'和8.8kb的小鼠rag1基因的上游调节序列3',以及5.6kb的rag2-rag1基因间区域。
ltvec由小鼠bac克隆rp23-374f10(invitrogen/lifetechnologies)构建,包含rag2和rag1基因,以及含有tdt基因的人bac克隆rp11-1070o2(invitrogen/lifetechnologies),使用标准分子生物学和重组技术,如pcr、限制性消化/连接、gibsonisothermalassembly、crispr/cas9、细菌同源重组等。最终ltvec从5'到3'含有:(1)loxp-pgkp-em7-neo-loxp序列盒,用于在es细胞或细菌中选择,(2)134,069bp的小鼠基因组序列,开始于rag2外显子1的上游129,440bp和结束于从rag2外显子3起始25bp(小鼠基因组坐标2:101,495,278-101,629,347,基于grcm38组装),(3)34,573bp的人tdt基因组序列,从外显子1的atg起始密码子开始,结束于polya信号的514bp3'(基于grch38组装的人基因组坐标10:96,304,498-96,339,063);在人tdt基因内,外显子7的剪接供体位点被缺失并被noti位点取代以阻止tdtl2同种型的表达,并且外显子12的剪接受体位点被删除以防止tdtl1同种型的表达(详细描述如下),(4)asisi网站;(5)10,742bp的小鼠基因组序列(grcm38基因组坐标2:101,630,931-101,641,672),其含有rag2外显子3(1599bp)的3'utr,5753bprag2/rag1基因间区域和rag1外显子2的3'utr(3390bp),(6)fsei位点,(7)含有lacz的249bppolya信号和egfp的793bpcds的负链上1,068bp,(8)13459bp的小鼠基因组序列(grcm38坐标2:101,644,793-101,658,251)在负链上有rag1,从rag1外显子2中的atg起始密码子开始,在rag1的转录起始位点的3'8,750bp结束,和(9)em7-cm盒用于细菌中的选择(参见图1)。
详细地,克隆步骤创建tdt基因的两个修饰以防止使用tdt外显子7和12(分别用于制备长同种型tdtl2和tdtl1)的可变剪接,同时仍然允许剪接编码短同种型的转录物使用bhr和连接从bac克隆rp11-1070o2构建tdts:
(1)缺失13bp,包括外显子7的剪接供体位点(gtcgggtcgtggt(seqidno:1),下划线为剪接供体),并用noti位点(gcggccgc(seqidno:2))代替。这产生了重叠的sacii位点(ccgcgg(seqidno:3)),和
(2)删除外显子12的2bp剪接受体位点。
最终的ltvec如图1所示,图中显示各种序列连接点的近似位置。连接点也总结在下表1中。
表1:rag-tdttgltvec的序列连接点
将最终的ltvec线性化并电穿孔到包含功能性异位小鼠adam6基因的
通过本领域已知的方法测定rag-tdt转基因的整合位点。在一个实施方案中,使用整个小鼠基因组的低覆盖度配对末端测序确定整合位点(测序文库-nexteradna文库制备,illumina;sequence-miseq,illumina)。例如,在一个实例中,确定rag-tdt转基因整合为染色体1上的坐标41130492和41130502之间的两个串联头尾拷贝(grcm38/mm10组装中的坐标),而不破坏任何编码区。
实施例1.2.在小鼠rag调节元件(rag-tdtigk)的控制下产生靶向免疫球蛋白κ基因座插入人tdt(tdts)的短同种型
为了在小鼠免疫球蛋白κ基因座上的rag调控元件的控制下产生包含人tdt的小鼠,将es细胞中用于重组的小鼠igk同源臂添加到如在实施例1.1和图1所述产生的构建体的5'和3'末端。通常,通过以下方式添加小鼠igk臂:(1)通过细菌同源重组修饰小鼠igkbac以插入侧翼为i-ceui和pi-scei限制酶位点的选择盒(例如hyg,neo等),和(2)通过i-ceui和pi-scei连接将tdt构建体插入小鼠igkbac中。最终的ltvec如图2所示。
该最终ltvec从5'至3'含有:(1)用于在细菌中选择的spec盒,(2)含有igkc基因的29591bp5'小鼠同源臂(grcm38基因组坐标6:70,725,823-70,754,415),igk3'增强子和3'igk重组序列(rs);小鼠臂结束于rs的2.6kb3',(3)pi-scei位点,(4)用于在es细胞或细菌中选择的loxp-ubcp-em7-hyg-loxp盒,(5)上述在实施例1.1和图1的构建体,含有rag2启动子-人tdts和rag1-egfp基因,(6)i-ceui位点,(7)44,900bp3'小鼠igk同源臂(grcm38基因组坐标6:70,754,508-70,799,678),和(8)用于细菌选择的cm盒。
最终的ltvec如图2所示,图中显示各种序列连接点的近似位置。连接点也总结在下表2中。
表2:rag-tdtigkltvec的序列连接点
将得到的ltvec线性化并电穿孔到包含功能性异位小鼠adam6基因的
实施例1.3.在小鼠免疫球蛋白重链增强子(eμ)和小鼠igvh1-72启动子(分别地migh-eμ-vh1-72-tdttg和migh-eμ-vh1-72-tdtigk)的控制下,短同种型人tdt(tdts)的随机转基因和靶向免疫球蛋白κ基因座插入的产生
用于制备实施例1.1和1.2中的rag-tdt的相同的人tdts基因(即从atg起始密码子至polya信号的约514bp3')被置于689bp小鼠eμ增强子和303bp小鼠igvh1-72启动子的控制下。该构建体随机整合到小鼠基因组中或靶向免疫球蛋白k(igk)基因座。对于靶向整合,将基因插入与实施例1.2中用于制备ltvec的相同的5'和3'小鼠igk同源臂之间。
具体地,最终ltvec从5'至3'含有(图3):(1)用于在细菌中选择的spec盒,(2)28591bp5'小鼠同源臂(grcm38基因组坐标6:70,725,823-70,754,415),其含有igk恒定(igkc)基因、igk3'增强子和3'igk重组序列(rs);小鼠臂结束于rs的~2.6kb3',(3)i-ceui位点,(4)反向取向的loxp-ubcp-em7-hyg-loxp盒,用于在es细胞或细菌中进行选择,(5)反向取向的在上述实施例中使用的相同34,573bp人tdts基因,(6)反向取向的303bp小鼠ighv1-72启动子(grcm38基因组坐标12:115,758,417-115,758,719),(7)反向取向的689bp小鼠eμ增强子(ecori-xbai片段,grcm38基因组坐标12:113,427,284-113,427,972),(8)pi-scei位点,(9)44,900bp3'小鼠igk同源臂(grcm38基因组坐标6:70,754,508-70,799,678),和(10)用于细菌选择的cm盒。
最终载体中特异性序列连接的近似位置如图3并且它们的序列如下表3所示。
表3:migh-eμ-vh1-72-tdtigkltvec的序列连接
将得到的ltvec线性化并电穿孔到包含功能性异位小鼠adam6基因的
实施例1.4.从tdtscdna产生靶向免疫球蛋白κ基因座插入以及转基因人tdts
或者,从头合成(blueheronbio)tdtscdna作为3682bpdna片段并掺入靶向载体中以引入es细胞中。靶向载体从5'至3'含有pi-scei位点、689bp小鼠igh内含子增强子(ecori-xbai片段)、303bp小鼠vh1-72启动子、735bp内含子2保留在外显子2和3之间用于内含子介导的表达增强的人tdts的1530bpcds(ncbirefseqnm_004088)、340bp人tdt3'utr/polya信号、用于在loxp-neo-loxp盒中连接的noti和sali限制酶位点、和i-ceui位点。将载体插入与用于制备实施例1.2中的ltvec的相同的5'和3'小鼠igk同源臂之间,并靶向igk基因座或随机整合到小鼠基因组中。
将得到的ltvec线性化并电穿孔到包含功能性异位小鼠adam6基因的
实施例1.5.表达人类tdts的小鼠
如上所述,一旦产生正确靶向的es细胞,通过
产生和测试人类tdts小鼠的几个版本,并且那些包括随机转基因和igk靶向tdts,其是在rag启动子和eμ-vh1-72调控元件的控制下。还包括具有一个、两个或几个tdts转基因拷贝的版本;以及从基因组tdt和cdnatdt序列产生的版本。其余实施例证明了以包含rag-基因组tdts的转基因的小鼠(1号染色体上两个拷贝的串联插入,如上面实施例1.1中所描述的)和靶向igk基因座的eμ-vh1-72-基因组tdts(实施例1.3)获得的数据。
首先,测试小鼠的tdt表达。pt-pcr被用于从
实施例2.包含人tdts的小鼠中人免疫球蛋白κ连接多样性
为了评估上文实施例1中描述的各种
具体地,通过使用抗cd19(小鼠)磁珠和
表4:用于igk库测序的文库制备中的引物
对于生物信息学分析,基于质量、长度和与κ恒定区引物的完美匹配,对原始illumina序列进行去除多重和过滤。使用自定义内部管道合并和分析重叠的配对末端读数。该管道使用igblast(ncbi,v2.2.25+)的局部安装来将重排的轻链序列与人种系v和j基因数据库比对。如果没有检测到终止密码子并且vj连接与j区段符合读框,则认为重排是有效的。否则,重排被认为是非生产性的,并被排除在分析之外。
使用国际免疫遗传学信息系统(imgt)边界提取cdr3序列。注释的v和j区段之间的连接区域被分类为p和n核苷酸。从每个序列中提取具有n/p添加的区域并计算其长度。通过分析独特的克隆型计算抗体库的多样性。序列多样性定义为随机选择的10,000个读数中的独特cdr3序列数。
图5显示与不包含人tdts的
实施例3.包含人类tdts的小鼠中非种系添加物的增加
cdr3中的非种系核苷酸添加物的百分比(其由vκ和jκ基因区段的部分组成)也由上文实施例2中描述的下一代测序确定。
如图6中所示,在两种版本的人源化tdts小鼠中,b细胞中约45%的人源化κ轻链显示具有非种系添加物,而与之对比在包含功能性异位小鼠adam6基因的
实施例4.从人tdts小鼠获得的免疫球蛋白中的人轻链cdr3长度
使用国际免疫遗传学信息系统(imgt)边界提取cdr3序列。基于已知的轻链v和j序列确定非模板核苷酸。
如图7a中所示,与对照(包含功能性异位小鼠adam6基因的
实施例5.人轻链vκ和jκ基因片段在人tdts小鼠中的应用
如如图8a和8b所示,与包含功能性异位小鼠adam6基因的
实施例6.包含人类tdts的小鼠中轻链λ免疫球蛋白基因座和其他重排基因座的连接多样性
除人免疫球蛋白κ基因座外,还可以研究来自b(λ轻链,重链)和t(α/β)淋巴细胞的其他基因座中的抗原-受体多样性。
例如,当将包含功能性异位小鼠adam6基因的
表5:用于igl-c1谱库测序的文库制备中的引物
另外,对于包含未经重排的人重链和轻链可变基因区段的
研究了tdt引入对双轻链小鼠的连接多样性的影响的一个这样的实例在下面的实施例7-10中给出。
实施例7.包含人tdts的双轻链(dlc)小鼠中的人免疫球蛋白κ连接多样性
通过以下产生包含双轻链基因座和人tdts的小鼠:培育包含功能性小鼠adam6基因(参见美国专利号8,642,835和8,697,940)以及具有包含双轻链基因座的小鼠的外源性人tdts(参见美国专利申请公开号us2013/0198880,通过引用并入本文)的
为了评估在具有含只有两个未重排的vκ基因区段:igvk3-20和igvk1-39以及五个未经重排的igjk基因区段的有限igκ基因座的dlc人类tdts小鼠模型中免疫球蛋白库的序列多样性(参见美国专利申请公开us2013/0198880,通过引用并入本文),通过5'race从具有migk恒定引物的各种小鼠的脾中扩增igκ序列,并使用illuminamiseq测序。在大多数实验中,使用对于ragtdttg杂合并且对于dlc基因座纯合的几个小鼠(ragtdttg(het)dlc)和两个对于ragtdttg纯合并且对于dlc基因座(ragtdttg(ho)dlc)纯合的小鼠是小鼠;ragtdttg(het)dlc的数据被描述为所有测试小鼠的平均值,而两个ragtdttg(ho)dlc小鼠被单独显示。
具体地,通过使用抗cd19(小鼠)磁珠和
对于生物信息学分析,基于质量、长度和与κ恒定区引物的完美匹配,对原始illumina序列进行去除多重和过滤。使用自定义内部管道合并和分析重叠的配对末端读数。该管道使用igblast(ncbi,v2.2.25+)的局部安装来将重排的轻链序列与人种系v和j基因数据库比对。如果没有检测到终止密码子并且vj连接与j区段符合读框,则认为重排是有效的。否则,重排被认为是非生产性的,并被排除在分析之外。
使用国际免疫遗传学信息系统(imgt)边界提取cdr3序列。注释的v和j区段之间的连接区域被分类为p和n核苷酸(非模板添加)。从每个序列中提取具有n/p添加的区域并计算其长度。通过分析独特的克隆型计算抗体库的多样性。序列多样性定义为随机选择的10,000个读数中的独特cdr3序列数。
图13显示与不包含引入的人tdts的dlc小鼠相比,在dlc人tdts小鼠模型中检测到独特cdr3氨基酸序列数量增加超2倍。
实施例8.包含人tdts的dlc小鼠中非种系添加物的增加
在dlctdt小鼠的免疫球蛋白序列中,cdr3中的非种系核苷酸添加物的百分比(其由vκ和jκ基因区段的部分组成)也由上文实施例7中描述的下一代测序确定。
如图14所示,b细胞中大约一半的人源化κ轻链显示在dlc人源化tdts小鼠中具有非种系添加物(对于tdt而言均为het和ho),而与之比较在dlc对照小鼠(未引入人tdt的dlc小鼠)中为约10%。
实施例9.从包含人tdts的dlc小鼠获得的免疫球蛋白中的人轻链cdr3长度
使用国际免疫遗传学信息系统(imgt)边界提取cdr3序列。从已知的轻链v和j序列确定非模板核苷酸。
如图15所示,与对照(没有引入人tdt的dlc小鼠)相比,在dlc人源化tdts小鼠(het和ho)中观察到的增加的非模板添加导致κ轻链cdr3长度增加。
实施例10.人轻链vκ和jκ基因片段用于包含人tdts的dlc小鼠
如图16所示,与dlc对照小鼠(没有引入人tdt的dlc小鼠)相比,在dlc小鼠中引入人tdts没有显着改变vκ基因区段或jκ基因区段的使用。
通过引用并入
本文提及的所有出版物、专利和专利申请均通过引用整体并入本文,如同每个单独的出版物、专利或专利申请被具体和单独地指出通过引用并入。在冲突的情况下,以本申请(包括本文中的任何定义)为准。
等同物
本领域技术人员将认识到或能够使用不超过常规的实验确定本文所述的本发明具体实施方案的许多等同物。这些等同物旨在由所附权利要求涵盖。
- 还没有人留言评论。精彩留言会获得点赞!