用于在移植前后实时评估包封装置中细胞的方法和系统与流程
本申请要求于2016年11月3日提交的美国专利申请No.62/417,039的优先权,其说明书的全部内容通过引用结合于此。
技术领域
本发明涉及实时评估容纳在包封装置中的细胞的各种参数的方法和系统。参数可包括胰岛素分泌水平和耗氧率或任何其它适当的参数。
背景技术:
在细胞移植之前和细胞移植之后,了解包封装置中的细胞是否健康、存活且有功能性是很重要的。本发明包括用于在移植之前和之后实时监测包封装置中的细胞(例如,例如通过测量耗氧率、胰岛素分泌水平等监测细胞存活率、功能等)的方法和系统。本发明还包括在包封装置加载过程中帮助减少细胞损伤的方法,例如在移植之前、在存储之前和在存储过程中等等。
本发明可用于其他细胞类型(不仅仅针对糖尿病治疗)。例如,细胞可包括生物人工肝的肝细胞、心脏细胞、肌肉细胞等。
以下美国专利的公开内容整体并入本文作为参考:美国专利No.5,713,888;美国专利申请No.2003/0087427。
技术实现要素:
本发明包括系统,例如,测量细胞耗氧率(OCR)、或测量其它特征诸如胰岛素分泌、pH、乳酸、CO2水平等的系统。在一些实施方式中,系统包括:具有入口和出口的生物反应器,其中第一氧气传感器设置于入口处并且第二氧气传感器设置于出口处;包括具有细胞的腔体以及血管化膜的包封装置,包封装置容纳在生物反应器中;热交换器和气体交换器的组合装置,用于将液体介质加热到从7℃到27℃(或从7℃到37℃)中的至少一个温度并从0到100%地控制含氧量;以及将液体介质经由入口从热交换器泵入生物反应器并经由出口从生物反应器泵出的泵。氧气传感器检测介质的含氧量以确定细胞的耗氧率。
在一些实施方式中,生物反应器被包封到可以调节并控制温度和氧气的培养箱中,例如,温度是4-40℃、含氧量是0-100%。
在一些实施方式中,所述系统包括用于获取在生物反应器出口之后的介质样品的样品移除出口。介质样品可用于测量胰岛素分泌。在一些实施方式中,气体交换器或热、气交换器组合装置向介质提供氧气。在一些实施方式中,介质中的产氧可被切断。
在一些实施方式中,介质样品用于测量胰岛素、胰高血糖素、胰多肽、C肽、激素、或其组合。在一些实施方式中,介质样品用于测量受可被引入系统中的各种分泌素和化学试剂(诸如葡萄糖、精氨酸、KCI、GLP-1)影响的化学释放(分泌)。
在一些实施方式中,细胞为胰岛细胞或干细胞衍生的β细胞。在一些实施方式中,系统包括葡萄糖传感器、乳酸传感器。pH传感器、CO2传感器、或其组合。在一些实施方式中,氧气传感器操作性地连接至调节输送至细胞的氧气的量的系统。在一些实施方式中,调节输送至细胞的氧气的量的系统可以,根据基于氧气传感器确定的含氧量接收的命令,调节供给到细胞的氧气水平。
本发明还包括测量细胞耗氧率(OCR)或其它特征(例如,上述胰岛素分泌等)的方法。所述方法包括通过系统泵送从7℃到27℃的温度下的介质,所述系统包括:具有入口和出口的生物反应器,其中第一氧气传感器设置于入口处并且第二氧气传感器设置于出口处;和包括具有细胞的腔体以及血管化膜的包封装置,包封装置容纳在生物反应器中;其中氧气传感器检测介质的含氧量以确定细胞的耗氧率。
在一些实施方式中,热交换器和气体交换器彼此分离。在一些实施方式中,热交换器和气体交换器组合在一起。
本发明还包括测量耗氧率(OCR)或其它特征(例如,上述胰岛素分泌等)的方法。所述方法可包括在从7℃到27℃的温度下通过根据本发明的系统泵送介质;其中氧气传感器检测介质的含氧量,以确定细胞的耗氧率。
本发明还包括测量细胞存活率的方法。在一些实施方式中,所述方法包括(在具有包封装置的系统中,包封装置具有细胞接受外源氧气,所述细胞包括胰岛细胞或干细胞衍生的β细胞),中断向细胞输送外源氧气;将包封装置中细胞的温度设置为从7℃到27°;以及测量耗氧率(OCR),其中某个特定的OCR水平表明有存活细胞。
本发明还包括测量细胞存活率的方法。在一些实施方式中,所述方法包括(在具有包封装置的系统中,包封装置具有细胞接受外源氧气,所述细胞包括胰岛细胞或干细胞衍生的β细胞),中断向细胞输送外源氧气;将包封装置中细胞的温度设置为从7℃到27°;以及测量耗氧率(OCR),其中某个特定的OCR水平表明有充足的用于移植包封装置的存活细胞。
在一些实施方式中,上述方法包括将温度升高到37℃,并测量细胞的葡萄糖刺激胰岛素分泌(GSIS)。在一些实施方式中,上述方法包括将温度升高到37℃,并测量细胞的葡萄糖刺激胰岛素分泌(GSIS),其中阈值水平之内或阈值水平之上的胰岛素分泌水平表明有充足的用于移植包封装置的存活细胞。
其它参数包括其它化学、激素/多肽释放(诸如葡萄糖、C-肽、胰多肽)的释放(细胞分泌),上述释放可被促分泌素或其它化学试剂(诸如葡萄糖、精氨酸、KCI、GLP-1)诱导或抑制。
在一些实施方式中,氧气传感器设置在保持具有细胞的包封装置的生物反应器的入口和出口处。在一些实施方式中,系统还包括葡萄糖传感器、乳酸传感器、pH传感器、CO2传感器、或其组合。
本发明还包括将细胞加载到接收外源氧气中(细胞包括胰岛细胞或干细胞衍生的β细胞)的包封装置中的方法。在一些实施方式中,所述方法包括将包封装置的温度降低到一定的低温(例如,4到8℃,7到15℃等);并且通过细胞加载端口将细胞加载到包封装置中,其中低温有助于最小化细胞的缺血性或物理性损伤。
在本文的一些实施方式中,外源氧气以约40%的含氧量输送至装置中。
在一些实施方式中,包封装置保持在容器中,所述容器适于将包封装置保持在介质中。在一些实施方式中,包封装置包括用于向一层或多层细胞提供冷却介质或氧气的导管。在一些实施方式中,氧气传感器操作性地连接至用于调节输送至细胞的外源氧气的系统。
本文描述的任何特征或特征的组合都包括在本发明的范围内,只要通过上下文、本申请文本及本领域普通技术人员的知识可以显而易见得出该任一组合中所包含的特性不是互相矛盾的。本发明的其它优势和方面从下面的详细描述及权利要求来看是显而易见的。
附图说明
结合附图给出的以下详细描述,本发明的特征和优势将变得显而易见。
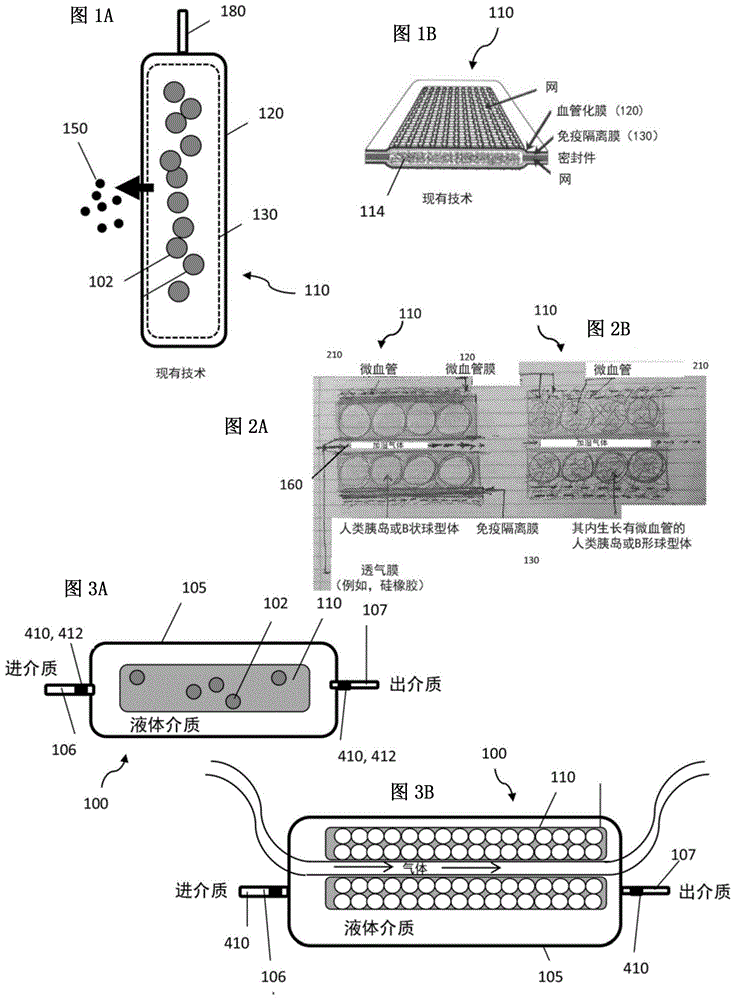
图1A示出了保持细胞或组织的单室包封装置的实例。该装置包括进入腔体的端口以加载细胞或组织。
图1B示出了图1A的装置的剖面视图。细胞被包封在利用网状插入物而形成的双层膜包膜中。该装置包括血管化膜和免疫隔离膜。本发明不限于使用免疫隔离膜的装置,在一些实施方式中,该装置仅包含血管化膜。
图2A示出了具有免疫隔离膜的包封装置的细节视图。该装置包括由气道分离的两个腔室或腔体。
图2B示出了不具有所述免疫隔离膜的包封装置的细节视图。该装置包括由气道分离的两个腔室或腔体。
图3A示出了包括生物反应器和细胞设置其中的包封装置的系统的示意图。液体介质通过入口(可包括具有氧气传感器的流体细胞)流进并从出口(可包括具有氧气传感器的流体细胞)流出。在一些实施方式中,包封装置是单室装置。在一些实施方式中,包封装置是具有设置在腔室之间的气道(例如,氧气通道)的双室装置(例如,允许更高密度)。在一些实施方式中,入口和出口处的传感器用于测量耗氧率(可被用作评估具有细胞的装置的存活率的方式)。
图3B示出了可能出现在图3A系统中的双室装置的示意图。气道可被密封或气体可通过气道的导管排出。
图4是本发明的系统的示意图。
具体实施方式
包封装置
包封装置是保持细胞或组织的装置。图1A中所示的包封装置(110)为单室包封装置。该装置(110)包括保持细胞(102)或组织的内腔和对细胞不可渗透至少一个膜,例如血管化膜(120)。在一些实施方式中,装置(100)还包括免疫隔离膜(130)。非细胞因子或分子(150)能够从细胞不可渗透膜逃逸。装置(110)还包括可以进入腔体的端口(180)以加载细胞或组织。图1B示出了包封装置的剖面视图。细胞被双层膜包膜、血管化膜(120)和免疫隔离膜(130)包封在腔体(114)内。装置(110)还具有结构支撑件,例如网、密封件等。脉管系统可在装置(110)周围生长。
在一些实施方式中,包封装置包括血管化膜(120)和免疫隔离膜(130)。在一些实施方式中,包封装置仅包括血管化膜(120)。这使得血管能够在移植组织中生长。
在图1A和图1B所示的实例中,其中的细胞直径约为5-15μm。外膜,即血管形成膜(120),的孔径为5-10μm,厚度约为15μm。免疫隔离膜(130)的孔径约为0.4μm,厚度约为30μm。在一些实施方式中,所述膜(120,130)由诸如聚四氟乙烯(PTFE)或其他类似材料构成。本发明中所使用的膜不限于上述孔径和厚度。本发明亦不限于上述材料。
包封装置(110)可以具有各种形状和尺寸,且可包括不同体积的腔体。例如,在一些实施方式中,腔体的体积为4.5μl。在一些实施方式中,腔体的体积为20μl。在一些实施方式中,腔体的体积为40μl。在一些实施方式中,装置(110)的长度为4-5cm。在一些实施方式中,装置(110)的长度为2-5cm,如3cm。在一些实施方式中,装置(110)的长度为5-10cm。本发明不限于上述尺寸及腔体的体积。例如,在一些实施方式中,腔体的体积约为100μl。在一些实施方式中,腔体的体积约为200μl。在一些实施方式中,腔体的体积为2-50μl。在一些实施方式中,腔体的体积为10-100μl。在一些实施方式中,腔体的体积为40-200μl。在一些实施方式中,腔体的体积为100-300μl。在一些实施方式中,腔体的体积为200-500μl。
在一些实施方式中,包封装置(110)内可以有细胞层或组织层,例如装置(110)内的多个腔体。例如,包封装置(110)可以包括两个腔室或腔体。在一些实施方式中,该装置包括两个以上的腔室或腔体,例如3个腔室或腔体,4个腔室或腔体,5个腔室或腔体等。图2A及图2B示出了包括被气道(160)隔开的两个腔体(两个腔室)的包封装置的实例。图2A及图2B也示出了血管化膜和微脉管系统,其中血管嵌入所述血管化膜。
在一些实施方式中,所述腔室或腔体包括单层细胞。在一些实施方式中,所述腔室或腔体包括两层细胞。在一些实施方式中,所述腔室包括三层或三层以上的细胞。在一些实施方式中,使用胰岛球状体(尺寸约为150μm)(图2A、2B中示出)。在一些实施方式中,使用了双层胰岛球状体(在腔室中或每个腔室中腔体厚度约为300μm)。在一些实施方式中,取决于所使用的球状体/细胞的新陈代谢活动和其它特征,支持第三层。请注意在一些配置中球状体彼此可能不能触碰到并且它们之间的空间可能是1或2个球状体(如,150μm、300μm),或更多或更少。
用于监测细胞的方法和系统
图3A示出了包括生物反应器和细胞设置其中的包封装置的系统(100)。液体包围包封装置(110)。在一些实施方式中,包封装置是单室装置。在一些实施方式中,包封装置是具有设置在腔室之间的气道(例如,氧气通道)的双室装置(例如,允许更高密度)。介质通过入口(106)(可包括具有氧气传感器(410)的流体细胞(412))流进并从出口(107)(可包括具有氧气传感器(410)的流体细胞(412))流出。在一些实施方式中,入口处和出口处的传感器用于测量耗氧率(可被用作评估细胞的存活率和健康状况的方式)。
图3B示出了包括双室装置(例如,在图3A所示的系统中使用)的系统的示意图,该装置具有被气道(160)分离的第一腔室(113a)和第二腔室(113b)。气体(例如,空气、氧气)经由气道通过腔室的中间被输送以保护细胞的存活率和功能。气道不会泄露到生物发生器的介质中,并且不会引起生物发生器中的介质的泄露(其与介质和生物发生器的入口/出口分离)。
胰岛素分泌要求生理温度,所以对装置中细胞胰岛素分泌的评估需要在37℃进行(在更低温度下进行的评估不准确)。
在气体流通气道的情况下,耗氧率(OCR)不能进行准确评估。对于OCR测量,气流需要停止,但是温度被降低以使得装置中心的细胞拥有充足的氧气并且OCR不受氧气限制。
OCR测量可在37℃以下进行(例如,7℃到27℃、例如,7℃、8℃、9℃、10℃、11℃、12℃、13℃、14℃、15℃、16℃、17℃、18℃、19℃、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃等)。温度可根据装置内的新陈代谢活动和细胞密度调节至更低值。OCR可预测地依赖于温度,因此细胞的健康状况仍可以由合适的温度校正(阿列纽斯型关系)来评估。例如,温度在7℃到37℃的范围内降低时,OCR可预测地下降。
图4是本发明的系统的示意图。生物反应器(105)容纳具有细胞的包封装置(110)例如单腔室、双腔室等。介质经由泵通过热交换器或气体交换器(或热、气交换器的组合装置)被泵送,这个过程将介质带到一定温度和特定含氧量的状态。然后介质流经入口(106)并经过氧气传感器(410),经过生物反应器(105)并且从出口(107)流出并经过另一个氧气传感器(410)。样品(用于胰岛素分泌评估)可从出口外侧的点获取。介质可以例如被回收并流经水槽或培养箱。或者介质可被废弃。
在一些实施方式中,热气交换器组合装置(或独立的热交换器)将介质加热至7℃到37℃之间的温度(胰岛素分泌评估可在37℃进行,并且温度接下来会降低以进行OCR测量)。在一些实施方式中,气体交换器将介质氧合至从0-100%的百分比(例如,40%)。含氧量可根据曝光量进行选择。
对于胰岛素分泌功能测量,高氧(例如,40%氧气)可能会在双细胞腔室装置中间出现(伴随温度为37℃)。
对于耗氧率(OCR)测量,在双细胞腔室中间不提供气体。温度被降低(例如,降低到7℃到17℃之间的温度)。
本发明包括在移植前(例如,在存储过程中)和/或在移植后实时监测包封装置中细胞的方法和系统(例如,细胞存活率、耗氧率、胰岛素分泌水平等)。图3和图4示出了用于将细胞存储在包封装置中的系统和装置的实例。这些装置可能装配有传感器(410)和读取器和其它特征以帮助实时测量细胞参数来确定细胞存活率。
在一些实施方式中,介质处于从4到8℃的温度,例如4℃、5℃、6℃、7℃、8℃。在一些实施方式中,介质处于从2到8℃的温度。在一些实施方式中,介质处于从4到10℃的温度。在一些实施方式中,介质处于从2到15℃的温度。在一些实施方式中,介质处于从10到20℃的温度。在一些实施方式中,介质处于从20到30℃的温度。在一些实施方式中,介质处于从30到38℃的温度。在一些实施方式中,含氧量约为40%。在一些实施方式中,含氧量低于40%或高于40%。在一些实施方式中,含氧量从0-5%。在一些实施方式中,含氧量从5-15%。在一些实施方式中,含氧量从15-25%。在一些实施方式中,含氧量从25-35%。在一些实施方式中,含氧量从35-40%。在一些实施方式中,含氧量从40-50%。在一些实施方式中,使用空气(例如,含氧量约为21%)。本发明不限制于这些温度或含氧量。含氧量也可以变化。在一些实施方式中,最初使用特定的含氧量并且晚些时候所述含氧量被升高或降低。在一些实施方式中,氧气先被打开再被关闭。在一些实施方式中,氧气先被关闭再被打开。在一些实施方式中,氧气在一段时间内或无限期的执行开通和断开的循环。
一个或多个传感器(例如,两个传感器、三个传感器、四个传感器等)被集成到系统中,例如,操作性地连接至包封装置或适当地定位在包封装置附近。传感器可帮助测量耗氧率、胰岛素分泌水平、葡萄糖水平、乳酸水平、pH水平、二氧化碳水平、或其组合。
例如,在一些实施方式中,第一氧气传感器设置在包封装置的入口处并且第二氧气传感器设置在包封装置的出口处,其中两个传感器用于测量耗氧率(OCR)。例如,第一氧气传感器和第二氧气传感器之间的pO2差异可被用来确定包封细胞的OCR。这是组织存活率的测量。
传感器(例如,氧气传感器)可被用来帮助确定细胞何时死亡(例如,通过氧气传感器等)。不希望本发明受限于任何理论或机制,如果装置内部和外部的含氧量基本没有差异,细胞很可能已死亡。通常,装置内部外部的含氧量之间都有差异(梯度),因为氧气正被活细胞消耗。因此,没有差异可能表明没有氧气消耗,细胞很可能已死亡。装置内部和外部含氧量更大的差异(梯度)可能表明有更多的存活细胞。用户可通过确定氧气梯度的变化来确定多少细胞正在死亡。
氧气流进包封装置会干预细胞的OCR测量。因此,本发明的方法包括停止向细胞输送氧气。测量OCR的方法还包括将包封装置和/或装置周围介质的温度降低到4到8℃之间的温度,其可以帮助降低细胞的代谢率并因此降低它们的氧气需求(允许氧气输送被切断)。OCR测量可能继续进行。不希望本发明限制于任何理论或机制,据信在OCR测量期间保持低温可帮助提高测量的准确性,因为在高温下测量OCR会受到浓集细胞内氧气耗尽的影响,由于这些细胞在高温下的氧气消耗更高。
细胞效能的测量,例如,葡萄糖刺激胰岛素分泌(GSIS)的测量会在细胞处于约37℃,或从34到40℃的温度(例如,34℃、35℃、36℃、37℃、38℃、39℃、40℃)时进行。
可以适当地每分钟或以更短或更长的时间间隔测量胰岛素。测量GSIS的方法被本领域技术人员知晓。不希望本发明限制于任何理论或机制,据信封装装置中的氧气流量可能对适当的GSIS测量至关重要。
本发明还包括帮助在包封装置加载期间降低细胞损伤(例如,缺血性损伤、物理性损伤等)的方法。在一些实施方式中,所述方法包括降低细胞的温度,例如,降至4到8℃的温度(其降低了细胞代谢率)。细胞可能存在于诸如传统培养基、诸如血清补充或人类血清蛋白(HSA)补充RPMI、DMEM、或任何其它恰当的介质中。所述方法可包括将氧气输送至装置或介质。在一些实施方式中,普朗尼克酸在加载期间被使用以避免细胞损伤。这可能有益于细胞加载最优化。同样,低温(例如,从4到8℃)下的OCR测量可帮助确定加载期间装置中的存活细胞数目。
以下美国专利的全部内容通过引用结合于此:PCT/US2011/055157。
除了本文所述内容之外,依照前述的描述,多种修正形式对于本领域的技术人员将显而易见。这些修正落入本发明随附权利要求的范围内。所引用的每篇参考文献都通过引用整体并入本申请中。
尽管已经示出并描述了本发明的优选实施方式,但是显而易见地,本领域技术人员可以对其进行不超出所附权利要求范围的修改。因此,本发明的范围仅受以下权利要求的限制。权利要求中记载的附图标记是示例性的,仅为了便于专利局审查,其不以任何方式限制本发明。在一些实施方式中,本专利申请中呈现的附图是按比例绘制的,包括角度,尺寸比等。在一些实施方式中,附图仅仅是一个代表,且权利要求不受附图尺寸的限制。在一些实施方式中,使用“包括”所描述的本发明的说明书包括可被描述为“由......组成”的实施方式。因此,满足使用短语“由......组成”来要求本发明的一个或多个实施方式的书面描述要求。
在以下权利要求中记载的附图标记仅仅是为了便于审查本专利申请,并且是示例性的。其不以任何方式将权利要求的范围限制为具有附图中的对应附图标记的特定特征。
- 还没有人留言评论。精彩留言会获得点赞!