一种朱顶红叶片诱导体细胞胚并再生植株的方法与流程
本发明属于植物诱导再生技术领域,具体涉及一种朱顶红叶片诱导体细胞胚并再生植株的方法。
背景技术:
朱顶红(hippeastrumhybridumhort.)又名朱顶兰、孤挺花、华胄兰等,为石蒜科朱顶红属重要多年生的草本植物,原产热带美洲,是世界著名的球根花卉。
朱顶红的组织培养研究始于20世纪70年代,多采用鳞茎、鳞茎盘、幼嫩蒴果、幼嫩花茎、幼胚或下胚轴为起始材料,经诱导培养获得愈伤组织、不定芽或体细胞胚,然后培养获得完整植株。上述再生技术效率较低。近年来的现有技术中,人们以花瓣为外植体建立了有效的植株再生体系,但花瓣外植体的获取受到季节等因素的限制,且繁殖效率仍然偏低。
技术实现要素:
针对现有技术的不足,本发明提供了一种朱顶红叶片诱导体细胞胚并再生植株的方法。本发明采用朱顶红试管苗叶片作为外植体,建立了高效的体细胞胚发生途径的植株再生体系。本发明可有效解决现有技术中花瓣外植体的获取受季节等因素限制的问题,并且可显著提高朱顶红组培繁殖效率。植株再生率最高可达98.6%,平均每个外植体最多可产生26.8棵小植株。
本发明是通过下文的技术方案予以实现的。
一种朱顶红叶片诱导体细胞胚并再生植株的方法,包括如下步骤:
s1.外植体获取:将朱顶红试管苗在24~26℃,每日12~14h光照环境下继代培养,待长出新叶后,切取叶片,(垂直于叶片纵轴进行横切,)叶片切成适宜长度片段作为外植体;
s2.体细胞胚诱导:将s1中处理好的外植体水平放置于诱导培养基上,在24~26℃,黑暗条件下培养,叶片的外表面产生体细胞胚;
s3.植株再生:将s2中产生的体细胞胚转移至再生培养基上,在24~26℃、,每日12~14h光照环境下培养,体细胞胚萌发形成完整植株。
优选地,s1中选取的长出新叶的长度为0.5~5.0cm,所述叶片切成适宜长度片段为0.5~1.0cm。
优选地,s1所述继代培养的培养基为以ms培养基为基本培养基,并添加0~1.0mg/l6-苄基氨基腺嘌呤(6-ba)和20~40g/l蔗糖,ph5.8~6.0。
优选地,s2所述诱导培养基以ms培养基为基本培养基,并添加0.1~1.0mg/l噻苯隆(tdz)和20~40g/l蔗糖,ph5.8~6.0。更优选地,所述噻苯隆(tdz)在诱导培养基中的添加量为0.2~0.7mg/l。
优选地,s3所述再生培养基以ms培养基为基本培养基,并添加0~1.0mg/l6-苄基氨基腺嘌呤(6-ba)和20~40g/l蔗糖,ph5.8~6.0。更优选地,所述6-苄基氨基腺嘌呤(6-ba)在再生培养基中的添加量为0~0.5mg/l。
优选地,s1和s3光照的强度为1000~1400lux。
优选地,s2中培养的时间8~12周,s3中培养的时间为4~8周。
更优选地,在s1中朱顶红试管苗在24~26℃,每日12~14h光照环境下继代培养,待长出新叶片后0.5~5.0cm长度时,切取叶片,垂直于叶片纵轴进行横切,切成适宜长度为0.5~1.0cm的片段作为外植体。
更优选地,在s2中,将s1中处理好的外植体水平放置于诱导培养基上,在24~26℃,黑暗条件下培养8~12周,叶片的外表面产生体细胞胚;诱导培养基为以ms培养基为基本培养基,添加0.5mg/l噻苯隆(tdz)和20~40g/l蔗糖,ph5.8~6.0。
更优选地,在s3中,将s2产生的体细胞胚转移至再生培养基上,在24~26℃,每日12~14h光照强度为1000~1400lux的环境下培养4~8周,体细胞胚萌发形成完整植株;再生培养基为以ms培养基为基本培养基,添加0.5mg/l6-苄基氨基腺嘌呤(6-ba)和20~40g/l蔗糖,ph5.8~6.0。
与现有技术相比,本发明的有益效果在于:
(1)在朱顶红试管苗培养过程中,能够不受季节的限制地源源不断的形成新的叶片组织。叶片外植体的获取非常容易,成本非常低廉。本发明利用叶片作为外植体进行组培快繁,有效解决了现有技术中花瓣外植体的获取受季节等因素限制的问题。
(2)目前,尚未以朱顶红叶片为外植体建立高效植株再生体系。本发明采用试管苗叶片作为外植体,建立了高效的体细胞胚发生途径的植株再生体系,其体细胞胚诱导率最高达96.7%,植株再生率最高达98.6%,平均每个外植体最多可产生26.8棵小植株。与现有技术相比,植株的再生效率明显提高。
(3)以再生植株及其继代培养的植株后代的叶片为外植体,可重复实现上述体细胞胚诱导与植株再生过程,从而实现朱顶红大规模的可持续的工厂化种苗生产。
附图说明
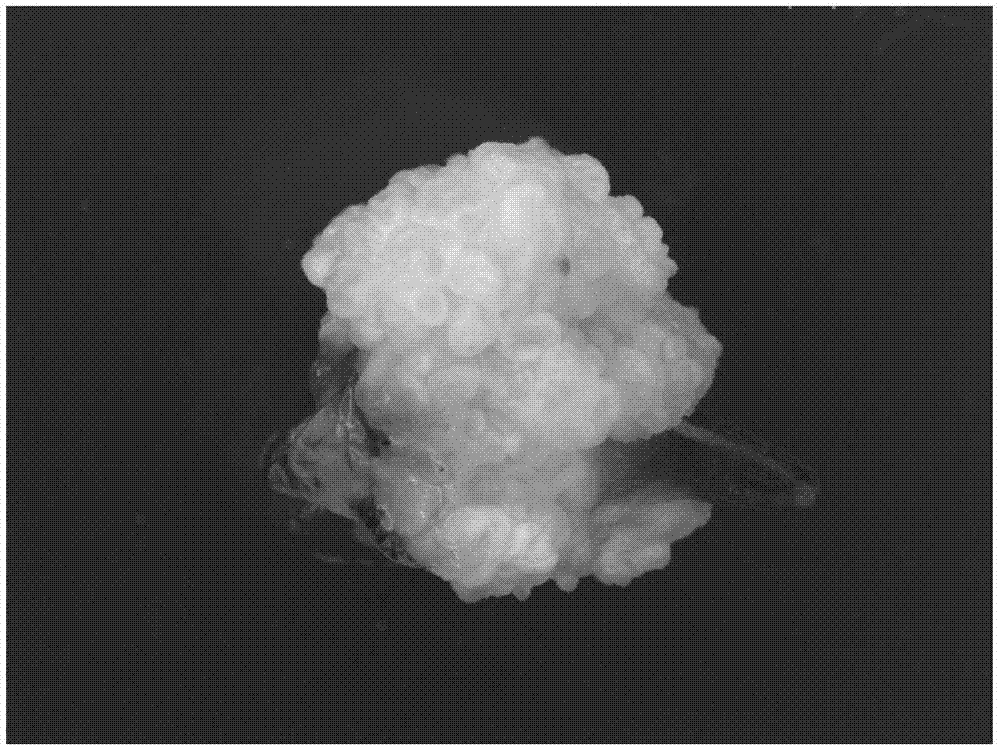
图1为朱顶红叶片外植体诱导形成体细胞胚的实物图。
图2为朱顶红植株再生后的实物图。
图3为本技术方案中实施例1的具体流程图。
具体实施方式
下面结合说明书附图和具体实施例对本发明做进一步详细说明,但实施例并不对本发明做任何形式的限定。本领域技术人员应当了解,本发明由权利要求书界定保护范围,任何形式的等同替换均落入本发明的权利要求。
图1为朱顶红叶片外植体诱导形成体细胞胚的实物图,图2为朱顶红植株再生后的实物图。从图1和图2可以看出,本发明的技术效果是可以实现的。
实施例1
如图3所示,本实施例1的一种朱顶红叶片诱导体细胞胚并再生植株的方法具体步骤如下:
步骤1、朱顶红试管苗在24~26℃,每日12~14h光照强度为1000~1400lux环境下继代培养,待长出新叶片后0.5~5.0cm长度时,切取叶片,垂直于叶片纵轴进行横切,切成适宜长度为0.5~1.0cm的片段作为外植体;
步骤2、将步骤1中处理好的外植体水平放置于诱导培养基上,在24~26℃,黑暗条件下培养8~12周,叶片的外表面产生体细胞胚;诱导培养基为以ms培养基为基本培养基,添加0.1~0.5mg/l噻苯隆(tdz)和20~40g/l蔗糖,ph5.8~6.0;
步骤3、将步骤2产生的体细胞胚转移至再生培养基上,在24~26℃,每日12~14h光照强度为1000~1400lux的环境下培养4~8周,体细胞胚萌发形成完整植株;再生培养基为以ms培养基为基本培养基,添加0.5mg/l6-苄基氨基腺嘌呤(6-ba)和20~40g/l蔗糖,ph5.8~6.0。
表1用以说明在浓度0.1~1.0mg/l的tdz对朱顶红叶片体细胞胚诱导率的影响。在其他条件稳定的情况下,从表中可以看出,0.1~0.4mg/l的噻苯隆(tdz)浓度时,随着tdz浓度的升高,体细胞胚的诱导率逐渐提高,在0.5mg/l时体细胞胚的诱导率达到最高值,随后当tdz浓度继续从0.6mg/l升高到1.0mg/l时,体细胞胚的诱导率开始明显下降。由此可知,0.5mg/l的tdz为体细胞胚诱导率最高的浓度,因此本实施例1在实施该方法时选择此0.5mg/l浓度的噻苯隆(tdz),以达到理想的实施效果,提高朱顶红叶片体细胞胚诱导再生的成功率。
表1tdz对朱顶红花瓣体细胞胚诱导的影响
注:体细胞胚诱导率(%)=(诱导出体细胞胚外植体数÷接种的全部外植体数)×100%。
实施例2
本实施例2的一种朱顶红叶片诱导体细胞胚并再生植株的方法具体过程如下:
步骤1、朱顶红试管苗在24~26℃,每日12~14h光照强度为1000~1400lux环境下继代培养,待长出新叶片后0.5~5.0cm长度时,切取叶片,垂直于叶片纵轴进行横切,切成适宜长度为0.5~1.0cm的片段作为外植体;
步骤2、将上述中处理好的外植体水平放置于诱导培养基上,在24~26℃,黑暗条件下培养8~12周,叶片的外表面产生体细胞胚;诱导培养基为以ms培养基为基本培养基,添加0.5mg/l噻苯隆(tdz)和20~40g/l蔗糖,ph5.8~6.0;
步骤3、将步骤2产生的体细胞胚转移至再生培养基上,在24~26℃,每日12~14h光照强度为1000~1400lux的环境下培养4~8周,体细胞胚萌发形成完整植株;再生培养基为以ms培养基为基本培养基,添加0~1.0mg/l6-苄基氨基腺嘌呤(6-ba)和20~40g/l蔗糖,ph5.8~6.0。
表2用以说明在浓度0~1.0mg/l的6-ba对植株再生的影响。在其他条件稳定的情况下,从表2中可以看出,在0~1.0mg/l浓度范围内的6-苄基氨基腺嘌呤(6-ba),在0.5mg/l浓度时达到植株再生的的最好效果。
表26-ba对植株再生的影响
注:植株再生率(%)=(再生出植株的外植体数÷接种的具有体细胞胚的外植体总数)×100%。
- 还没有人留言评论。精彩留言会获得点赞!