昆虫中的核酸内切酶定性和绝育的制作方法
相关申请的交叉引用
本申请要求2017年11月21日提交的,题目为“novelsterileinsecttechnique”的美国临时申请系列号62/589,405的优先权和权益,其全部内容通过引用并入本文。
关于联邦资助的研究和开发的声明
本发明是在美国国立卫生研究院授予的基金号5k22ai113060和1r21ai123937以及国防部高级研究计划局授予的基金号hr0011-17-2-0047的政府支持下进行的。政府享有本发明的某些权利。
背景技术:
被称为昆虫不育技术(sit)的不育雄性的大规模生产和释放在历史上一直被用来控制和根除害虫种群,这可追溯到二十世纪三十年代中期。先前的方法依靠dna破坏剂进行不育,基本上降低了释放的雄性的整体健康度(fitness)和交配竞争力。为了克服这些问题,已经开发了微生物介导的不育技术比如基于沃尔巴克氏菌的昆虫不相容技术(iit)和现代遗传sit样系统比如携带显性致死基因的昆虫的释放(昆虫显性致死释放技术,releaseofinsectscarryingadominantlethal,ridl),以及基因杀死雌性的释放可育雄性的其他方法,比如雌性特异性ridl(fsridl)和常染色体连锁的x染色体粉碎机(shredder)。虽然这些第一代基因sit技术代表了显著进步,但iit严格要求不能释放被感染的雌性,这在野外难以实现,并且已知使用四环素消融(ablate)微生物群会损害ridl/fsridl雄性的健康度,并且x染色体粉碎机原则上只能在具有异配性染色体的物种中开发,从而限制了对其他物种的广泛适用性。因此,采用更有效的基于sit的技术在逻辑上将是有利的,该技术可以部署为卵——只有不育的雄性存活。
技术实现要素:
本公开内容的实施方式的方面涉及包括精确引导的昆虫不育技术(pgsit)的方法。
在本公开内容的一些实施方式中,在基因修饰的昆虫中指导雄性定性的方法包括:将至少一个核酸序列整合到第一昆虫的基因组中,该至少一个核酸序列具有至少一个第一引导多核苷酸,该第一引导多核苷酸靶向雌性特异性生存力所必需的雌性必要的基因组序列;将核酸内切酶引入第二昆虫内,第二昆虫能够与第一昆虫遗传杂交;并将第一昆虫和第二昆虫遗传杂交,从而产生表达核酸内切酶和至少一个核酸序列的后代,来自该后代的雄性昆虫卵成熟至成年。
在本公开内容的一些实施方式中,产生基因修饰的不育雄性昆虫卵的后代的方法包括:将至少一个核酸序列整合到第一昆虫的基因组中,该至少一个核酸序列具有至少一个第一引导多核苷酸,该第一引导多核苷酸靶向雌性特异性生存力所必需的雌性必要的基因组序列;将核酸内切酶引入第二昆虫内,第二昆虫能够与第一昆虫遗传杂交,其中至少一个核酸序列进一步包括至少一个第二引导多核苷酸,该第二引导多核苷酸靶向雄性特异性不育所必需的雄性不育基因组序列;和将第一昆虫和第二昆虫遗传杂交以产生基因修饰的不育雄性昆虫卵的后代。
在本公开内容的一些实施方式中,将至少一个核酸序列整合到第一昆虫的基因组中包括纯合地整合到基因组中的所有染色体拷贝中。在一些实施方式中,整合至少一个核酸序列包括在胚胎阶段期间将至少一个核酸序列引入第一昆虫。
在本公开内容的一些实施方式中,至少一个第一引导多核苷酸和至少一个第二引导多核苷酸各自包括至少一个引导核糖核酸(grna)。
在本公开内容的一些实施方式中,雌性必要的基因组序列包括雌性特异性生存力必要的基因或雌性特异性发育和/或雌性特异性生存力必要的雌性特异性外显子。
在本公开内容的一些实施方式中,至少一个第一引导多核苷酸包括多于一个第一引导多核苷酸,每一个第一引导多核苷酸靶向雌性特异性生存力所必需的相同的雌性必要的基因组序列的不同区域。
在本公开内容的一些实施方式中,至少一个第一引导多核苷酸包括多于一个第一引导多核苷酸,每一个第一引导多核苷酸靶向雌性特异性生存力所必需的不同的雌性必要的基因组序列。
在本公开内容的一些实施方式中,雌性必要的基因组序列是基因或基因的剪接变体,该基因选自性决定致死基因(sxl)、转换基因(tra)、双性基因(dsx)、其同源物、其直系同源物、其旁系同源物或其组合。
在本公开内容的一些实施方式中,至少一个第一引导多核苷酸包括多于一个第一引导多核苷酸,每一个第一引导多核苷酸靶向选自sxl、tra或dsx的不同基因,包括其同源物、其直系同源物或其旁系同源物。
在本公开内容的一些实施方式中,多于一个第一引导多核苷酸包括两个第一引导多核苷酸,每一个第一引导多核苷酸靶向选自sxl、tra或dsx的不同基因,包括其同源物、其直系同源物或其旁系同源物。
在本公开内容的一些实施方式中,多于一个第一引导多核苷酸包括两个第一引导多核苷酸,每一个第一引导多核苷酸靶向选自sxl或dsx的不同基因,包括其同源物、其直系同源物或其旁系同源物。
在本公开内容的一些实施方式中,雄性不育基因组序列是选自βtubulin85d(βtub)、fuzzyonions(fzo)、鱼精蛋白a(prota)或精母细胞阻滞(spermatocytearrest)(sa)的基因,包括其同源物、其直系同源物或其旁系同源物。
在本公开内容的一些实施方式中,当第二昆虫是雄性时,将核酸内切酶引入第二昆虫中包括纯合地整合编码核酸内切酶的基因,和当第二昆虫为雌性时,将核酸内切酶引入第二昆虫中包括纯合地或杂合地整合编码核酸内切酶的基因或将核酸内切酶蛋白沉积到第二昆虫中。
在本公开内容的一些实施方式中,将核酸内切酶引入第二昆虫中包括在胚胎阶段期间将核酸内切酶引入第二昆虫中。
在本公开内容的一些实施方式中,基因修饰的昆虫卵的后代包括根据本公开内容的方法产生的高达100%的雄性昆虫卵。
在本公开内容的一些实施方式中,基因修饰的昆虫卵的后代包括根据本公开内容的方法产生的高达100%的不育雄性昆虫卵。
在一些实施方式中,根据本公开内容的方法产生的基因修饰的不育雄性昆虫能够通过与野生型雌性昆虫交配增加未孵化卵的比率。
在本公开内容的一些实施方式中,减少野生型昆虫种群的方法包括将根据本公开内容的方法产生的基因修饰的不育雄性引入野生型昆虫种群中。
附图说明
专利或申请文件包含至少一个彩色执行的附图。在请求并支付必要的费用后,专利局将提供带有彩色附图(一个或多个)的本专利或专利申请公开的副本。附图与说明书一起图解了本公开内容的实例实施方式,并且与说明书一起用于解释本公开内容的原理。
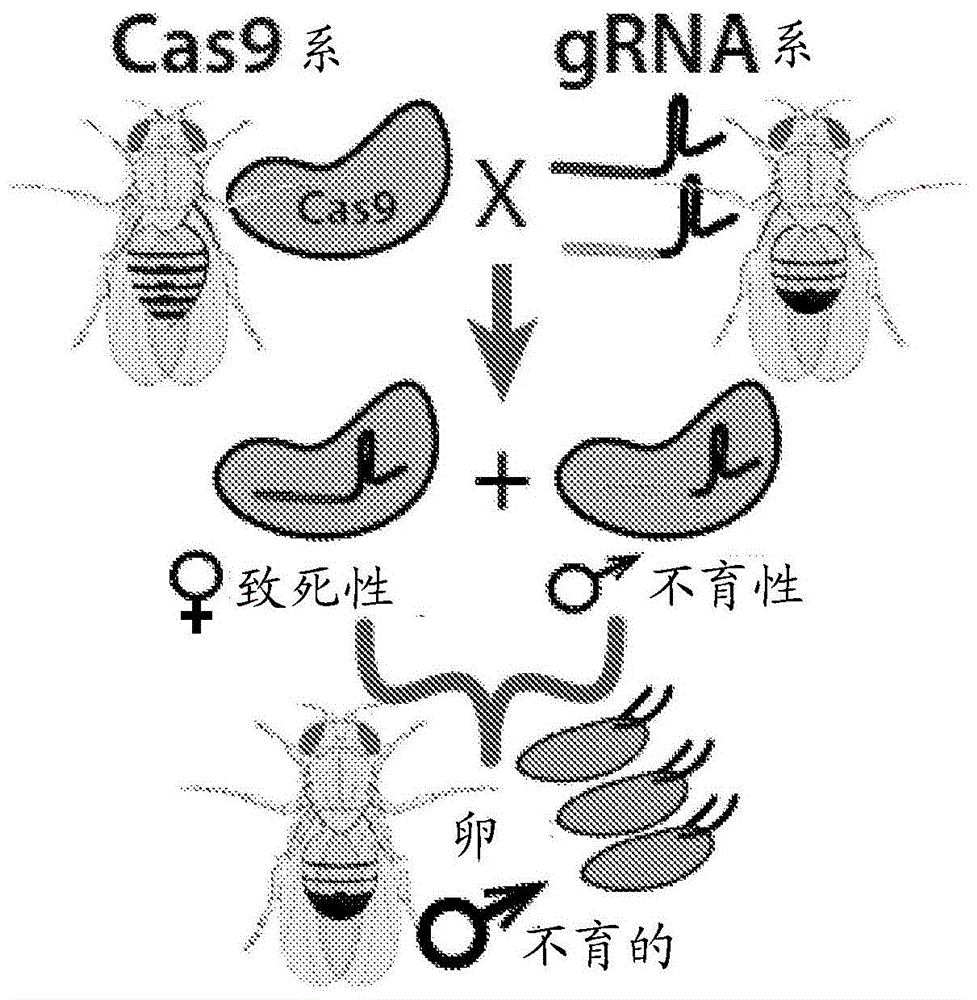
图1a是根据本公开内容的实施方式,利用二元crispr/cas9系统的两种组分——核酸内切酶cas9和引导核糖核酸(grnas)(蓝色或绿色靶特异性序列)的pgsit的示意图,该这两组分保持为分开的纯合系,它们的杂交导致雌性生存力所需的基因和雄性不育所需的基因的并发或同时基因敲除,导致仅f1不育雄性的存活。
图1b是根据本公开内容的实施方式,由sxl(绿色)和tra(黄色)蛋白质的雌性表达调节的sxl、tra和dsx基因中的性别特异性可变剪接的示意图(灰色线);关键性别决定基因sxl、tra和dsx的雌性特异性外显子的破坏,破坏了雌性发育;并且pgsit外显子靶标由黄色叉号表示。
图1c呈现了根据本公开内容的实施方式工程化的所有构建体的示意图,其中功能构建体和蝇类分别保藏于addgene.org和bloomington果蝇保存中心(bloomingtondrosophilastockcenter)。基因名称和grna靶位点序列呈现在框中。spcas9的编码序列在两端侧接两个核定位信号(nls)和在c-端侧接带有egfp编码序列的自切割t2a肽,充当cas9表达的视觉指标。
图1d是根据本公开内容的实施方式工程化的表达酿脓链球菌cas9(spcas9)的三个新的纯合系的荧光立体显微镜图像。开发了支持spcas9在严格的生殖系或与体细胞一起的生殖系中表达的三种果蝇系。使用
图1e显示了与根据本公开内容的实施方式的工程化的亲本昆虫杂交的f1后代中平均性别频率的条形图。上面的两个图描绘了来自纯合sgrna系与野生型(wt)的双向对照杂交的性别频率,这表明可育雌性和雄性(♀和♂)以相似的比率存在,但是未鉴定到不育的雌雄间性(□)。可育雌性以粉红色显示,可育雄性以蓝色显示,不育雌性以橙色显示,和不育雄性以灰色显示。下面的两个图显示了来自纯合子nanos-cas9(nos-cas9)与野生型(对照)和四个纯合sgrna系(实验)的杂交的性别频率。独立于母本或父本cas9继承,100%的反式杂合sgrnasxl♀是致死的,100%的反式杂合sgrnatr和sgrnadsxf♀被雄性化为不育雌雄间性□,并且100%的反式杂合sgrnaβtu♂是不育的。将反式杂合子中的性别频率和生育力与nos-cas9(实线)或sgrnas(虚线)和野生型蝇类的对照杂交的相应后代中的那些比较。每个条形图显示平均性别频率和一个标准差。用t检验计算统计学显著性,假设方差不相等,并且对于雄性不育,使用皮尔森卡方检验计算列联表的p值(红色*)。(p>0.001***)。
图1f是根据本公开内容的实施方式来自纯合的单个grna(sgrna/sgrna)和纯合的nos-cas9(nos-cas9/nos-cas9)之间的杂交的f1后代的表。
图1g是使用根据本公开内容的实施方式的方法,由grna靶向的基因分型基因座的表,其中在反式杂合蝇中发现插入/缺失((insertions/deletions)indel)(红色文本)。
图2a显示了根据本公开内容的实施方式由双grna(dsrna)和cas9纯合系之间的杂交产生的反式杂合f1后代的性别(♀(雌性)、♂(雄性)和□雌雄间性)频率的条形图。将分别与βtub组合靶向sxl、tra或dsx的三个双引导rna(dgrna)与由nanos(nos)、vasa(vas)和ubiquitin-63e(ubi)启动子驱动的三个cas9系双向杂交,并足以确保在每个正反交中雌性致死/雄性化和雄性不育二者的完全外显率,如图1c-1d中所指示的。将反式杂合子中的性别频率和生育力与cas9(左侧的条形组,实线)或dgrna(上图,虚线)和野生型蝇类的对照杂交的相应后代中的那些比较。每个条形图显示平均性别频率和一个标准差。用t检验计算统计学显著性,呈现方差不相等,并且对于雄性不育,使用皮尔森卡方检验计算列联表的p值(红色*)。(p>0.01**,p>0.001***)。
图2b是根据本公开内容的实施方式来自纯合双grna(sgrna/dgrna)和纯合cas9(cas9/cas9)系之间的杂交的f1后代的表。
图2c是根据本公开内容的实施方式显示后代中性别决定路径中靶向基因的顺序(上图)和相应的基因敲除表型(利用图像)的数据表。与野生型♀和♂相比,dgrna的表型指导基因敲除和雌雄间性形态。βtub、sxl基因敲除♀在蛹阶段期间消失,如图2d-2e中所指示的。如所显示,dgrnaβtub,tra/+;nos-cas9/+雌雄间性(□),但不是dgrnaβtub,dsxf/+;nos-cas9/+□,具有性梳—参见放大的内部插图。
图2d显示了条形图,该条形图显示了根据本公开内容的实施方式,估计的通过杂交纯合的nos-cas9/nos-cas9♀和dgrnaβtub,sxl/dgrnaβtub,sxl♂产生的dgrnaβtub,sxl/+;nos-cas9/+卵的孵化率(百分比)与表2中指示的野生型(wt)卵的孵化率在统计学上没有不同(实施例6)。用t检验计算统计学显著性,呈现方差不相等。(p<0.05ns,p>0.001***)。
图2e显示了条形图,该条形图显示了根据本公开内容的实施方式,孵化的dgrnaβtub,sxl/+;nos-cas9/+幼虫的不同结果的比率,将50只孵化的幼虫批次饲养至成年,如表3中所示记录其性别或死亡的发育时间(实施例6)。在蛹转变期间发生大部分另外的幼虫死亡,并且蛹死亡的百分比与野生型♀百分比在统计学上没有不同。用t检验计算统计学显著性,呈现方差不相等。(p<0.05ns,p>0.001***)。
图2f是根据本公开内容的实施方式携带cas9和双grna(dsrna)的反式杂合蝇类的表型特征的表。
图2g显示了根据本公开内容的实施方式在βtub,tra基因敲除□中的性梳刚毛的数量的可变表达的显微镜图像。
图2h显示了根据本公开内容的实施方式,野生型雌性(上图)的内部生殖器官的显微镜图像:两个卵巢(ov)、纳精囊(sr)、双受精囊(sp)、两个副腺(ag)和子宫(ut),并且dgrnaβtub,tra/+;nos-cas9/+□雌雄间性蝇类(下图)具有一个未发育卵巢,和类似于雄性副腺的器官。
图2i是根据本公开内容的实施方式扩增的转录体的琼脂糖凝胶图像,该图像表明dsx基因的雄性和雌性剪接变体二者均在βtub,tra基因敲除雌雄间性中表达。rt-pcr用于评估与野生型(wt)雌性(♀)、野生型雄性(♂)和dgrnaβtub,tra/+;nos-cas9/+雌雄间性(βtub*,tra*□)相比,dsx的雌性特异性和雄性特异性可变剪接变体。雌性和雄性特异性dsx转录体二者均在βtub*,tra*□中鉴定。指示了双链dna的分子梯(ml)和无模板对照(ntc)。
图2j显示了根据本公开内容的实施方式,dgrnaβtub,dsxf/+;nos-cas9/+□雌雄间性蝇类仅发育如所指示的通常不与输卵管连接的单个卵巢(ov)和类似于雄性特异性副腺(ag)的器官的显微镜图像。
图2k显示了根据本公开内容的实施方式,具有所指示的睾丸(ts)和肾上腺(ag)的dgrnaβtub,sxl/+;nos-cas9/+♂蝇类中的雄性内部生殖系统的显微镜图像。
图2l显示了根据本公开内容的实施方式,具有所指示的睾丸(ts)和肾上腺(ag)的dgrnaβtub,sxl/+;nos-cas9/+♂蝇类中的雄性内部生殖系统的显微镜图像。
图2m显示了根据本公开内容的实施方式,具有细长胞囊的野生型wt睾丸(左图)的显微镜图像,细长胞囊中具有在dgrnaβtub,sxl/+;nos-cas9/+睾丸(ts)(如这里和图2k-2l中所指示的)中没有发现的成熟精子细胞。
图2n是根据本公开内容的实施方式,关于反式杂合dgrnaβtub,sxl/+;nos-cas9/+(双基因敲除)不育雄性(♂)中的βtubulin85d(βtub)靶标的序列信息的示意图,其显示在βtub靶位点精确地嵌合(mosaic)插入/缺失。上图呈现了grna靶位点和用于pcr的引物相对于靶向基因的遗传结构的位置。从两端读取序列推断模板的多样性,模板特异性地位于不育♂中用grna靶向的位点处,而野生型♂具有单等位基因,没有任何序列歧义。
图2o是根据本公开内容的实施方式,关于反式杂合dgrnaβtub,sxl/+;nos-cas9/+(双基因敲除)不育雄性(♂)中的性决定致死基因(sxl)靶标的序列信息的示意图,其显示在相同dgrnaβtub,sxl/+;nos-cas9/+不育雄性(♂)中的sxl靶位点处鉴定的嵌合插入/缺失,并且可能与图2d-2e中观察到的反式杂合雌性的蛹致死性有关。上图呈现了grna靶位点和用于pcr的引物相对于靶向基因的遗传结构的位置。从两端读取序列推断模板的多样性,模板特异性地位于不育♂中用grna靶向的位点处,而野生型♂具有单等位基因,没有任何序列歧义。
图2p是根据本公开内容的实施方式,关于反式杂合dgrnaβtub,tra/+;nos-cas9/+双基因敲除不育雄性(♂)和雌雄间性(□)中的转换基因(tra)靶标的序列信息的示意图,其显示了位于由dgrnaβtub,tra双引导rna(dgrna)靶向的tra位点处的嵌合插入/缺失。上图显示了grna靶标和用于pcr的引物相对于靶向基因的遗传结构的位置。从两端读取序列推断模板的多样性,模板特异性地位于不育♂和□中用grna靶向的位点处,但野生型♂具有单等位基因,在两个位点处均没有任何序列歧义。
图2q是根据本公开内容的实施方式,关于dgrnaβtub,dsxf/+;nos-cas9/+不育♂和□中反式杂合dgrnaβtub,dsxf双grna中的双性基因(dsxf)靶标的序列信息的示意图,其显示嵌合插入/缺失在dsxf位点靶标处鉴定。上图显示了grna靶标和用于pcr的引物相对于靶向基因的遗传结构的位置。从两端读取序列推断模板的多样性,模板特异性地位于不育♂和□中用grna靶向的位点处,但野生型♂具有单等位基因,在两个位点处均没有任何序列歧义。
图3a显示了条形图,其表示由cas9的母本装载引起的显性作用的遗传定量,其中通过纯合dgrna和杂合cas9蝇类之间的正反交生成的蝇类的基因型、性别频率和生育力由图例中所显示的粉红色、蓝色、橙色或灰色实心或条纹条形图表示。与杂合父本cas9杂交的后代显示在左图,和与杂合母本cas9杂交的后代显示在右图中。每个条形图显示平均性别频率和一个标准差。用t检验计算统计学显著性,呈现方差不相等。(p>0.01**,p>0.001***)。条纹条形图指示cas9作为基因的继承,而实心条形图指示+等位基因的继承。
图3b是根据本公开内容的实施方式的显示在胚胎中的基因型和母本/合子贡献的组合及其外显率的示意表。
图3c是根据本公开内容的实施方式,来自纯合双grna(dgrna/dgrna)和杂合cas9(cas9/tm3,sb)之间的杂交的f1后代的表。
图3d是示意表,其显示了在整个昆虫发育过程中高水平的双等位基因嵌合体(bm)的积累导致有机体水平的基因功能的丧失,并且确保所指示的诱导表型的完全外显率:致死性(致死双等位基因嵌合体(lbm))(粉红色框)、雌性雄性化或雄性不育。未切割野生型等位基因(浅绿色框)和由nhej生成的抗性等位基因(黄色框)对一些细胞中的基因功能的补充(complementation)不足以在有机体水平上拯救诱导的表型,并且因此100%的反式杂合后代具有诱导的表型。随着细胞分裂,方框变得越来越小并且越来越丰富。
图4a是根据本公开内容的实施方式,估计dgrnaβtub,sxl/+;nos-cas9/+不育雄性(用红色标记)与野生型雄性竞争以确保与野生型雌性交配的交配竞争力的实验装置的示意图。交配的雌性对下一次交配有抵抗力,持续约24小时,并且通过生育力降低(例如,通过提高卵的未孵化率)评估不育雄性的交配成功性。
图4b显示了条形图,其显示产下的卵和孵化的卵的百分比,其中将产下的卵的数量相对于最高卵数量(n=199)进行归一化以将它们转换为如图4c的表中所指示的百分位数。一只不育雄性的存在导致雌性生育力的显著下降(#3对#2),其可以通过去除一只野生型雄性来解释(#2对#1)。用t检验计算统计学显著性,比较第#3与第#2组和第#1组,呈现方差不相等(p>0.003**,p>0.0001***)。
图4c是根据本公开内容的实施方式,基于产下的卵、未孵化的卵和孵化的卵,与野生型雄性相比,dgrnabtub,sxl/+;nos-cas9/+雄性与指示的杂交的交配竞争力的表格。
图4d是根据本公开内容的实施方式,野生型雄性(蓝线)和具有父本(红线)或母本(绿线)cas9继承的两种类型的dgrnaβtub,sxl/+;nos-cas9/+不育雄性的存活曲线的图。存活曲线显示三个雄性组的非参数最大似然估计(npmle),以及用浅色阴影显示辅助(bootstrap)估计的95%置信区间,并且用深色阴影显示代表性非唯一性。y-轴显示估计的存活百分比。两种类型的pgsit雄性活得显著长于野生型雄性(p<2.2–16),而在在两种类型的pgsit雄性之间没有发现统计学显著差异。sun对数秩检验的一般化用于测试存活曲线中的差异。
图4e是根据本公开内容的实施方式,与对照w-雄性相比,dgrnabtub,sxl/+;nos-cas9/+雄性的存活期数据(按天计的寿命)的表。
图4f是根据本公开内容的实施方式,用于如本文公开的埃及伊蚊种群抑制模型的输入参数的表。如表中所指示的所有引用的参考文献的全部内容通过引用并入本文。
图4g是根据本公开内容的实施方式,使用如本文描述的抑制模型,与基于沃尔巴克氏菌的昆虫不相容技术的释放(iit)(紫色)、携带显性致死基因的昆虫的释放(ridl)(浅蓝色)和雌性特异性ridl(fsridl)(红色)相比,pgsit卵的释放(深蓝色)对埃及伊蚊蚊虫种群密度的模型预测影响的图。在六个月时期内,每周进行释放,释放率(相对于野生成虫)如插图图例中所指示的。使用对于随机混合10,000只成年雌性的埃及伊蚊种群的mgdrive模拟框架的随机实施的2000次实现和图4f的表中所描述的模型参数,计算模型预测。如所显示的,pgsit释放超过所有其他抑制或降低技术中的那些,显示消除局部种群的最大潜力。
图4h显示了测量pgsit模型预测对雄性交配竞争力的敏感性、寿命降低的图,其中每只野生成虫200只卵的释放率,保持所有其他参数恒定,如图4f的表中所阐释的。使用对于随机混合10,000只成年雌性的埃及伊蚊种群的mgdrive模拟框架的随机实施的250次实现来计算模型预测。根据本公开内容的实施方式,如左图中所显示,每只野生成虫每周200只卵的释放率,并且由于pgsit构建体使寿命降低恒定保持在18%,对于25%的雄性交配竞争力,可以可靠地实现消除;但是5%的雄性交配竞争力不可以实现消除,如ridl成年雄性中的情况。根据本公开内容的实施方式,如右图中所显示,每只野生成虫每周200只卵的释放率并且使雄性交配竞争力恒定保持在78%,对于寿命降低小于或等于75%,可以可靠地实现消除。
图4i是根据本公开内容的实施方式,显示宽范围的参数值(如所指示的,并发变化的寿命降低和雄性交配竞争力)的图,考虑到每只野生成虫每周200只卵的释放率,对于该参数值可以可靠地实现局部埃及伊蚊消除(黄褐色瓷砖)。
图4j显示了测量pgsit模型预测对雄性交配竞争力的敏感性、寿命降低的图,其中每只野生成虫100只卵的释放率,保持所有其他参数恒定,如图4f的表中所阐释的。根据本公开内容的实施方式,如左图中所显示,每只野生成虫每周100只卵的释放率,并且由于pgsit构建体使寿命降低恒定保持在18%,对于50%的雄性交配竞争力,可以可靠地实现消除;但是25%的雄性交配竞争力不可以实现消除。根据本公开内容的实施方式,如右图中所显示,每只野生成虫每周100只卵的释放率,并且使雄性交配竞争力恒定保持在78%,对于寿命降低小于或等于50%,可以可靠地实现消除。
图4k是根据本公开内容的实施方式,显示宽范围的参数值(如所指示的,并发变化的寿命降低和雄性交配竞争力)的图,考虑到每只野生成虫每周100只卵的释放率,对于该参数值可以可靠地实现局部埃及伊蚊消除(黄褐色瓷砖)。
图5是根据本公开内容的实施方式的示意图,其显示位于美国(蓝点)的工厂产生用于分发(例如,通过无人机)的pgsit卵并且在全世界边远地区(例如,南美洲、非洲和亚洲(粉红色点))释放。
具体实施方式
昆虫不育技术(sit)是一种环境安全且经过验证的用于抑制以减少野生种群的技术。本公开内容的实施方式包括使用基于crispr的技术基因修饰昆虫的方法,本文称为“精确引导的sit”(pgsit)方法。如在整个本公开内容中更详细地公开的,pgsit方法机械地依赖于显性遗传技术,该技术使得能够对昆虫进行定性以及并发或同时地进行定性和绝育。昆虫卵的并发或同时定性和绝育允许将卵释放到环境中确保出现不育成年雄性的能力。对于田间应用,卵的释放消除了对雄性手动定性和绝育的负担,从而减少了总体工作量并提高了可扩展性。
为了证明根据本公开内容的实施方式的pgsit技术的效力,对多个pgsit系统工程化,并以果蝇作为实例昆虫进行证明。本文描述和引用的基因技术和方法应理解为适用于多种昆虫。
本文公开的雄性定性的pgsit方法以及雄性定性和不育的方法使用基于crispr的技术的精确度和准确度来破坏雌性生存力必要的基因(用于雄性定性)或并发或同时破坏雌性生存力和雄性生育力必要的基因。本公开内容的pgsit方法利用简单的育种方案,该方案需要两种昆虫品系(第一亲本品系和第二亲本品系),一种表达核酸内切酶(例如,cas9),和另一种表达核酸序列构建体,该构建体具有导向至待破坏的一个或多个基因的至少一个引导多核苷酸。这两个亲本品系之间的单一交配机械地导致在整个发育过程中一个或多个靶基因的同步多核苷酸-引导的(例如,rna-引导的)显性等位基因或显性双等位基因敲除。
crispr技术指规则间隔成簇短回文重复序列,并且已经被广泛研究和修改以用于大部分研究的生物体中的基因组编辑,如sternberganddoudna,mol.cell58,568–574(2015)中所公开的,其全部内容通过引用并入本文。
如本文所使用的,关于基于crispr的技术,术语“引导多核苷酸”是指具有能够结合相应的核酸内切酶蛋白(例如,cas9)的“合成序列”和能够结合基因组靶标的可变靶序列(例如,在靶基因的外显子中发现的核苷酸序列)的多核苷酸。在本公开内容的一些实施方式中,引导多核苷酸为引导核糖核酸(grna)。在一些实施方式中,引导多核苷酸的可变靶序列是靶标内的任何序列,其相对于基因组的其余部分是独特的,并且紧邻前间区序列邻近基序(pam)。pam序列的确切序列可能会不同,因为不同的核酸内切酶需要不同的pam序列。如本文所使用的,表述“具有两个不同的单引导rna(sgrna)的单一异源构建体”指双引导rna(dgrna)。
关于基于crispr的技术的核酸内切酶蛋白,术语“核酸内切酶”指任何合适的核酸内切酶蛋白或其变体,其将由选择的引导多核苷酸特异性地导向以酶促基因敲除引导多核苷酸的靶序列。如本文所使用的,关于核酸内切酶所使用的术语“其变体”指在任何合适的宿主生物体或表达系统中表达的其酶功能形式的和/或包括增强核酸内切酶的酶活性的任何修饰的参考核酸内切酶。
遍及本公开内容公开的实例表示用于产生不育雄性昆虫后代的方法,其中雌性生存力基因和雄性生育力基因二者均使用至少两个引导多核苷酸进行破坏。然而,如本领域普通技术人员将理解的,用于指导雄性定性的方法包括当前公开的方法,其中靶向雌性生存力必要的基因,而不靶向雄性不育的基因。例如,参考图1a,核酸内切酶亲本昆虫(标记的cas9系)与具有靶向雌性必要基因和雄性不育基因的两个grna(一个蓝色,一个绿色)的引导rna亲本(grna系)杂交。然而,对于指导雄性定性的方法,grna系将不被基因修饰以表达雄性不育基因。
如本文所使用的,术语“整合(integrating、integration)”和类似术语指将异源重组核酸序列引入靶昆虫中。如本领域普通技术人员将理解的,昆虫基因修饰的技术是已知的,并例如在cockburn等,biotechnologyandgeneticengineeringreviews,2:68-99,(1984)中描述,其全部内容通过引用并入本文。如本文所使用的,整合可指将重组核酸序列整合到靶昆虫的基因组中。靶昆虫的基因组包括靶昆虫的至少一个染色体,但是可以包括所有相关的染色体拷贝。因此,整合到基因组中可以是杂合的或纯合的。
如本文所使用的,术语“将核酸内切酶引入”靶昆虫中是指将核酸内切酶重组引入昆虫中,使得核酸内切酶存在于昆虫中。将核酸内切酶引入昆虫中不需要基因组整合,但是可以包括基因组整合。例如,将核酸内切酶引入包括将核酸内切酶“沉积”到昆虫中,如在例如linandpotter,g3,(2016),doi:10.1534/g3.116.034884中所描述的,其整篇内容通过引用并入本文。
另外,尽管本公开内容的实例包括用于获得高达100%雄性不育后代的方法,但是用于产生小于100%雄性不育后代的方法也包括在本公开内容的范围内。例如,在本公开内容的一些实施方式中,表达引导多核苷酸的亲本昆虫品系对于引导多核苷酸(单个、两个或更多个引导多核苷酸)可以是杂合的或纯合的。在一些实施方式中,表达引导多核苷酸的亲本昆虫品系对于引导多核苷酸是纯合的,从而确保所有的后代都接受引导多核苷酸。
参考图2a和3a,在本公开内容的进一步实施方式中,如果表达核酸内切酶的亲本昆虫品系是雄性的,则雄性亲本对于核酸内切酶可以是杂合的或纯合的,而如果表达核酸内切酶的亲本昆虫品系是雌性的,则核酸内切酶可以沉积在雌性中,杂合地或纯合地表达。
参考图2f,如果两个亲本品系对于其各自的核酸内切酶或引导多核苷酸是纯合的,则由于非孟德尔完全外显率所有或几乎所有的后代接受核酸内切酶和引导多核苷酸(一个或多个)。因此,在所有后代中的期望表型(例如,所有的雄性昆虫或所有的雄性且不育昆虫)可以在一代中产生。如本文所使用的,术语“几乎所有的后代”是指至少70%、75%80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的后代。参考表3,在本公开内容的一些实施方式中,在成年阶段确定后代的生存力。
在本公开内容的一些实施方式中,用于指导雄性定性的方法包括将核酸内切酶引入第一昆虫亲本中和将至少一个核酸序列构建体整合到第二昆虫亲本的基因组(例如,质粒载体)中,该核酸序列具有至少一个第一引导多核苷酸(例如,sgrna或dgrna),该第一引导多核苷酸靶向雌性必要的基因组序列中的核苷酸序列,和使第一昆虫亲本和第二昆虫亲本交配以产生所有的或几乎所有的雄性后代。如本文所使用的,术语“雌性必要的基因组序列”包括对雌性昆虫特异性的任何基因组序列或基因。雌性必要的基因组序列的实例包括性别决定基因或其雌性特异性剪接变体,在雄性中未发现的基因或基因的剪接变体,雌性性腺发育必要的基因或基因的剪接变体,和/或对雄性生存力不是必要的基因或基因的剪接变体。参考图1b,雌性必要的基因组序列的非限制性实例包括性别决定果蝇基因sxl、tra和dsx中的雌性特异性外显子,包括其同源物、直系同源物和旁系同源物。如本文所使用的,术语“同源物”是指在另一生物体中发现的赋予相同功能的生物体的可比基因。如本文所使用的,术语“直系同源物”和“旁系同源物”是指同源物的类型。直系同源物是在不同世系中的相应基因并且是物种形成的结果,和旁系同源物由基因复制产生。
在昆虫中由tra蛋白或tra/tra-2复合物介导的调节和性别特异性可变剪接是已知的并在pane等,development129:3715-3725(2002)中讨论,其全部内容通过引用并入本文。dsx基因的剪接产物的雄性-和雌性特异性是已知的,并在suzuki等人,insectbiochemmolbiol31:1201-1211(2001)、salvemini等人,bmcevol.biol.11,41(2011)和scali等人,j.exp.biol.208,3701–3709(2005)中讨论,所有文献的全部内容通过引用并入本文。
在本公开内容的一些实施方式中,用于指导雄性定性的方法包括将核酸内切酶引入第一昆虫亲本中和将至少一个核酸序列构建体整合到第二昆虫亲本的基因组中,核酸序列具有至少一个第一引导多核苷酸,该第一引导多核苷酸靶向雌性必要的基因组序列中的核苷酸序列,所述雌性必要的基因组序列选自tra和/或dsx基因中的雌性特异性外显子,包括其同源物、直系同源物或旁系同源物,其中第一昆虫亲本和第二昆虫亲本交配以产生所有的或几乎所有的雄性后代。
在本公开内容的一些实施方式中,用于产生雄性不育昆虫卵的方法包括将核酸内切酶引入第一昆虫亲本中和将至少一个核酸序列构建体整合到第二昆虫亲本的基因组中,至少一个核酸序列构建体具有至少一个第一引导多核苷酸和至少一个第二引导多核苷酸,该第一引导多核苷酸靶向雌性特异性生存力或发育所必需的雌性必要的基因组序列,该至少一个第二引导多核苷酸靶向雄性生育力所必需的雄性不育基因组序列,和使第一昆虫亲本和第二昆虫亲本交配以产生所有的或几乎所有的不育雄性后代。如本文所使用的,术语“雄性不育基因组序列”是指昆虫中的雄性生育力所必需的任何雄性特异性基因组序列,其不影响雄性昆虫的发育或雄性昆虫的生存力。昆虫中雄性生育力所必需的雄性特异性基因组序列的非限制性实例包括基因βtubulin85d(βtub)、fuzzyonions(fzo)、鱼精蛋白a(prota)和精母细胞阻滞(sa)和其同源物、直系同源物和旁系同源物。在一些实施方式中,核酸序列构建体包括一个或多个第二引导多核苷酸,该第二引导多核苷酸靶向雄性生育力所必需的一个或多个雄性特异性基因组序列。在catteruccia等人,nat.biotechnol.23,1414–1417(2005)和smith等人,insectmol.biol.16,61–71(2007)中描述了包括按蚊和埃及伊蚊在内的βtubulin85d的功能保守性,这两篇的全部内容通过引用并入本文。
如本领域普通技术人员将理解的,可以靶向对于雌性生存力和雄性生育力重要的许多基因。在akbari等人,g33,1493–1509(2013)和papa等人,(2016)doi:10.1101/081620中讨论了用于破坏的另外的雌性/雄性特异性昆虫基因,这两篇的全部内容通过引用并入本文。
在本公开内容的一些实施方式中,基因修饰的昆虫和用于生成基因修饰的昆虫的方法包括来自双翅目、鳞翅目或鞘翅目的昆虫。
在本公开内容的一些实施方式中,基因修饰的昆虫和用于生成基因修饰的昆虫的方法包括选自覆蚊亚属、伊蚊、按蚊或库蚊属的蚊虫的昆虫。在这些属中,实例蚊虫种包括埃及伊蚊、白纹伊蚊、三列骚扰蚊亚属(ochlerotatustriseriatus)(三列伊蚊(aedestriseriatus))、斯氏按蚊(anophelesstephensi)、白魔按蚊(anophelesalbimanus)、冈比亚按蚊(anophelesgambiae)、四斑按蚊(anophelesquadrimaculatus)、泛生按蚊(anophelesfreeborni)、库蚊种(culexspecies)或黑尾赛蚊(culisetamelanura)。
另外,已经在包括埃及伊蚊、冈比亚按蚊和斯氏按蚊的主要登革热和疟疾疾病载体中开发了cas9-表达品系,如分别在li等人,(2017)doi:10.1101/156778、hammond等人,nat.biotechnol.34,78–83(2016)和gantz等人,proc.natl.acad.sci.u.s.a.112,e6736–43(2015)中所描述的,所有文献的全部内容通过引用并入本文。
在一些实施方式中,基因修饰的昆虫和用于生成基因修饰的昆虫的方法包括选自下述任一项的任何昆虫:实蝇科果蝇,其选自地中海果蝇(medfly)(地中海实蝇(ceratitiscapitata))、mexfly(墨西哥按实蝇(anastrephaludens))、东方果蝇(orientalfruitfly)(橘小实蝇(bactroceradorsalis))、橄榄果蝇(olivefruitfly)(橄榄果实蝇(bactroceraoleae))、瓜实蝇(melonfly)(瓜实蝇(bactroceracucurbitae))、纳塔尔果蝇(natalfruitfly)(纳塔尔实蝇(ceratitisrosa))、樱桃果蝇(cherryfruitfly)(樱桃实绳(rhagoletiscerasi))、昆士兰果蝇(queenslandfruitfly)(bactroceratyroni)、桃实蝇(peachfruitfly)(桃实蝇(bactrocerazonata))、加勒比果蝇(caribbeanfruitfly)(加勒比按实蝇(anastrephasuspense))、东方果蝇(orientalfruitfly)(橘小实蝇(bactroceradorsalis))、西印度果蝇(westindianfruitfly)(西印度按实蝇(anastrephaoblique))、新大陆螺旋蛆(newworldscrewworm)(嗜人锥蝇(cochliomyiahominivorax))、旧大陆螺旋蛆(oldworldscrewworm)(蛆症金蝇(chrysomyabezziana))、澳大利亚绵羊绿头苍蝇/绿蝇(australiansheepblowfly/greenbottlefly)(铜绿蝇(luciliacuprina))、棉红铃虫(pinkbollworm)(棉红铃虫(pectinophoragossypiella))、欧洲吉普赛蛾(theeuropeangypsymoth)(舞毒蛾(lymantriadispar))、脐橙蠕虫(thenavelorangeworm)(脐橙螟(amyeloistransitella))、桃条麦蛾(thepeachtwigborer)(桃条麦蛾(anarsialineatella))、水稻二化螟(thericestemborer)(三化螟(tryporyzaincertulas))、夜蛾(thenoctuidmoth)、实夜蛾亚科(heliothinae)、日本甲虫(thejapanesebeetle)(papillajaponica)、白缘象甲(white-fringedbeetle)(白缘象某些种(graphognatusspp.))、棉铃象鼻虫(bollweevil)(棉铃象鼻虫(anthonomousgrandis))、马铃薯甲虫(thecoloradopotatobeetle)(马铃薯叶甲(leptinotarsadecemlineata))、葡萄粉蚧(thevinemealybug)(无花果粉蚧(planococcusficus))、亚洲柑橘木虱(asiancitruspsyllid)(柑桔木虱(diaphorinacitri))、斑翅果蝇(spottedwingdrosophila)(樱桃果蝇(drosophilasuzukii))、蓝绿蝉(bluegreensharpshooter)(雕木蝉(graphocephalaatropunctata))、玻璃翅叶蝉(glassywingedsharpshooter)(玻璃翅叶蝉(homalodiscavitripennis))、浅棕色苹果蛾(lightbrownapplemoth)(苹果褐卷蛾(epiphyaspostvittana))、bagradabug(bagradahilaris)、棕色大理石臭虫(brownmarmoratedstinkbug)(茶翅蝽(halyomorphahalys))、亚洲吉普赛蛾(其选自亚洲舞毒蛾(lymantriadisparasiatica)、日本舞毒蛾(lymantriadisparjaponica)、lymantriaalbescens、lymantriaumbrosa和lymantriapostalba)、亚洲天牛(asianlonghornedbeetle)(天牛(anoplophoraglabripennis))、椰树犀牛甲虫(coconutrhinocerosbeetle)(椰蛀犀金龟(oryctesrhinoceros))、白蜡树蛀虫(emeraldashborer)(白蜡窄吉丁(agrilusplanipennis))、欧洲葡萄蛾(europeangypsymoth)(葡萄小卷叶蛾(lobesiabotrana))、欧洲吉普赛蛾(舞毒蛾)、伪苹果卷叶蛾(falsecodlingmoth)(苹果异胫小卷蛾(thaumatotibialeucotreta))、火蚁(其选自红火蚁(solenopsisinvictaburen)和黑火蚁(s.richteriforel))、旧大陆螟蛉虫(oldworldbollworm)(棉铃虫(helicoverpaarmigera))、斑彩白蜡虫(spottedlanternfly)(斑衣蜡蝉(lycormadelicatula))、非洲蜜蜂(africanizedhoneybee)(非洲蜜蜂(apismelliferascutellata))、果梢蛀虫(fruitandshootborer)(黄斑螟(leucinodesorbonalis))、玉米根虫(cornrootworm)(叶甲属某些种(diabroticaspp.))、西部玉米根虫(westerncornrootworm)(玉米根虫(diabroticavirgifera))、粉虱(whitefly)(烟粉虱(bemisiatabaci))、家蝇(housefly)(家蝇(muscadomestica))、绿蝇(greenbottlefly)(铜绿蝇(luciliacuprina))、蚕蛾(silkmoth)(家蚕(bombyxmori))、红蚌质蚧(redscale)(aonidiellaaurantia)、犬心丝虫(dogheartworm)(犬恶丝虫(dirofilariaimmitis))、南部松小蠢(southernpinebeetle)(松大小蠹(dendroctonusfrontalis))、鳄梨蓟马(avocadothrip)(缨翅目某种(thysanopteraspp.)),马蝇(botfly)(其选自狂蝇科某些种(oestridaespp.)和人皮蝇(dermatobiahominis))、马蝇(tabanussulcifrons)、角蝇(西方角蝇(tabanussulcifrons))、螺旋蛆蝇(其选自腐败锥蝇(c.macellaria)、嗜人锥蝇(c.hominivorax)、c.aldrichi或c.minima)、采采蝇(tsetsefly)(舌蝇属某种(glossinaspp.))、皮蝇(warblefly)(其选自牛皮蝇(hypodermabovis)或纹皮蝇(hypodermalineatum))、斑彩白蜡虫(spottedlanternfly)(斑衣蜡蝉(lycormadelicatula))、虫斑皮蠹(khaprabeetle)(谷斑皮蠹(trogodermagranarium))、蜜蜂螨(honeybeemite)(狄斯瓦螨(varroadestructor))、白蚁(家白蚁(coptotermesformosanus))、铁杉球蚜(hemlockwoollyadelgid)(铁杉球蚜(adelgestsugae))、胡桃枝甲虫(walnuttwig)(胡桃木细小蠹(pityophthorusjuglandis))、欧洲木蜂(europeanwoodwasp)(云杉树蜂(sirexnoctilio))、粉红色斑点的螟蛉虫(pink-spottedbollworm)(pectinophorascutigera)、两个斑点的红蜘蛛(twospottedspidermite)(二斑叶螨(tertanychusurticae))、小菜蛾(diamondbackmoth)(小菜蛾(plutellaxylostella))、芋头毛毛虫(tarocaterpillar)(斜纹夜蛾(spodopteralitura))、赤拟谷盗(redflourbeetle)(赤拟谷盗(triboliumcastaneum))、桃蚜(greenpeachaphid)(桃蚜(myzuspersicae))、棉蚜(cottonaphid)(棉蚜(aphisgossypii))、褐飞虱(brownplanthopper)(褐飞虱(nilaparvatalugens))、甜菜夜蛾(beetarmyworm)(甜菜夜蛾(spodoteraexigua))、西花蓟马(westernflowerthrips)(西花蓟马(frankliniellaoccidentalis))、苹果小卷蛾(codlingmoth)(苹果小卷蛾(cydiapomonella))、四纹豆象(cowpeaweevil)(四纹豆象(callosobruchusmaculatus))、豌豆蚜(peaaphid)(豌豆蚜(acyrthosiphonpisum))、tomatoleafminer(番茄斑潜蝇(tutaabsoluta))、葱蓟马(onionthrips)(烟蓟马(thripstabaci))和棉铃虫(cottonbollworm)(棉铃虫(helicoverpaarmigera))。
在本公开内容的一些实施方式中,合适的核酸内切酶包括crispr-相关序列9(cas9)核酸内切酶或其变体、crispr-相关序列13(cas13)核酸内切酶或其变体、crispr-相关序列6(cas6)核酸内切酶或其变体、来自普雷沃氏菌和弗朗西斯氏菌1的crispr(cpf1)核酸内切酶或其变体、或来自microgenomates和smithella1的crispr(cms1)核酸内切酶或其变体。
在本公开内容的一些实施方式中,合适的核酸内切酶包括酿脓链球菌cas9(spcas9)、金黄色葡萄球菌cas9(sacas9)、新凶手弗朗西斯氏菌cas9(fncas9)或其变体。变体可以包括前间区序列邻近基序(pam)spcas9(xcas9)、高保真度spcas9(spcas9-hf1)、高保真度sacas9或高保真度fncas9。
在本公开内容的其他实施方式中,核酸内切酶包括cas融合核酸酶,该cas融合核酸酶包括与foki核酸酶或其变体融合的cas9蛋白质或其变体。该融合核酸酶的cas9蛋白质的变体包括催化无活性的cas9(例如,死亡cas9)。
在本公开内容的一些实施方式中,核酸内切酶可以是cas9、cas13、cas6、cpf1、cms1蛋白质或其任何变体,其源自下列或由下列表达:海沼甲烷球菌c7、白喉棒状杆菌、高效棒状杆菌ys-314、谷氨酸棒杆菌(atcc13032)、谷氨酸棒杆菌(atcc13032)、谷氨酸棒杆菌r、柯氏棒状杆菌(corynebacteriumkroppenstedtii)(dsm44385)、脓肿分枝杆菌(atcc19977)、皮疽诺卡菌(nocardiafarcinica)ifm10152、红平红球菌(rhodococcuserythropolis)pr4、贾斯汀红球菌(rhodococcusjostii)rha1、不透明红球菌(rhodococcusopacus)b4(uid36573)、解纤维素热酸菌(acidothermuscellulolyticus)11b、氯酚节杆菌(arthrobacterchlorophenolicus)a6、kribbellaflavida(dsm17836、uid43465)、弯曲热单孢菌(thermomonosporacurvata)(dsm43183)、齿双歧杆菌(bifidobacteriumdentium)bd1、长双歧杆菌(bifidobacteriumlongum)djo10a、还原天芥菜碱斯奈克氏菌(slackiaheliotrinireducens)(dsm20476)、persephonellamarinaexh1、脆弱拟杆菌(bacteroidesfragilis)nctc9434、黄褐二氧化碳嗜纤维菌(capnocytophagaochracea)(dsm7271)、嗜冷黄杆菌(flavobacteriumpsychrophilum)jip0286、嗜粘蛋白艾克曼菌(akkermansiamuciniphila)(atccbaa835)、光合玫瑰菌(roseiflexuscastenholzii)(dsm13941)、玫瑰弯菌属(roseiflexus)rs1、集胞藻属(synechocystis)pcc6803、微小迷踪菌(elusimicrobiumminutum)pei191、未培养的白蚁第1类细菌菌种(unculturedtermitegroup1bacteriumphylotype)rsd17、产琥珀酸丝状杆菌(fibrobactersuccinogenes)s85、蜡状芽孢杆菌(atcc10987)、无害利斯特菌(listeriainnocua)、干酪乳酸杆菌(lactobacilluscasei)、鼠李糖乳酸杆菌gg、唾液乳酸杆菌ucc118、无乳链球菌-5-a909、无乳链球菌nem316、无乳链球菌2603、似马停乳链球菌(streptococcusdysgalactiaeequisimilis)ggs124、马链球菌兽瘟亚种(streptococcusequizooepidemicus)mgcs10565、解没食子酸链球菌(streptococcusgallolyticus)ucn34(uid46061)、戈尔登氏链球菌子集(streptococcusgordoniichallissubst)ch1、变形链球菌nn2025(uid46353)、变形链球菌、酿脓链球菌(streptococcuspyogenes)m1gas、酿脓链球菌mgas5005、酿脓链球菌mgas2096、酿脓链球菌mgas9429、酿脓链球菌mgas10270、酿脓链球菌mgas6180、酿脓链球菌mgas315、酿脓链球菌ssi-1、酿脓链球菌mgas10750、酿脓链球菌nz131、嗜热链球菌cnrz1066、嗜热链球菌lmd-9、嗜热链球菌lmg18311、肉毒梭状芽胞杆菌a3lochmaree、肉毒梭状芽胞杆菌beklund17b、肉毒梭状芽胞杆菌ba4657、肉毒梭状芽胞杆菌flangeland、解纤维素梭菌h10、大芬戈尔德菌(finegoldiamagna)(atcc29328)、直肠真杆菌(eubacteriumrectale)(atcc33656)、鸡败血支原体(mycoplasmagallisepticum)、可移动支原体(mycoplasmamobile)163k、穿通支原体(mycoplasmapenetran)、滑液囊支原体(mycoplasmasynoviae)53、念珠状链杆菌(streptobacillusmoniliformis)(dsm12112)、慢生根瘤菌(bradyrhizobium)btai1、汉氏硝化细菌(nitrobacterhamburgensis)x14、红假单胞菌属双b18(rhodopseudomonaspalustrisbisb18)、红假单胞菌属双b5、食清洁剂细小棒菌(parvibaculumlavamentivorans)ds-1、芝江沟鞭玫瑰杆菌(dinoroseobactershibae)dfl12、重氮营养葡糖酸醋杆菌(gluconacetobacterdiazotrophicus)pal5faperj、重氮营养葡糖酸醋杆菌pal5jgi、固氮螺菌b510(uid46085)、深红红螺菌(rhodospirillumrubrum)(atcc11170)、对氯苯胺(diaphorobacter)tpsy(uid29975)、蚯蚓肾寄生菌(verminephrobactereiseniae)ef01-2、脑膜炎奈瑟菌(neisseriameningitides)053442、脑膜炎奈瑟菌α14、脑膜炎奈瑟菌z2491、需盐脱硫弧菌(desulfovibriosalexigens)dsm2638、空肠弯曲杆菌德莱亚种(campylobacterjejunidoylei)26997、空肠弯曲菌(campylobacterjejuni)81116、空肠弯曲菌、红嘴鸥弯曲杆菌(campylobacterlari)rm2100、肝螺旋杆菌(helicobacterhepaticus)、产琥珀酸沃廉菌(wolinellasuccinogenes)、奥湖甲苯单胞菌(tolumonasauensis)dsm9187、大西洋假交替单胞菌(pseudoalteromonasatlantica)t6c、shewanellapealeana(atcc700345)、巴黎嗜肺军团菌(legionellapneumophilaparis)、琥珀酸放线杆菌(actinobacillussuccinogenes)130z、多杀性巴氏杆菌(pasteurellamultocida)、francisellatularensisnovicidau112、francisellatularensisholarctica、土拉热弗朗西斯菌fsc198、francisellatularensistularensis、土拉热弗朗西斯菌wy96-3418、或齿垢密螺旋体(atcc35405)。
参考图4a-4c,使用根据本公开内容的实施方式的pgsit方法产生的不育雄性的交配竞争力表明这些不育雄性能够成功地交配和能够成功地在野外竞争雌性配偶。此外,参考图4d-4e,使用根据本公开内容的实施方式的pgsit方法产生的不育雄性的生活空间(lifespace)表明这些不育雄性的寿命(总天数)至少与相应的野生型雄性的寿命一样长——如果不比相应的野生型雄性的寿命更长的话。交配竞争力和长寿是实现局部消除的主要因素,因为一旦实现了初始抑制或减少,幼虫资源就会丰富,并且因此通过释放的不成熟形式的更大消耗的影响较小。卵释放导致从开始就快速种群抑制或减少,因为孵化幼虫消耗原本可育幼虫可利用的资源。此外,当在野外释放时,根据本公开内容的实施方式的pgsit雄性不育卵可以产生孵化幼虫,因为在胚胎/幼虫阶段发生雌性致死性,通过释放不成熟形式导致幼虫资源的最大消耗。
另外,本文公开的pgsit方法不依赖于染色体易位、化学不育剂、辐射、抗生素或细菌感染,其可严重损害释放的不育雄性的健康度和交配竞争力。
参考图4f-4k,使用本文实施例5中所述的mgdrive模拟框架,模拟了每只野生成虫每周释放200pgsit雄性不育卵,表明可靠地实现了局部埃及伊蚊消除的宽范围的参数值。
参考图5,抑制或减少包括疾病载体和农业害虫的昆虫物种的昆虫种群的方法包括将使用本公开内容的pgsit方法产生的雄性不育卵引入需要靶向昆虫抑制或减少的区域。
本公开内容的一些实施方式包括开发饲养设施以单独地繁殖纯合核酸内切酶(例如,cas9)和表达dgrna的品系。在一些实施方式中,实施自动化工作流程以对未成熟阶段进行性别分选(例如,cas9雌性与dgrna雄性),并组合到笼子中用于成熟、交配和繁殖卵。性别分选可以通过许多合适的方式来实现,包括机械尺寸分离、组合基因定性品系的自动化copas性别分选平台(unionbiometrica)或自动机器人光学分选。在papathanos等人,transgenicinsects:techniquesandapplications83–100,(october,2014)和gilles等人,actatrop.132,s178–s187(2014)中讨论了合适的性别分选方法,其全部内容通过引用并入本文。
在一些实施方式中,产生不育雄性卵的pgsit方法对于在卵阶段期间滞育的昆虫物种是特别有效的。在卵阶段期间滞育的昆虫包括例如埃及伊蚊和白纹伊蚊,如在diniz等人,parasit.vectors10,310(2017)中所描述的,其全部内容通过引用并入本文。这种滞育将使可扩展(scalable)的卵积聚用于超量(inundative)释放。因此,如图5中大体描绘的,单个有效的pgsit卵生产设施可以将pgsit卵分发到世界各地的许多边远野外,在那里它们可以被简单地孵化、饲养和释放,消除或减轻了在每个野外地点性别分选、绝育和释放脆弱的成年雄性的逻辑负担,从而提高可扩展性和效率,实现了更广泛的大规模种群抑制或减少能力。
给出以下实施例仅用于说明目的,并且不限制本申请的范围或内容。
实施例
实施例1.二元crispr诱导的雌性雄性化/致死性或雄性不育性。为了工程化pgsit,在果蝇中生成了单引导rna(sgrna)和spcas9(从这里开始cas9)表达系。总共开发了9个纯合的sgrna系以靶向雌性生存力必要的基因或雄性生育力重要的基因。对于雌性生存力,这些基因包括性别特异性可变剪接性别决定基因,其包括如图1b-1c中所显示的以及在slee和bownes,q.rev.biol.65,175–204(1990);bell等人,cell65,229–239(1991);boggs等人,cell50,739–747(1987)和burtis和baker,cell56,997–1010(1989)中所描述的性决定致死基因(sxl,两个单独的转基因系-sgrnasxl、sgrnasxl-b)、转换基因(tra,两个单独的系-sgrnatra、sgrnatra-b)或双性基因(dsxf、sgrnadsxf),所有文献的全部内容均通过引用并入本文。为了破坏雄性生育力,靶向在精子发生期间活跃的基因,比如图1c中所显示的和在kemphues等人,cell21,445–451(1980)、hales和fuller,cell90,121–129(1997)、kanippayoor等人,spermatogenesis3,e24376(2013)和lim等人,spermatogenesis2,158–166(2012)中所描述的βtubulin85d(βtub、sgrnaβtub)、fuzzyonions(fzo,sgrnafzo)、鱼精蛋白a(prota、sgrnaprota)或精母细胞阻滞(sa,sgrnasa),通过引用将其全部内容并入本文。为了促进稳健的cas9表达,建立了在两个强的主要生殖系特异性启动子的控制下的三个纯合的cas9表达系,其包括在sano等人,mech.dev.112,129–139(2002)和doren等人,curr.biol.8,243–246(1998)中所描述的nanos(nos-cas9)或vasa(vas-cas9),其全部内容都通过引用并入本文。另外,建立了在akbari等人,bmccellbiol.10,8(2009)中所描述的和图1d中显示的遍在启动子ubiquitin63e(ubi-cas9)https://paperpile.com/c/ckxxhc/zewao以实现在几乎所有生命发育阶段期间都能在体细胞和生殖系组织中稳健表达。将自切割的t2a肽和egfp编码序列插入到启动子驱动的cas9的下游(3’),一起用作启动子活性的视觉指标,如图1c-1d中所显示的和li等人,(2017).doi:10.1101/156778中所描述的,其全部内容通过引用并入本文。
为了评估sgrna系的遗传活性,将每个品系与nos-cas9杂交,并分析所得的反式杂合f1后代。从这些杂交中,包括sgrnasxl、sgrnatra、sgrnadsxf、sgrnaβtub的4/9的sgrna显示出预期的表型,并进行进一步表征。为了进一步评估这四个sgrna,将这四个选定品系中的每一个与野生型wt双向杂交(重复杂交数在10♀和10♂之间,n=24;后代数,n=3519),或与纯合的nos-cas9双向杂交(n=28,n=3628),如图1f中所显示的。参考图1e-1f,野生型杂交未产生显著的性别比例偏差或受损的生育力(n=30,n=4371)。继续参考1e-1f,无论nos-cas9是母本还是父本继承的,所有继承sgrnasxl的f1反式杂合子都是100%雄性(n=7,n=540),而100%的继承sgrnatra或sgrnadsxf的反式杂合雌性转化为无法排卵的不育雄性化雌雄间性(n=14,n=942),并且100%的sgrnaβtub反式杂合雄性是不育的(n=7,n=517)。这些表型在靶向遗传基因座进行了分子上探索,并且如图1g中所显示,所有测序的蝇类(n=16)在靶向基因座处具有嵌合插入/缺失。
实施例2.创建高达100%不育雄性的种群。在本公开内容的一些实施方式中,公开的pgsit方法可用于破坏雌性生存力和/或雄性不育所必要的基因。在一些实施方式中,公开的pgsit方法可用于并发或同时破坏雌性生存力和雄性不育所必要的基因,以将大部分或全部(高达100%)存活的f1后代从基因上导向至不育雄性。为了实现这种导向的定性和不育,生成了表达多重双grna(dgrna)组合的三个另外的纯合品系,其包括dgrnaβtub,sxl、dgrnaβtub,tra和dgrnaβtub,dsxf,如图1c中所显示。为了基因评估这些pgsit品系的活性,将每个品系与野生型或纯合cas9(nos-cas9、vas-cas9或ubi-cas9)双向杂交。参考图2a-2b,野生型杂交没有产生显著的性别偏差或受损的生育力(n=36,n=5747)。继续参考图2b,除了由于βtub的并发或同时破坏导致100%雄性不育(n=24,n=2521)以外,dgrnaβtub,sxl与每个cas9品系之间的杂交由于sxl的破坏而导致100%的雌性致死率。而且,由于tra或dsx的破坏,由每个cas9品系和dgrnaβtub,tra(n=24,n=1697)或dgrnaβtub,dsxf(n=24,n=1791)之间的杂交产生的100%的雌性被雄性化为不育雌雄间性,并且由于βtub的并发或同时破坏,100%的雄性后代是不育的(n=48,n=4231)。因此,参考图2a-2c,本公开内容的pgsit方法导致高度活性的cas9-grna复合物,其不被dgrna饱和并且可再生地和以前所未有的效率产生高达100%不育雄性成年后代。
关于图2a-2c的杂交的f1后代的表型分析,在成年前阶段期间,100%的dgrnaβtub,sxl基因敲除雌性动物死亡,大部分在蛹转变期间死亡,如图2d-2e中所显示。对于雌雄间性表型,生育力总是受到损害,然而如图2c和2f中所显示,观察到可变的表现度,这是因为个体之间的解剖雄性化程度不同,并且与dgrnaβtub,dsxf相比,在dgrnaβtub,tra基因敲除中更显著。例如,参考2f和2h,dgrnaβtub,tra基因敲除雌雄间性具有带有可变刚毛数的性梳,并且很少发展超过一个未发育卵巢。另外,参考图2i,在分子上,dgrnaβtub,tra基因敲除雌雄间性表达了dsx基因的雌性和雄性特异性可变剪接变体,推测是由于缺少tra,tra对于抑制dsx的雄性特异性和促进雌性特异性可变剪接是重要的,如在nagoshi等人,cell53,229–236(1988)中所描述的,其全部内容通过引用并入本文。相反,参考图2c、2f和2j中,未观察到dgrnaβtub,dsxf基因敲除雌雄间性发育出性梳,并且雌雄间性具有使它们能够妊娠的正常卵巢——尽管不能排卵。
为了分析雄性不育表型,使用在βtub85d-启动子(βtub-gfp)的控制下生成的表达egfp的转基因系荧光标记睾丸和精子,对f1不育雄性中的睾丸和发育中的精子细胞的解剖进行可视化,如图1c中所描绘。用dgrna品系渐渗。参考图2k,当用纯合的nos-cas9渐渗时,反式杂合的dgrnaβtub,sxl/+;βtub-gfp/nos-cas9f1不育雄性显示出完全发育的卷曲睾丸(ts)和副腺(ag)。然而,这些f1不育雄性的精子细胞发育完全被破坏,表型与以前的βtub破坏报告一致,如kemphues等人,cell21,445–451(1980)中所描述的,其全部内容通过引用并入本文。例如,参考图2l,在gfp标记的不育雄性的睾丸(ts)中仅鉴定出圆形胞囊和早期精母细胞,而参考图2m,野生型睾丸(ts)具有稳健的gfp标记的胞囊与细长的晚期精子细胞。参考图2f,尽管在dgrnaβtub,tra或grnaβtub,dsxf基因敲除雌雄间性中均未鉴定出gfp阳性睾丸(n>20),但是在两种雌雄间性类型中都存在成对的假定的雄性副腺样器官,如图2h、2j和2k中所显示。为了确认导致基因敲除表型的分子变化,对来自个体f1果蝇的两个靶向基因座进行了测序。参考图1g和2n-2q,与对照蝇类(n=32)相比,每个检查的双基因敲除蝇类(n=20)在切割位点处精确地具有嵌合插入/缺失,其防止通过pcr扩增子两端的测序。
实施例3.由合子表达导致的完全外显率。cas9/grna复合物在发育中的胚胎中的母本沉积足以确保接收后代中突变的非孟德尔继承,即使那些后代没有在基因上继承遗传编码编辑组分的基因。这种现象被称为显性母本效应,如在lin和potter,g3(2016)doi:10.1534/g3.116.034884中所描述的,其全部内容通过引用并入本文。在这方面,研究了与相容组分的母本沉积组合的核心组分之一(例如,cas9或dgrna)的父本继承,以确定是否任一种足以生成可遗传的突变。参考图1g和3b,纯合的cas9父亲与杂合的表达dgrna的母亲之间的交配不足以在未继承dgrna作为基因的f1后代中诱导突变(n=12)或基因敲除表型(n=6,n=252)。不受任何特定机制或理论的束缚,该结果可能是由于在母本沉积期间不存在cas9的情况下短dgrna半衰期的结果而导致的。参考图3a和3c,杂合cas9父亲和纯合的表达dgrna的母亲之间的交配导致继承cas9基因的所有反式杂合f1后代(n=27,n=2191)中的雄性不育和雌性致死/雄性化表型,而在仅继承dgrna编码基因的所有f1后代中保持正常特征(n=27,n=2640)。继续参考图3a和3c,杂合的cas9母亲和纯合的表达dgrna的父亲之间的杂交导致在所有的反式杂合f1后代中的雄性不育和雌性致死/雄性化表型(n=36,n=3019)。另外,参考图3a,当靶向tra或dsx时,cas9蛋白的母本贡献足以诱导未接受cas9基因的后代中的雌雄间性表型(n=24,n=782),这显示出显性母本效应。然而,参考图3a-3b,只有ubi-cas9(n=4;n=0,存活雌性的数量)而不是nos-cas9和vas-cas9(n=8,n=556)对cas9的母本贡献诱导dgrnaβtub,sxl/+;+/+雌性致死,这表明启动子强度可能影响突变效率。参考图1g和3b中,尽管接受由nos-cas9母本装载的cas9蛋白并接收dgrnaβtub,sxl基因的雌性没有致死性表型,但是这些存活的雌性在sxl基因座上有嵌合插入/缺失(n=2)。类似地,参考图1g和3a-3b,所有仅继承dgrna基因(n=36,n=1490)并具有母本装载的cas9蛋白的雄性后代对于所有指示的cas9品系都是可育的,但是每个基因分型的雄性(n=6)在βtub基因座具有嵌合插入/缺失。根据本公开内容的一些实施方式,如图3d中所描绘的,在不存在作为基因继承的cas9的情况下,引导多核苷酸(例如,grna)的父本继承连同核酸内切酶(例如,cas9)在发育中的胚胎中的母本沉积足以诱导可检测的双等位基因嵌合体。
实施例4.pgsit雄性对配偶的性竞争,并且其存活率没有降低。参考图4a,为了评估具有精确基因敲除雌性特异性存生存力和精子细胞成熟所需的单基因的pgsit雄性的总体和交配健康度,实施了交配竞争试验并计算了估计的存活曲线。参考图4b-4c,pgsit生成的雄性能够求偶(court)、交配并成功地与野生型雄性竞争。继续参考图4b-4c,与pgsit雄性相对于野生型雄性的78%的交配竞争力一致,相对于两个野生型雄性的85.1%±13.5%的卵孵化率(n=5,p>0.003)或一个野生型雄性的87.6%±7.2%的卵孵化率(n=5,p>0.001),一个野生型与一个pgsit雄性一起观察到47.9%±13.8%的降低的卵孵化率。参考图4d,与野生型雄性相比,pgsit雄性的存活期(例如寿命)没有受损。此外,如lin和potter,g3(2016)doi:10.1534/g3.116.034884所报道的,已知母本沉积的cas9影响后代表型,分别考虑两种类型的pgsit雄性,一种具有继承的父本cas9,和另一种母本cas9。参考图4d-4e,野生型雄性的中位存活时间估计为32.3±1.3天(n=5,n=275),而对于携带父本cas9和母本cas9的雄性,pgsit雄性的中位存活时间分别为52.7±1.6(n=5,n=220)和53.7±0.9天(n=5,n=275)。参考图4d,这两种cas9pgsit雄性的存活时间均显著长于野生型雄性(p<2.2–16),而这两种类型的pgsit雄性的寿命(以天为单位的存活时间)之间没有显著差异。考虑到报道了果蝇野生型雄性不同的中位存活时间,例如,35.5天(tatar等人,science292,107-110(2001)所报道的)和57天(clancy等人,science292,104–106(2001)和lin等,science282,943–946(1998)中所报道的),已知繁殖条件,例如食物成分、温度等影响存活时间。因为pgsit雄性的中位存活时间与报道的野生型雄性更长的存活时间相当,并且pgsit雄性显示出78%的交配竞争力,因此根据本公开内容的方法产生的基因工程化的pgsit雄性昆虫的存活率(例如寿命)或交配竞争力均未受到损害。
实施例5.pgsit抑制或减少蚊虫种群的潜力超过了当前方法。
为了评估本公开内容的pgsit方法与当前可用的自限性抑制或减少技术(例如ridl、fsridl和iit)相比如何,使用sanchez等人,(2018),doi:10.1101/350488中公开的mgdrive模拟框架模拟了这些技术中的每一种的释放方案,该文献的全部内容通过引用并入本文。该模拟框架模拟了卵、幼虫、蛹和成年蚊虫的生命阶段——具有重叠的代,随着幼虫密度的增加而增加的幼虫死亡率,以及交配结构,雌性将在它们的成年寿命期间与其交配的成年雄性的遗传物质保留在其中。参考图4f中的表格,对模拟框架进行了编程,用以释放到由10,000只成年雌性蚊虫组成的随机混合种群中,具有指示的模型和干预参数。
参考图4f-4g,对于ridl和iit,模拟了成年雄性的每周释放,并且对于fsridl和pgsit,模拟了6个月内的卵。按照在carvalho等人,(2015)(上文)中公开的巴西的埃及伊蚊ridl蚊虫的田间试验的先例,成虫释放率为每只野外成虫10只成年ridl/iit雄性,并且考虑到雌性埃及伊蚊(ae)在温带气候下每天大约产卵20个,如在otero等人,2006(同上)公开的,卵的释放率为每只野生成虫200只卵。这些模拟的结果表明,释放卵的系统(例如pgsit和fsridl)在最初的三周内导致最快的种群抑制或减少,因为释放的卵会迅速孵化为幼虫并且由于密度依赖性幼虫竞争降低可育幼虫的存活率。pgsit方法从第一个月末开始显示出最大的抑制或减少,并且在释放时期期间消除种群的潜力最大。这是由于pgsit雄性(野生型雄性的78%)——与之相比fsridl雄性(根据开曼群岛和巴西的ridl田间试验,大约是野生型雄性的5%)(分别是harris等人,2011和carvalho等人,2015)(同上)——的较高交配竞争力,当通过释放未成熟形式大量消耗幼虫资源而对抑制或减少较小影响时,这成为低种群密度下的显性因素。由于对密度依赖性幼虫竞争影响的延迟,成年ridl雄性以10:1释放导致的种群抑制或减少落后于fsridl卵释放2-3周,但幅度相似。成年iit雄性的等量释放对模拟策略的影响较小,这是因为通过沃尔巴克氏菌感染诱导雄性不相容性,并且通过低水平照射降低沃尔巴克氏菌感染的雌性干扰抑制或降低的意外释放的机会,如在zhang等人,20151和zhang等人,20152(上文),这导致释放的iit雄性的寿命大致减半,如yamada等人,2014(同上)中所报道的。
实施例6.材料和方法。
crispr靶位点设计.为了赋予雌性致死性和雄性不育性,分别在性别决定基因——性决定致死基因(sxl)、转换基因(tra)和双性基因(dsx)——的雌性特异性外显子内和雄性特异性基因——βtubulin85d(βtub)、fuzzyonions(fzo)、鱼精蛋白a(proa)和精母细胞阻滞(sa)——中选择了引导rna(grna)的靶位点。chopchopv2(如labun等人,nucleicacidsres.44,w272–6(2016)中所公开的,其全部内容通过引用并入本文)用于从果蝇基因组(dm6)中的指定序列选择grna靶位点以最小化脱靶切割。由于可变剪接,功能性sxl和tra蛋白仅在雌性果蝇中产生,而dsx蛋白的两种形式——雌性(dsxf)或雄性(dsxm)——各自在相应的性别中制成,如图1b中所描绘的。如在kemphues等人,cell21,445–451(1980)(上文)中所报道的,在βtub85dd(b2td)突变体等位基因附近选择βtub的grna靶标。在图1c中呈现了grna靶位点的序列。
构建体的设计和组装.如在gibson等人,nat.methods6,343–345(2009)中所公开的,使用gibson酶组装方法来构建所有的构建体,其全部内容通过引用并入本文。先前描述的带有spcas9-t2a-gfp——其中核定位信号(nls)侧接spcas9编码序列和opie2-dsred转化标记——的质粒用于构建本文使用的果蝇cas9构建体。如li等人,(2017)doi:10.1101/156778中所公开的,该质粒被用于埃及伊蚊转基因并且具有piggybac和attb-停靠位点(addgene#100608)。通过在noti&xhoi位点处切割并用nanos(nos)、或ubiquitin-63e(ubi)、或vasa(vas)启动子替换,将埃及伊蚊启动子从质粒去除,如图1c中示意性显示的。使用表1中列出的下述引物:nos-f、nos-r、ubi-f、ubi-r、vas-f和vas-f从果蝇基因组dnapcr扩增启动子片段。为了生成具有单grna的构建体,在白色基因和用于黑腹果蝇(d.melanogaster)转化的质粒内的attb-停靠位点之间的多克隆位点(mcs)处克隆果蝇u6-3启动子和具有靶标、支架和终止子信号的引导rna(grna),如在akbari等人,curr.biol.23,671–677(2013)中所描述的,其全部内容通过引用并入本文。对于该系列中的第一个质粒u6-3-grnaβtub,使用u6-1f和u6-2r引物从果蝇基因组dna中扩增果蝇u6-3启动子,同时从由整合dna技术(idt)合成的两个
表1.引物序列
蝇类遗传学和成像.将蝇类维持在25℃的标准条件下。在rainbowtransgenicflies,inc.(http://www.rainbowgene.com)进行胚胎注射。参考图1c,将cas9和grna构建体分别插入第3条染色体(bloomington#9750)上的pbac{y+-attp-3b}kv00033和第2条染色体(bloomington#9750)上的p{caryp}attp1;同时将βtub-gfp构建体插入第3条染色体(bloomington#24486)上的m{3xp3-rfp.attp’}zh-86fa。转基因蝇类用下述平衡:w1118;cyo/snasco和w1118;tm3、sb1/tm6b、tb1;并用下述双重平衡:w1118;cyo/sp;dr1/tm6c、sb、tb1。将βtub-gfp(第3条染色体上)双重平衡并用grnaβtub,sxl、grnaβtub、tra和grnaβtub、dsxf——每个在第2条染色体上——渐渗,以生成反式杂合平衡的原种(dgrna/cyo;βtub-gfp/tm6c,sb,tb)。
为了测试由sgrna引起的基因敲除效率和相应的表型,将每种性别的七只蝇类杂交以对于sgrna的每个组合生成反式杂合的f1sgrna/+;nos-cas9/+蝇类;并检查了它们的外部形态和生育力。两种转基因均在荧光立体显微镜下用w+眼(sgrna、dgrna)和dsred(cas9)鉴定。对于每个复制杂交,使用10♂和10♀蝇类在两个方向上,将引起基因敲除表型的sgrna系进一步测试为具有nos-cas9蝇类的纯合原种。用纯合的nos-cas9、vas-cas9和ubi-cas9系双向测试dgrna系。另外,将sgrna、dgrna和cas9纯合系在两个方向上与w-蝇类杂交以提供比较对照。如lin和potter,g3(2016)doi:10.1534/g3.116.034884中所公开的,为了测试作为蛋白质装载到胚胎中的cas9的非孟德尔显性母本效应,将纯合的dgrna蝇类与杂合的cas9蝇类杂交;并比较具有母本cas9或父本cas9的dgrna/+;+/tm3,sb后代的表型。来自与父本cas9杂交的f1后代用作对照组,以检查cas9的显性母本效应。为了测试生成的具有和不具有cas9基因的基因敲除蝇类的生育力,将10-20只f1雄性和雌性或雌雄间性的批次与相应地来自w-和/或cantoss原种的15-20只雌性处女型蝇类和雄性蝇类杂交。在杂交后三天或四天,将蝇类传代到新鲜的小瓶中,并在一周内检查两个小瓶中是否存在任何能成活的(viable)后代。当在一个小瓶中鉴定出能成活的幼虫时,将整个批次的生育力评分为100%,而在两个小瓶中均未孵化出后代时,其评分为0%。还检查了包含雌雄同体和野生型雄性的小瓶中产卵的存在性。所有的杂交至少重复三次,以生成用于统计比较的平均值和标准差,并且因此测量结果的一致性和稳健性。
蝇类在配备有leicadmc2900相机的leicam165fc荧光立体显微镜上进行评分、检查和成像。为了生成成年蝇类的图像,将在不同焦面板上收集的图像堆栈在heliosfocus6中编译为单个图像,并且然后在adobephotoshopcs6中编辑。为了研究雌雄间性蝇类和不育雄性的内部解剖学特征,将其生殖器官在pbs缓冲液中解剖(dissect)、检查并成像。为了评估基因敲除表型的变化,对于每种测试的基因型,解剖了大约10-20只蝇类。
sxl致死性的发育阶段.为了鉴定sxl基因敲除雌性死亡的发育阶段,对dgrnaβtub,sxl/+;nos-cas9/+反式杂合蝇类的卵孵化和幼虫死亡率进行了量化。为了量化卵孵化率,每个具有20-30只纯合的nos-cas9处女型雌性和10-20只dgrnaβtub,sxl雄性的三个复制杂交设置在具有葡萄汁琼脂板的胚胎收集笼(geneseescientific59-100)中。具有w-蝇类的三个胚胎收集笼用作比较对照。从每个收集笼中计数产卵大约200个的批次,并且跟踪36个小时以上以计数未孵化卵的数量。为了量化幼虫的死亡率,从每个琼脂板上转移两批次50只出现的幼虫以将蝇类瓶与食物分开,并饲养到成年,然后记录出现的成虫数量和性别。为了量化蛹阶段的致死性,还记录了每个小瓶中的死亡的蛹的数量。在表2和表3中分别呈现了grna(βtub.sxl)/+;nos-cas9/+胚胎的孵化率和雌性蛹致死率的数据。
表2.grna(βtub.sxl)/+;nos-cas9/+胚胎的孵化率。
表3.grna(βtub.sxl)/+;nos-cas9/+胚胎中的雌性蛹致死率。
dsx的雌性和雄性特异性剪接转录体的rt-pcr.为了评估tra基因敲除对dsx剪接的影响,我们筛选了tra基因敲除雌雄间性中dsx的雌性和雄性特异性mrna。按照mirvanamirna分离试剂盒(ambion)的标准方案,从成年w-雄性、w-雌性和tra基因敲除(dgrnaβtub,tra/+;nos-cas9/+)雌雄间性蝇类提取总rna。为了去除dna污染,使用turbodna-freetm试剂盒(ambion)用turbotmdnase处理2μg。按照该方案,用
用grna靶向的基因分型基因座.为了检查在携带cas9和grna的蝇类中引起雌性致死或雄性化和雄性不育的分子变化,扩增并测序了包括四个功能性grna的靶位点的四个基因座(图1c)。通过在30μl新鲜制备的压碎缓冲液(10mmtris-clph8.0、1mmedta、25mmnacl、200μg/ml蛋白酶k)中使蝇类均质化,在37℃下温育35分钟,并在95℃下加热2分钟,制备单蝇类基因组dna制备物。在利用
不育雄性的竞争试验.为了评估βtub基因敲除(grnaβtub,sxl/+;nos-cas9/+)雄性的竞争力,评估了在存在野生型雄性的情况下确保与雌性交配的能力。w-雄性与βtub基因敲除雄性享有相同的遗传背景,并且提供理想的比较。将两个野生型雄性、一个野生型雄性、一个野生型雄性加一个βtub基因敲除雄性或两个βtub基因敲除雄性放进具有在酵母糊上分离的十只w-处女型的蝇类瓶中持续两天,并允许求偶,并在黑暗中与雌性交配,过夜(12小时)。为了增加雄性求偶欲望,将新出现的dgrnaβtub,sxl/+;nos-cas9/+和野生型雄性与雌性隔离,并且在竞争试验之前老化(age)四天。雌性果蝇在寿命期间与多只雄性交配;并且在交合之后没有精子转移至受精囊的情况下,雌性在交合之后禁欲,持续一天,如在peng等人,curr.biol.15,207–213(2005)中所公开的,其全部内容通过引用并入本文。因此,在交配12小时之后,将所有的雄性从小瓶移出,同时将雌性转移至具有葡萄汁琼脂板的小型胚胎收集笼(geneseescientific59-100)中。在36小时内收集三批卵,并对未孵化的卵进行计数。通过未孵化卵的数量评估的生育力降低表明在存在野生型雄性的情况下grnaβtub,sxl/+;nos-cas9/+雄性与雌性获得成功交配的能力;并且因此提供对βtub基因敲除雄性的竞争力的解读(readout)。使用单个野生型雄性测试其在12小时内使十只雌性的每只受精的能力,并且因此在两只野生型雄性的真实竞争或稀释效应之间进行区分。
估计pgsit雄性的存活期的存活曲线.为了比较pgsit(grnaβtub,sxl/+;nos-cas9/+)和野生型雄性之间的存活差异,评估了三个实验组的雄性的平均存活期。将两种类型的pgsit蝇类作为单独的实验组处理——一种携带父本cas9和另一种携带母本cas9。运用三组的每组重复五次来估计存活曲线。每天收集每种类型的雄性,并以每小瓶20只雄性的批次老化。每次重复将40至75只雄性分别保存在2或4个小瓶中。在将蝇类转移到装有新鲜食物的新小瓶期间,每三天记录死亡蝇类的数量。通过计算每个组的存活曲线的非参数最大似然估计(npmle),分析三个实验组的至事件(例如死亡)的间隔检查时间数据,在r包“间隔”中实施,如在fay等人,j.stat.softw.36,(2010)中所描述的,其全部内容通过引用并入本文。估计程序考虑了三天观察时期引入的不确定性。应用具有10,000重复次数的辅助程序来量化中位存活时间和标准差。
数学建模.为了模拟与当前可用的自限性抑制或减少技术ridl、fsridl和iit相比,pgsit在抑制或减少局部埃及伊蚊种群方面的预期性能,使用mgdrive模拟框架针对每个模拟了释放方案,如sanchez等人,2018,doi:10.1101/350488(https://marshalllab.github.io/mgdrive/)中所公开的,其全部内容通过引用并入本文。该框架模拟了卵、幼虫、蛹和成年蚊虫的生命阶段(模拟了雄性和雌性成虫)——实现每日时间步长、重叠的代和交配结构,其中成年雄性在其一生中都在交配,而成年雌性在出现之后交配一次,在其成年寿命期间保留与之交配的成年雄性的遗传物质。假定在幼年生命阶段的密度依赖性死亡率是相同的,并且在没有密度依赖性死亡的情况下选择其与种群生长速率一致。在幼虫阶段发生另外的密度依赖性死亡,采取来自deredec等人,proc.natl.acad.sci.u.s.a.108,e874–80(2011)的形式,其全部内容通过引用并入本文。连同对成虫寿命、雄性交配竞争力和化蛹(pupatory)成功的影响,pgsit、ridl、fsridl和iit系统的继承模式在mgdrive框架https://paperpile.com/c/ckxxhc/fx0p6的继承模块中建模,如sanchez等人,2018,doi:10.1101/350488中所描述的。实施mgdrive框架的随机版本以捕获低种群规模时的随机效应以及种群消除的可能性。在6个月的时期内模拟每周释放到处于平衡的由10,000名成年雌性组成的随机混合种群中,在图4f中的表格中列出了埃及伊蚊生命史和干预参数值。
统计分析.通过sasinstituteinc.在jmp8.0.2中进行了统计分析。使用三到五个生物学重复来生成用于比较的统计手段。针对方差不相等的两样本学生t检验计算p值。为了检验雄性绝育的显著性,使用了皮尔森卡方检验列对联表计算p值。为了测试推断的存活曲线之间的差异,我们使用了sun的对数秩检验的概括,如sun,stat.med.15,1387–1395(1996)中所描述的,其全部内容通过引用并入本文。此外,我们采用保守的bonferroni校正对两个pgsit组之间的差异进行了成对事后检验。
保藏数据.完整的注释质粒序列和质粒dna是在addgene公众订购可获得的。转基因蝇类从bloomington果蝇保存中心订购可获得。
虽然已经参考某些示例性实施方式图解和描述了本公开内容,但是本领域普通技术人员将理解,可以在不背离本公开内容的精神和范围的情况下对所描述的实施方式进行各种修改和改变,如权利要求书中所限定的。
- 还没有人留言评论。精彩留言会获得点赞!