一种基于声致微流的冷冻防护剂导入去除微系统和方法、及细胞的低温保存方法与流程
本发明属于细胞低温保存技术领域,具体涉及一种基于声致微流的冷冻防护剂导入去除微系统,一种利用该冷冻防护剂导入去除微系统的冷冻防护剂导入去除方法,以及一种利用该冷冻防护剂导入去除方法的细胞的低温保存方法。
背景技术:
在临床应用中,普遍需要大量新鲜细胞供医疗使用,这便涉及到如何培养和保存细胞的问题。细胞低温保存(cryopreservation)技术是一种能有效延长细胞寿命的方法,且细胞的形态、完整性、功能等在保存过程中不受破坏。细胞低温保存技术的一个典型应用就是脐带间充质干细胞(umbilicalcordmatrixmesenchymalstemcells(hucm-mscs))的保存。由于间充质干细胞具有可再生的能力,使得其在细胞疗法中具有广泛的应用。但是临床应用前需要将此类干细胞低温保存,避免细胞出现染色体异常、恶性转化或功能受损等情况。
在低温保存技术中,需要使用冷冻防护剂(cryoprotectiveagent,cpa)抑制细胞在冷冻和解冻过程中胞内冰(intracellularice)的形成,因此在进行液氮低温保存前,需要将cpa导入(loading)到细胞中。由于cpa具有毒性,细胞进入临床使用前,需要将cpa从细胞中彻底去除(unloading)。传统cpa导入和去除的方法,采用试管,手动操作来完成。
具体地,cpa的导入和去除需要分成多步实现,每一步将不同浓度的cpa溶液与细胞溶液进行混合,通过手动摇晃试管使溶液充分混合,细胞壁内外cpa的浓度差导致cpa向细胞内扩散,置换胞内水。通过依次递增cpa浓度,可以将胞内水彻底置换成cpa。传统方式手动操作,耗时很长、对细胞产生的渗透压冲击和机械损伤(细胞与吸液管壁碰撞造成的)大,使得细胞的形态、完整性得到破坏,从而降低了细胞的存活率。还可能引入人为操作失误,生物交叉污染等。传统方式使用试管操作,因此不适用于微量细胞的操作和冷冻保护。
因此,迫切需要一种新的高效cpa导入和去除系统及细胞低温保存方法来解决上述问题,实现cpa的高效导入和去除,及细胞的快速冷冻,在整个低温保存过程中较好地保持细胞的形态、完整性,提高细胞的存活率。
技术实现要素:
本发明的目的是提供一种基于声致微流的冷冻防护剂导入去除微系统,该冷冻防护剂导入去除微系统利用声表面波器件的声致微流作用完成冷冻防护剂与胞内水的置换,实现将冷冻防护剂导入细胞和将冷冻防护剂从细胞中去除,降低了传统手动操作方式对细胞造成的渗透压冲击和机械损伤。
本发明的另一目的是提供一种基于声致微流的冷冻防护剂导入去除方法,该冷冻防护剂导入去除方法利用了上述冷冻防护剂导入去除微系统,分成多步将具有浓度差的冷冻防护剂与细胞培养液混合,降低了传统手动操作方式对细胞造成的渗透压冲击和机械损伤。
本发明的再一目的是提供一种细胞的低温保存方法,该细胞的低温保存方法利用了上述冷冻防护剂导入去除方法,因此,能够更好地保存细胞的形态和完整性,提高细胞的存活率。
为实现上述发明目的,本发明提供以下技术方案:
一种基于声致微流的冷冻防护剂导入去除系统,包括声表面波器件,对声表面波器件的部分表面进行疏水处理,形成疏水表面区域,在该疏水表面区域完成冷冻防护剂与胞内水的置换,实现将冷冻防护剂导入细胞和/或将冷冻防护剂从细胞中去除。
该声表面波器件工作时,即可以产生声表面波,该声表面波与疏水表面区域上的液滴相遇时,声表面波会以漏波的形式耦合到液滴中。在液滴中声表面波的能量迅速衰减,损失的能量转化为液体的动能,在液体内部形成液流,这种现象称为声致微流。在声致微流的作用下,cpa与细胞培养液快速均匀混合,在细胞内外冷冻防护剂浓度差的作用下,冷冻防护剂与胞内水发生置换,即可实现将冷冻防护剂导入细胞和/或去除细胞中的冷冻防护剂。
具体地,所述声表面波器件的微流致动能力由rayleigh微流实现,rayleigh微流具有漏波能量高、微流致动效果好的特点,有利于实现cpa和细胞培养液的快速充分混合,cpa与胞内水的快速、彻底置换。也可以利用其他能够产生声致微流的波实现功能类似的微系统,如板波和剪切波(剪切波也能引起声致微流)。
其中,所述声表面波器件的压电层采用铌酸锂、钽酸锂、石英、氧化锌、氮化铝等单晶材料或多晶材料。声表面波器件的尺寸约为1cm×1cm,具有微型化的特点。
本发明中,可以采用氟化处理或将silane(硅烷)等沉积在声表面波器件表面上,以实现对声表面波器件部分表面的疏水处理。形成的疏水表面有利于细胞培养液在表面上平滑移动或产生声致微流,降低细胞的机械损伤,使得细胞的完整性和表面形态保持良好,提高细胞存活率。
优选地,所述声表面波谐振器包括压电衬底、至少一个叉指换能器,其中,所述至少一个叉指换能器制备在所述压电衬底表面。
优选地,所述声表面波器件的驱动微波功率低于+34dbm。在该驱动微波功率范围内,通过精确调控驱动微波功率可以调整和优化冷冻防护剂多步导入和去除的效果。
进一步地,所述声表面波器件的工作频率为10~100mhz。较低的工作频率有助于提高声表面波与液体的相互作用,增加声表面波在液体中的衰减长度,从而增强微流致动性能。冷冻后的细胞壁较脆,过高的微波功率会形成过快的声致微流,从而造成细胞壁的破损。
进一步地,所述声表面波谐振器工作时的表面温度最大为37℃。该该温度适宜细胞的存活。为了降低细胞冷冻的成本和提高声表面波器件的利用率,所述cpa的导入和去除可使用同一个声表面波芯片。
一种基于声致微流的冷冻防护剂导入去除方法,包括以下步骤:
(1)提供上述的冷冻防护剂导入去除微系统,所述冷冻防护剂导入去除微系统包含声表面波器件;
(2)采用滴管或者微流控器件将冷冻防护剂和含有细胞的细胞培养液导入到所述声表面波器件上的疏水表面区域;
(3)用低于+34dbm的功率驱动所述声表面波器件,所述声表面波器件产生声表面波,在所述声表面波的驱动下,所述冷冻防护剂与所述细胞营养液混合均匀,在细胞内外冷冻防护剂的浓度差引起的扩散作用下,完成冷冻防护剂与胞内水的置换,实现将冷冻防护剂导入细胞或将冷冻防护剂从细胞中去除。
具体地,步骤(3)中,可以控制+27dbm~+34dbm的功率驱动所述声表面波谐振器。该范围的驱动功率能够更精确地冷冻防护剂多步导入和去除的效果。
一种细胞的低温保存方法,包括以下步骤:
(1)利用上述的冷冻防护剂导入去除方法将冷冻防护剂导入到细胞中;
(2)对导入了冷冻防护剂的细胞进行液氮冷冻;
(3)对液氮冷冻的细胞进行水浴解冻;
(4)利用上述的冷冻防护剂导入去除方法将水浴解冻的细胞进行处理,将细胞中的冷冻防护剂去除。
在发明提供的细胞的低温保存方法中,cpa的导入至少分成2步完成,举例说明可以分成3到6步完成,cpa的浓度依次递增。每一步将不同浓度的cpa与细胞培养液在声表面波器件的疏水表面区域完成混合,利用细胞壁内外cpa浓度差,通过扩散,与细胞内水实现交换。随着cpa的浓度依次递增,最终获得目标值的细胞内cpa浓度。具体地,步骤(1)包括:
(1-1)配置具有浓度差的至少2种浓度的冷冻防护剂;
(1-2)将最低浓度的冷冻防护剂和含有细胞的细胞培养液滴通过滴管或微流控器件导入到所述声表面波器件的疏水表面区域,用低于+34dbm的功率驱动所述声表面波器件,在声表面波的驱动下,最低浓度的冷冻防护剂与细胞培养液混合均匀,在8~12s声致微流的作用下,细胞内外的冷冻防护剂浓度达到平衡,实现将最低浓度的冷冻防护剂导入到细胞内;
(1-3)按照浓度由低到高,利用步骤(1-2)的方法,依次将不同浓度的冷冻防护剂导入到细胞内。
在发明提供的细胞的低温保存方法中,cpa的去除也至少分成2步完成,举例说明可以分成3到6步完成,cpa去除的步数越多,对细胞产生的渗透压冲击越小,细胞完整性和存活率越高。每一步将不同浓度的cpa与细胞培养液在声表面波器件的表面完成混合。细胞壁内外cpa的浓度差导致cpa向外扩散,实现水溶液与细胞内cpa的交换;且随着去除步数的增加,cpa的浓度递减至零,即将细胞内的cpa完全去除。具体地,步骤(4)包括:
(4-1)配置具有浓度差的至少3种浓度的冷冻防护剂;
(4-2)将最高浓度的冷冻防护剂和水浴解冻的细胞培养滴通过滴管或微流控器件导入到所述声表面波器件的疏水表面区域,用低于+34dbm的功率驱动所述声表面波器件,在声表面波的驱动下,最高浓度的冷冻防护剂与细胞培养液混合均匀,在8~12s声致微流的作用下,细胞内外的冷冻防护剂浓度达到平衡,以稀释细胞内的冷冻防护剂;
(4-3)按照浓度由高到低,利用步骤(4-2)的方法,依次利用不同浓度的冷冻防护剂稀释细胞内的冷冻防护剂,直到将细胞内的冷冻防护剂彻底去除。
上述的细胞的低温保存方法中,cpa的导入和去除均可在一分钟内完成,快速高效。
与现有技术相比,本发明具有的有益效果为:
本发明提供的冷冻防护剂导入去除微系统,利用声表面波器件的声波致流效应,可以自动实现对冷冻防护剂和细胞的混合。
本发明提供的冷冻防护剂导入去除方法,cpa的导入和去除在声表面波器件上实现,通过精确控制器件的驱动功率、液滴的容量和混合时间,可以自动、快速、高效地实现cpa与胞内水的置换。
本发明提供的细胞的低温保存方法,利用了上述冷冻防护剂导入去除方法实现将冷冻防护剂导入细胞和去除细胞中的冷冻防护剂。与传统的手动操作方式相比,该冷冻防护剂导入去除方法具有渗透压冲击小,机械损伤低的特点,使得细胞完整性和形态保持良好,细胞存活率大幅提高,可以避免人为操作失误/生物交叉污染,适用于微量细胞的低温保存等。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图做简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动前提下,还可以根据这些附图获得其他附图。
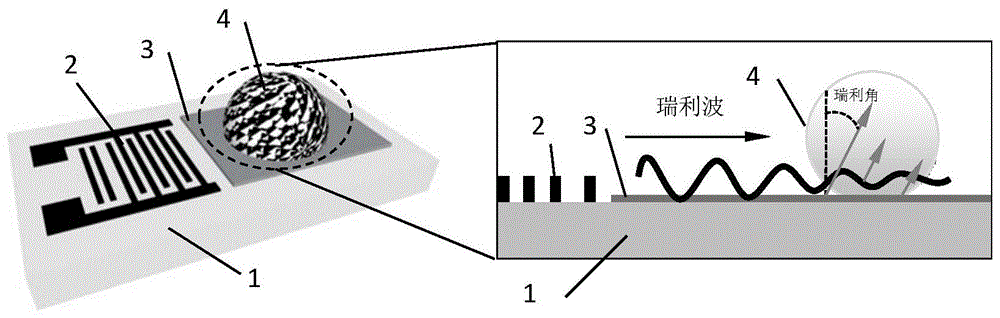
图1是实施例提供的冷冻防护剂导入去除系统的结构示意图,及rayleigh声致微流原理示意图;
图2是实施例提供的基于单个叉指换能器的cpa导入步骤示意图;
图3是实施例提供的基于单个叉指换能器的cpa去除步骤示意图;
图4是实施例提供的基于四个叉指换能器的cpa导入步骤示意图;
图5是实施例提供的基于四个叉指换能器的cpa去除步骤示意图;
图6是实施例提供的细胞的液氮冷却和水浴解冻步骤示意图;
标注说明:128°y-cutlinbo3压电衬底1,叉指换能器2,疏水表面3,液滴4,冷冻防护剂(cpa)5,人体脐带基质间充质干细胞(hucm-mscs)6,微流管道7,微流管道8,叉指换能器9,叉指换能器10,叉指换能器11。
具体实施方式
为使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例对本发明进行进一步的详细说明。应当理解,此处所描述的具体实施方式仅仅用以解释本发明,并不限定本发明的保护范围。
实施例1
参见图1,本实施例提供的基于声致微流的冷冻防护剂导入去除微系统包括声表面波器件,具体由128°y-cutlinbo3单晶压电衬底1、沉积在铌酸锂单晶压电衬底1上的图形化叉指换能器2构成单端声表面波谐振器。该单端声表面波谐振器的长度为0.9cm,宽度为0.6cm。
叉指换能器2的前方中间区域先进行氧等离子处理,接着在其表面通过氟化处理或蒸发一层silane(1h,1,2h,2h-perflurodecyltriethoxyl),来完成疏水表面3的处理。在进行cpa的导入和去除时,液滴4(cpa或细胞悬浮液)位于疏水表面3上。疏水表面3有助于液滴4的平滑移动或引入声致微流以迅速达到液体的均匀混合,降低对细胞造成的机械损伤。
进行cpa的导入和去除时,根据冷冻防护剂导入去除系统设计的波长,在叉指换能器2两端施加10~100mhz的交变信号,由于逆压电效应,128°y-cutlinbo3单晶压电衬底1的表面会激发rayleigh波。当rayleigh波与液滴4相遇时,rayleigh波会以漏波的形式耦合到液滴4中。在液滴4中rayleigh波的能量迅速衰减,损失的能量转化为液体的动能,在液体内部形成液流,这种现象称为声致微流。基于声致微流效应,当cpa与细胞悬浮液的混合液为液滴4时,便能实现cpa与细胞悬浮液的快速均匀混合。
在叉指换能器2两端施加交变信号时,信号的功率不宜过高,应低于+34dbm。在该功率范围内,声表面波谐振器工作时的表面温度及液体温度低于37℃,利于细胞的存活。信号功率较低时,声致微流速度较低,液体混合不均匀,会引起较大的渗透压冲击,造成细胞壁的破损。
实施例2
本实施例提供了一种基于单端声表面波谐振器的冷冻防护剂导入去除方法,具体采用如图1所示的冷冻防护剂导入去除系统,该单端声表面波谐振器由128°y-cutlinbo3单晶压电衬底1、沉积在铌酸锂单晶压电衬底1上的图形化叉指换能器2构成,通过氟化处理形成疏水表面3。
具体地,冷冻防护剂导入去除方法包括将冷冻防护剂导入到细胞中,和去除细胞中的冷冻防护剂,具体过程如下:
图2为将冷冻防护剂导入到细胞中的过程图,以将cpa导入到待低温保存的人体脐带基质间充质干细胞(humanumbilicalcordmatrixmesenchymalstemcells,hucm-mscs)6中为例,具体说明将冷冻防护剂导入到细胞中的过程:
(1)cpa溶液5为二甲基亚砜(dimethylsulfoxide,dmso)和海藻糖(trehalose)的混合液。配置3种不同浓度的cpa溶液,具体地,每一种浓度的cpa溶液都包含0.5m的trehalose,但是dmso浓度不同,分别为2m、3m、4m。其中,3m为液氮冷冻所需的dmso浓度。将3种不同浓度的cpa溶液标记为cpa#1、cpa#2、cpa#3。
(2)采用滴管将30ul的hucm-mscs培养液(含hucm-mscs细胞6)和30ul的cpa#1先后导入到声表面波器件的疏水表面区域。使用功率为28dbm的交变信号驱动声表面波器件,在rayleigh声波的驱动下,cpa#1与hucm-mscs培养液开始混合,cpa#1逐渐扩散到hucm-mscs细胞壁内,hucm-mscs细胞6中的水溶液渗出,hucm-mscs细胞6的体积开始减小。在约10s声致微流的作用下,细胞内外的cpa浓度达到平衡,完成cpa的第一步导入。
(3)在步骤(2)的基础上,采用滴管将30ul的cpa#2导入到声表面波器件疏水表面区域,与步骤(2)处理后的hucm-mscs细胞悬浮液混合。声表面波器件的驱动功率和频率保持不变,在rayleigh声波的驱动下,cpa#2与hucm-mscs悬浮液开始混合,cpa#2进一步扩散到hucm-mscs细胞壁内,hucm-mscs细胞6中的水溶液继续渗出,hucm-mscs细胞6的体积进一步减小。在约10s声致微流的作用下,细胞内外的cpa浓度达到平衡,完成cpa的第二步导入。
(4)在步骤(3)的基础上,采用滴管将30ul的cpa#3导入到疏水表面区域与步骤(3)处理后的hucm-mscs细胞悬浮液混合。声表面波器件的驱动功率和频率保持不变,在rayleigh声波的驱动下,cpa#3与hucm-mscs悬浮液开始混合,cpa#3继续扩散到hucm-mscs细胞壁内,hucm-mscs细胞6中的水溶液进一步渗出,hucm-mscs细胞6的体积进一步减小。在约10s声致微流的作用下,细胞内外的cpa浓度达到平衡,完成cpa的第三步导入。
至此,cpa的三步导入步骤全部完成。将hucm-mscs细胞悬浮液静置10分钟,经过扩散平衡后hucm-mscs细胞6的体积恢复到原始大小。图2中的坐标曲线图的三个峰示意了hucm-mscs细胞在cpa的三步导入过程中细胞体积的变化情况。
如图3所示,去除细胞中的冷冻防护剂的过程包括:
(a)配置6种浓度的cpa溶液,dmso的含量分别为0m,1m,1.5m,2m,2.5m,3m,trehalose的含量均为0.5m,分别标记为cpa0#、cpa1#、cpa2#、cpa3#、cpa4#、cpa5#。
(b)将待去除cpa的hucm-mscs细胞悬浮液导入到声表面波谐振器的疏水表面区域,再导入30ul的cpa#5,声表面波器件的驱动功率和频率保持不变,在rayleigh微流的驱动下,cpa#5与hucm-mscs细胞悬浮液开始混合,由于hucm-mscs细胞6内的cpa浓度比细胞外高,水溶液逐渐扩散到hucm-mscs细胞壁内,细胞中的cpa逐渐渗出,hucm-mscs细胞6的体积开始增大。声表面波器件工作10s后,完成cpa的第一步去除。
(c)在步骤(b)的基础上,滴30ulcpa#4于疏水表与步骤(b)处理后的hucm-mscs悬浮液混合。声表面波器件的驱动功率和频率保持不变,在rayleigh微流的驱动下,cpa#4与hucm-mscs细胞6培养液开始混合,水溶液继续扩散到hucm-mscs细胞壁内,hucm-mscs细胞6中的cpa进一步渗出,hucm-mscs细胞6体积进一步增大。声表面波器件工作10s后,完成cpa的第二步去除。
(d)在步骤(c)的基础上,按照步骤(c)的过程,将cpa3#与步骤(c)处理后的hucm-mscs悬浮液混合,以稀释细胞内的cpa,完成cpa的第三步去除。
(e)在步骤(d)的基础上,按照步骤(c)的过程,将cpa2#与步骤(d)处理后的hucm-mscs悬浮液混合,以稀释细胞内的cpa,完成cpa的第四步去除。
(f)在步骤(e)的基础上,按照步骤(c)的过程,将cpa1#与步骤(e)处理后的hucm-mscs悬浮液混合,以稀释细胞内的cpa,完成cpa的第五步去除。
(g)在步骤(f)的基础上,按照步骤(c)的过程,将cpa0#与步骤(f)处理后的hucm-mscs悬浮液混合,以稀释细胞内的cpa,完成cpa的第六步去除。
当步骤(a)~步骤(g)完成,hucm-mscs细胞6内的cpa被稀释到几乎为0,至此认为cpa被完全去除。将hucm-mscs细胞悬浮液静置10分钟,直至细胞体积恢复到原始大小。图3中的坐标曲线图的6个峰示意了hucm-mscs细胞在cpa的六步去除过程中细胞体积的变化情况。
本实施例利用利用声表面器件的微流致动效果,实现cpa与细胞溶液的快速均匀混合,通过细胞壁内外cpa的浓度差,实现cpa与胞内水的置换。该方法通过微流控器件实现cpa与细胞溶液的充分混合,降低了传统手动操作方式对细胞造成的机械损伤。通过cpa浓度递增(递减)的多步导入(去除)法将不同浓度的cpa与细胞溶液混合,可以降低每一步中细胞壁内外的cpa浓度梯度,降低渗透压冲击,更好地保存细胞的形态和完整性,提高细胞的存活率。
此外,还可以通过精确控制声表面波器件的驱动功率,调整cpa溶液导入(去除)的速度,获得最佳cpa导入(去除)效果,提高细胞的存活率。通过对声表面波器件的表面做疏水处理,能实现细胞在其表面更加平滑的移动混合,进一步降低对细胞造成的机械损伤。在此基础上,采用液氮冷却,可以实现细胞从液相到玻璃态的转变,无胞内及胞外结晶发生。
实施例3
如图4和图5,本实施例提供的声表面波器件包括128°y-cutlinbo3单晶压电衬底1、均匀沉积在铌酸锂单晶压电衬底1上的图形化叉指换能器2、叉指换能器9、叉指换能器10、叉指换能器11。先对4个叉指换能器的中心交叉区域进行氧等离子处理,接着在中心交叉区域蒸发一层silane(1h,1,2h,2h-perflurodecyltriethoxyl),以形成疏水表面3。微流管道8位于叉指环能器9和10之间,微流管道7位于叉指换能器2和叉指换能器11之间。将细胞液(冷冻前或解冻后)从微流管道7导入,在微流管道7左右两边的叉指换能器2和叉指换能器11的声致微流驱动下,细胞液将流动到疏水表面区域。将cpa溶液5从微流管道8导入,在微流管道8左右两边的叉指换能器9和10的声致微流驱动下,cpa溶液5将流动到疏水表面区域与细胞液6混合。
利用该声表面波器件进行冷冻防护剂导入去除方法过程和实施例2相同,在此不再赘述。
实施例4
本实施例提供了一种细胞的低温保存方法,该细胞的低温保存方法主要包括以下步骤:
步骤1,将冷冻防护剂导入到细胞中;
步骤2,对导入了冷冻防护剂的细胞进行液氮冷冻;
步骤3,对液氮冷冻的细胞进行水浴解冻;
步骤4,将水浴解冻的细胞中的冷冻防护剂去除。
其中,步骤1中,将冷冻防护剂导入到细胞中的具体过程如实施例2中的步骤(1)~步骤(4),步骤(1)和步骤(4)完成后,将细胞悬浮液静置10分钟,经过扩散平衡后细胞的体积恢复到原始大小。
如图6所示,步骤2中,使用移液管将hucm-mscs细胞悬浮液从疏水表面移取到试管中,接着使用注射器将hucm-mscs细胞悬浮液转移到吸管中,并放置在液氮(ln2)中进行快速玻璃化冷冻保存;
步骤3中,待需要使用hucm-mscs细胞6时,将吸管从液氮中取出,并放置在37℃水浴10中进行解冻。
步骤4中,将水浴解冻的细胞中的冷冻防护剂去除的具体过程如实施例2中步骤(a)~步骤(g),当步骤(a)~步骤(g)完成,细胞内的cpa被稀释到几乎为0,至此认为cpa被完全去除。将细胞悬浮液静置10分钟,直至细胞体积恢复到原始大小。
与传统的手动操作方式相比,该冷冻防护剂导入去除方法具有渗透压冲击小、机械损伤低的特点,使得细胞完整性和形态保持良好,细胞存活率大幅提高,可以避免人为操作失误/生物交叉污染,适用于微量细胞的低温保存等。
以上所述的具体实施方式对本发明的技术方案和有益效果进行了详细说明,应理解的是以上所述仅为本发明的最优选实施例,并不用于限制本发明,凡在本发明的原则范围内所做的任何修改、补充和等同替换等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!