咖啡愈伤组织的悬浮培养方法与流程
本发明涉及植物组织培养技术领域,尤其涉及咖啡愈伤组织的悬浮培养方法。
背景技术:
咖啡(coffeassp.)为茜草科咖啡属多年生常绿灌木或小乔木,与可可、茶并称为世界三大饮料作物,在世界热带农业经济、国际贸易及人们生活中占有重要地位,也是我国主要热带经济作物。
生产上咖啡栽培种主要包括中粒种(c.arabica)和小粒种(c.canaphara)。中粒种咖啡为异花授粉植物,通过种子繁殖会发生性状分离,子代不能保留亲本的优良性状。小粒种咖啡为自花授粉植物,经过多世代选育的纯系品种可通过种子繁殖,但常规纯系品种需经过多世代回交纯化,周期太长,育种效率低下。目前,杂交育种,特别是f1代杂交选育种已成为小粒种咖啡品种选育的趋势,而杂交品种必须通过无性繁殖才能保留杂交亲本的优良性状。目前,咖啡生产上主要通过嫁接、扦插等进行无性繁殖,且嫁接、扦插所用接穗和插条必须为长势旺盛的直生枝条,而每株咖啡树生长的直生枝数量很少,使大规模种苗生产受到限制,远远满足不了生产需要,优良咖啡品种不能得以大面积推广。
相较嫁接、扦插等传统无性繁殖方式,组织培养在高通量无性繁殖方面具有无可比拟的优势。咖啡组织培养主要通过体细胞胚胎发生方式进行,利用外植体先诱导出初级愈伤组织,在此基础上诱导胚性愈伤组织,再以胚性愈伤组织为材料诱导体细胞胚。目前,咖啡胚性愈伤组织诱导周期较长,从初级愈伤组织诱导出胚性愈伤组织一般需要半年以上时间,且部分咖啡品种胚性愈伤组织诱导率较低,通过胚性愈伤组织悬浮培养增殖,提高胚性愈伤组织得率是提高咖啡体胚发生组织培养种苗繁殖效率的有效手段。
1977年,sondahl等建立了咖啡间接体胚发生体系,使咖啡体胚发生效率大大提高,但仍面临胚性愈伤诱导、增殖效率较低等问题,影响咖啡体胚发生种苗繁育效率。
技术实现要素:
有鉴于此,本发明的目的在于提供一种咖啡愈伤组织的悬浮培养方法,使得该方法具有较高的悬浮增殖率,且获得的悬浮细胞可保持较高的胚性活力。
为了实现本发明的目的,本发明采用如下技术方案:
咖啡愈伤组织的悬浮培养方法,包括:
将咖啡胚性愈伤组织接种至悬浮培养基中进行悬浮起始培养;所述悬浮培养基由以下组分组成:50%ms大量元素、50%ms微量元素、50%ms铁盐、10mg/l半胱氨酸、5mg/l维生素b1、1mg/l尼克酰胺酸、1mg/l维生素b6、100mg/l肌醇、100mg/l酪蛋白、200mg/l麦芽提取物、1.5mg/l2,4-d、1.5mg/lkt、15mg/l蔗糖,ph值为5.6~5.8;
取所述悬浮起始培养后的新生细胞团,以0.03~0.04ml新生细胞团/1ml液体培养基的浓度接种至所述悬浮培养基中进行继代增殖培养。
一些实施方案中,所述咖啡愈伤组织为由咖啡叶片诱导获得的胚性愈伤组织。
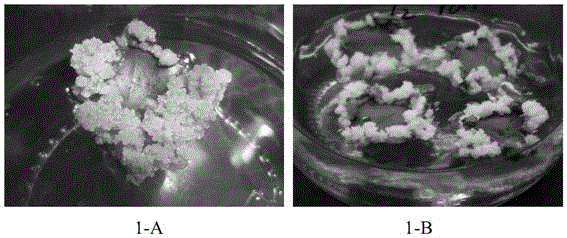
本发明所述的咖啡愈伤组织,以中粒咖啡或小粒咖啡为材料,根据sondahl的方法诱导获得。其中,中粒种与小粒种分别于2~4个月和5~8个月后诱导出胚性愈伤组织(如图1所示)。
本发明中,优选疏松易分离、富含细小球形胚,且发育时间不超过4周的咖啡愈伤组织进行悬浮培养。
一些具体实施例中,所述悬浮培养基由以下组分组成:
50%ms大量元素、50%ms微量元素、50%ms铁盐、10mg/l半胱氨酸、5mg/l维生素b1、1mg/l尼克酰胺酸、1mg/l维生素b6、100mg/l肌醇、100mg/l酪蛋白、200mg/l麦芽提取物、1.5mg/l2,4-d、1.5mg/lkt、15mg/l蔗糖,ph值为5.6。
一些实施方案中,所述悬浮起始培养中,咖啡愈伤组织的接种浓度为0.1g咖啡愈伤组织/5ml悬浮培养基。
一些实施方案中,所述继代增殖培养的接种浓度为0.03~0.04ml新生细胞团/1ml悬浮培养基。一些具体实施例中,继代增殖培养的接种浓度为0.03ml新生细胞团/1ml悬浮培养基或0.04ml新生细胞团/1ml悬浮培养基。
一些实施方案中,所述悬浮起始培养在27℃、全光照、光照强度1500lux的间接光源下进行培养。
一些实施方案中,所述悬浮起始培养的转速为100rpm。
一些实施方案中,所述悬浮起始培养的时间为30d。
本发明中,所述悬浮起始培养期间,每15天换液一次。
一些实施方案中,所述新生细胞团的直径小于1mm。
一些实施方案中,所述继代增殖培养的时间为90d,温度为27℃,光照强度1500lux。
一些具体实施例中,所述继代增殖培养包括三个阶段,具体包括:
取直径小于1mm的新生细胞团,以0.03ml新生细胞团/1ml液体培养基的浓度接种至12.5ml所述悬浮培养基中培养一个月;然后转移至25ml所述悬浮培养基中培养一个月;再转移至50ml所述悬浮培养基中培养一个月;
其中,继代增殖培养期间,每15天换液一次。
本发明将咖啡胚性愈伤组织接种至悬浮培养基中进行悬浮起始培养;然后取所述悬浮起始培养后的新生细胞团,以0.03~0.04ml新生细胞团/1ml液体培养基的浓度接种至所述悬浮培养基中继代增殖培养,获得大量增殖且细胞胚性强、分化和再生性好的稳定的悬浮细胞系。其中,继代增殖一个月后悬浮细胞的净增殖率达264%~312%。经本发明悬浮培养后获得的悬浮细胞,继续继代培养4个月后,依然能够保持稳定的分生增殖能力(图4);将图4所示的培养物接种于yasuda固体培养基上进行体胚诱导,结果发现,接种4~6周后,悬浮细胞萌发增殖并诱导出球形胚,10~12周后,球形胚逐渐发育成鱼雷型体胚,胚性活力良好(如图5所示)。
以上结果表明,经本发明悬浮培养后获得的悬浮细胞分生增殖能力高、胚性活力良好,继代4月后依然能够保持稳定的分生增殖能力和良好的胚性活力。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1示根据sondahl方法诱导的咖啡胚性愈伤组织,其中,1-a为小粒种咖啡胚性愈伤;1-b为中粒种咖啡胚性愈伤;
图2示实施例1中6孔培养皿悬浮起始培养;其中,2-a为胚性愈伤接种至6孔培养皿;2-b为在6孔培养皿培养1月后;
图3示本发明实施例1悬浮培养后获得的悬浮细胞,其中,3-a为接种至12.5ml悬浮培养液中培养一个月获得的悬浮细胞;3-b为转移至25ml悬浮培养液中培养一个月获得的悬浮细胞;3-c为转移至50ml所述悬浮培养基中培养一个月获得的悬浮细胞;
图4示实施例1悬浮培养后的悬浮细胞继续继代培养4个月后的增殖结果;
图5示图4所示的悬浮细胞体胚诱导结果,其中,5-a为球形胚诱导结果;5-b为鱼雷型体胚诱导结果。
具体实施方式
本发明公开了咖啡愈伤组织的悬浮培养方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
对所公开的实施例的说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
本发明采用的试材皆为普通市售品,皆可于市场购得。
本发明以中粒种和小粒种咖啡叶片作为外植体材料,根据sondahl的方法诱导胚性愈伤组织,作为本发明悬浮培养的起始材料。其中,中粒种与小粒种分别于2-4个月和5-8个月后诱导出胚性愈伤组织(图1所示)。
下面结合实施例,进一步阐述本发明:
实施例1本发明咖啡愈伤组织的悬浮培养方法
1、在体视显微镜下筛选疏松易分离,富含细小球形胚的咖啡胚性愈伤组织作为悬浮培养起始材料,以约0.1g/5ml的起始密度接种至每孔带有5ml悬浮培养基的6孔培养皿中。置于27℃、全光照、光照强度1500lux的间接光源条件下,100rpm的恒温摇床中进行悬浮培养。每15天更换培养液,培养1个月(如图2所示)。
2.利用10ml移液管筛选直径1mm以下的新生细胞团作为继代材料,依次继代至50ml三角瓶(含12.5ml悬浮培养基)、125ml三角瓶(含25ml悬浮培养基)和250ml三角瓶(含50ml悬浮培养基)中进行增殖培养。每次继代起始密度保持在0.03ml新生细胞团/1ml液体培养基,每15天更新一次培养液,每次继代培养时间为一个月。获得细胞团粒大小均匀、质量稳定的50ml胚性愈伤悬浮培养体系(图3)。
其中,悬浮培养基由以下组分组成:
50%ms大量元素、50%ms微量元素、50%ms铁盐、10mg/l半胱氨酸、5mg/l维生素b1、1mg/l尼克酰胺酸、1mg/l维生素b6、100mg/l肌醇、100mg/l酪蛋白、200mg/l麦芽提取物、1.5mg/l2,4-d、1.5mg/lkt、15mg/l蔗糖,ph值为5.6。
实施例2本发明咖啡愈伤组织的悬浮培养方法
1、在体视显微镜下筛选疏松易分离,富含细小球形胚的咖啡胚性愈伤组织作为悬浮培养起始材料,以约0.1g/5ml的起始密度接种至每孔带有5ml悬浮培养基的6孔培养皿中。置于27℃、全光照、光照强度1500lux的间接光源条件下,100rpm的恒温摇床中进行悬浮培养。每15天更换培养液,培养1个月。
2.利用10ml移液管筛选直径1mm以下的新生细胞团作为继代材料,依次继代至50ml三角瓶(含12.5ml悬浮培养基)、125ml三角瓶(含25ml悬浮培养基)和250ml三角瓶(含50ml悬浮培养基)中进行增殖培养。每次继代起始密度保持0.04ml新生细胞团/1ml悬浮培养基,每15天更新一次培养液,每次继代培养时间为一个月。获得细胞团粒大小均匀、质量稳定的50ml胚性愈伤悬浮培养体系(图3)。
其中,悬浮培养基由以下组分组成:
50%ms大量元素、50%ms微量元素、50%ms铁盐、10mg/l半胱氨酸、5mg/l维生素b1、1mg/l尼克酰胺酸、1mg/l维生素b6、100mg/l肌醇、100mg/l酪蛋白、200mg/l麦芽提取物、1.5mg/l2,4-d、1.5mg/lkt、15mg/l蔗糖,ph值为5.6。
实施例3增殖与胚性活力检测
按照实施例1步骤2的继代方法,对实施例1获得的50ml胚性愈伤悬浮培养系每个月继代至带有50ml实施例1悬浮培养基的250ml三角瓶中,进行增殖与胚性保持,4个月后,悬浮培养系依旧保持稳定的分生增殖能力(如图4所示)。采集培养物样品在yasuda固体培养基上进行体胚诱导,测试培养物胚性活力。结果表明,接种4~6周后,悬浮细胞萌发增殖并诱导出球形胚,10~12周后,球形胚逐渐发育成鱼雷型体胚,胚性活力良好(如图5所示)。
对比例:1~7
对比例1~2与实施例1悬浮培养方法相比,继代增殖培养时新生细胞团的接种浓度不同,其他条件相同。对比例3~7与实施例1的悬浮培养方法相比,悬浮培养基的配方不同,其他条件相同,其中:
对比例1:继代增殖培养的接种浓度为0.05ml新生细胞团/1ml培养基。
对比例2:继代增殖培养的接种浓度为0.02ml新生细胞团/1ml培养基。
对比例3:悬浮培养基由以下组分组成:
50%ms大量元素、50%ms微量元素、50%ms铁盐、10mg/l半胱氨酸、5mg/l维生素b1、1mg/l尼克酰胺酸、1mg/l维生素b6、100mg/l肌醇、100mg/l酪蛋白、200mg/l麦芽提取物、1mg/l2,4-d、2mg/lkt、15mg/l蔗糖,ph值为5.6。
对比例4:悬浮培养基由以下组分组成:
50%ms大量元素、50%ms微量元素、50%ms铁盐、10mg/l半胱氨酸、5mg/l维生素b1、1mg/l尼克酰胺酸、1mg/l维生素b6、100mg/l肌醇、100mg/l酪蛋白、200mg/l麦芽提取物、1mg/l2,4-d、1mg/lkt、15mg/l蔗糖,ph值为5.6。
对比例5:悬浮培养基由以下组分组成:
50%ms大量元素、50%ms微量元素、50%ms铁盐、10mg/l半胱氨酸、5mg/l维生素b1、1mg/l尼克酰胺酸、1mg/l维生素b6、100mg/l肌醇、100mg/l酪蛋白、200mg/l麦芽提取物、2mg/l2,4-d、1mg/lkt、15mg/l蔗糖,ph值为5.6。
对比例6:悬浮培养基由以下组分组成:
50%ms大量元素、50%ms微量元素、50%ms铁盐、10mg/l半胱氨酸、5mg/l维生素b1、1mg/l尼克酰胺酸、1mg/l维生素b6、100mg/l肌醇、100mg/l酪蛋白、200mg/l麦芽提取物、0.5mg/l2,4-d、0.5mg/lkt、15mg/l蔗糖,ph值为5.6。
对比例7:悬浮培养基由以下组分组成:
50%ms大量元素、50%ms微量元素、50%ms铁盐、10mg/l半胱氨酸、5mg/l维生素b1、1mg/l尼克酰胺酸、1mg/l维生素b6、100mg/l肌醇、100mg/l酪蛋白、200mg/l麦芽提取物、2mg/l2,4-d、2mg/lkt、15mg/l蔗糖,ph值为5.6。
根据sondahl方法诱导咖啡愈伤组织,选同一实验批次诱导的愈伤作为悬浮培养的起始材料。按照实施例1~2、对比例1~7的方法对进行悬浮培养,对悬浮增殖及胚性活力进行检测,结果见表1。
表1
注:胚性活力按体胚诱导率分为4个等级。体胚诱导率≥75%为优;≥50%,<75%为良;≥25%,<50%为中;<25%为差。
结果表明,综合考虑悬浮增殖率和悬浮细胞胚性活力,本发明实施例1~2的悬浮培养方法增殖效率与胚性活力均能保持较好水平,适用于咖啡愈伤组织的悬浮培养。其中,实施例1的效果最佳。
实施例4不同培养时间对悬浮培养及其胚性的影响
本实施例比较了不同时间(1~7个月)的继代增殖培养对悬浮培养及其胚性的影响,其他条件与实施例1相同,结果见表2。
表2不同培养时间对悬浮培养及其胚性的影响比较
注:胚性活力按体胚诱导率分为4个等级。体胚诱导率≥75%为优;≥50%,<75%为良;≥25%,<50%为中;<25%为差。
结果表明,随着继代次数的增加和悬浮培养时间的延长,悬浮培养的增殖效果和体胚诱导率在继代培养三个月达到了最佳效果。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!