植物用抗性诱导剂的制作方法
[0001]
本发明涉及pr1基因表达诱导活化剂、植物用抗性诱导剂、以及植物病害预防剂。
背景技术:
[0002]
在农作物及园艺用植物等农业相关领域,大多使用农药来减少由病原菌引起的病害、促进生长或提高产量。但是由于使用农药会有导致农药暴露、造成环境负担以及存在农药残留的危险,因此需要减少农药使用量。
[0003]
近年来,通过转基因来增强害虫抗性(bt)和除草剂耐受性的品种得到普及,但这些品种仅限于特定品种。另外,非转基因的农作物、园艺用植物等更受青睐。
[0004]
为了得到满足这些要求的农药,正在进行植物用抗性诱导剂的开发。植物用抗性诱导作用并不是杀灭病原体,而是活化植物固有防御机制。通过这种活化,植物本身即可抵御病原体。通常,由于具有该植物用抗性诱导作用的化合物不依赖于杀虫、杀菌活性,具有耐药菌出现率低、使用量少、效果持久、对防除目标以外的生物影响小等优点。另外,这种植物用抗性诱导化合物与品种改良、转基因作物不同,可在必要时于必要场所用于必要植物(例如农作物、园艺用植物等),还具有通用性高的优点。
[0005]
作为植物用抗性诱导化合物,已知有水杨酸、烯丙异噻唑、井冈霉素a等,这些化合物已得到实际使用,并作为植物用抗性诱导剂在市场中销售。当使用了该植物用抗性诱导剂的植物感知到植物的系统获得抗性病原体的攻击时,会提高植物体中水杨酸的浓度,再通过转录调控因子npr1来表达pr基因群,提高对病原体的抗性。即,植物用抗性诱导剂能够打开植物体pr基因群的开关,使植物体整体获得对病原体的抗性。
[0006]
另外,为了探索新型植物用抗性诱导剂,基于sar模型进行了利用pr-1α基因的基因表达监测系统的筛选方法的开发。
[0007]
例如,专利文献1公开了以下内容,即,含卤素和氧基的杂环化合物等具有pr-1α基因表达增强作用,通过该表达增强作用能够诱导或促进具有广抗菌谱的pr蛋白质的表达,并且能够诱导植物用抗性。
[0008]
现有技术文献
[0009]
专利文献
[0010]
专利文献1:日本特开2013-124241号公开
[0011]
专利文献2:日本特开2017-197456号公开
[0012]
非专利文献
[0013]
非专利文献1:荧光素酶生物发光报告系统对烟草pr-1α启动子监测防御基因表达的评估,《生物科学,生物技术和生物化学》(evaluation of the use of the tobacco pr-1αpromoter to monitor defense gene expression by the luciferase bioluminescence reporter system,biosci.biotechnol.biochem.),75(9),1796-1800(2011).
技术实现要素:
[0014]
发明要解决的课题
[0015]
然而,植物用抗性诱导剂的研发知识还远远不够。因此对具有植物用抗性诱导作用的成分进行了各种研究。本发明人等认为,这些成分是向提高植物抗性方面进行诱导的成分,因此导致植物生长抑制等的缺点很少。
[0016]
因此,本发明的主要目的是提供一种具有植物用抗性诱导作用的成分。
[0017]
解决课题的手段
[0018]
本发明人等通过pr-1α基因表达诱导活性试验发现了具有参与植物用抗性诱导的pr1基因表达诱导活性作用的化合物。
[0019]
本发明人等经过深入研究,发现了一种具有绿色光合色素的单细胞藻类的培养物,该培养物中含有胞外多糖,该培养物具有pr-1α基因表达诱导活性作用以及植物用抗性诱导作用,从而完成了本发明。本发明内容如下。
[0020]
〔1〕一种pr1基因表达诱导活化剂,其以绿色光合色素的单细胞藻类的培养物作为有效成分。
[0021]
〔2〕如上述〔1〕所述的pr1基因活化剂,其中,上述藻类为trebouxiophyceae(共球藻纲)藻类和/或chlorophyceae(绿藻纲)藻类。
[0022]
〔3〕如上述〔1〕或〔2〕所述的pr1基因活化剂,其中,上述藻类为选自双胞藻属、尾丝藻属、绿球藻属以及椭圆球藻属中的1种或2种以上。
[0023]
〔4〕如上述〔1〕至〔3〕中任一者所述的pr1基因活化剂,其中,上述培养物中的胞外多糖至少含有糖醛酸。
[0024]
〔5〕如上述〔1〕至〔4〕中任一者所述的pr1基因活化剂,其中,上述培养物中的胞外多糖至少含有糖醛酸5~40质量%和中性单糖,该中性单糖为选自甘露糖、半乳糖和鼠李糖中的1种或2种以上。
[0025]
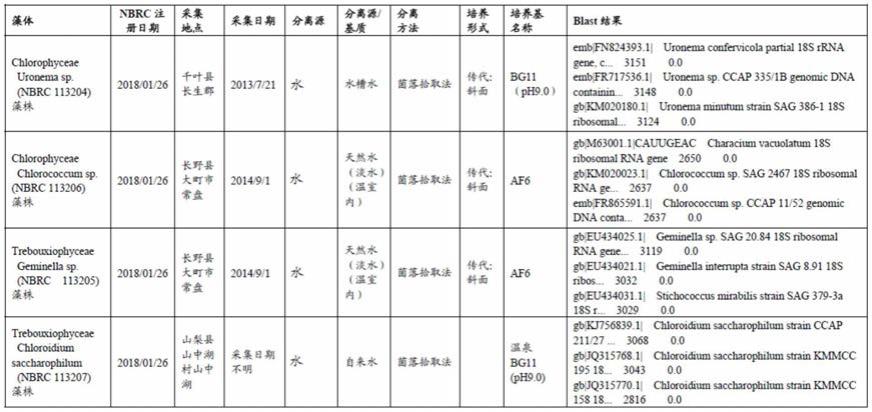
〔6〕如上述〔1〕至〔5〕中任一者所述的pr1基因活化剂,其中,上述藻体为选自[1]chlorophyceae uronema sp.(nbrc 113204)藻株、[2]trebouxiophyceae geminella sp.(nbrc 113205)藻株、[3]chlorophyceae chlorococcum sp.(nbrc 113206)藻株、[4]trebouxiophyceae chloroidium saccharophilum yama(nbrc 113207)藻株、[5]trebouxiophyceae chloroidium saccharophilum kami(nbrc 113807)藻株中的1种或2种以上。
[0026]
〔7〕一种植物用抗性诱导剂,其以具有绿色光合色素的单细胞藻类的培养物作为有效成分。
[0027]
〔8〕一种植物病害预防改善剂,其以具有绿色光合色素的单细胞藻类的培养物作为有效成分。
[0028]
〔9〕一种植物用抗性诱导成分的制备方法,其中,将具有绿色光合色素的单细胞藻类在有氧条件下培养,得到含有胞外多糖的培养物。
[0029]
〔10〕具有绿色光合色素的单细胞藻类在制备植物用抗性诱导成分中的使用。
[0030]
发明效果
[0031]
根据本发明,可提供具有植物用抗性诱导作用的成分。应予说明,这里记载的效果并未被限定,可以是本说明书中记载的任意效果。
附图说明
[0032]
图1表示各藻类的培养物、昆布多糖(阳性对照)、对照(h2o)的活性强度的经时变化。
具体实施方式
[0033]
接下来对本发明的优选实施方式进行说明。但是本发明并非限定于以下优选实施方式,可以在本发明的范围内自由变更。应予说明,在本说明书中,除非另有说明,百分比为质量百分比。
[0034]
1.绿色藻类的培养物及其制备方法
[0035]
本发明是以具有绿色光合色素的单细胞藻类的培养物作为有效成分的pr1基因表达诱导活化剂、植物用抗性诱导剂或者植物病害预防剂。
[0036]
如下文所述,本发明的培养物具有pr1基因表达诱导活性作用、植物用抗性诱导作用或者植物病害预防作用。该培养物优选含有细胞外产生的多糖。
[0037]
本发明的具有绿色光合色素的单细胞藻类(以下也称为“绿色单细胞藻类”)的培养物可使用该绿色藻类按以下方法制备,但并非限定于该制备方法。
[0038]
本说明书中的“具有绿色光合色素的藻类”是指广义上外观呈绿色的藻类,含有作为光合色素的叶绿素a和b,也可以含有其以外的叶绿素或色素。另外,该单细胞藻类并不限定于单细胞的状态,也可以在培养中成为群体状态。
[0039]
本发明中使用的绿色单细胞藻类没有特别限定,例如可举出chlorophyceae(绿藻纲)藻类和/或trebouxiophyceae(共球藻纲)藻类等。
[0040]
另外,本发明中使用的绿色单细胞藻类没有特别限定,例如为选自裸藻、小球藻、尾丝藻属、绿球藻属、双胞藻属和椭圆球藻属中的1种或2种以上。其中,优选选自双胞藻属、尾丝藻属、绿球藻属和椭圆球藻属中的1种或2种以上。另外,这些各种藻株可举出属于市售产品的藻株、保存于微生物保藏机构培养物保藏所(例如nbrc(nite生物资源中心)保藏中心(nbrc(nite biological resource center)culture collection)、atcc(美国菌种保藏中心(american type culture collection))等)的藻株、根据布达佩斯条约在国际保藏机构(例如nite(国立技术与评估研究所(national institute of technology and evaluation))等)作为保藏菌株保存的藻株、将来发现的藻株等,可选择产生起到本发明目的的效果即pr1基因活化作用的培养物的藻株。
[0041]
例如可以从nbrc(nite生物资源中心)的培养物保藏获得以下[1]至[5]的藻株,可使用其中的1种或2种以上。
[0042]
[1]chlorophyceae uronema sp.(nbrc 113204)藻株:nbrc 113204 uronema sp.(http://www.nbrc.nite.go.jp/nbrc2/nbrccataloguedetailservlet?id=nbrc&cat=00113204)/公开2018/03/29;
[0043]
[2]trebouxiophyceae geminella sp.(nbrc 113205)藻株:nbrc 113205 geminella sp.(http://www.nbrc.nite.go.jp/nbrc2/nbrccataloguedetailservlet?id=nbrc&cat=00113205)/公开2018/03/29;
[0044]
[3]chlorophyceae chlorococcum sp.(nbrc 113206)藻株:nbrc 113206 chlorococcum sp.(http://www.nbrc.nite.go.jp/nbrc2/nbrccataloguedetailservlet?
id=nbrc&cat=00113206)/公开2018/03/29;
[0045]
[4]trebouxiophyceae chloroidium saccharophilum yama(nbrc 113207)(yama-mizu-03-3)藻株:nbrc 113207chloroidium saccharophilum(http://www.nbrc.nite.go.jp/nbrc2/nbrccataloguedetailservlet?id=nbrc&cat=00113207)/公开2018/03/29;
[0046]
[5]trebouxiophyceae chloroidium saccharophilum kami(nbrc 113807)(kami-04(3))藻株:nbrc 113807chloroidium saccharophilum(http://www.nbrc.nite.go.jp/nbrc2/nbrccataloguedetailservlet?id=nbrc&cat=00113807)/公开2019/02/25。
[0047]
应予说明,nbrc(nite biological resource center)的主页地址于2019年3月由「http://www.nbrc.nite.go.jp/nbrc2/nbrccataloguedetailservlet?id=nbrc&cat==00******(*为nbrc no.)变更为「https://www.nite.go.jp/nbrc/catalogue/nbrccataloguedetailservlet?id=nbrc&cat=00******」。
[0048]
作为上述chlorophyceae(绿藻纲)藻类,例如可举出chlorophyceae uronema(尾丝藻属)藻类、chlorophyceae chlorococcum(绿球藻属)藻类等。
[0049]
作为上述trebouxiophyceae(共球藻纲)藻类,例如可举出trebouxiophyceae geminella(双胞藻属)藻类、trebouxiophyceae chloroidium(椭圆球藻属)藻类等。
[0050]
作为椭圆球藻属,从可良好地发挥出本发明效果的观点出发,优选椭圆球藻属(chloroidium)藻。作为椭圆球藻属,优选trebouxiophyceae chloroidium saccharophilum(nbrc 113207)等。
[0051]
作为裸藻,从可良好地发挥出本发明效果的观点出发,优选裸藻属(euglena)藻。作为裸藻,例如优选细小裸藻等。
[0052]
作为小球藻,从可良好地发挥出本发明效果的观点出发,优选小球藻属(chlorella)藻。作为小球藻,例如可举出普通小球藻等,优选chlorella vulgaris chikugo株(chikugo株:chlorella industry co.,ltd.)等。
[0053]
作为尾丝藻属,从可良好地发挥出本发明效果的观点出发,优选尾丝藻属(uronema)藻。作为尾丝藻属,优选chlorophyceae uronema sp.(nbrc 113204)等。
[0054]
作为绿球藻属,从可良好地发挥出本发明效果的观点出发,优选绿球藻属(chlorococcum)藻。作为绿球藻属,优选chlorophyceae chlorococcum sp.(nbrc 113206)等。
[0055]
作为双胞藻属,从可良好地发挥出本发明效果的观点出发,优选双胞藻属(geminella)藻。作为双胞藻属,优选trebouxiophyceae geminella sp.(nbrc 113205)等。
[0056]
作为椭圆球藻属,从可良好地发挥出本发明效果的观点出发,优选椭圆球藻属(chloroidium)藻。作为椭圆球藻属,优选trebouxiophyceae chloroidium saccharophilum yama(nbrc 113207)(yama-mizu-03-3)(以下也称为yama)和/或trebouxiophyceae chloroidium saccharophilum kami(nbrc 113807)(kami-04-(3))(以下,也称为kami)等,从生产率的观点出发,更优选为trebouxiophyceae chloroidium saccharophilum kami(nbrc 113807)。
[0057]
在本发明中,与上述藻株实质上同种的藻株即可。实质上同种的藻株是指其
18srrna基因的碱基序列(例如序列号1~5)分别有99.5%以上(优选99.8%以上、更优选100%)一致,且优选具有与上述藻株相同的藻类学性质(形态观察及胞外多糖产生)。此外,只要不损害本发明的效果(特别是pr1基因活化作用成分的产生能力),本发明的藻株也可以是从上述藻株或与其实质上同种的藻株通过变异处理、转基因、自然变异株的选择等育种后得到的藻株。
[0058]
作为培养本发明的绿色单细胞藻类制备培养物时所使用的培养基,优选可培养一般单细胞藻类的基础培养基。
[0059]
可培养一般单细胞藻类的基础培养基中,例如作为无机盐,可举出kh2po4、mgso4等微量无机成分,作为氮源,含有硫酸铵、尿素等。该基础培养基中各成分的含量优选为
±
10%的范围。
[0060]
作为上述基础培养基,更具体而言,例如可举出下文〔实施例〕所示的af6培养基、bg11培养基、ko2培养基等。其中,使用af6培养基时,优选小球藻、绿球藻属、双胞藻属、椭圆球藻属、裸藻等。使用bg11培养基时,优选尾丝藻属、椭圆球藻属等。使用ko2培养基时,优选裸藻等。
[0061]
在进行制备本发明培养物的培养时,优选在有氧条件下培养,该条件能够稳定产生含上述多糖的培养物。从提高多糖生产率的观点考虑,优选通气培养。作为通气手段,例如可举出搅拌、振荡、通气和起泡等。这些手段可以单独进行也可以组合2种以上进行。由此可在培养基中混合适度的气体。
[0062]
培养温度没有特别限定,5~40℃的常温程度即可。
[0063]
另外,培养基中的ph(20℃)优选为所使用的培养基组成的ph
±
2,更优选为ph
±
1。另外,培养基中的ph优选为1.5~9.5。使用尾丝藻属、绿球藻属、双胞藻属、椭圆球藻属和小球藻时,培养基中的ph更优选为6~9。
[0064]
培养时间没有特别限定,以4天~3周左右为1个周期适合于产生多糖。更优选为7天~2周左右。
[0065]
培养照度没有特别限定,从容易获得含多糖的培养物的观点出发,优选为1500~10000lux。
[0066]
另外,在自养培养条件下增加藻体数时,可使用阳光;植物栽培用灯、led等人工光源等的光,优选补充二氧化碳气体并搅拌。
[0067]
应予说明,使用本发明的绿色单细胞藻类(优选小球藻、绿球藻属、双胞藻属、裸藻、尾丝藻属、椭圆球藻属)产生含多糖的培养物时,可采用自养培养,这也是本发明的优点。
[0068]
另外,本发明不限定于自养培养下的培养物的生产方法,可以使能培养一般的单细胞藻类的基础培养基中含有葡萄糖等碳源来产生含多糖的培养物。另外,培养基中含有碳源、氮源、磷即可,作为本发明所使用的培养基,也可以使用污水、甲烷发酵罐中产生的消化液(液肥)。
[0069]
另外,本发明的培养物的生产方法可以是间歇式和连续式中的任一者,优选连续式,因为其可提高生产率。另外,开放式培养和封闭式培养均可,例如可举出培养罐内的封闭培养和开放式的露天培养等。从培养条件管理的方面考虑,优选封闭式培养。
[0070]
使上述单细胞緑藻类产生本发明的培养物后,通过水溶液清洗、超声波、离心分
离、过滤等物理手段和化学手段将含多糖的培养物从藻体中分离,优选得到含多糖的上清液。
[0071]
本发明中,推测藻体外的代谢产物在一定程度上有助于本发明的效果,因此该培养物中除了多糖以外还可以含有各种藻类的代谢产物(例如蛋白质、肽、氨基酸、核酸、有机酸、脂质等)。
[0072]
另外,作为本发明的培养物,可使用藻体外的代谢产物,因此能够边从培养后的藻体表面分离多糖边连续获得培养物,从能够连续培养的观点考虑,可以说本发明的藻类是优异的。作为连续获得培养物的方法,例如可单独使用或者组合使用离心分离(优选5000~9000rpm、5分钟左右)和过滤(例如助滤剂和过滤器等)。
[0073]
得到的培养物可以适当调整为稀释液、浓缩液或干燥物等状态。作为干燥手段,优选冷冻干燥。
[0074]
本发明的培养物中优选至少含有多糖,在不损害本发明效果的范围内,可以在该多糖中结合糖质以外的物质(例如蛋白质、肽、氨基酸、核酸、有机酸、脂质等),作为这样的多糖,例如可举出糖蛋白、肽聚糖、糖脂质等。
[0075]
对于本发明的多糖产量,在培养液中可得到20mg/l以上,更优选为50mg/l以上,进一步优选为100mg/l以上。本发明可将产量提高至300~500mg/l。
[0076]
作为多糖生产率高的藻类,优选为绿球藻属和椭圆球藻属。另外,作为产生效果高的多糖的藻类,优选绿球藻属和尾丝藻属。
[0077]
本发明中,藻类的培养物中按干燥物质换算优选含有20质量%以上的多糖,更优选含有20质量%以上的中性单糖。
[0078]
另外,藻类的培养物中的多糖优选含有5质量%以上的糖醛酸,更优选含有10质量%以上,作为其上限值优选为40质量%以下、更优选为35质量%以下、进一步优选为30质量%以下、更进一步优选为25质量%以下,作为该数值范围,更优选为5~30质量%。该多糖优选为胞外多糖,因为其容易回收,可期望实现高生产效率和高产量。
[0079]
本发明的绿色单细胞藻类(优选chlorophyceae藻类和/或trebouxiophyceae藻类)产生的多糖没有特别限定,优选至少含有糖醛酸作为本发明的多糖的单糖组成,该糖醛酸优选为葡萄糖醛酸,但并不限定于此。由此可期待下文所述的pr1基因活化等本发明的效果。
[0080]
另外,作为本发明的多糖中含有的中性单糖优选六碳糖(优选己醛糖)。作为该中性单糖,更具体而言,从本发明效果的观点考虑,优选至少以甘露糖、半乳糖和鼠李糖中的任意1种或2种以上作为主要单糖组成。此外,从本发明效果的观点考虑,优选该中性单糖中至少含有甘露糖或鼠李糖。
[0081]
本发明的培养物中的胞外多糖优选至少包括糖醛酸,进一步优选本发明的多糖中含有糖醛酸和中性单糖作为本发明的多糖的单糖组成。由此,可期待下文阐述的pr1基因活化等本发明的效果。此时的中性单糖进一步优选为选自甘露糖、半乳糖和鼠李糖中的1种或2种以上。
[0082]
此外,从发挥出本发明良好效果的观点考虑,优选上述选自尾丝藻属、绿球藻属、双胞藻属和椭圆球藻属中的1种或2种以上的藻类所生产的培养物中含有的多糖。
[0083]
作为上述尾丝藻属产生的多糖的产量,优选培养液中为20mg/l以上。
[0084]
尾丝藻属产物中的胞外多糖(以下也称为“尾丝藻属多糖”)优选含有糖醛酸,其下限值优选为5质量%以上,更优选为10质量%以上,进一步优选为15质量%以上,另外其上限值优选为35质量%以下,更优选为30质量%以下,该数值范围更优选为10~30质量%。该尾丝藻属多糖中更优选含有葡萄糖醛酸,下限值优选为5质量%以上,更优选为10质量%以上,另外,上限值优选为30质量%以下,更优选为20质量%以下,该数值范围更优选为5~15质量%,进一步优选为10~15质量%。
[0085]
尾丝藻属产物中的多糖作为中性单糖优选含有20质量%以上,作为其它成分优选含有70质量%以下。
[0086]
进一步优选在尾丝藻属的培养物中,甘露糖为0~4质量%,阿拉伯糖为0~1.5质量%,半乳糖为0~1.5质量%,木糖为0~2质量%,葡萄糖为0~6质量%,鼠李糖为5~20质量%(更优选为5~15质量%),核糖为0~1质量%,岩藻糖为0~1质量%,糖醛酸为15~30质量%。可以含有其中的任一种或者组合含有多种。
[0087]
尾丝藻属产物中的胞外多糖中,中性糖优选至少含有甘露糖和/或鼠李糖,进一步优选以鼠李糖作为主要成分。
[0088]
尾丝藻属多糖中的中性糖的主要单糖组成比优选为甘露糖(man):鼠李糖(rha):葡萄糖(glc)=1~10:5~20:1~10,更优选为man:rha:glc=0~1:1~3:0~1。另外,尾丝藻属多糖中的中性糖的主要单糖组成比更优选为man:rha=1~1/3:1。
[0089]
另外,尾丝藻属多糖中的主要单糖组成比优选为鼠李糖(rha):糖醛酸(ua)=1~4:1~6,更优选为rha:ua=1~2:1~3。
[0090]
作为上述绿球藻属所产生的多糖的产量,在培养液中优选为50mg/l以上。
[0091]
绿球藻属产物中的胞外多糖(以下也称为绿球藻属多糖)优选含有糖醛酸,其下限值优选为5质量%以上、更优选为10质量%以上,另外,其上限值优选为25质量%以下,更优选为20质量%以下,该数值范围更优选为10~20质量%。更优选该绿球藻属多糖中含有葡萄糖醛酸,其下限值优选为5质量%以上,更优选为10质量%以上,另外,其上限值优选为25质量%以下,更优选为20质量%以下,该数值范围更优选为10~20质量%。
[0092]
绿球藻属产物中的多糖中,中性单糖优选含有60质量%(更优选70质量%)以上,其它成分优选含有30质量%以下。
[0093]
绿球藻属的培养物中,进一步优选甘露糖为10~30质量%(更优选为14~25质量%),阿拉伯糖为10~30质量%(更优选为20~30质量%),半乳糖为10~30质量%(更优选为17~30质量%),木糖为0~5质量%,葡萄糖为0~1质量%,鼠李糖为0~2质量%,核糖为0~1质量%,岩藻糖为0~1质量%,糖醛酸为10~20质量%。可以含有其中的任一种或者多种的组合。
[0094]
绿球藻属产物中的胞外多糖中,中性糖优选含有甘露糖、阿拉伯糖和半乳糖,进一步优选以甘露糖、阿拉伯糖和半乳糖作为主要成分。
[0095]
绿球藻属多糖中的中性糖的主要单糖组成比优选为甘露糖(man):阿拉伯糖(ara):半乳糖(gal)=1~3:1~3:1~3,更优选为man:ara:gal=1~2:1~2:1~2。另外,绿球藻属多糖中的中性糖的主要单糖组成比更优选为man:ara:gal=1:1~2:1~2。
[0096]
另外,绿球藻属多糖中的主要单糖组成比优选为甘露糖(man):阿拉伯糖(ara):半乳糖(gal):糖醛酸(ua)=1~3:1~3:1~3:1~3,更优选为man:ara:gal:ua=1~2:1~2:1
~2:1~2。
[0097]
作为上述双胞藻属所产生的多糖的产量,优选在培养液中为20mg/l以上。
[0098]
双胞藻属产物中的胞外多糖(以下也称为“双胞藻属多糖”)优选含有糖醛酸,其下限值优选为5质量%以上,其上限值优选为20质量%以下,该数值范围更优选为5~15质量%。该双胞藻属多糖中更优选含有葡萄糖醛酸,其下限值优选为5质量%以上,其上限值优选为20质量%以下,更优选为15质量%以下,该数值范围更优选为5~15质量%。
[0099]
双胞藻属产物中的多糖中,作为中性单糖优选含有35质量%(更优选为40质量%)以上,作为其它成分优选含有60质量%以下。
[0100]
双胞藻属的培养物中,进一步优选甘露糖为0~30质量%(优选为9~25质量%),阿拉伯糖为0~8质量%,半乳糖为3~20质量%,木糖为0~3量%,葡萄糖为0~1质量%,鼠李糖为2~20质量%,核糖为0~1质量%,岩藻糖为0~4质量%,糖醛酸为5~15质量%。可以含有其中的任一种或者多种的组合。
[0101]
双胞藻属产物中的胞外多糖中,中性糖中优选以甘露糖、半乳糖和鼠李糖作为主要成分。
[0102]
双胞藻属多糖中的中性糖的主要单糖组成比优选为甘露糖(man):阿拉伯糖(ara):半乳糖(gal):鼠李糖(rha)=1~6:0~1:1~3:1~3,更优选为man:gal:rha=1~6:1~2:1~2。另外,双胞藻属多糖中的中性糖的主要单糖组成比优选为man:gal:rha=1:0~2/5:0~3/10,更优选为实质上由man构成。
[0103]
双胞藻属多糖中的主要单糖组成比优选为甘露糖(man):半乳糖(gal):鼠李糖(rha):糖醛酸(ua)=1~6:0~1:1~3:1~3:1~4,更优选为man:ua=1~2:1~2。
[0104]
作为上述椭圆球藻属所产生的多糖的产量,优选在培养液中为250mg/l以上。
[0105]
椭圆球藻属产物中的胞外多糖(以下也称为“椭圆球藻属多糖”)优选含有糖醛酸。其下限值优选为5质量%以上,更优选为10质量%以上,其上限值优选为30质量%以下,更优选为25质量%以下,该数值范围更优选为10~25质量%。该椭圆球藻属多糖中更优选为含有葡萄糖醛酸,其下限值优选为5质量%以上,更优选为10质量%以上,其上限值优选为25质量%以下,更优选为20质量%以下,该数值范围更优选为5~15质量%,进一步优选为10~15质量%。
[0106]
椭圆球藻属产生多糖中,作为中性单糖优选含有30质量%(更优选为34质量%)以上,作为其它他成分优选含有70质量%以下。
[0107]
椭圆球藻属的培养物中进一步优选甘露糖为3~18质量%,阿拉伯糖为3~12质量%,半乳糖为0~20质量%(更优选为5~15质量%),木糖为0~9质量%,葡萄糖为0~5质量%,鼠李糖为0~5质量%,核糖为0~1质量%,岩藻糖为0~1质量%,糖醛酸为10~30质量%(更优选为15~25质量%)。可以含有其中的任一种或者多种的组合。
[0108]
椭圆球藻属产物中的胞外多糖中,中性糖中优选以甘露糖、阿拉伯糖、半乳糖、葡萄糖和木糖作为主要成分。
[0109]
椭圆球藻属多糖的中性糖的主要单糖组成比优选为甘露糖(man):阿拉伯糖(ara):半乳糖(gal):葡萄糖(glc):木糖(xyl)=1~2:1~2:1~3:0~1:0~1。
[0110]
椭圆球藻属多糖的主要单糖组成比优选为甘露糖(man):阿拉伯糖(ara):半乳糖(gal):木糖(xyl):葡萄糖(glc):糖醛酸(ua)=1~2:0~2:1~3:0~1:0~1:1~4。椭圆球
藻属多糖的主要单糖组成比更优选为man:ara:gal:xyl:ua=1~2:0~1:1~2:0~1:1~3。
[0111]
椭圆球藻属kami藻体的多糖(以下也称为“椭圆球藻属kami多糖”)的中性糖的主要单糖组成比进一步优选为man:ara:gal:xyl:rha=1~2:1~2:1~2:1~2:0~1。
[0112]
另外,椭圆球藻属kami多糖中的糖醛酸更优选为5~30质量%、10~30质量%,葡萄糖醛酸更优选为5~15质量%。
[0113]
另外,椭圆球藻属kami多糖的主要单糖组成比更优选为man:ara:gal:xyl:rha:ua=1~4:1~2:1~2:1~2:0~1:1~5。
[0114]
椭圆球藻属yama藻体的多糖(以下也称为“椭圆球藻属yama多糖”)的中性糖的主要单糖组成比进一步优选为man:gal:glc=1~2:1~2:1。
[0115]
另外,椭圆球藻属yama多糖的多糖中的糖醛酸优选为10~20质量%。
[0116]
另外,椭圆球藻属yama多糖的主要单糖组成比更优选为man:gal:glc:ua=1~2:1~2:0~1:1~3,进一步优选为man:gal:ua=1~2:1~2:1~3。
[0117]
本发明的培养物可以适当采用公知的分离
·
纯化技术,例如液液分液、固液分液、过滤膜、活性炭、吸附树脂、离子交换树脂等方法除去非活性杂质,进一步纯化。
[0118]
可以从本发明的培养物中进一步回收多糖。作为回收多糖的方法,可使用公知的多糖分离方法。获得水溶性多糖时,例如优选将培养物溶解于水溶液后,去除不溶性组分,回收水溶性组分。优选在溶解于水时进行混合。进行处理时的水温优选为5~40℃。溶解后优选在低温(例如1~10℃)放置(例如5~15小时)。不溶性组分的去除优选采用离心分离和超滤膜等物理手段。由此可得到水溶性更高、纯度更高的多糖,因此可利用于各种用途。
[0119]
2.本发明的培养物的用途
[0120]
如下文〔实施例〕所述,本发明的培养物具有pr1基因表达诱导活性作用,因此能够诱导或促进pr蛋白质(病程相关蛋白(pathogenesis-related proteins))等的表达。这里,pr蛋白质是其自身具有抗菌活性的蛋白质以及可生成其它抗菌性物质的蛋白质的总称。一般而言,植物生成的pr蛋白质具有非常广的抗菌谱,因此可认为本发明的培养物对于病原性微生物(例如丝状菌(例如colletotrichum(炭疽菌)属等)、细菌(例如pseudomonas(假单胞菌)属等)、病毒)等也是有效的。
[0121]
本发明的培养物通过人为开启抗逆基因的一种即pr-1a基因来引起植物用抗性诱导。由此,本发明的培养物能够调动出植物本来具有的抗逆性。作为该应激的原因,可举出疾病(炎症、感染等)、环境(冷热、干旱、光、营养成分、盐浓度、药物等)等。作为该抗逆性,更具体而言,例如可举出(1)促进过敏细胞死亡、促进抗菌物质生成、提高细胞壁效果之类的疾病抗性,(2)控制气孔开闭、促进根伸长之类的环境耐久性等。
[0122]
在pr-1a基因启动子表达诱导中,施加水杨酸等的二次刺激时可出现迅速且强烈的诱导活性。该现象起因于诱导pr-1α基因表达的水杨酸(sa)信号转导途径等被二次刺激诱导。而本发明的培养物即使不施加二次刺激也能够表达,因此认为能够预先对防御反应基因进行强表达诱导,提高植物抗性。这样能够提高植物抗性,因此认为本发明的培养物也可用于预防病原体感染或发病之类的疾病或其发病的预防。
[0123]
另外,本发明的培养物具有pr-1a基因表达诱导作用,因此认为通过适当调整用法用量(例如添加时期、添加浓度等),本发明在植物受到感染的情况下也能够建立可迅速响应的准备状态,还可用于疾病或发病后的治疗。
[0124]
因此,本发明的培养物如上所述具有pr1基因表达诱导活性作用,因此能够发挥出植物用抗性诱导作用和植物病害预防作用。
[0125]
而且,本发明的培养物可用作含有该培养物的pr1基因表达诱导活化剂、植物用抗性诱导剂或植物病害预防剂等的有效成分。另外,本发明的培养物出于发挥上述作用的目的能够进行使用。此外,本发明的培养物可用作这些制剂或组合物所使用的成分,还可用于制备这些制剂或组合物。
[0126]
此外,本发明的培养物也可以根据目的并用任意成分,作为该任意成分,优选可增强本发明效果的成分。
[0127]
作为本发明的增强成分,例如可举出来源于海藻的提取物、来源于微生物的提取物等,作为提取物,优选含有多糖。获得这些成分时的培养方法、采集方法、提取方法等没有特别限定,可适当使用公知方法。
[0128]
作为海藻,可举出褐藻类(例如鼠尾藻、昆布、羊栖菜、墨角藻、马尾藻、海蕴、喇叭藻、裙带菜等)、红藻类(例如浅草海苔、天草等)、绿藻类(例如绿藻、青海苔、伞藻、仙掌藻、冈村蕨藻、刺松藻等)。
[0129]
作为微生物,例如可举出蘑菇等菌、细菌、曲霉等霉菌等。
[0130]
可选择使用其中的1种或2种以上。
[0131]
其中,优选来源于海带的提取物,其中昆布多糖具有迟效性的pr1基因表达诱导活性作用,因而优选。如下文实施例所示,昆布多糖具有迟效作用,因此通过与本发明的绿色单细胞藻类培养物并用,能够调整效果的表达时期和持续性等,能够更好地发挥本发明的效果。
[0132]
应予说明,昆布多糖存在于海带等褐藻类中,是由β1-3键和β1-6键的葡萄糖主链构成的直链多糖,通常β1-3键与β1-6键的比为约3:1。另外,昆布多糖也称为海带多糖(laminaran)、β-葡聚糖、β1,3-葡聚糖,该昆布多糖可使用市售品。
[0133]
另外,选自双胞藻属提取物、尾丝藻属提取物、绿球藻属提取物和椭圆球藻属提取物中的1种或2种以上与昆布多糖相比具有速效性,从该观点考虑,优选向其中混合含昆布多糖的褐藻类提取物或昆布多糖。
[0134]
以本发明的培养物为对象的病害种类和病原菌种类没有特别限制。下文实施例中,作为十字花科植物的拟南芥中,成为获得植物抗性的指标的pr-1α基因的表达有所提高。因此,本发明的植物病害预防或改善方法优选以预防或改善病原性丝状菌感染引起的病害为目的来进行。
[0135]
作为上述病原性的丝状菌,例如优选引起青霉病、赤枯病、槽腐病、丝状菌性或锈菌导致的赤衣病、赤霉病、灰霉病、红烧病、腐叶病、黄化病、枯萎病、白粉病、紫霉病、轮纹病、灰斑病、角斑病、丝状菌性导致的褐色腐败病、褐色圆斑病、褐色圆霉病、褐点病、褐斑病、穿孔性褐斑病、褐变病、褐纹病、株腐病等的丝状菌,更优选colletotrichum属的丝状菌,进一步优选colletotrichum higginsianum(以下称为c.higginsianum)。作为细菌,优选引起黑腐病、软腐病、斑点细菌病等的细菌。
[0136]
作为本发明使用对象的植物的种类没有特别限制,可以是陆地植物也可以是水生植物。作为陆地植物,优选被子植物、裸子植物,更优选菊科、兰科、百合科、豆科、禾本科、茜草科、大戟科、莎草科、伞形科、唇形科、葫芦科、茄科和十字花科,进一步优选茄科和十字花
科。其中,优选上述可通过sar模型(例如参照非专利文献1)获得抗性的植物。
[0137]
作为上述百合科(广义)植物,可例示洋葱(葱属)。作为上述豆科植物,可例示大豆。
[0138]
作为上述伞形科植物,可例示胡萝卜。作为上述禾本科植物,例如可举出水稻、玉米、小麦等。
[0139]
作为上述葫芦科植物,例如可举出甜瓜、西瓜、冬瓜、黄瓜、南瓜等。作为上述茄科植物,例如可举出烟草、西红柿、土豆、茄子、青椒等。
[0140]
作为上述十字花科植物,例如可举出荠菜、油菜、甘蓝、羽衣甘蓝、白菜、芜菁、萝卜、山葵、芥菜等。
[0141]
其中,如下文〔实施例〕所示,在作为十字花科植物的拟南芥中,作为病害抗性指标的pr-1α基因的表达提高,因此认为优选使用十字花科植物。
[0142]
本发明中的植物或者针对病害和成为该致病原因的病原菌的该植物的使用方法没有特别限制。
[0143]
本发明对植物使用的部位没有特别限定,例如可用于地上部分(叶或杆等)和地下部分(根、根茎等)。
[0144]
在本发明中,由于培养物中含有多糖,所以从堆肥利用和效果维持的观点考虑,优选用于地下部分。另外,在本发明中,从使用量成本的观点考虑,优选用于地上部分。
[0145]
对于本发明的使用,按通常的农药使用方式进行使用即可,例如可举出散布、注入、涂布或埋设等。另外,上述制剂或组合物可以是用于植物的农药用物质,或者也可以是与农药、堆肥等农业原料配合使用的材料或制剂。
[0146]
作为本发明的使用方法,例如可举出曝露于对象植物的方法等。通过该方法能够对对象植物诱导病害抗性。
[0147]
在本发明中,曝露于对象植物的具体操作和手段没有特别限制。例如可例示如下操作:以可成为有效成分的浓度溶解制备药液,采用喷雾等手段将该药液喷洒于植物体,或者将浸有该药液的纱布与植物体紧密接触,或者用注射器将该药液注射于植物体的茎部,或者使用点滴器具該药液点滴于植物体的根部。
[0148]
应予说明,使用本发明时的制剂或组合物的制备(调配)可采用与现有植物抗性诱导剂等相同的公知方法进行。
[0149]
该制备所使用的溶剂只要是能将本发明的培养物以可成为有效成分的浓度溶解的溶剂就没有特别限制,可使用公知溶剂。优选上述溶剂对植物无害或少害。本发明培养物可悬浮或溶解于水中,并且水容易获得且安全性高,因此更优选使用水。
[0150]
本发明中,作为可成为有效成分的浓度范围没有特别限定。另外,本发明的使用期间没有特别限定。本发明的培养物以多糖这种碳水化物为主体,因此即使大量使用对植物本身、环境、喷洒者和动物的影响也小,另外还能够自然降解作为肥料进行再利用。
[0151]
对于本发明的使用期间,可以长期间持续使用。另外使用后5~8天左右效果达到高峰,因此优选持续使用3天以上,更优选持续使用5天以上。
[0152]
本发明的浓度范围例如可根据下文实施例中说明的植物用抗性诱导方法研究来决定。作为该浓度的下限值,从发挥效果的观点考虑,优选为0.01mg/l以上,更优选为0.1mg/l以上,进一步优选为1mg/l以上。另外,作为该浓度的上限值,从成本的观点考虑,优
选为10g/l以下,更优选为5g/l以下,进一步优选为1g/l以下。作为该浓度范围更优选为0.02mg/l~10g/l,进一步优选为0.2mg/l~5g/l。
[0153]
本发明可采用以下构成。
[0154]
〔1〕以具有绿色光合色素的单细胞藻类的培养物作为有效成分的pr1基因表达诱导活化剂、植物用抗性诱导剂或植物病害预防改善剂。
[0155]
〔2〕用于pr1基因表达诱导活性、植物用抗性诱导或植物病害预防
·
改善的具有绿色光合色素的单细胞藻类的培养物或其使用。
[0156]
〔3〕以具有绿色光合色素的单细胞藻类的培养物作为有效成分的pr1基因表达诱导活性方法、植物用抗性诱导方法或植物病害预防
·
改善方法。
[0157]
〔4〕具有绿色光合色素的单细胞藻类的培养物在制备pr1基因表达诱导活化剂、植物用抗性诱导剂或植物病害预防改善剂中的使用。
[0158]
〔5〕上述〔1〕至〔4〕的任一项中,优选将具有绿色光合色素的单细胞藻类的培养物与海藻类提取物或昆布多糖并用。
[0159]
〔6〕上述〔1〕至〔5〕的任一项中,优选上述培养物中的藻类多糖至少含有糖醛酸。更优选该培养物中的多糖至少含有5~40质量%的糖醛酸。
[0160]
〔7〕上述〔1〕至〔6〕的任一项中,优选上述培养物中的藻类多糖至少含有糖醛酸和中性糖。进一步优选该中性糖为选自甘露糖、半乳糖和鼠李糖中的1种或2种以上。
[0161]
〔8〕上述〔1〕至〔7〕的任一项中,优选上述藻体为trebouxiophyceae(共球藻纲)藻类和/或chlorophyceae(绿藻纲)藻类。
[0162]
〔9〕上述〔1〕至〔8〕的任一项中,优选上述藻类为选自裸藻、尾丝藻属、绿球藻属、双胞藻属、椭圆球藻属和小球藻中的1种或2种以上。更优选为选自双胞藻属、尾丝藻属、绿球藻属和椭圆球藻属中的1种或2种以上。
[0163]
另外,从与昆布多糖相比具有速效性的观点考虑,优选将选自双胞藻属提取物、尾丝藻属提取物、绿球藻属提取物和椭圆球藻属提取物中的1种或2种以上用作速效用途。
[0164]
〔10〕上述〔1〕至〔9〕的任一项中,优选选自以下(a)~(d)中的1种或2种以上。
[0165]
(a)尾丝藻属为chlorophyceae uronema sp.(nbrc 113204)。
[0166]
(b)绿球藻属为chlorophyceae chlorococcum sp.(nbrc 113206)。
[0167]
(c)双胞藻属为trebouxiophyceae geminella sp.(nbrc 113205)。
[0168]
(d)椭圆球藻属为trebouxiophyceae chloroidium saccharophilum yama(nbrc 113207)和/或trebouxiophyceae chloroidium saccharophilum kami(nbrc 113807)。
[0169]
〔11〕上述〔1〕至〔10〕的任一项中,优选上述藻体为选自[1]chlorophyceae uronema sp.(nbrc 113204)藻株、[2]trebouxiophyceae geminella sp.(nbrc 113205)藻株、[3]chlorophyceae chlorococcum sp.(nbrc 113206)藻株、[4]trebouxiophyceae chloroidium saccharophilum yama(nbrc 113207)藻株、[5]trebouxiophyceae chloroidium saccharophilum kami(nbrc 113807)藻株中的1种或2种以上。
[0170]
〔12〕一种植物用抗性诱导成分、pr1基因表达诱导活性成分或植物病害预防改善成分的制备方法,其中,将具有绿色光合色素的单细胞藻类在有氧条件下培养,得到含有胞外多糖的培养物。优选使用自养培养基。
[0171]
〔13〕用于制备植物用抗性诱导成分、pr1基因表达诱导活性成分或植物病害预
防
·
改善成分的具有绿色光合色素的单细胞藻类或其使用。
[0172]
〔14〕上述〔12〕或〔13〕中,优选上述藻体为chlorophyceae(绿藻纲)藻类和/或trebouxiophyceae(共球藻纲)藻类。
[0173]
〔15〕上述〔12〕至〔14〕的任一项中,优选上述藻类为选自裸藻、尾丝藻属、绿球藻属、双胞藻属、椭圆球藻属和小球藻中的1种或2种以上。更优选为选自尾丝藻属、绿球藻属、双胞藻属和椭圆球藻属中的1种或2种以上。
[0174]
〔16〕上述〔12〕至〔15〕的任一项中,优选选自以下(a)~(d)中的1种或2种以上。
[0175]
(a)尾丝藻属为chlorophyceae uronema sp.(nbrc 113204)。
[0176]
(b)绿球藻属为chlorophyceae chlorococcum sp.(nbrc 113206)。
[0177]
(c)双胞藻属为trebouxiophyceae geminella sp.(nbrc 113205)。
[0178]
(d)椭圆球藻属为trebouxiophyceae chloroidium saccharophilum yama(nbrc 113207)和/或trebouxiophyceae chloroidium saccharophilum kami(nbrc 113807)。
[0179]
〔17〕上述〔12〕至〔15〕的任一项中,优选上述藻体为选自(1)chlorophyceae uronema sp.(nbrc 113204)藻株、(2)trebouxiophyceae geminella sp.(nbrc 113205)藻株、(3)chlorophyceae chlorococcum sp.(nbrc 113206)藻株、(4)trebouxiophyceae chloroidium saccharophilum yama(nbrc 113207)藻株、(5)trebouxiophyceae chloroidium saccharophilum kami(nbrc 113807)藻株中的1种或2种以上。
[0180]
〔18〕上述〔12〕至〔17〕的任一项中,优选上述培养的温度为5~40℃。
[0181]
〔19〕上述〔12〕至〔18〕的任一项中,优选上述培养的ph为1.5~10。
[0182]
〔20〕上述〔12〕至〔19〕的任一项中,优选在上述培养后,通过单独进行离心分离或过滤或者将两者组合来去除藻体。
[0183]
〔21〕上述〔12〕至〔20〕的任一项中,优选去除上述藻体后进行冷冻干燥,然后溶解成水溶液后回收水溶性组分。
[0184]
〔22〕上述〔12〕至〔21〕的任一项中,优选采用藻类培养物(优选多糖)的制备方法或者使用藻类而得到的藻类培养物(优选多糖)。
[0185]
实施例
[0186]
以下使用实施例等进一步详细说明本发明,但本发明并不限定于这些实施例。
[0187]
<使用藻株>
[0188]
所使用的各藻株即尾丝藻属藻株、绿球藻属藻株、双胞藻属藻株、椭圆球藻属yama藻株、椭圆球藻属kami藻株从nbrc保藏中心获得(参照表1)。另外,将各藻株的18srrna公开于表2~5(序列号1~4)和表12(序列号5)。
[0189]
1)chlorophyceae uronema sp.(nbrc 113204):(公开日2018年3月29日/网站url:http://www.nbrc.nite.go.jp/nbrc2/nbrccataloguedetailservlet?id=nbrc&cat=00113204、网站打印日2018年3月29日)
[0190]
2)chlorophyceae chlorococcum sp.(nbrc 113206):(公开日2018年3月29日/网站url:http://www.nbrc.nite.go.jp/nbrc2/nbrccataloguedetailservlet?id=nbrc&cat=00113206、网站打印日2018年3月29日)
[0191]
3)trebouxiophyceae geminella sp.(nbrc 113205):(公开日2018年3月29日/网站url:http://www.nbrc.nite.go.jp/nbrc2/nbrccataloguedetailservlet?id=nbrc&
cat=00113205、网站打印日2018年3月29日)
[0192]
4)trebouxiophyceae chloroidium saccharophilum yama(nbrc 113207):(公开日2018年3月29日/网站url:http://www.nbrc.nite.go.jp/nbrc2/nbrccataloguedetailservlet?id=nbrc&cat=00113207、网站打印日2018年3月29日)
[0193]
[表1]
[0194]
表1
[0195][0196]
[表2]
[0197][0198][0199]
[表3]
[0200][0201]
[表4]
[0202][0203][0204]
[表5]
[0205][0206]
<制备例1~4:来源于藻类的培养物(含多糖的培养物)的制备方法和该培养物的分析>
[0207]
<来源于藻类的培养物(含多糖的培养物)的制备方法>
[0208]
<制备例1>
[0209]
将含表1和6所示的“尾丝藻属藻株”的斜面培养基(50ml)添加于表7或8所示的基础培养基100ml(300ml三角烧瓶)中,在自养培养条件下以照度1500~10000lux、23℃、120rpm预培养12天。应予说明,在预培养前可以预先增加藻体数量。
[0210]
进一步将预培养后的培养液1l转移至10l容积的发酵罐中主培养12天,以此作为主培养后的培养液1。此时的培养条件为在照度1500~10000lux、23℃、200rpm、通气0.56vvm的有氧条件,并且在自养培养条件下进行。
[0211]
<制备例2~4>
[0212]
对表1和6所示的“绿球藻属藻株”、“双胞藻属藻株”、“椭圆球藻属藻株”各藻株(参照表1)按照与上述“尾丝藻属藻株”的多糖的制备方法相同的方法分别进行培养,得到主培
养后的培养液2~4。
[0213]
绿球藻属藻株、双胞藻属藻株、小球藻藻株、裸藻藻株使用af6培养基(表7)。尾丝藻属藻株、椭圆球藻属藻株使用bg11培养基(表8)。
[0214]
<制备例1~4的来源于藻类的培养物1~4的回收>
[0215]
将上述来源于尾丝藻属的培养液1离心分离(7000rpm(6500g)、25℃),将含胞外多糖的上清液与藻体分离。
[0216]
接着使用截留分子量5000的uf膜将培养液浓缩至400ml,冷冻干燥后得到来源于尾丝藻属的含多糖的培养物1。
[0217]
另外,与来源于尾丝藻属的培养物1的方法同样地从来源于各藻株(绿球藻属藻株、双胞藻属藻株、椭圆球藻属藻株)的培养液2~4得到表6所示的来源于各藻株的含多糖的培养物2~4。
[0218]
另外,对藻体分离后的上清液采用苯酚硫酸显色法(标准品:葡萄糖)进行测定各藻株的多糖的产量(mg/培养上清1l),将其结果示于表6。
[0219]
[表6]
[0220]
表6
[0221][0222]
[表7]
[0223][0224]
[0225]
[表8]
[0226][0227]
<制备例1~4的来源于各藻株的各培养物的分析>
[0228]
将来源于各藻株的各培养物1~4冷冻干燥得到粉末。各培养物1~4为来源于尾丝藻属的培养物1、来源于绿球藻属的培养物2、来源于双胞藻属的培养物3、来源于椭圆球藻属的培养物4。
[0229]
对各粉末采用酸水解法(例如水解条件为使用72%硫酸水溶液,在室温搅拌1小时后,调整为4%硫酸水溶液,其后用4%硫酸水溶液进行高压灭菌处理(121℃、1小时))hplc分析、各种糖分析等,测定各培养物中的单糖组成(中性单糖:甘露糖、阿拉伯糖、半乳糖、木糖、葡萄糖、鼠李糖、核糖、岩藻糖)。各藻株的培养物所含多糖的中性糖构成如表9所示。
[0230]
1)chlorophyceae uronema sp.(nbrc 113204)藻株:尾丝藻属培养物中测得的中性单糖含有25质量%,该培养物中的中性糖中主要的构成糖为鼠李糖13质量%、葡萄糖5.5质量%。
[0231]
2)chlorophyceae chlorococcum sp.(nbrc 113206)藻株:绿球藻属培养物中测得的中性单糖含有71质量%,该培养物中的中性糖中主要的构成糖为甘露糖20质量%、阿拉伯糖23质量%、半乳糖24质量%。
[0232]
3)trebouxiophyceae geminella sp.(nbrc 113205)藻株:双胞藻属培养物(第1次)中测得的中性单糖含有41质量%,该培养物中的中性糖中主要的构成糖为阿拉伯糖7质量%、半乳糖13质量%、鼠李糖15质量%。
[0233]
双胞藻属培养物(第2次)中测得的中性单糖含有25质量%,该培养物中的中性糖中,主要构成糖为甘露糖10质量%、半乳糖4质量%、鼠李糖3质量%、岩藻糖3质量%。
[0234]
4)trebouxiophyceae chloroidium saccharophilum(nbrc 113207)藻株:椭圆球藻属培养物中测得的中性单糖含有34质量%,该培养物中的中性糖中主要的构成糖为甘露糖8质量%、阿拉伯糖7质量%、半乳糖11质量%。
[0235]
[表9]
[0236][0237]
<实施例1~2:pr-1a基因启动子表达诱导试验>
[0238]
将有在pr-1a基因启动子下游连接萤火虫荧光素酶基因的质粒构建物(pr-1a::fluc
+
)导入的拟南芥种子与100μl灭菌水一起接种于96孔板,进行5天春化处理后添加终浓度0.1mm的萤光素,置于生物气候室(明条件12小时、暗条件12小时、相对湿度100%)。
[0239]
应予说明,本实施例可参照专利文献1和2、非专利文献1进行。另外,按照非专利文献1所示的内容,可得到具有在来源于烟草的病程相关基因(pathogenesis-related gene)1a(pr-1a)基因启动子的下游连接萤火虫荧光素酶基因(firefly luciferase;f-luc)而成的融合基因(pr-1a::f-luc)的质粒。将该质粒介由农杆菌(agrobacterium tumefaciens lba4404)导入拟南芥,可得到具有pr-1a::f-luc的转基因拟南芥种子(pr-1a::f-luc)。
[0240]
作为pr-1a基因启动子表达诱导试验的样品,使用上述从各藻体获得的培养物1~4。各培养物1~4为上述来源于尾丝藻属的培养物1、来源于绿球藻属的培养物2、来源于双胞藻属的培养物3、来源于椭圆球藻属的培养物4。
[0241]
出芽后用灭菌水调整后的各培养物1~4的样品按1/10量添加于各孔,作为最终浓度。各板的最终浓度为板1(实施例1):0.02wt%(200μg/ml)、板2(实施例2):0.002wt%(20μg/ml)。应予说明,样品是将培养物粉末用灭菌水调整为1%(10mg/ml)溶液并在-20℃保存。
[0242]
对各样品的各处理区域重复进行12次,pr-1a启动子表达诱导以fluc发光活性作为指标进行评价。将处理产生的植物体的发光量作为基因表达诱导活性,经时监测其强度。
[0243]
使用光子计数装置gaasp image intensifier unit c8600(滨松光子株式会社)和分析软件wasabi测定各孔内的发光强度,测定报告基因f-luc的表达量,从而对各样品的pr-1a基因表达诱导活性进行评价。
[0244]
经时监测的分析时间点设定为0.24、48、72、96、120、144、168、192、216小时。将以0小时的发光量设为1的相对值作为相对发光量,将120小时的结果示于表10和11。
[0245]
如表10和11所示,显示出各藻类的藻体外产生的含多糖的培养物具有显著的pr-1a基因表达诱导活性。该含多糖的培养物是来源于尾丝藻属、绿球藻属、双胞藻属、椭圆球藻属的产物。另外,它们也是chlorophyceae(绿藻纲)藻类和/或trebouxiophyceae(共球藻
纲)藻类。
[0246]
因此,认为作为具有绿色光合色素的单细胞藻类在藻体外产生的多糖是活化pr-1a基因表达诱导的主要原因。这些培养物中,均以甘露糖、鼠李糖和/或半乳糖中的任意1种或2种以上作为中性糖的单糖组成,因此认为它们参与发挥某些效果。
[0247]
另外,来源于尾丝藻属的多糖在中性糖中以鼠李糖、葡萄糖作为主要单糖组成。认为含有该主要单糖组成的多糖参与活化pr-1a基因表达诱导。
[0248]
另外,来源于绿球藻属的多糖,在中性糖中以半乳糖、阿拉伯糖、甘露糖作为主要单糖组成。认为含有该主要单糖组成的多糖参与活化pr-1a基因表达诱导。
[0249]
来源于双胞藻属的多糖,在中性糖中以甘露糖、鼠李糖、半乳糖作为主要单糖组成。认为含有该主要单糖组成的多糖参与活化pr-1a基因表达诱导。
[0250]
来源于椭圆球藻属的多糖,在中性糖中以半乳糖、甘露糖、阿拉伯糖、木糖作为主要单糖组成。认为含有该主要单糖组成的多糖参与活化pr-1a基因表达诱导。
[0251]
[表10]
[0252][0253]
[表11]
saccharophilum kami(nbrc 113807)藻株(参照表1),其18srrna公开于表12(序列号5),用作绿球藻属kami藻株。
[0261]
实施例3中使用,于2005年5月在现在的日本国宫城县大崎市鸣子的泻沼(katanuma)采集的裸藻藻株。
[0262]
实施例3中作为阳性对照使用昆布多糖(sigma公司制)。
[0263]
实施例4中使用chlorophyceae chlorococcum sp.(nbrc 113206)藻株作为绿球藻属藻株。
[0264]
实施例4中使用chlorella vulgaris chikugo株(chikugo株:chlorella industry co.,ltd.)作为小球藻藻株。
[0265]
5)trebouxiophyceae chloroidium saccharophilum kami(nbrc 113807):(公开日2019年2月25日/网站url:http://www.nbrc.nite.go.jp/nbrc2/nbrccataloguedetailservlet?id=nbrc&cat=00113807、网站打印日2019年2月25日)
[0266]
采集地(藻株由来)北海道斜里郡清里町神的子池)kaminoko pond,shari-gun,kiyosato-cho,hokkaido)采集日:2012/5/7。
[0267]
[表12]
[0268][0269]
<实施例3~4中使用的样品>
[0270]
与上述<制备例1~4:来源于藻类的培养物(含多糖的培养物)的制备方法和该培养物的分析><来源于藻类的培养物(含多糖的培养物)的制备方法>同样地,从<实施例3~4
中使用的藻株>记载的各藻株获得各培养物,用作各样品。
[0271]
具体而言,绿球藻属藻株、双胞藻属藻株、椭圆球藻属yama藻株、小球藻藻株使用af6培养基(表7),尾丝藻属藻株、椭圆球藻属kami藻株使用bg11培养基(表8)、裸藻藻株使用ko2培养基,参考上述制备例1~4进行适合于各藻株的培养,分别得到含多糖的培养物。
[0272]
由此,作为实施例3的样品,得到来源于尾丝藻属的培养物5、来源于绿球藻属的培养物6、来源于双胞藻属的培养物7、来源于椭圆球藻属kami的培养物8、来源于裸藻的培养物9。另外,作为实施例4的样品,得到来源于椭圆球藻属yama的培养物10、来源于小球藻的培养物11。
[0273]
此时,椭圆球藻属kami藻株中的多糖的产量(mg/培养上清1l)通过对藻体分离后的上清液采用苯酚硫酸显色法(标准品:葡萄糖)进行测定,结果为300mg/l。
[0274]
〔ko2培养基组成〕
[0275]
硝酸钠85mg:硫酸铵66mg:磷酸二氢钾27mg:七水磷酸镁25mg:二水氯化钙11mg:七水硫酸铁2mg:edta-2na 3mg:n1金属盐溶液
※
10.1ml:蒸馏水99ml:ph2:制备量100ml。
[0276]
※
1[n1金属盐溶液组成]
[0277]
硼酸2.86g:四水氯化锰1.81g:七水硫酸锌0.22g:五水硫酸铜0.08g:三氧化钼15mg:蒸馏水1000ml:制备量1000ml。
[0278]
<实施例3~4:pr-1a基因启动子表达诱导试验>
[0279]
实施例3~4的pr-1a基因启动子表达诱导试验与<实施例1~2:pr-1a基因启动子表达诱导试验>相同,确认各样品的表达诱导。此时使用的浓度为0.02mg/ml。
[0280]
经时监测的分析时间点设定为0.24、48、72、96、120、144、168、192、216、240、264小时。将以0小时的发光量设为1的相对值作为相对发光量。
[0281]
将pr-1a基因启动子表达诱导试验中的实施例3的各样品的结果示于表13和图1,将实施例4的各样品的结果示于表14。
[0282]
如表13和14所示,显示出各藻类在藻体外产生的含多糖的培养物具有显著的pr-1a基因表达诱导活性。该含多糖的培养物是来源于尾丝藻属、绿球藻属、双胞藻属、椭圆球藻属(优选kami)、裸藻、小球藻的产物。说明这些产物具有使pr-1a基因启动子表达诱导活化的作用。
[0283]
其中,来源于尾丝藻属(1.35倍)、绿球藻属(1.11倍)、双胞藻属(1.37倍)、椭圆球藻属kami(1.12倍)、裸藻(1.10倍)的产物的最大峰(活性)值比昆布多糖高。另外,这些产物的最大峰值比昆布多糖的最大峰值更向前移,时间差为昆布多糖的最大峰值时间的0.67~0.78,可以说与昆布多糖相比为速效型。这些来源于藻类的培养物中的活性物质还在研究中,但通常由于多糖为高分子,因此多为迟效型。但是,这些来源于藻类的培养物虽然与昆布多糖同为高分子多糖,但却是速效型,可以说是突出的优势。另外,通过将各产物和昆布多糖两者并用,能够容易地调整作用时间。
[0284]
[表13]
[0285][0286]
[表14]
[0287]
表14:pr1基因表达诱导活性[相对发光量]
[0288][0289]
[相对发光量:下划线为峰值]
[0290]
<实施例3~4的来源于各藻株的各培养物的分析>
[0291]
对实施例3~4的来源于各藻株的各培养物进行分析。具体而言,作为实施例3的样品,使用来源于尾丝藻属的培养物5、来源于绿球藻属的培养物6、来源于双胞藻属的培养物7、来源于椭圆球藻属kami的培养物8,另外,作为实施例4的样品,使用来源于椭圆球藻属yama的培养物10。
[0292]
对如下所示的这些来源于藻株的各培养物,使用abee标记法分析各培养物中单糖组成(yasuno,s.,et al.,biosci.biotechnol.biochem.,61,1944(1997)、yasuno,s.,et al.,biosci.biotechnol.biochem.,63,1353(1999))。
[0293]
man:甘露糖、ara:阿拉伯糖、gal:半乳糖、xyl:木糖、glc:葡萄糖、rha:鼠李糖、rib:核糖、fuc:岩藻糖、nac-glcn:n乙酰葡糖胺、nac-galn:n乙酰半乳糖胺、nac-mann:n乙酰甘露糖胺、galua:半乳糖醛酸、glcua:葡萄糖醛酸。
[0294]
1)hplc装置
[0295]
acquity uplc h class系统(制造商waters)acquity uplc beh c18 column,1.7μm,2.1x 100mm(制造商:j-oil mills)、柱温度:50℃、流动相:a/b=0.2m硼酸钾(ph 8.9)/acn、流速:0.7ml/min、检测:荧光(ex.305nm,em.360nm)。
[0296]
向样品中添加milliq水(mqw)制备10mg/ml溶液,将该溶液10μl作为水解样品。具体而言,将各样品按10μl分装于各管中,向分装好的各管添加tfa(三氟乙酸),搅拌、离心后,在100℃加热3小时。空气冷却后进行离心处理,用speedvac进行浓缩干燥。加入2-丙醇,搅拌后用speedvac进行浓缩干燥,向浓缩样品中加入吡啶/甲醇和醋酐,在室温反应30分钟。利用speedvac使溶液浓缩干燥,接着进行abee标记。加入abee标记试剂(abee、氰基硼氢化钠、醋酸、甲醇),在80℃反应1小时。使用mqw 200μl、氯仿200μl进行后处理,回收水层,注入到hplc中。根据峰面积制作各单糖的校正曲线,定量样品中含有的单糖。
[0297]
接着,使用咔唑硫酸显色法(galua换算),调整为干燥培养物100μg/ml,进行各培养物中的糖醛酸的分析。将各样品中的糖醛酸含量(galua换算)结果示于表16。
[0298]
[表15]
[0299][0300]
[表16]
[0301]
表16样品中各藻类中的糖醛酸含量(质量%)
[0302][0303]
测定方法:咔唑硫酸显色法(abs530nm):std.galua
[0304]
表15中示出abee标记法的糖分析结果,表16中示出糖醛酸的结果。
[0305]
双胞藻属、尾丝藻属、绿球藻属和椭圆球藻属各藻株的培养物中含有的各多糖中的单糖构成如表15所示。
[0306]
来源于尾丝藻属的多糖以鼠李糖、甘露糖、葡萄糖醛酸作为主要单糖组成。
[0307]
来源于绿球藻属的多糖以甘露糖、阿拉伯糖、半乳糖、葡萄糖醛酸作为主要单糖组成。
[0308]
来源于双胞藻属的多糖以甘露糖、葡萄糖醛酸作为主要单糖组成。
[0309]
来源于椭圆球藻属kami的多糖以甘露糖、阿拉伯糖、半乳糖、木糖、鼠李糖和葡萄糖醛酸作为主要单糖组成。
[0310]
来源于椭圆球藻属yama的多糖以甘露糖、半乳糖、和葡萄糖作为主要单糖组成。
[0311]
双胞藻属、尾丝藻属、绿球藻属和椭圆球藻属各藻株的培养物中含有的各多糖中含有糖醛酸,该糖醛酸(galua换算)的含有率如表16所示。由此,具有绿色光合色素的单细胞藻类在藻体外产生的多糖中含有糖醛酸,从而认为具有与不含糖醛酸的昆布多糖不同的pr-1a基因表达诱导作用(例如效果速度等)。
[0312]
如上所述,上述各多糖具有上述糖醛酸和中性单糖作为单糖组成,从而认为参与活化pr-1a基因表达诱导。
[0313]
本发明的培养物为具有绿色光合色素的单细胞藻类的培养物,因此认为不显示直接的杀虫
·
杀菌性。而且,由于本发明的培养物不显示直接的杀虫
·
杀菌性,因此耐性菌出现率低,少量施用即可,效果持久,对防除目标以外的生物的影响少。
[0314]
另外,本发明的培养物富含多糖碳源,并且在该培养物中可含有各种成分,因此也可期待植物的施肥效果。
[0315]
本发明的培养物是通过液体培养获得的,因此水溶性高,可简便地与农场等的灌溉水混合使用。另外,本发明的培养物即使含有不溶性成分,在进行喷洒等施用后也会逐渐降解,因此可期待发挥长期效果,且环境负担低。另外,还具有施用时几乎不会像化学农药那样发生体内暴露的优点。
[0316]
另外,本发明的培养物能够在必要时于必要场所使用于必要作物,通用性高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1