多氏囊霉属菌株、包含它的组合物及用途的制作方法
发明领域
本发明涉及农学领域。具体而言,其涉及多氏囊霉属(dominikiasp.)菌株、包含它的组合物以及所述组合物的用途,例如作为生物刺激剂和生物杀线虫剂的用途。已发现包含多氏囊霉属菌株的组合物在谷物作物中尤其有用。
背景技术:
目前,在球囊菌门(glomeromycota)中描述了30个属的约300个物种。然而,基于核酸(dna、rna)的生物多样性研究指出,球囊菌门具有远远更高的多样性,且目前已描述了多个新的物种和属。
大多数球囊菌门是丛枝菌根真菌(arbuscularmycorrhizalfungi,amf),其是约80%的全部维管陆地植物的互惠共生体(mutualisticsymbiont)。amf寄生的植物的营养摄取直接通过根表皮和根毛发生,但也通过具有丛枝或根内菌丝团(intraradicalhyphalcoil)的特征形式的真菌-根-界面发生。除了在其宿主体内增加营养摄取的作用外,amf在土壤团聚(soilaggregation)和保护植物免受干旱胁迫和抵抗土生植物病原体的方面也起着重要作用。由于这种高度有益的特性,多种菌根组合物是本领域中已知的,且已经开发它们以对提供给的作物提供有益作用。
wo2015/000612和wo2015/000613公开了包含glomusiranicumvar.tenuihypharumvar.nov.菌株的组合物及其用途。
具体而言,wo2015/000612公开了包含glomusiranicumvar.tenuihypharumvar.nov.菌株和2:1的蒙脱石泥土的组合物。公开了wo2015/000612的组合物对莴苣作物的作物产量提供积极作用(即可用作生物刺激剂)。
类似地,wo2015/000613公开了包含glomusiranicumvar.tenuihypharumvar.nov.菌株和2:1的蒙脱石泥土、金属离子和几丁质的组合物。wo2015/000613公开了所述组合物在番茄作物中作用为生物杀线虫剂。
然而,就生物刺激剂和生物杀线虫剂的作用而言,现有技术中公开的组合物均未对谷物作物提供可接受的积极影响。
发明概述
因此,本发明的一个目的是提供适合包含在组合物,即适合于对作物、尤其是对谷物作物产生积极影响的组合物中的真菌菌株。
本发明的另一个目的是提供有效作为谷物作物的生物刺激剂的组合物。
本发明的另一个目的是提供有效作为谷物作物的生物杀线虫剂的组合物。
本发明的另一个目的是提供一种获得所述组合物的方法。
发明详述
因此,本发明的一个目的是球囊菌门的菌株,即保藏号为mucl57072的多氏囊霉属菌株。
本发明的菌株是从西班牙穆尔西亚福尔图纳(fortuna,murcia(spain))当地的、表面有大量盐矿床(saltdeposit)的、非常水成的(hydromorphic)、高度紧实的钠盐土壤类型(潜育碱土(solonetzgley))中分离出来的。
本发明的多氏囊霉属菌株于2018年3月21日保藏在国际保藏机构比利时微生物协调保存中心(belgiancoordinatedcollectionsofmicro-organisms,bccm),鲁汶天主教大学(universitécatholiquedelouvain),mycothequèquedel’universitécatholiquedelouvain(mucl),croixdusud2,boxl7.05.06,1348louvain-la-neuve,比利时,保藏人西姆博格有限公司(symborgs.l.),地址campusdeespinardo,7,edificioceeim,30100murcia,西班牙。
本发明的菌株多氏囊霉属已由保藏人用参考号smb01标识,并收到来自所述国际保藏机构的保藏号mucl57072。
本发明的菌株的孢子果(sporocarp)是未知的。在本发明的菌株中,孢子存在于土壤中的松散簇(loosecluster)中,并且可以是端生的(terminal)或菌丝内的(intercalary);孢子也可以在根内形成。孢子是透明至淡赭色的,具有近球形至球形结构(很少不规则),相对较小,即直径为24.0至42μm,直径平均值为30.7±3.7μm。孢子呈现出复合的三层孢子壁(厚度为1至4μm)。特别地,外层、中间层和内层是可以识别的。
孢子壁的外层基本上是粘液状的和易消散的,因此新生孢子具有粗糙的外观,而大龄孢子则表现出有些蓬松的外观。孢子壁的外层在用梅尔泽试剂(melzer'sreagent)染色时表现糊精反应,使新生孢子呈棕红色。孢子壁的中间层基本上是永久的,且厚度为0.5至2.0μm。
孢子壁的内层基本上是层状的,厚度为0.5至1.5μm。孢子的内容物具有发白和滴状斑点(guttulate)的外观。抱有孢子的菌丝颜色为透明至淡赭色,并且呈直径2.5至4.5μm(平均值为3.0μm)的直条或波浪形。菌丝呈圆柱状至略呈漏斗状,其至少在成熟孢子中与孢子壁的开孔层(open-poredlayer)融合。萌发结构包含生长的芽管,且其通过菌丝与孢子的结合而向后发育。它形成泡囊丛枝菌根(vesiculararbuscularmycorrhizae)。
根外菌丝体(extraradicalmycelium)形成广泛的网络。
申请人生成了13418srdna序列(包括环境序列和参考序列)的种系发生分析。在大多数多氏囊霉物种中没有18s序列或仅有相对较短的部分18s序列。可以在这个种系发生分析中包括印度多氏囊霉(dominikiaindica)和伊朗多氏囊霉(d.iranica)序列。这两个物种的序列比数据集中其余的那些的序列短。将数据集修剪到这些序列的长度会导致解析不完全的树。通过使用全长序列,可以生成具有代表较高分类学水平的分支的树。然而,用这个数据集无法生成由来自多个多氏囊霉属(dominikiaspp.)的序列组成的可靠的单系分支。多氏囊霉属与伊朗多氏囊霉(dominikiairanica)以及来自不同宿主植物和不同地域的无名的环境球囊霉目序列(glomeraleansequence)一起形成一个具有充分支持的分支。
对包括来自大多数所述多氏囊霉物种的序列的ssu-its1数据集的种系发生分析指示了多氏囊霉属分支紧挨着d.aurea。
通常聚集在松散簇或紧密簇中的小孢子(直径不超过65至70μm)是多氏囊霉属的特征。多氏囊霉属成员的孢子壁由两层或三层组成。形成孢子表面的外层是粘液状的、寿命短的并在梅尔泽试剂中染色,或者是整个的(不分为子层)、永久的并在梅尔泽试剂中不反应。抱有孢子的菌丝呈圆柱至漏斗状,带有开放的或被隔膜封闭的孔。将极小多氏囊霉(dominikiaminuta)(基础名(basidionym):微小球囊霉(glomusminutum))指定为模式物种(type-species)。本发明的菌株,即多氏囊霉属,具有与极小多氏囊霉的孢子大小相同的透明孢子,但是,与多氏囊霉属相反,微小球囊霉(即极小多氏囊霉)的孢子被隔膜封闭。多氏囊霉属(d.sp.)与极小多氏囊霉的不同之处还在于相比于极小多氏囊霉具有两层孢子壁,多氏囊霉属具有三层孢子壁,且由于多氏囊霉属中存在糊精反应而极小多氏囊霉中不存在。
多氏囊霉属也不同于其他的所述多氏囊霉物种和菌株。dominikiaachra的孢子的外层和内层在梅尔泽试剂中染色为深红色,而在多氏囊霉属中仅外层显示糊精反应。印度多氏囊霉与多氏囊霉属的不同之处在于前者在地下聚集体(hypogeousaggregate)中形成小的透明孢子。与多氏囊霉属中的三层相反,印度多氏囊霉的孢子壁由两个透明的层组成:粘液状的、寿命短的并在梅尔泽试剂中染色为桃红至粉红色的薄的外层,以及层状的、光滑的、永久的较厚的内层。
基于18s-its1的种系发生,dominikiaaurea与本发明的多氏囊霉属亲缘关系最近。这两个物种在许多形态特征上有所不同(见表1),最明显的不同是dominikiaaurea的在不规则的孢子果中聚集的主要呈卵形的孢子。
当对基因库进行blast时,可以发现许多与本发明的多氏囊霉属的序列高度相似的序列(e-值为0.00,同一性为99%)。这些序列存在于来自不同国家和大陆的各种各样的不同宿主(例如苔类、单子叶植物)中,表明其分布遍及世界。这些发现表明了多氏囊霉属分布广泛。
如上所述,已发现多氏囊霉属尤其可用于包含在组合物,尤其是提供给谷物作物的组合物中。
本发明的另一个目的是包含以保藏号mucl57072保藏于2018年3月21日的多氏囊霉属的组合物,如上所述。
不受特定解释的束缚,令人惊讶地观察到,多氏囊霉属和包含其的组合物在对作物,尤其是谷物作物提供有益作用上特别有效。
特别地,已经观察到,通过向作物例如谷物作物(例如玉米作物、小麦作物、大麦作物或水稻作物)提供包含多氏囊霉属的组合物,可获得与未向其提供多氏囊霉属的作物相比增加的营养摄取和谷物作物产量的提高。
优选地,组合物中多氏囊霉属的浓度为按重量计的4.0%至1.0%,更优选为按重量计的3.0%至2.0%,甚至更优选为按重量计的2.5%至2.3%。
根据实施方案,本发明的组合物是液体、固体或凝胶组合物。
优选地,本发明的组合物是固体组合物。
根据实施方案,本发明的组合物可以是粉末、乳化原液、颗粒或微粒形式。
本发明的组合物是固体组合物,并且根据“最大概率数法(mostprobablenumbermethod)”(porter,aust.j.soilres.,1979,17,515-19)测量的组合物中的多氏囊霉属的繁殖体(propagule)的浓度为每克组合物180至120个繁殖体,优选每克组合物150至120个繁殖体,更优选每克组合物125至120个繁殖体。
繁殖体的浓度是指最终产品中繁殖体的浓度。
根据一个优选的实施方案,本发明的组合物是微粒形式。
根据一些实施方案,所述微粒的尺寸范围为500μm至2000μm,优选800μm至1500μm,更优选900μm至1200μm。
有利地,可以根据预定的最终应用来选择本发明的组合物中的多氏囊霉属浓度,以及组合物的呈现形式,例如微粒。
根据一些实施方案,本发明的组合物进一步包含至少一种杀真菌剂和/或至少一种生物杀真菌剂和/或至少一种杀虫剂和/或至少一种生物杀虫剂和/或至少一种杀线虫剂和/或至少一种生物刺激剂。
根据一个优选的实施方案,本发明的组合物是用于种子包衣的形式。
例如,所述杀真菌剂选自由以下组成的组:代森锰(maneb)、代森锰锌(mancozeb)、甲霜灵-瑞毒霉(metalaxyl-ridomil)、腈菌唑(myclobutanil)、olpisan、霜霉威(propamocarb)、五氯硝基苯(quintozene)、链霉素(streptomycin)、硫磺(sulfur)、甲基硫菌灵(thiophanate-methyl)、福美双(thiram)、嗪氨灵(triforine)、免克宁(vinclozolin)、锌白(zincwhite)、代森锌(zineb)、福美锌(ziram)、氯唑灵(banrot)、混铜灵(fixedcopper)、百菌清(chlorothalonil)、克菌丹(captan)、地茂散(chloroneb)、环唑醇(cyproconazole)、zincethelene、双二硫代氨基甲酸酯(bisdithiocarbamate)、土菌灵(etridiazole)、地克松(fenaminosulf)、芬瑞莫(fenarimol)、福多宁(flutolanil)、福尔培(folpet)、乙磷铝(fosetyl-al)和异菌脲(iprodione)。
示例性的生物杀真菌剂是:木霉菌属(trichodermassp)、枯草芽孢杆菌(bacillussubtilis)、地衣芽孢杆菌(bacilluslicheniformis)、短小芽孢杆菌(bacilluspumilus)、解淀粉芽孢杆菌(bacillusamyloliquefaciens)、链霉菌属(streptomycessp)、盾壳霉(coniothyriumminitans)和寡雄腐霉菌(pythiumoligandrum)。
根据一些实施方案,杀虫剂选自由以下组成的组:有机磷酸酯、氨基甲酸酯和新烟碱类。
根据一些实施方案,所述生物杀虫剂选自由以下组成的组:芽孢杆菌属(bacillussp.)、色杆菌属(chromobacteriumsp.)、白僵菌属(beauveriasp.)和绿僵菌属(metarhiziumsp.)。
根据一些实施方案,所述杀线虫剂是有机磷酸酯或氨基甲酸酯。
根据一些实施方案,所述生物杀线虫剂是巴斯德氏菌(pasteuriasp.)。
本发明的另一个目的是一种生产包含本发明的多氏囊霉属菌株的组合物的方法。
本发明的方法包括以下步骤:
a.提供基质;
b.向所述基质提供宿主植物种子和保藏号为mucl57072的多氏囊霉属菌株;
c.培养所述宿主植物并浇水以将所述基质的水分含量保持在至少75%的土壤容水量(fieldcapacity);
d.中断所述浇水至少7天的时间;
e.移除所述宿主植物的地上部分和基质;
f.使移除的基质干燥;
g.研磨干燥的基质以获得粒径小于100μm的颗粒。
优选地,基质包含泥土。
根据一些实施方案,步骤b.中提供的多氏囊霉属是包含多氏囊霉属繁殖体的种菌(inoculum)。优选地,通过向宿主植物的根系提供基本上纯的多氏囊霉属,在优选包含泥土(优选无菌蒙脱石粘土)的基质上将所述宿主植物优选培养宿主植物的一个生命周期,并随后拔出根系,以获得种菌,来获得所述种菌。在这种情况下,种菌包含一定量的基质、小根和多氏囊霉属繁殖体。
根据一个优选的实施方案,本发明的方法进一步包括微粒化的步骤h1.。
优选地,通过微粒化可以获得微粒形式的包含本发明的多氏囊霉属菌株的组合物。
如上所述,所述微粒的尺寸范围为500μm至2000μm,优选800μm至1500μm,更优选900μm至1200μm。
根据一个优选的实施方案,本发明的方法进一步包括步骤h2.:制备用于谷物种子包衣的浓缩生物接种剂(inoculant),即用于对根据步骤g.获得的研磨产品的谷物进行种子包衣的浓缩生物接种剂。必须指出,在这种情况下,用于谷物的种子包衣的浓缩生物接种剂的步骤h2.意指其中组合物中的多氏囊霉属(例如多氏囊霉属繁殖体)浓度增加的步骤。
例如,所述浓缩的步骤h2.可以通过筛分根据步骤g.获得的研磨产物以选择粒径大于预定值,例如大于35μm的颗粒来完成。
有利地,浓缩步骤h2.可以将多氏囊霉属(例如多氏囊霉属繁殖体)的浓度增加至初始浓度的最高10倍,优选初始浓度(即,步骤h2.之前的产品中多氏囊霉属的浓度)的最高50倍,更优选初始浓度的最高100倍,即相对于步骤h2.之前的组合物浓度的100倍。
根据一些实施方案,将多氏囊霉属(例如多氏囊霉属繁殖体)的浓度增加至初始浓度(即,步骤h2.之前的产品中多氏囊霉属的浓度)的100倍以上是可能的。
根据一个优选的实施方案,本发明的方法进一步包括种子包衣的步骤i.,即根据步骤h2.获得的浓缩产物的种子包衣。
所述步骤i.的种子包衣包括以下步骤:
i1.用粘合物质(adhesivesubstance)覆盖种子;
i2.添加浓缩生物接种剂;
i3.任选提供一种或多种选自以下的相容处理:
i3.1用与形成菌根的真菌(mycorrhizalformingfungi)相容的杀真菌剂、杀虫剂和/或除草剂进行处理,
i3.2用有益微生物进行处理,
i3.3用大量营养元素(macronutrient)和/或微量营养元素(micronutrient)进行处理,
i3.4用刺激剂进行处理,
i3.5用与菌根真菌相容的着色颜料进行处理;
i4.使种子干燥。
本发明的另一个目的是包含保藏号为mucl57072的多氏囊霉属的组合物作为生物刺激剂的用途。
如本文所用,术语“生物刺激”是指由根据本发明的组合物在与所述组合物一起提供的植物中施加的刺激。
不受特定科学解释的束缚,可以假设本发明的多氏囊霉属菌株发挥转运营养的功能,通过从土壤或基质中吸收这些营养,并在其代谢系统中使用所述营养,它将所述营养从其菌丝体网络中转运出来,并随后在根细胞中交换它们。
根据一个优选的实施方案,本发明的组合物用作对谷物的生物刺激剂。
本发明的另一个目的是包含保藏号为mucl57072的多氏囊霉属的组合物作为生物杀线虫剂的用途。
换句话说,本发明的组合物可用于保护植物免受线虫侵害。
根据一个优选的实施方案,本发明的组合物用作对谷物的生物杀线虫剂。
有利地,可以通过多种方式将本发明的组合物提供给植物,即作物,例如谷物作物。
根据一些实施方案,可以通过以下方式将本发明的组合物应用到植物:种子处理(即种子包衣)、根处理、将根插在乳剂中、添加到灌溉用水中、灌溉、将粉末施用给根系或将乳液注射到根系中。
优选地,通过以下方式提供本发明的组合物,尤其是当必须将其提供给谷物时:种子包衣或在播种时与种子一起提供,或以微粒形式并在播种时与种子一起提供。
附图简要说明
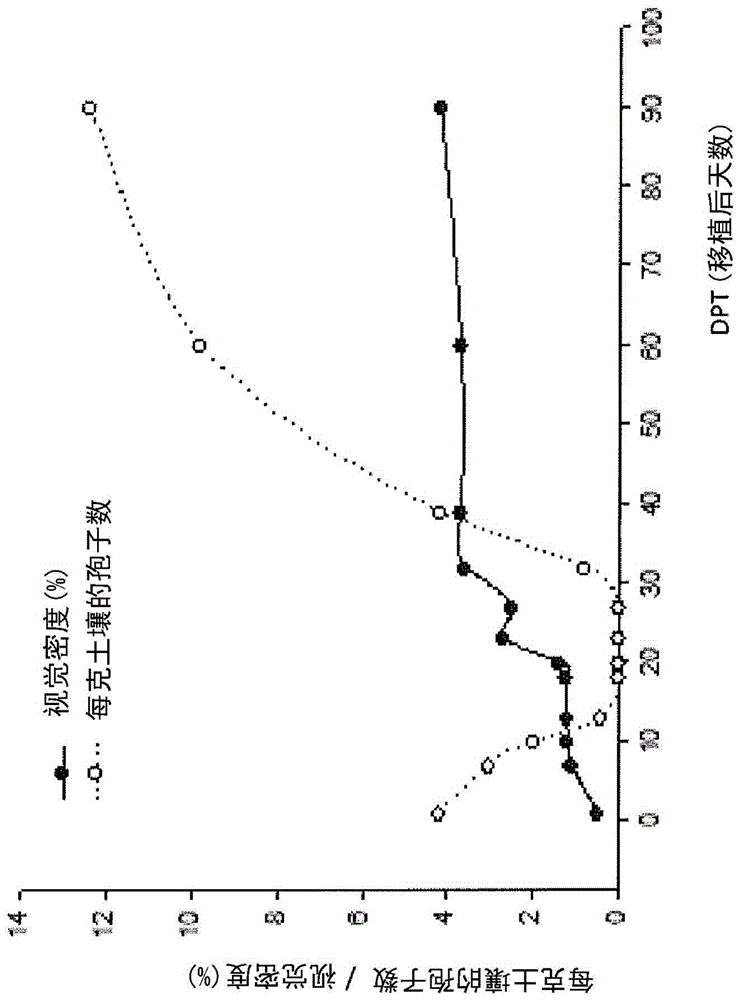
图1:在经多氏囊霉属处理的植物中的孢子产生和真菌占据(fungaloccupation)的动态,以视觉密度(%)表示。
图2:在多氏囊霉属处理下的丛枝外部菌丝体(arbuscularexternalmycelium)和丛枝内生菌(arbuscularendophyte)的行为。
图3:在多氏囊霉属处理下的外部丛枝菌丝体和丛枝内生菌之间的关系。
实施例部分
实施例1:分子分析
dna提取
将分离的菌丝和孢子转移到装有0.2g玻璃珠子(直径为2mm)和100μlctab缓冲液(2%ctab=十六烷基三甲基溴化铵(cetyltrimethylammoniumbromide),1.4mnacl,0.1mtris-hclph7.5,0.2mna-edta)的1.5mleppendorf管中。使用retschmm301球磨机将这个混合物在50hz下均质化30秒。添加另外的400μlctab缓冲液,并将混合物在65℃下温育1小时。将400μl氯仿-异戊醇(24:1)添加到悬浮液中,并通过颠倒反应管进行混合,然后以15000xg离心5分钟,并将上层回收到干净的eppendorf管中。将这个步骤重复两次。添加200μl5m醋酸铵到这个悬浮液中;将这个混合物在4℃下温育至少30分钟,然后在4℃和15000xg下离心20分钟。在-20℃下用700μl异丙醇使dna沉淀过夜。将异丙醇沉淀后获得的dna沉淀物用冰冷的70%乙醇洗涤,风干并重新溶解在50μlte缓冲液(10mmtris,10mmedta,ph8)+4.5urnase/ml中。
pcr条件
使用引物geoa2、geo11(schwarzottd,schüsslera(2001)asimpleandreliablemethodforssurrnagenednaextraction,amplification,andcloningfromsingleamfungalspores.mycorrhiza10:203-207)扩增18srdna。用于18srdna-内部转录间隔区pcr扩增和测序的引物是glom1310和its4i(redeckerd.(2000)specificpcrprimerstoidentifyarbuscularmycorrhizalfungiwithincolonizedroots.mycorrhiza10:73–80)。在0.2mmdntp-mix,1mm的每种引物,10%的pcr反应缓冲液和无菌分子级水中进行扩增。以4u/100μl反应混合物添加的
序列数据和球囊菌门分类学
使用由krüger等人发表的参考比对(referencealignment)(krügerm,krügerc,walkerc,stockingerh,schüβlera(2012)phylogeneticreferencedataforsystematicsandphylotaxonomyofarbuscularmycorrhizalfungifromphylumtospecieslevel.newphytol193:970–984;在www.amf-phylogeny.com可下载)作为18s种系发生的基础。为了鉴定相似的环境序列,在genbank中对多氏囊霉属的序列进行blast,且将高度相似的序列包含在形成18s树的基础的比对中。将已发布的部分18s-its1-部分5.8s序列用于多氏囊霉种系发生。
数据分析
比对最初由clustalw完成。通过cipres网络门户(millerma,pfeifferw,schwartzt.(2010)creatingthecipressciencegatewayforinferenceoflargephylogenetictres.inproceedingsofthegatewaycomputingenvironmentsworkshop(gce),2010年11月14日,neworleans,lapp1-8;http://www.phylo.org/)的raxml版本8.0(stamatakis等人,2014),使用100个引导复制(bootstrapreplicate)和gtrgamma模型,计算了最大似然种系发生分析。使用mrbayes版本2.0.5构建贝叶斯共识树(bayesianconsensustree)。使用gtr+i模型,使用随机生成的起始树对每个具有一个冷链和三个加热链的2m代进行两次分离的mc3运行。所有参数均根据数据进行估算。每1000代对树进行采样。将200000代作为“老化的(burn-in)”丢弃,并从返回的样本中构建共识树。
实施例2:本发明的组合物的一个实施方案的生产程序-用于种子包衣的浓缩组合物
第一阶段-温室条件
基质:蒙脱石粘土的ph值应在7.8到8之间,并在用作基质前以3天的交替循环进行灭菌。
amf菌株:使用纯化条件下的多氏囊霉属繁殖体作为起始种菌。无论是在生长箱中还是在具有可控的宿主植物条件的温室中,此类种菌始终以90至180天的周期连续重现。使用不同的植物在连续的周期中繁殖种菌,以避免疾病在同一宿主中传播。
夏季-秋季:高粱(sorghumvulgare)和罗勒属(ocimumsp.)
冬季-春季:黑麦草(loliumperenne)。
培养盆:使用15升体积的盆。
宿主植物的生长条件:
在生长箱或温室中,栽培开始于在无菌的蒙脱石粘土基质中将所选的丛枝菌根真菌(多氏囊霉属)菌株的纯种菌直接接种到宿主植物的根系上。这些植物将生长其整个生命周期,根据植物的类型将持续90到180天。这些植物始终保持充足的水分,每天有灌溉供应(无菌水),温度范围为25至28℃且相对湿度为65%。一旦完成生长,将含有蒙脱石基质、小根和纯amf繁殖体的根系拔出,随后将其用于第二阶段的扩大规模(scaleup)。
为了确定种菌的质量,使用了以下最低规格:
总孢子:50-225个孢子/克。
表生(extramatrical)菌丝体:>70mg/kg基质。
定植小根百分比:高粱(sorghum)>50%,黑麦草(lolium)>45%,罗勒属(ocimum)>40%。
mpn浓度:每100ml基质>1x104个繁殖体。
第二阶段-扩大规模
步骤1:准备床(bed)
床由塑料衬里材料构成,从而使床与周围的土壤隔离;床的构造应使排水得以发生,并防止不希望的植物生长,优选使用塑料覆盖层。
床应填充有所选的蒙脱石粘土(arcillarojagalve)。粘土的湿度应是约15%,以利于床填充过程中的操作。在填充后应提供饱和灌溉以改善结构。
-床位于排水良好处。
-床可以是任何大小,并考虑到方便床护理所需的人员和设备的过境所需的通道。
-床具有根据当地需求指示的灌溉系统。优选的系统设置可以是滴灌或洒水器,并且应该是自动化的,并可以对床的选定区域进行独立浇水。
步骤2:宿主植物物种
确定可以置于系统中的宿主植物物种和菌根真菌:宿主植物和真菌物种的选择和确定将对应于具体的场所条件和生产目标。使用黑麦草(loliumperenne)和先前在第一阶段生产的amf。
步骤3:播种宿主植物并接种
在种植宿主植物前测试种子的萌发。根据这个测试的结果确定合适的播种率。就多年生黑麦草而言,先前用丸化种(pelletedseed)证明了以80kg/ha撒播种子。还将amf种菌以20g/m2床与种子一起直接施用到蒙脱石粘土。
在播种后立即进行细雾灌溉,以防止种子和种菌的重新分布。
灌溉用水优选应具有以下特征:
-ph值≥6且≤7.5
-电导率:<1.6ms/m
-可溶性总盐:<1000ppm
-钠吸收率(sar)<10
-不含重元素和病原体。灌溉用水优选是饮用水。
步骤4:培养活动和灌溉
施用的灌溉应足以达到100%的土壤容水量,但要避免浇太多水并造成积水(pondingwater)或滞水(standingwater)。当泥土水分降至土壤容水量的75-80%时,应再次对床进行灌溉。
步骤5:管理菌根共生的建立以及对菌根真菌定植(colonization)的发展动态的知识。
在宿主植物的生长和发育过程中,amf根定植发生并在植物和真菌之间建立共生。为了评估这种关系的发展,定期进行根系采样以评估菌根的发展。用于评估定植的方法包括gerdeman&nicolson(1963)(gerdemannj.w.,nicolsont.h.1963.sporesofmycorrhizalendogenspeciesextractedfromsoilbywetsievinganddecanting.transactionsofthebritishmycologicalsociety46(2):235-44.)、mcgonigle(1990)(mcgonigle,t.p.,millerm.h.,evansd.g.,fairchildg.l.,swanj.a.1990.anewmethodwhichgivesanobjectivemeasureofcolonizationofrootsbyvesiculararbuscularmycorrhizalfungi.newphytologist115(3):495-501),和phillips&hayman(1970)(phillips,j.m.,haymand.s.1970.improvedproceduresforclearingrootsandstainingparasiticandvesiculararbuscularmycorrhizalfungiforrapidassessmentofinfection.transactionsofthebritishmycologicalsociety55:158-161.)。
采样从种植后两个月开始,并每月进行一次直到生长季节结束。根据从这些样本中获得的信息,可以确定接种剂内菌根共生的发展动态。
生产过程的评估基于菌根根定植、菌丝体的表生浓度以及定期采集的泥土样本的孢子含量。
了解菌根生产发展的动态可以确定最佳收获时间,并充分利用宿主植物和菌根真菌上的共生过程。
步骤6:收获
如果所使用的寄主植物是多年生黑麦草(lolium),则最佳收获时间通常在播种后的6至7个月之间,因为在此期间,植物成熟,完成其生命周期并表现出活力丧失和变黄的趋势。
在预定收获日期的前十五天,取消灌溉供应,并保留叶子以使泥土缓慢失去水分,从而确保接种过程的完成。如果这个活动正值雨季,则需用防水塑料覆盖床以保护床免受雨淋,从而使其能及时干燥。
首先手动移除宿主植物的地上叶。通过从床上移除泥土来完成收获。将泥土块尽可能细地分开以移除基质,以利于在贯穿整个剖面的深度上混合其内容物并将其放入袋中进行运输。
步骤7:种菌的干燥和研磨
干燥:将收获的基质和菌根繁殖体在50℃下进行日晒和热消毒30天。可以延长干燥时间直到水分含量低于5%,以利于研磨过程。
研磨:将产品在工业研磨机中研磨,冷却至2℃以防止菌根繁殖体过热。继续研磨直到粒径达到小于100微米。
第三阶段-浓缩
在步骤7后,将磨碎的生物质通过35微米的筛子达到产品浓度。将获得的低于这个量度(介于初始产品的60%至70%之间)的颗粒丢弃并留在下层,而25%至30%的超浓缩产品不会通过这个尺寸,最终得到浓缩组合物。通过使用这个技术,我们从每100毫升1.2x104个繁殖体达到每100毫升1.2x106个繁殖体。
产品的出口相对湿度低于5%。
质量控制:最终产品的纯度和浓度是根据porter(1979)的最大概率数法(porter,w.m.1979.themostprobablenumbermethodforenumeratinginfectivepropagulesofvesiculararbuscularmycorrhizalfungiinsoils.aust.j.soilres.17:515-519.)确定的。
包装:将成品包装并贴上标签用于运输。
浓缩组合物的最终浓度为:
mpn浓度:每100毫升产品>1.2x106个繁殖体。
第四阶段-种子包衣
可以在用于种子包衣的专用机器中,在常规混凝土搅拌机中或手动地在混合容器中用菌根接种剂包衣种子。所述包衣需要多个步骤,这些步骤按照执行它们的顺序描述于下。
1.作为初始步骤,用粘合物质包衣种子。除了水之外还可能使用的粘合物质包括有机粘合剂(明胶、乙基纤维素、丙二醇等)和无机粘合剂(矿物油、聚乙烯化合物、塑料树脂等)。所用的优选粘合剂是聚乙烯基团的聚合物或共聚物,例如聚乙烯吡咯烷酮(polyvinylpyrrolidone)和聚乙酸乙烯酯。将粘合剂添加到水溶液或醇溶液中以达到其最佳溶解度,粘合剂的用量在要包衣的种子的总重量的0.1%至15%之间,优选0.5%至10%之间,且更优选1.0%至5%之间变化。粘合剂的用量将取决于其化学性质以及待处理种子的类型。对于每100kg的所用种子,用粘合剂处理种子的时间可以在1至60秒之间变化,优选在5至50秒之间变化,且还更优选在10至40秒之间变化。
2.用粘合剂包衣后,然后添加菌根接种剂。取决于类型和变种(variety),添加到种子中的接种剂的比例可以选自以下范围:种子重量的0.1%至15%之间,优选0.5%至10%之间,且还更优选1%至5%之间。对于每100kg的所用种子,用菌根接种剂处理种子的时间可以在1至50秒之间变化,优选在5至40秒之间变化,且还更优选在10至30秒之间变化。
菌根处理可与第2a至2e节中所述的其他处理结合。这些处理也可以独立于菌根接种剂处理而进行,以获得多层包衣。在每一层包衣中要进行的步骤与在菌根接种剂的情况下的步骤相同。这些层可以通过用钙质(碳酸钙和类似物质)的无害物质、泥土或聚合物来源包衣种子来分离。制粒(pelletizing)或包壳(encrusting)物质不得超过种子重量的50%,优选不超过40%,且还更优选不超过30%,并如第1节所述将其与粘合物质一起添加到种子中。
2a.用与形成菌根的真菌相容的杀真菌剂、杀虫剂和/或除草剂进行处理。一般而言,所有市售除草剂和杀虫剂均与形成菌根的真菌相容。然而,并非所有杀真菌剂都与菌根真菌的存活相容。要使用的主要杀真菌剂包括嘧菌酯(azoxystrobin)、萎锈灵(carboxin)、环丙唑醇(cyproconazole)、百菌清、甲霜灵、腈菌唑和丙硫菌唑(prothioconazole)。杀虫剂(pesticide)的用量取决于制造商的建议,并且可以根据需要使用各种杀虫剂。
2b.用有益的微生物(包括木霉属(trichodermaspp.)、根瘤菌(rhizobiumbacteria))和/或对根际(rhizosphere)有益的微生物(例如曲霉菌(aspergillus)、青霉菌(penicillium)和固氮菌(nitrogenfixingbacteria))的组合进行处理。
2c.用大量营养元素和/或微量营养元素进行处理,其中氮(n)、磷(p)、钾(k)、钙(ca)、镁(mg)和硫(s)是必需的大量营养元素,且铁(fe)、锌(zn)、锰(mn)、硼(b)、铜(cu)、钼(mo)和氯(cl)是必需的微量营养元素。用于包衣的营养元素剂量可以在要包衣的种子的总重量的0.01%至15%之间,优选0.05%至10%之间,且还更优选0.1%至5%之间变化。
2d.用刺激剂进行处理。用诱导种子萌发和生长以及植物防御和孢子形成以及菌根真菌生长的刺激剂包衣种子。刺激剂可以是植物激素(脱落酸、独脚金内酯(strigolactone)、油菜素类固醇(brassinosteroid)等)及其诱导剂和衍生物、次级代谢产物(类黄酮(flavonoid)、萜类化合物(terpenoid)等)和辅因子(金属离子等)。
2e.用着色颜料进行处理:这些颜料必须与菌根真菌的生存相容,并且能将经处理的种子和未经处理的种子清楚地区分开。
3.步骤1和2意指在1至40秒,优选5至30秒,且还更优选10至20秒的时间内用粘合物质将菌根接种剂完全包衣,用粘合物质进行菌根接种剂的完全包衣。
4.进行菌根处理后,将种子干燥一段时间,这段时间可以在1至50秒之间,优选5至40秒之间,且还更优选10至30秒之间变化。这个步骤可以在步骤5后进行。
5.最后,将经包衣的种子从包衣组分中卸放到容器中。卸放的持续时间可以在5至30秒之间,优选10至25秒之间,并且还更优选15至20秒之间变化。
实施例3:本发明的组合物的一个实施方案的生产程序-微粒化组合物
第一阶段-温室条件
基质:蒙脱石粘土的ph值应在7.8到8之间,并在用作基质前以3天的交替循环进行灭菌。
amf菌株:使用纯化条件下的多氏囊霉属繁殖体作为起始种菌。无论是在生长箱中还是在具有可控的宿主植物条件的温室中,此类种菌始终以90至180天的周期连续重现。使用不同的植物在连续的周期中繁殖种菌,以避免疾病在同一宿主中传播。
夏季-秋季:高粱(sorghumvulgare)和罗勒属(ocimumsp.)
冬季-春季:黑麦草(loliumperenne)。
培养盆:使用15升体积的盆。
宿主植物的生长条件:
在生长箱或温室中,栽培开始于在无菌的蒙脱石粘土基质中将所选的丛枝菌根真菌(多氏囊霉属)菌株的纯种菌直接接种到宿主植物的根系上。这些植物将生长其整个生命周期,根据植物的类型将持续90到180天。这些植物始终保持充足的水分,每天有灌溉供应(无菌水),温度范围为25至28℃且相对湿度为65%。一旦完成生长,将含有蒙脱石基质、小根和纯amf繁殖体的根系拔出,随后其将用于第二阶段的扩大规模。
为了确定种菌的质量,使用了以下最低规格:
总孢子:50-225个孢子/克。
表生菌丝体:>70mg/kg基质。
定植小根百分比:高粱(sorghum)>50%,黑麦草(lolium)>45%,罗勒属(ocimum)>40%。
mpn浓度:每100ml基质>1x104个繁殖体。
第二阶段-扩大规模
步骤1:准备床
床由塑料衬里材料构成,从而使床与周围的土壤隔离;床的构造应使排水得以发生,并防止不希望的植物生长,优选使用塑料覆盖层。
床应填充有所选的蒙脱石粘土(arcillarojagalve)。粘土的湿度应是约15%,以利于床填充过程中的操作。在填充后应提供饱和灌溉以改善结构。
-床位于排水良好处。
-床可以是任何大小,并考虑到方便床护理所需的人员和设备的过境所需的通道。
-床具有根据当地需求指示的灌溉系统。优选的系统设置可以是滴灌或洒水器,并且应该是自动化的,并可以对床的选定区域进行独立浇水。
步骤2:宿主植物物种
确定可以置于系统中的宿主植物物种和菌根真菌:宿主植物和真菌物种的选择和确定将对应于具体的场所条件和生产目标。使用黑麦草(loliumperenne)和先前在第一阶段生产的amf。
步骤3:播种宿主植物并接种
在种植宿主植物之前测试种子的萌发。根据这个测试的结果确定合适的播种率。就多年生黑麦草而言,先前用丸化种证明了以80kg/ha撒播种子。还将amf种菌以20g/m2床与种子一起直接施用到蒙脱石粘土中。
在播种后立即进行细雾灌溉,以防止种子和种菌的重新分布。
灌溉用水优选应具有以下特征:
-ph值≥6且≤7.5
-电导率:<1.6ms/m
-可溶性总盐:<1000ppm
-钠吸收率(sar)<10
-不含重元素和病原体。灌溉用水优选是饮用水。
步骤4:培养活动和灌溉
施用的灌溉应足以达到100%的土壤容水量,但要避免浇太多水并造成积水或滞水。当粘土的水分降至土壤容水量的75-80%时,应再次对床进行灌溉。
步骤5:管理菌根共生的建立以及对菌根真菌定植的发展动态的知识。
在宿主植物的生长和发育过程中,amf根定植发生并在植物和真菌之间建立共生。为了评估这种关系的发展,定期进行根系采样以评估菌根的发展。用于评估定植的方法包括gerdeman&nicolson(1963)(gerdemannj.w.,nicolsont.h.1963.sporesofmycorrhizalendogenspeciesextractedfromsoilbywetsievinganddecanting.transactionsofthebritishmycologicalsociety46(2):235-44.),mcgonigle(1990)(mcgonigle,t.p.,millerm.h.,evansd.g.,fairchildg.l.,swanj.a.1990.anewmethodwhichgivesanobjectivemeasureofcolonizationofrootsbyvesiculararbuscularmycorrhizalfungi.newphytologist115(3):495-501),和phillips&hayman(1970)(phillips,j.m.,haymand.s.1970.improvedproceduresforclearingrootsandstainingparasiticandvesiculararbuscularmycorrhizalfungiforrapidassessmentofinfection.transactionsofthebritishmycologicalsociety55:158-161.)。
采样从种植后两个月开始,并每月进行一次直到生长季节结束。根据从这些样本中获得的信息,可以确定接种剂内菌根共生的发展动态。
生产过程的评估基于菌根根定植、菌丝体的表生浓度以及定期采集的泥土样本的孢子含量。
了解菌根生产发展的动态可以确定最佳收获时间,并充分利用宿主植物和菌根真菌上的共生过程。
步骤6:收获
收获是生产过程中最为关键的步骤。如果所使用的寄主植物是多年生黑麦草(lolium),则最佳收获时间通常在播种后的6至7个月之间,因为在此期间,植物成熟,完成其生命周期并表现出活力丧失和变黄的趋势。
在预定收获日期的前十五天,取消灌溉供应,并保留叶子以使泥土缓慢失去水分,从而确保接种过程的完成。如果这个活动正值雨季,则需用防水塑料覆盖床以保护床免受雨淋,从而使其能及时干燥。
首先手动移除宿主植物的地上叶子。通过从床上移除泥土来完成收获。将泥土块尽可能细地分开以移除基质,以利于在贯穿整个剖面的深度上混合其内容物并将其放入袋中进行运输。
步骤7:种菌的干燥和研磨
干燥:将收获的基质和菌根繁殖体在50℃下进行日晒和热消毒30天。可以延长干燥时间直到水分含量低于5%,以利于研磨过程。
研磨:将产品在工业研磨机中研磨,冷却至2℃以防止菌根繁殖体过热。继续研磨直到粒径达到小于100微米。
第三阶段-微粒化
微粒化过程分为三个步骤:
-将颗粒状支持物(granularsupport)添加到旋转双锥形混合器中。使用以下来生产支持物:云母、绿坡缕石(attapulgite)和石灰石的混合物,其范围在按重量计的40-90%之间,更优选在按重量计的50-80%之间,甚至更优选在按重量计的60-70%之间。
-添加菌根(丛枝菌根真菌):amf的剂量为按多氏囊霉属重量计的10-60%,更优选为按重量计的20-50%,甚至更优选为按重量计的30-40%,所述多氏囊霉属先前在旋转双锥形混合器中通过螺杆与粘合剂(binder)(蜡、亚麻籽油、阿拉伯树胶、黄蓍胶(gumtragacanth)、甲基纤维素、聚乙烯醇、木薯粉、乳糖、蔗糖、微晶纤维素、聚乙烯吡咯烷酮、乳糖粉、蔗糖粉、木薯淀粉(木薯粉)和微晶纤维素、树胶或蛋白质例如蛋清或酪蛋白)以按重量计的1至25%,更优选按重量计的5至20%,甚至更优选按重量计的10至15%的范围一起生产(步骤7)。在这个操作过程中,混合器一直保持运行状态,直到颗粒完全均质化为止。
-包装:一旦所配制的产品完全均质化,将其卸放到筛子上以移除产生的团块和粉尘。最后,将产品收集在包装料斗中,从中自动前进以到达相应的充填容器。
质量控制和包装
质量控制:最终产品的纯度和浓度是根据porter(1979)的最大概率数法(porter,w.m.1979.themostprobablenumbermethodforenumeratinginfectivepropagulesofvesiculararbuscularmycorrhizalfungiinsoils.aust.j.soilres.17:515-519.)确定的。
包装:将成品包装并贴上标签用于运输。
微粒化组合物的最终浓度为:
mpn浓度:每100毫升产品>1x104个繁殖体。
实施例4:本发明的组合物对小麦(硬粒小麦(triticumdurum))发育的作用
为了证明本发明的包含保藏号为mucl57072的丛枝菌根真菌(amf)多氏囊霉属的组合物对小麦的有效性,在位于穆尔西亚(murcia)的为cebas-csic所有的实验领域“trescaminos”进行了试验。
实验设计是具有四个重复的随机区块。实验田长3m,宽4.2m。
施用了以下处理:
-对照:无化学施肥且无施用的真菌
-本发明的组合物:以微粒形式,以10kg/ha的比率,与化学施肥结合提供(guerra,b.e.micorrizaarbuscular.recursomicrobiológicoenlaagriculturasostenible.tecnologíaenmarcha,2008,vol.21,no.1,p.191-201)。
-标准产品:化学施肥(guerra,b.e.micorrizaarbuscular.recursomicrobiológicoenlaagriculturasostenible.tecnologíaenmarcha,2008,vol.21,no.1,p.191-201):150kg/ha的氮,54kg/ha的磷,100kg/ha的钾,15kg/ha的钙,15kg/ha的镁,23kg/ha的硫和其他微量营养元素。
播种于2013年11月1日完成,并于2014年6月1日开始收获,共计240天。所用的播种和接种类型是机械的,并通过谷物播种机冲程(graindrillstroke)进行,并且微粒形式的本发明的组合物以10kg/ha与种子一起施用。
所使用的土壤被归类为黏绨土(nitisols)(iussworkinggroup.wrb.worldreferencebaseforsoilresources2006.worldsoilresourcesreports.rome:fao,2006)。为了对土壤进行化学表征,使用了以下分析方法:
-ph:土壤-溶液比率为1:2.5。
-有机质(organicmatter,mo):walkley和black。
-p2o5:oniani。
-可交换阳离子:用ph值为7的1mol/lnh4ac进行提取,并进行络合滴定(ca和mg)和火焰光度测定(na和k)。
这些方法在用于分析土壤、叶、有机肥料和化学肥料的分析技术手册中进行了描述(institutonacionaldecienciasagrícolas.manualdetécnicasanalíticasparaanálisisdesuelo,foliar,abonosorgánicosyfertilizantesquímicos:lahabana.1989)。
土壤的化学表征结果(表2)显示出中等至高的肥力(fertility)以及有机质的平均含量,这与针对这种类型土壤的描述相符(hernández,a.;morell,f.;ascanio,m.o.;borges,y.;morales,m.yyong,a.cambiosglobalesdelossuelosferralíticosrojoslixiviados(nitisolesródicos
表2:土壤的化学表征
本发明的多氏囊霉属的真菌菌株分离自盐渍土壤(salinesoil),这种真菌对高盐浓度耐受。
分析的变量是:每克根际土壤中amf的孢子数(gederman,j.w.ytrappe,j.m.theendogonaceaeinthepacificnorthwest.mycologiamemoirno5.thenewyorkbotanicgarden.1974,no.5),通过根染色技术(phillips,j.m.yhayman,d.s.improvedproceduresforclearingrootsandstainingparasiticandvesiculararbuscularmycorrhizalfungiforrapidassessmentofinfection.tranfer.britanic:mycologysociety,1970,vol.55,p.158-161)分析的菌根定植百分比,通过截距法(giovannetti,m.ymosse,b.anevaluationoftechniquestomeasurevesicular–arbuscularinfectioninroots.newphytology,1980,vol.84,p.489-500)分析的视觉密度(visualdensity)百分比,和通过高压锅法(wright,s.e.;nichols,k.a.yschmidt,w.f.comparisonofefficacyofthreeextractantstosolubilizeglomalinonhyphaeandinsoil.chemosphere,2006,vol.64,no.7,p.1219-1224)获得的总球囊霉素(glomalin)(糖蛋白)含量。
通过inca分析技术实验室手册(institutonacionaldecienciasagrícolas.manualdetécnicasanalíticasparaanálisisdesuelo,foliar,abonosorgánicosyfertilizantesquímicos:lahabana.1989)中描述的方法确定叶营养元素含量(%n、p和k)和总蛋白质含量。
如下所述评估产率:评估每个谷穗的谷粒数;每m2的谷穗数;每1000个谷粒的重量以及农业产量(t/ha)。
实验结果的统计处理是通过单因素方差分析(onewayanova)完成的,并使用了邓肯检验(testofduncan)(duncan,d.b.multiplerangeandmultipleftests.biometrics,1955,vol.11,no.1),当处理之间有差异时意味着在所有情况下均使用统计处理器spss11.5。
结果与讨论
表3显示了不同处理对菌根变量的结果。这些值清楚地表明,相对于对照(无化学施肥)和标准产品,施用本发明的组合物时孢子数量增加。
表3:处理对所研究的菌根变量的作用。
*同一列中的不同字母是p<0.05的显著差异。
以上可能是由于强烈的定植活性,使其他种类的丛枝菌根真菌的根定植变得困难。另一方面,它表明,与其他处理相比,使用本发明的组合物的菌根定植也更有效,反映出更高的值。
应当注意的是,土壤中的天然菌株显示出低的定植值。通过观察视觉密度值(定量菌根定植强度的变量),表明使用本发明的组合物获得最高的百分比。
要强调的另一个变量是总糖蛋白含量,其在使用本发明的组合物时更高。这个现象再次证明了当施用本发明的组合物时的菌根共生更好,以及接种剂使土壤中聚集体形成增加的可能影响。此外,未施用菌根接种剂的处理中这个变量的值较低,这可能归因于天然菌根的低效性。
表4显示了每个处理中叶的矿物质含量。在施用本发明的组合物时,氮和磷的含量较高,而使用化学施肥时钠含量较高。
表4:叶的氮、磷、钾和总蛋白。
*同一列中的不同字母是p<0.05的显著差异。
应当注意的是,这个变量(叶的%氮)的报告值(lópez-bellido,l.cultivosherbáceos.cereales.ed.mundi-prensa,1991.p.151-158)高于小麦产量的临界指数(4至5t/ha之间)。
相似的结果(cornejo,p.;borie,f.;rubio,r.yazcon,r.influenceofnitrogensourceontheviability,functionalityandpersistenceofglomusetunicatumfungalpropagulesinanandisol.appliedsoilecology,2007,vol.35,no.2,p.423-431;echeverria,e.ystiddert,g.a.elcontenidodenitrógenoenlahojabanderadeltrigocomopredictivodelincrementodeproteínaenelgranoporaplicacionesdenitrógenoenlaespigazón(thenitrogencontentinthewheatflagleafaspredictiveoftheincreaseinproteininthegrainbynitrogenapplicationstotheear).revistadelafacultaddeagronomía,1998,vol.103,no.1,p.10)表明这个营养元素在叶组织中的存在,这归因于通过菌丝来吸收和运输营养的菌根共生过程。在任何处理中,叶磷的含量均未显示出显著差异,这可能是由于这个元素在土壤中的含量(表4),植物通过其根(radical)和系统,在这个特定情况下是通过植物-丛枝菌根(菌根共生)和土壤的三方相互作用,从土壤溶液中吸收了这个元素,指出了这个元素的值高于硬粒小麦中其叶临界值(lópez-bellido,l.cultivosherbáceos.cereales.ed.mundi-prensa,1991.p.151-158),并且表明作物生长良好。在施用本发明的组合物时,这个值也呈较高的趋势。
另一个相关变量是叶蛋白含量,其在使用本发明的组合物的处理中更高(甚至比使用化学施肥的处理更高)。最后,对照处理的百分比显著较低。
产量及其组分的(表4)结果清楚地反映了硬质小麦对施用本发明的组合物和标准产品的响应,两者均具有高的n含量。
表5:处理对产量及其变量的作用。
*同一列中的不同字母是p<0.05的显著差异。
使用本发明的组合物和标准产物的处理相对于对照在每个变量上都给出了最高值。这可以解释为固体接种剂的效力更高和高剂量氮的施用。
值得注意的是,与本发明的组合物相关的小麦栽培允许以可接受的菌根操作指标实现充分的生产响应,不仅改善了土壤的生物活性,而且相对于对照和标准产品使产量有了8.8%的显著提高。
实施例5:本发明的组合物对玉米(zeamays)发育的作用。
为了证明本发明的包含保藏号为mucl57072的丛枝菌根真菌(amf)多氏囊霉属的组合物对玉米的有效性,在邻近egeadeloscaballeros镇的田地上进行了试验。检测了本发明的组合物的微粒形式。在雏形土(cambisolsoil)上,使用标准产品以比较两种产品对玉米(vardkc6717,monsanto)栽培的作用。
播种于2014年4月12日完成,并于12月14日开始收获,共计230天。所用的播种和接种类型是机械的,并通过谷物播种机冲程进行,并且本发明的微粒组合物以10kg/ha与种子一起施用。所使用的种植面积为0.7mx0.16m,每平方米总计80株植物。所用的喷雾系统为18x18m。
实验设计是具有三个重复的随机区块。实验田长20m,宽20m。
施用了以下处理:
-本发明的组合物:以10kg/ha与化学施肥一起提供(guerra,b.e.micorrizaarbuscular.recursomicrobiológicoenlaagriculturasostenible.tecnologíaenmarcha,2008,vol.21,no.1,p.191-201)。
-标准产品:化学施肥(guerra,b.e.micorrizaarbuscular.recursomicrobiológicoenlaagriculturasostenible.tecnologíaenmarcha,2008,vol.21,no.1,p.191-201):325kg/ha的氮,80kg/ha的磷和200kg/ha的钾,并初始提供10kg/ha的浆液形式的有机质。
所使用的土壤被归类为雏形土(cambisol)(iussworkinggroup.wrb.worldreferencebaseforsoilresources2006.worldsoilresourcesreports.rome:fao,2006)。为了对土壤进行化学表征,使用以下分析方法:
-ph:土壤-溶液比率为1:2.5。
-有机质(mo):walkley和black。
-p2o5:oniani。
-可交换阳离子:用ph值为7的1mol/lnh4ac进行提取,并进行络合滴定(ca和mg)和火焰光度测定(na和k)。
这些方法在用于分析土壤、叶、有机肥料和化学肥料的分析技术手册中进行了描述(institutonacionaldecienciasagrícolas.manualdetécnicasanalíticasparaanálisisdesuelo,foliar,abonosorgánicosyfertilizantesquímicos:lahabana.1989)。
土壤的化学表征结果(表6)显示出中等至高的肥力以及有机质的平均含量,这与针对这种类型土壤的描述相符(hernández,a.;morell,f.;ascanio,m.o.;borges,y.;morales,m.yyong,a.cambiosglobalesdelossuelosferralíticosrojoslixiviados(nitisolesródicos
表6:土壤的化学表征
本发明的多氏囊霉属的真菌菌株分离自盐渍土壤,这种真菌对高盐浓度耐受。
分析的变量是:通过根染色技术(phillips,j.m.yhayman,d.s.improvedproceduresforclearingrootsandstainingparasiticandvesiculararbuscularmycorrhizalfungiforrapidassessmentofinfection.tranfer.britanic:mycologysociety,1970,vol.55,p.158-161)分析的菌根定植百分比,和通过截距法(giovannetti,m.ymosse,b.anevaluationoftechniquestomeasurevesicular–arbuscularinfectioninroots.newphytology,1980,vol.84,p.489-500)分析的视觉密度(vd)百分比。通过inca分析技术实验室手册(institutonacionaldecienciasagrícolas.manualdetécnicasanalíticasparaanálisisdesuelo,foliar,abonosorgánicosyfertilizantesquímicos:lahabana.1989)中描述的方法确定叶营养元素含量(%n、p和k)。
如下所述评估产率:评估每个谷穗的谷粒数;每平方米的谷穗数;每1000个谷粒的重量以及农业产量(t/ha)。
实验结果的统计处理是通过单因素方差分析(onewayanova)完成的,并使用了邓肯检验(testofduncan)(duncan,d.b.multiplerangeandmultipleftests.biometrics,1955,vol.11,no.1),当处理之间有差异时意味着在所有情况下均使用统计处理器spss11.5。
结果与讨论
表7显示了种植后45天和120天的菌根活性演变的结果。这些值清楚地表明了在施用本发明的组合物时活性增加,不仅达到更高的菌根定植百分比,而且达到更高的定植强度(由更高的视觉密度反映)。
表7:处理对所研究的菌根变量的作用。
*同一列中的不同字母是p<0.05的显著差异。
这个测定显示,最有效的接种剂是本发明的组合物,其与其他处理相比反映出更高的值。
视觉密度(定量菌根定植强度的变量)的值表明了最高百分比也与本发明的组合物有关,其与有效性紧密相关。
测量了叶的矿物质含量(表8)。结果显示本发明的组合物和标准产品的两种处理之间没有显著差异。然而,存在营养供应增加的趋势,尤其是对于存在多氏囊霉属(本发明的组合物)下的氮含量而言。
表8:在120天时玉米的叶氮、磷、钾。
*同一列中的不同字母是p<0.05的显著差异。
应当注意的是,在使用本发明的组合物的处理下获得的氮含量值高于产量为4至5t/ha之间的小麦的临界指数(lópez-bellido,l.cultivosherbáceos.cereales.ed.mundi-prensa,1991.p.151-158)。
在任何处理中,叶磷的含量均未显示出显著差异,这可能是由于这个元素在所用土壤中的含量(表8)。植物通过其根系(radicalsystem),在这个特定情况下是通过植物-丛枝菌根(菌根共生)和土壤的三方相互作用吸收磷。叶磷含量高于这个营养元素在硬粒小麦中的临界值(lópez-bellido,l.cultivosherbáceos.cereales.ed.mundi-prensa,1991.p.151-158),表明作物生长良好。然而,这个值在经本发明的组合物处理的处理中呈较高的趋势。
在小麦和玉米上的相似结果表明了矿物施肥对定植根长度的百分比的作用,其中施用了低剂量的磷。这支持了本发明的组合物对于玉米和小麦植物在存在或不存在氮和磷下增加从土壤中的磷吸收的重要性和有用性,其实现了肥料施用量的最小化。
所研究的不同处理间的叶钾含量相似,显示出对于这个作物来说令人满意的水平,这与关于谷物中这个大量元素的说法相吻合(lópez-bellido,l.cultivosherbáceos.cereales.ed.mundi-prensa,1991.p.151-158)。此外,在菌根植物和非菌根植物中都发现了高浓度的这个元素(bolleta,a.ykrugger,h.fertilizacióneinoculaciónconhongosmicorrízicosarbuscularesentrigo.buenosaires:institutonacionaldetecnologíaagropecuaria.2004.,saleque,m.a.;timsina,j.;panaullah,g.m.;ishaque,m.;pathan,d.j.;saha,p.k.;quayyum,m.a.;humphreys,e.ymeisner,c.a.nutrientuptakeandapparentbalancesforrice-wheatsequences.ii.phosphorus.journalofplantnutrition,2006,vol.29,no.1,p.157-172),这可能归因于这个元素在土壤溶液中更易移动的事实。
下表总结了获得的结果(表9),其清楚地反映了玉米对本发明的组合物和对标准产品的施用的响应。
表9:处理对培养中的产量及其组分的作用。
*同一列中的不同字母是p<0.05的显著差异。
与用标准产品相比,用本发明的组合物处理过的植物达到最高值,这可以解释为固体接种剂建立与植物的共生的效力更高并因此产生更好的高剂量氮素同化作用(assimilation)。
在最后和在结论中值得指出的是,与本发明的组合物相关的玉米栽培从性能的角度可以实现积极的生产响应,与矿物施肥相比达到了9.18%的增产。而且,营养指标显示出更高的趋势,并且本发明的丛枝菌根真菌的使用不仅改善土壤生物活性,而且基于更加可持续的管理促进了产量的显著增加。
实施例6:用多氏囊霉属和粘合物质包衣玉米种子对菌根活性的有效性。
目的:了解用多氏囊霉属和粘合物质包衣玉米种子对菌根活性的功效。
为了实现这一目标,用三个播种机(每个播种机都视为一个重复)种植用保藏号为mucl57072的多氏囊霉属和粘合物质包衣的玉米种子。
种子于2016年8月3日播种,并在种植后21天和35天使用1970年phillips和hayman的染色技术对根进行菌根定植测定。
表10:分别在种植后(dpp)21天和35天测定用多氏囊霉属和粘合物质的组合包衣的玉米种子的小根的菌根定植百分比(%mc)。
表10显示,在所分析的每个样本中,菌根定植百分比均为正值,其随植物的生长而增加。在这个阶段,仅检测了玉米上由刚刚开始形成的表生菌丝体网络形成的初始定植点。
结论:
使用含有多氏囊霉属和粘合物质的浓缩接种剂包衣玉米种子是有效的,因为它在植物的第一阶段在根部产生了菌根结构作为表生菌丝体。可看见萌发物种的孢子,并形成了内部萌发和定植网络。还显示了取决于玉米生长时间的定植值。
实施例7:从在小麦和大麦中应用微粒形式的本发明的组合物的田间获得的结果。
在下表11中报告了从在小麦和大麦中应用微粒形式的包含保藏号为mucl57072的多氏囊霉属的本发明的组合物的田间获得的结果。
实施例8:从在玉米中应用微粒形式的本发明的组合物的田间获得的结果。
在下表12中报告了从在玉米中应用微粒形式的包含保藏号为mucl57072的多氏囊霉属的本发明的组合物的田间获得的结果。
实施例9:多氏囊霉属在水浸地(floodedsoil)中的水稻(orizasativa)栽培中的菌根活性。
进行实验以确定在水浸的盐渍土壤条件下,浓缩形式的含有保藏号为mucl57072的多氏囊霉属的本发明的组合物的菌根活性。所用组合物的浓度为1-4×106个繁殖体/克基质。相反,根据一些实施方案,组合物的浓度可以为1-2×104个繁殖体/克基质,优选为1,2-1,8×104个繁殖体/克基质。
材料与方法:
实验是在cebas-csic所有并位于桑托梅拉(穆尔西亚)市马坦萨地区(matanzaarea,municipalityofsantomera(murcia))的“trescaminos”实验农场进行的。植物生长在单层隧道式实验温室中,其表面积约为60m2,覆盖有聚碳酸酯,且顶部窗户有防绊网(antitripsmesh)保护。它配备了冷却系统和镀铝的遮阳系统。试验是用水稻植物(orizasativa)(品种j104)进行的,其进行了两种菌根接种剂处理和未经菌根处理的相应对照。菌根处理是用浓缩形式的含有保藏号为mucl57072的多氏囊霉属的本发明的组合物以1kg/ha的剂量包衣水稻种子。
当确保了单独的芽中的接种时,在萌发后的第15天,使用hidromórfico潜育瘤状盐渍化土壤(hidromórficogleynodularsalinizadosoil)(根据unesco土壤分类法(hernádez,a;pérez,j.m;bosch,d;rivero,l:nuevaversióndeclasificacióngeneticadelossuelosdecuba.soilinstitute.agrinfor,lahabana,1999.64p))作为两个容器中的基质,以每混凝土通道(表面积为2m2)10株植物的浓度移植植物。主要特征如表1所示。在所有处理中,在播种18天后,进行栽培工作并添加一层水。
表13:实验中使用的hidromórfico潜育瘤状盐渍化土壤的一些化学性质和每50克土壤的孢子数。
浓缩形式的本发明的组合物的特征
在本实施例中,浓缩形式的本发明的菌根接种剂组合物含有保藏号为mucl57072的形成丛枝菌根的真菌多氏囊霉属。所用组合物的浓度为1-4×106繁殖体/克基质。
所进行的确定
确定了移植后(dpt)90天的生长动态,其中测量了植株高度和根系深度,且还测量了收获产量及其某些组分。
通过使用立体显微镜(zeiss,德国-5-)和axiostar复式显微镜(zeiss,德国)测量定植百分比(%)、视觉密度(%)、丛枝表生菌丝体和丛枝内生菌,来确定作物生长期间的菌根活动。计算了丛枝表生菌丝体与内生菌丝体之间的比例(mea:ea)。
使用根部染色技术(phillips,d.m和hayman,d.s.improvedproceduresforclearingrootsandstainingparasiticandvesiculararbuscularmycorrhizalfungiforrapidassessmentofinfection.trans.br.mycol.soc.55.158-161.1970)对样本进行了菌根评估,并通过截距法(giovannetti,m.和mosse,b.(1980):anevaluationoftechniquestomeasurevesicular-arbuscularinfectioninroots.newphytology.,84:489-500)确定了定植百分比。根据提议的方案(trouvelot,a.,kough,j.和gianinazzipearson,v.(1986).mesuredutauxdemycorhizationvad'unsystemeradiculaire.recherchedemethodesd'estimationayantunesignificationfonctionnelle.proceedingsofthe1steuropeansymposiumonmycorrhizae:physiologicalandgeneticalaspectsofmycorrhizae,dijón,15july,1985.(eds.v.gianinazzipearson和s.gianinazzi).inra,paris.pp.217222;herrera-peraza,r.eduardofurrazola,robertol.ferrer,rigelfernándezvalle和yamirtorresarias.2004.functionalstrategiesofroothairsandarbuscularmycorrhizaeinanevergreentropicalforest,sierradelrosario,cuba.revistaceniccienciasbiológicas,vol.35,no.2,2004)确定了视觉密度、丛枝内生菌和菌根活性的数学计算。还测定了每克土壤的总孢子种群(sporepopulation)。
统计学分析
通过对分类方差的简单分析进行结果的统计处理,且当平均值之间存在显著差异时,使用程序
使用表达式2arcsen√x转换菌根定植的百分比值。
结果与讨论
上面报告的表13显示了实验中使用的土壤的一些化学性质。土壤的ph呈弱碱性,有机质为平均水平,p和ca2+值在10cmol.kg-1级。关于盐特征,na含量高且电导率高,表明了强的盐特征,尽管肥力对于水稻作物的发育是可接受的。
在这个基质中发现的孢子数量非常少,这是其中丛枝菌根真菌(amf)的多样性和强度降低的重度使用的农业土壤的特征,这是由于过度耕种(intensivetillage)、过度开发以及典型的化学化和盐化过程等(rao,d.l.n.,1998.biologicalameliorationofsalt-affectedsoils.in:microbialinteractionsinagricultureandforestry,vol.1.sciencepublishers,enfield,usa,pp.21–238)。
在这些条件下的水稻植物生长动态的分析显示出处理下的所研究的变量的行为变化。植物的高度稳定增加,在第27天后其生长加速(表14)。
表14:在盐渍土壤条件下,在90dpt期间,用多氏囊霉属处理的(d.t)植物和对照(c)植物的高度(cm)、根系深度(cm)和菌根定植(%mc)。
图注:drs:根系深度,dpt:处理后天数,st.sig.:标准差
同一列中的相同字母在p≤0.05时没有显著差异。
两种处理在高度增加期间都显示出显著差异。在对照处理中,直到18天才获得最高值,其后行为发生变化,而在接种处理中,在使用有效的丛枝菌根真菌时获得植物高度的最高值。
在这些条件下对水稻植物生长动态的分析揭示了处理下变量的行为变化。植物的高度稳定增加,在第27天后其生长加速。
两种处理在高度增加期间都显示出显著差异。在对照处理中,直到18天才获得最高值,其后行为发生变化,而在接种处理中,在使用有效的丛枝菌根真菌时获得植物高度的最高值。
在根系深度中观察到高度变量的类似行为,其在32dpt之后在经处理的植物中比在对照植物中更大。在这种情况下,由于这是在其中建立真菌的植物的一部分,因此行为更加明显。
菌根定植的研究显示出与在先前分析的变量中发现的行为不同的行为。在这种情况下和在两种处理中,定植是进行式的,并且其在接种处理中相比于在对照处理中总是达到最高值,尽管其未进行接种却显示出自然的菌根定植水平,这是在自然条件下进行实验的典型结果。
在接种amf的处理的情况下,如果考虑到实验是在水浸条件下或添加一层水20天后进行的,发育是非常明显的,其达到高值。在栽培结束时,根定植值达到44%,认为这个值与其他对水稻菌根的研究相比是高的,后者在固体基底上接种时定植最大不超过25%(fernández,f.;ortiz,r.;martínez,m.a.;costales,a.;llonín,d.theeffectofcommercialarbuscularmycorrhizalfungi(amf)inoculantsonrice(oryzasativa)indifferenttypesofsoils.cultivostropicales18(1):5-9,1997)。
图1显示了在使用具有浓缩形式的本发明的组合物的接种剂的处理下的菌根活性中,孢子种群和真菌占据这两个非常重要的真菌变量的发展,它们通过视觉密度百分比(即菌丝体在根内部定植的强度)表示。
视觉密度显示了具有明确延迟期的典型微生物行为,其中真菌在0至20天缓慢地定植在根内部,并随后呈指数增长直至40天,这是其到达稳定期和栽培结束的时间。
就孢子种群而言,在接种的前几天在土壤中检测到源自接种(在茎中长达15天)的值,其随后随时间逐渐消失,在有利的湿度和高温条件下的萌发产物直到土壤中孢子种群下降。30天后,由于外部真菌生物量的发展以及与植物的共生的发展,开始产生新的孢子。在这种情况下,种群继续增长至接近于每克土壤12个孢子的值。
对丛枝外部菌丝体和丛状内生菌变量(图2)的分析十分有趣,因为它显示了随着每年栽培周期中共生的发展,菌根共生体的内部和外部行为是如何发生的。
在这种情况下,在共生发展的初始阶段观察到高的外部菌丝体值,这是由以植物生长(在几年后表现)为代价的真菌生长引起的(bethlenfalvay,g.j.,brown,m.s.,franson,r.l.,mihara,k.l.,1989.theglycine-glomus-bradyrhizobiumsymbiosis.ix.nutritional,morphologicalandphysiologicalresponseofnodulatedsoybeantogeographicisolatesofthemycorrhizalfungusofglomusmosseae.physiol.plant.76,226–232),作为弗兰克寄生过程(frankparasiticprocess),其衍生自在低光合作用阶段且代谢成本高的植物中的菌根定植早期(小时计)中的菌丝体的旺盛生长。丛枝内生菌的发展遵循相反的趋势。在开始的数天中,值非常低,直到生长25天后才达到显著生长,该阶段被认为是丛枝菌根共生的过渡阶段。
30天后,外部菌丝体减少并稳定下来,而与植物生长和共生发展有关的内生菌逐渐增加。
图3显示了水稻作物中的菌根组分之间建立的关系(丛枝外部菌丝体和内生菌丝体之间的比例(mea:ea))。共生的两个主要组分(外部菌丝体和内生菌)之间的这种对应关系表现出经历了不同的发育阶段的这个关联的活性(hirrel,m.c.,1981.theeffectofsodiumandchloridesaltsonthegerminationofgigasporamargaria.mycology43,610–617)。
具有高的外部菌丝体值以及非常低的内生菌值(其平息了弗兰克寄生)的初始阶段,不仅由这些变量表示,而且表现为与不引起植物发育实质性变化的未接种的或无效菌根化的对照相比的植物生长减少(表2)。
其中两个部分开始达到平衡的中间阶段或过渡阶段,以及当各组分的平衡值等于1或甚至更小时的交换的互惠阶段(mutualistphase),使得根内部出现显著增加,从而确保了在细胞内的丛枝水平下合适的营养交换。
尤其对于这个作物,能够很好地定义两个阶段;长达20至25天的初始过渡以及该时间后的互惠阶段。与此平行地,对植物高度的分析显示,在种植27天后,植物的生长相对于未接种的对照出现了腾飞,这与在这些盐度条件下的菌根共生的互惠阶段相符合。
随后可以在对产量及其组分的分析中显示这个作用(表15)。
表15:在盐渍土壤中,在用多氏囊霉属处理的(d.t)水稻植物和对照未处理植物(c)中的每株穗数(n)、穗重(g)、100粒的重量(g)和产量(每株克数)。
图注:npp:每株穗数(n),pp:穗重(g),p100g:100粒的重量(g),r:产量(每株g数),st.sig.:标准差。同一列中的相同字母在p≤0.05时没有显著差异。
相比于对照未接种植物,在用多氏囊霉属处理的植物中测得的产量的所有组分均增加。就研究的盐度条件而言,这尤其有趣。
作为结论,使用这种菌根真菌菌株对这些土壤条件是有效的。这作为针对盐胁迫引起的不利条件的可行且可持续的替代方法是十分有趣的。
pct/ro/134表
- 还没有人留言评论。精彩留言会获得点赞!