卵子或卵裂期胚胎的玻璃化冷冻液及冷冻方法与流程
本发明涉及动物胚胎工程,特别是涉及一种卵子或卵裂期胚胎的玻璃化冷冻液及冷冻方法。
背景技术:
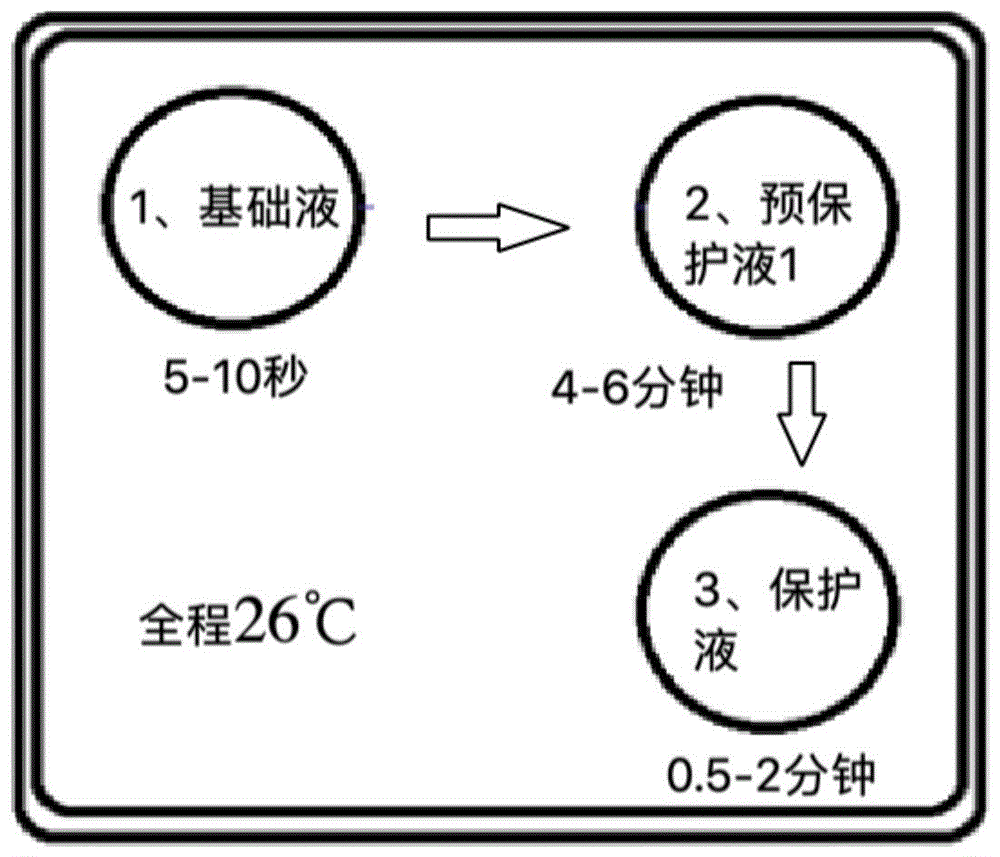
:玻璃化冷冻技术是将细胞及其保护剂溶液以足够快的降温速度,过冷到“玻璃化转变温度”而被固化成完全的玻璃态,并以这种玻璃态在低温下保存,避免了冰晶的形成,从而减少冰晶对细胞的冷冻损伤,达到冷冻保护的作用。近年来,囊胚期胚胎的玻璃化冷冻技术取得了显著的进步,冻融后存活率得到了较大的提高。囊胚期胚胎相较于卵裂期胚胎具有更好的发育潜能和耐解冻损伤性,具有更高的冻融后存活率和妊娠率。但是,囊胚由于经过了囊胚培养时期的自我筛选和淘汰,其可用胚胎率远远低于卵裂期胚胎,从而存在无胚胎可移植的风险。而卵裂期胚胎比囊胚期胚胎的可用胚胎率更高,具有更大的应用前景。因此,探索可以提高卵裂期胚胎的冻融后存活率的方法具有重要意义。然而,目前对于卵子和卵裂期胚胎的玻璃化技术的研究较少。而用于囊胚期的冷冻方法对卵子或早期卵裂阶段胚胎的冷冻效果较差,难以适用。在玻璃化冷冻技术中,选择合适的玻璃化冷冻液十分关键。在玻璃化冷冻液中最常见的冷冻保护剂是糖类(蔗糖、葡萄糖和果糖等)、二甲亚砜和醇类溶剂(乙二醇、丙二醇和丙三醇等)。但是,不同的冷冻保护剂及其组合在不同胚胎冷冻中效果差别较大。目前在卵子及卵裂期胚胎冷冻保存中广泛使用的冷冻保护剂主要包括蔗糖、体积百分比高达15%左右的dmso等。但是高添加量的dmso细胞毒性较大,对胚胎有伤害作用。且现有的卵子及卵裂期胚胎冷冻液普遍存在冷冻保护效果不佳、耗时长(预保护液需作用10~15min,保护液需作用3~5min)等缺陷。因此,仍然有待探索新的适用于卵子和卵裂期胚胎的玻璃化冷冻液,以提高冷冻保护效果,降低耗时,提高卵子和卵裂期胚胎的冻融存活率。技术实现要素:基于此,本申请的目的之一是提供一种dmso添加量低、冷冻保护效果好、耗时短的卵子或卵裂期胚胎的玻璃化冷冻液。具体技术方案如下:一种卵子或卵裂期胚胎的玻璃化冷冻液,包括基础液、预保护液和保护液;所述基础液包括m199培养液和血清替代物;所述基础液和血清替代物的体积比为90~110:15~30;所述预保护液包括m199培养液、血清替代物、乙二醇、二甲亚砜和丙二醇;所述预保护液、血清替代物、乙二醇、二甲亚砜和丙二醇的体积比为90~110:10~30:5~10:1~6:1~6。所述保护液包括m199培养液、血清替代物、乙二醇、二甲亚砜、丙二醇和海藻糖;所述保护液、血清替代物、乙二醇、二甲亚砜和丙二醇的体积比为90~110:10~30:10~20:5~10:5~10;所述海藻糖在所述保护液中摩尔浓度为0.3~1.0mol/l。本发明的另一目的是提供一种卵子或卵裂期胚胎的冷冻方法,其使用上述的玻璃化冷冻液对卵子或卵裂期胚胎进行冷冻。与现有技术相比,本发明具有以下有益效果:本发明的发明人经大量的实验研究发现,选择海藻糖、乙二醇、丙二醇以特定的比例与dmso复配作为保护液,并配合其他基础液和预保护液,可以在降低dmso添加量的基础上,提高卵子或卵裂期胚胎膜的稳定性,降低渗透损伤,提高卵子或卵裂期胚胎的存活率。同时,本发明的玻璃化冷冻液操作耗时短,可降低冷冻过程对卵子或卵裂期胚胎的伤害。附图说明图1为本发明冷冻方法的示意图;图2为小鼠卵子在预保护液中皱缩的形态。具体实施方式为了便于理解本发明,下面将参照实施例对本发明进行更全面的描述,以下给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。本实施方式提供一种卵子或卵裂期胚胎的玻璃化冷冻液,包括基础液、预保护液和保护液;所述基础液包括m199培养液和血清替代物;所述基础液和血清替代物的体积比为90~110:15~30;所述预保护液包括m199培养液、血清替代物、乙二醇、二甲亚砜和丙二醇;所述预保护液、血清替代物、乙二醇、二甲亚砜和丙二醇的体积比为90~110:10~30:5~10:1~6:1~6。所述保护液包括m199培养液、血清替代物、乙二醇、二甲亚砜、丙二醇和海藻糖;所述保护液、血清替代物、乙二醇、二甲亚砜和丙二醇的体积比为90~110:10~30:10~20:5~10:5~10;所述海藻糖在所述保护液中摩尔浓度为0.3~1.0mol/l。在其中一些实施例中,所述基础液和血清替代物的体积比为100:15~30;所述预保护液、血清替代物、乙二醇、二甲亚砜和丙二醇的体积比为100:10~30:5~10:1~6:1~6;所述保护液、血清替代物、乙二醇、二甲亚砜和丙二醇的体积比为100:10~30:10~20:5~10:5~10;所述海藻糖在所述保护液中摩尔浓度为0.4~0.8mol/l。在其中一些实施例中,所述保护液、血清替代物、乙二醇、二甲亚砜和丙二醇的体积比为100:10~30:14~16:5~10:7~10。在其中一些实施例中,所述基础液和血清替代物的体积比为100:19~21。在其中一些实施例中,所述预保护液、血清替代物、乙二醇、二甲亚砜和丙二醇的体积比为100:19~21:7~8:3.5~4:3.5~4。在其中一些实施例中,所述保护液、血清替代物、乙二醇、二甲亚砜和丙二醇的体积比为100:19~21:14~16:7~8:7~8。在其中一些实施例中,所述海藻糖在所述保护液中摩尔浓度为0.4~0.6mol/l。在其中一些实施例中,所述血清替代物为sss。在其中一些实施例中,所述m199培养液为hepes改良型199培养液。本实施方式还提供一种卵子或卵裂期胚胎的冷冻方法,使用上述的玻璃化冷冻液对卵子或卵裂期胚胎进行冷冻。在其中一些实施例中,上述冷冻方法包括以下步骤:将卵子或卵裂期胚胎依次经所述基础液洗5秒~40秒、所述预保护液作用4分钟~12分钟和所述保护液作用1分钟~3分钟。在其中一些实施例中,卵子的冷冻方法包括以下步骤:将卵子依次经所述基础液洗5秒~10秒、所述预保护液作用7分钟~9分钟和所述保护液作用1分钟~3分钟。在其中一些实施例中,卵裂期胚胎的冷冻方法包括以下步骤:将卵裂期胚胎依次经所述基础液洗5秒~10秒、所述预保护液作用4分钟~6分钟和所述保护液作用0.5分钟~2分钟。在其中一些实施例中,液体置换的步骤在超净台上操作;所述操作的温度为22~28℃,优选为26℃。在其中一些实施例中,所述卵子或卵裂期胚胎为非人哺乳动物的卵子或卵裂期胚胎。在其中一些实施例中,所述非人哺乳动物为牛、羊、兔子或小鼠。以下结合具体实施例对本发明作进一步详细的说明。下述实施例中的实验方法,如无特殊说明,均为常规实验方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规试剂商店购买得到的。以下实施例中使用的小鼠的来源:icr品系spf级别小鼠,采购于北京维通利华实验动物技术有限公司。实施例1玻璃化冷冻液的配制方法:(1)基础液的配制:取2ml的sss(serumsuostitutesupplement),用8ml的m199培养液(withhepes)溶解。(2)预保护液的配制:取2mlsss、0.75ml乙二醇、0.375ml丙二醇、0.375ml二甲亚砜,用6.5ml的m199培养液(withhepes)溶解。(3)保护液的配制:用4ml的m199培养液(含hepes,美国sigma公司)溶解1.891g海藻糖(分子量:378.3),再加入2mlsss、1.5ml乙二醇、0.75ml丙二醇、0.75ml二甲亚砜,用m199培养液(withhepes)定容至10ml。实施例2玻璃化冷冻液的配制方法:(1)基础液的配制:取2ml的sss(serumsuostitutesupplement),用8ml的m199培养液(withhepes)溶解。(2)预保护液的配制:取2mlsss、0.75ml乙二醇、0.375ml丙二醇、0.375ml二甲亚砜,用6.5ml的m199培养液(withhepes)溶解。(3)保护液的配制:用3.75ml的m199培养液(withhepes)溶解1.891g海藻糖,再加入2mlsss、1.5ml乙二醇、0.75ml丙二醇、1ml二甲亚砜,用m199培养液(withhepes)定容至10ml。实施例3玻璃化冷冻液的配制方法:(1)基础液的配制:取2ml的sss(serumsuostitutesupplement),用8ml的m199培养液(withhepes)溶解。(2)预保护液的配制:取2mlsss、0.75ml乙二醇、0.375ml丙二醇、1ml二甲亚砜,用5.875ml的m199培养液(withhepes)溶解。(3)保护液的配制:用4ml的m199培养液(withhepes)溶解1.891g海藻糖,再加入2mlsss、1.25ml乙二醇、1ml丙二醇、0.75ml二甲亚砜,用m199培养液(withhepes)定容至10ml。对比例1玻璃化冷冻液的配制方法:(1)基础液的配制:取2ml的sss(serumsuostitutesupplement),用8ml的m199培养液(withhepes)溶解。(2)预保护液的配制:取2mlsss、0.75ml乙二醇、0.375ml丙二醇、0.375ml二甲亚砜,用6.5ml的m199培养液(withhepes)溶解。(3)保护液的配制:用4ml的m199培养液(withhepes)溶解1.891g蔗糖,再加入2mlsss、1.5ml乙二醇、0.75ml丙二醇、0.75ml二甲亚砜,用m199培养液(withhepes)定容至10ml。对比例2玻璃化冷冻液的配制方法:(1)基础液的配制:取2ml的sss(serumsuostitutesupplement),用8ml的m199培养液(withhepes)溶解。(2)预保护液的配制:取2mlsss、0.75ml乙二醇、0.375ml丙二醇、0.375ml二甲亚砜,用6.5ml的m199培养液(withhepes)溶解。(3)保护液的配制:用4.75ml的m199培养液(withhepes)溶解1.891g海藻糖,再加入2mlsss、1.5ml乙二醇、0.75ml二甲亚砜,用m199培养液(withhepes)定容至10ml。效果实验:实验一卵子的玻璃化冷冻(1)通过手术获得小鼠的卵子,经过脱颗粒处理。(2)在26℃超净台上将卵子转移到基础液中洗5秒。(3)将洗过的卵子转移到预保护液中平衡作用8分钟。(4)将平衡过的卵子转移到保护液中,静置2分钟。将所得卵子装载于载体后投入液氮保存。分别用实施例和对比例得到的玻璃化冷冻液进行卵子的玻璃化冷冻,均选用mii成熟卵子,每例均玻璃化冷冻30枚鼠卵。分三次各解冻10枚,解冻后,测定卵子死亡情况;将未死亡的卵子在37℃培养箱培养一段时间后,经icsi(单精子胞浆注射)后测定是否能正常受精及发育。结果如表1所示:表1卵子存活数(枚)存活卵子受精率实施例12896.4%实施例22391.3%实施例32286.36%对比例12588%对比例21973.7%实验二2~4细胞的小鼠卵裂期胚胎的玻璃化冷冻(1)选择发育到2~4细胞评分3分以上的小鼠卵裂期胚胎。(2)在26℃超净台上转移到基础液中洗8秒。(3)将洗过的2~4细胞的小鼠卵裂期胚胎转移到预保护液中平衡作用5分钟。(4)将平衡过的2~4细胞的小鼠卵裂期胚胎转移到保护液中,静置1分钟。将所得保护液中的2~4细胞的小鼠卵裂期胚胎装载于载体后投入液氮保存。分别用实施例和对比例中的玻璃化冷冻液进行2~4细胞的小鼠卵裂期胚胎的玻璃化冷冻,每例均玻璃化冷冻40枚鼠胚。第一次解冻14枚,第二次解冻14枚,第三次解冻12枚,解冻后,测定卵裂期胚胎死亡情况;将未死亡的卵裂期胚胎在37℃培养箱培养一段时间后,测定是否能继续分裂发育。结果如表2所示:表2卵裂期胚胎存活数(枚)存活胚胎的分裂率实施例13992.3%实施例23488.2%实施例33281.3%对比例13485.3%对比例22975.9%实验三6~10细胞的小鼠卵裂期胚胎的玻璃化冷冻(1)选择发育到6~10细胞评分3分以上的的小鼠卵裂期胚胎。(2)在26℃超净台上转移到基础液中洗10秒。(3)将洗过的6~10细胞的小鼠卵裂期胚胎转移到预保护液中平衡作用5分。(4)将平衡过的6~10细胞的小鼠卵裂期胚胎转移到保护液中,静置1分钟。将所得保护液中的6~10细胞的小鼠卵裂期胚胎装载于载体后投入液氮保存。分别用实施例和对比例中的玻璃化冷冻液进行6~10细胞的小鼠卵裂期胚胎的玻璃化冷冻,每例均玻璃化冷冻35枚鼠胚。第一次各解冻15枚,第二次解冻10枚,第三次解冻10枚,解冻后,测定卵裂期胚胎死亡情况;将未死亡的卵裂期胚胎在37℃培养箱培养一段时间后,测定是否能继续分裂发育。结果如表3所示:表3由表1~3的结果可知,本发明选择海藻糖、乙二醇、丙二醇以特定的比例与dmso复配作为保护液,并配合其他基础液和预保护液,可以在降低dmso添加量的基础上,提高卵子或卵裂期胚胎膜的稳定性,降低渗透损伤,提高卵子或卵裂期胚胎的存活率,并且明显在保证冷冻效果的前提下,节约了冷冻时间。由对比例1和2可知,当将本发明保护液中的海藻糖替换成蔗糖,或者舍弃丙二醇后,卵子或卵裂期胚胎的冻融存活率以及继续受精或发育率均有不同程度的下降。由此可知,本发明的玻璃化冷冻液是在海藻糖、乙二醇、丙二醇与dmso等组分以特定的配比相互配合、共同作用下,实现了本发明的效果。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1