一种大蒜愈伤组织超低温保存的方法及超低温保存设备与流程
本发明属于农产品超低温保存
技术领域:
,尤其涉及一种大蒜愈伤组织超低温保存的方法及超低温保存设备。
背景技术:
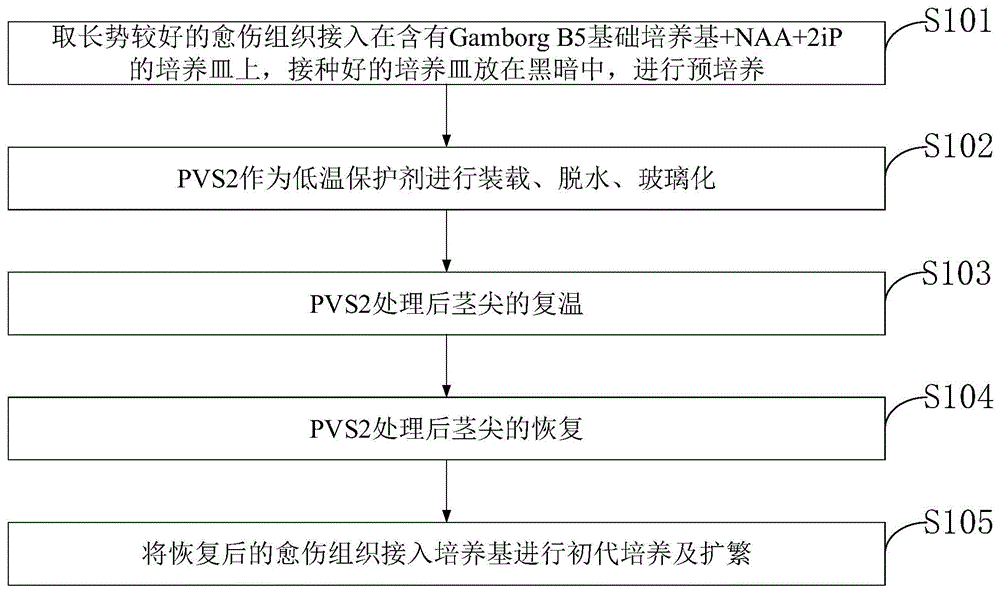
:目前,大蒜(英文名称garlic;拉丁名称alliumsativuml.),为百合科(liliaceae)葱属(allium)植物的地下鳞茎。我国是世界上最大的大蒜种植和出口国,大蒜是重要的农作物品种之一,大蒜及其制品是人民群众喜欢的传统调味食品。同时大蒜也是一种季节性非常强的农产品,新鲜的大蒜可以通过冷藏来保存,但也只能储存至第二年的新蒜上市而已,否则会失去其商业价值。我国是大蒜的出口大国,其每年带来的利润也尤为可观。因此,研究大蒜不同的优良品种,延长其保存时长,提高优质品种的产量十分重要。超低温保存技术是目前长期有效保存植物资源的唯一方法,是指在-80℃以下的超低温中保存种植资源的生物学技术,其中液氮最为常用。超低温保存一般是-196℃(液氮)的超低温环境下使被保存的活细胞的物质代谢和生长活动几乎完全停滞。这种方法能够保持生物材料的遗传稳定性,而且也不会丧失其形态发生的潜能。超低温保存技术可以保存和抢救物种,能避免物种突变的发生,是长期稳定保存植物种资源以及珍贵实验材料的重要方法。到目前为止,被用于超低温保存的植物已有100多种,超低温保存早期大多使用冻结化保存技术,主要分为快和慢两种方法,随着技术的不断成熟,已有玻璃化法、干燥冷冻法、包埋脱水法等。玻璃化法超低温保存技术是目前植物种质资源长期稳定保存的理想方法。传统的大蒜超低温保存是通过人工在显微镜下进行茎洒剥离的方法实现的,这种方法不仅需要成熟的剥离茎尖的操作技术,且在剥离过程中要在无菌条件下严格进行,不仅费时费工,且容易污染,给大蒜资源的规模化超低温保存带来较大挑战。愈伤组织是通过细胞的全能性特点,形成的组织块,不仅脱毒效果好,且容易实现大规模的繁殖,如果能够发明一种可以通过愈伤组织进行大蒜超低温保存,将为大蒜资源的安全保存提供一种新的思路和方法。通过上述分析,现有技术存在的问题及缺陷为:(1)尚未见大蒜愈伤组织的报道,无参考方法。(2)现有技术中,大蒜其他组织超低温保存后成活率不高。(3)现有技术中,大蒜的其他组织恢复生长速率较慢.解决以上问题及缺陷的难度为:(1)尚无有关大蒜愈伤组织超低温保存的方法。(2)相关研究在我国起步较晚,现有技术中资料少且不成体系。(3)不同的大蒜外植体,乃至不同的大蒜品种,适宜其离体诱导不定芽的基本培养基和激素配比均有所不同。但目前的研究中,关于大蒜离体再生体系广适性的探索涉及较少。解决以上问题及缺陷的意义为:(1)发明一种大蒜愈伤组织的超低温保存方法。(2)愈伤组织可以作为大蒜资源保存的重要载体组织,具有广阔的应用价值。(3)提高大蒜组织超低温保存效果,提高成活率。(4)建立适合大蒜资源的超低温保存体系。(5)高效安全的保存大蒜种质资源。技术实现要素:为了解决现有技术存在的问题,本发明提供了一种大蒜愈伤组织超低温保存的方法及超低温保存设备。本发明是这样实现的,一种大蒜愈伤组织超低温保存的方法,包括:s1、取长势较好的愈伤组织接入在含有gamborgb5基础培养基+naa+2ip的培养皿上,接种好的培养皿放在黑暗中,进行预培养;s2、pvs2作为低温保护剂进行装载、脱水、玻璃化;s3、pvs2处理后茎尖的复温;s4、pvs2处理后茎尖的恢复;s5、将恢复后的愈伤组织接入培养基进行初代培养及扩繁。进一步,所述步骤s1的实现过程如下:步骤s11、配置含pi和naa的gamborgb5培养皿:向蒸馏水中添加gamborgb5basalmedium(g3982)3.21g/l、2ip0.05毫克/l、naa0.01毫克/l、蔗糖30g/l、琼脂6.5克/l;步骤s12、接种:将愈伤组织接种在培养皿放在黑暗中5℃的条件下,分别进行预培养2天。所述2ip保存在零下20度冻存,要提前分装避免2ip的反复冻融。进一步,所述步骤s2的实现过程如下:步骤s21、装载:将预培养的愈伤组织转移到加载介质的培养皿中,让愈伤组织浸泡二十分钟;步骤s22、脱水:二十分钟后取出愈伤组织,用冷冻(0℃)过的pvs2玻璃化溶液替代,将茎尖置于pvs2溶液中,置于冰上十五分钟;步骤s23、玻璃化:十五分钟后,用镊子将4~5个茎尖放在无菌的箔条上(0.5*15mm)。不需要从铝箔上去除多余的pvs2,立即将箔条插入含有液氮的浅容器中。所述加载介质的培养皿为msbasalsaltmixture5(m5242)2.165g/l、甘油184.2g/l、蔗糖205.4g/l、ms-g625ml和ms-vitamins610ml,其中ms-g6和ms-vitamins6需要提前配制。所述ms-g6溶液由硫胺素0.08g/l、肌醇20g/l配制,冷冻保存。ms-vitamins6溶液由甘氨酸0.2g/l、肌醇10g/l、烟酸0.05g/l、盐酸吡哆醇0.05g/l和硫胺素0.01g/l配制,在5℃下储存。所述pvs2玻璃化溶液由甘油300g/l、乙二醇135ml、试剂级蔗糖137g/l和dmso136ml配制,需在超净工作台进行过滤。进一步,所述步骤s3的具体操作过程如下:一旦盖子受热到可以打开,立即从低温瓶中取出冰冻的箔条。将箔条浸入1.2m蔗糖+1/2ms培养基中浸泡二十分钟,十分钟后换新的溶液,一旦加热到愈伤组织脱落,立即从介质中移除箔条。二十分钟后,将组织转移到含有gamborgb5基本培养基+naa+2ip的新培养皿中,将培养皿用铝箔包起来(防止暴露在光线下),放置在生长室24小时。所述1.2m蔗糖+1/2ms培养基为msbasalmediumw/vitamins5(m5192)4.43g/l、蔗糖410.76g/l。进一步,所述步骤s4的具体操作过程如下:24小时后,将组织移入含有gamborgb5基本培养基+naa+2ip的新培养皿中,用锡纸包起来,将培养皿放置在生长室四天,然后取下箔纸,在昏暗的灯光下再放置五天,五天之后,移至全光,将组织放在培养皿中,直到其生长超过培养皿的空间,然后将其移至含有gamborg+naa+2ip的培养皿中。本发明的另一目的在于提供一种实施所述大蒜愈伤组织超低温保存方法的大蒜愈伤组织超低温保存设备。结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明提供的大蒜愈伤组织超低温保存的方法,取长势较好的愈伤组织接入含pi和naa的gamborgb5培养皿上,接种好的培养皿放在黑暗中,进行预培养;pvs2作为低温保护剂进行装载、脱水、玻璃化;pvs2处理后茎尖的复温;pvs2处理后茎尖的恢复;将恢复后的愈伤组织接入培养基进行初代培养及扩繁。本发明在含有gamborgb5基础培养基+naa+2ip的培养皿黑暗预培养时间2天,2m甘油+0.6m蔗糖+1/2ms加载介质装载时间20分钟,pvs2玻璃化溶液处理15分钟,解决了大蒜愈伤组织超低温保存后成活率低的问题。通过本发明方法,实现了大蒜愈伤组织的超低温保存;通过条件优化,有效地提高了大蒜愈伤组织超低温保存后的成活率:本发明选取的愈伤组织节省了传统茎尖超低温保存中,进行剥离茎尖的繁琐工作,具有省时省力节约成本的优势具有推广意义并有效的减少了污染率。预培养时间2天,加载介质装载时间20分钟,pvs2玻璃化溶液处理15分钟,愈伤组织成活率明显提高。本发明的方法简易,更易应用于生产,可应用于大蒜愈伤组织超低温保存。可用于大蒜种质资源的保存,有效保存种质,可有效提高种质资源的利用。结合实验或试验数据和现有技术对比得到的效果和优点:(1)本发明使用的大蒜的愈伤组织,是创造性的发明。(2)查找文献可知大蒜茎尖玻璃化法超低温保存的茎尖存活率在百分之七十到百分之八十左右,本发明存活率在百分之七十五到百分之九十左右,大大提高了大蒜超低温保存的存活率。(3)茎尖等实验材料的不易获取,须经消毒等繁琐的制备工作,消毒时间过久影响茎尖的生理状况,消毒时间不足导致材料本身污染,而愈伤材料进行超低温保存便于随时使用,因此本发明简化超低温保存步骤,减少材料污染,具有省时省力节约成本的优势,具有推广意义。附图说明为了更清楚地说明本申请实施例的技术方案,下面将对本申请实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本申请的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。图1是本发明实施例提供的大蒜愈伤组织超低温保存的方法流程图。图2是本发明实施例提供的愈伤诱导培养基正交实验分析的主效应图。图3是本发明实施例提供的传统的方法与本发明方法对比图。图中:a,传统的茎尖方法效果图;b本发明的愈伤组织途径效果图:具体实施方式为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。现有技术中,尚未有通过愈伤组织实现大蒜资源的超低温保存方法。现有技术中,大蒜鳞茎超低温保存效果差。现有技术中,大蒜品种愈伤组织超低温保存后成活率低。针对现有技术存在的问题,本发明提供了一种大蒜愈伤组织超低温保存的方法及超低温保存设备,下面结合附图对本发明作详细的描述。如图1所示,本发明实施例提供的大蒜愈伤组织超低温保存的方法包括:s101、取长势较好的愈伤组织接入在含有gamborgb5基础培养基+naa+2ip的培养皿上,接种好的培养皿放在黑暗中,进行预培养。s102、pvs2作为低温保护剂进行装载、脱水、玻璃化。s103、pvs2处理后茎尖的复温。s104、pvs2处理后茎尖的恢复。s105、将恢复后的愈伤组织接入培养基进行初代培养及扩繁。步骤s101的实现过程如下:步骤s11、配置含pi和naa的gamborgb5培养皿:向蒸馏水中添加gamborgb5basalmedium(g3982)3.21g/l、2ip0.05毫克/l、naa0.01毫克/l、蔗糖30g/l、琼脂6.5克/l。步骤s12、接种:将愈伤组织接种在培养皿放在黑暗中5℃的条件下,分别进行预培养2天。所述2ip保存在零下20度冻存,要提前分装避免2ip的反复冻融。所述步骤s102的实现过程如下:步骤s21、装载:将预培养的愈伤组织转移到加载介质的培养皿中,让愈伤组织浸泡二十分钟;步骤s22、脱水:二十分钟后取出愈伤组织,用冷冻(0℃)过的pvs2玻璃化溶液替代,将茎尖置于pvs2溶液中,置于冰上十五分钟;步骤s23、玻璃化:十五分钟后,用镊子将4~5个茎尖放在无菌的箔条上(0.5*15mm)。不需要从铝箔上去除多余的pvs2,立即将箔条插入含有液氮的浅容器中。所述加载介质的培养皿为msbasalsaltmixture5(m5242)2.165g/l、甘油184.2g/l、蔗糖205.4g/l、ms-g625ml和ms-vitamins610ml,其中ms-g6和ms-vitamins6需要提前配制。所述ms-g6溶液由硫胺素0.08g/l、肌醇20g/l配制,冷冻保存。ms-vitamins6溶液由甘氨酸0.2g/l、肌醇10g/l、烟酸0.05g/l、盐酸吡哆醇0.05g/l和硫胺素0.01g/l配制,在5℃下储存。所述pvs2玻璃化溶液由甘油300g/l、乙二醇135ml、试剂级蔗糖137g/l和dmso136ml配制,需在超净工作台进行过滤。所述步骤s103的具体操作过程如下:一旦盖子受热到可以打开,立即从低温瓶中取出冰冻的箔条。将箔条浸入1.2m蔗糖+1/2ms培养基中浸泡二十分钟,十分钟后换新的溶液,一旦加热到愈伤组织脱落,立即从介质中移除箔条。二十分钟后,将组织转移到含有gamborgb5基本培养基+naa+2ip的新培养皿中,将培养皿用铝箔包起来(防止暴露在光线下),放置在生长室24小时。所述1.2m蔗糖+1/2ms培养基为msbasalmediumw/vitamins5(m5192)4.43g/l、蔗糖410.76g/l。所述步骤s104的具体操作过程如下:24小时后,将组织移入含有gamborgb5基本培养基+naa+2ip的新培养皿中,用锡纸包起来,将培养皿放置在生长室四天,然后取下箔纸,在昏暗的灯光下再放置五天,五天之后,移至全光,将组织放在培养皿中,直到其生长到超过培养皿的空间,然后将其移至含有gamborg+naa+2ip的培养皿中。下面结合具体实施例及实验对本发明作进一步描述。实施例本发明实施例提供的大蒜愈伤组织超低温保存的方法包括:步骤s1、取长势较好的愈伤组织接入在含有gamborgb5基础培养基+naa+2ip的培养皿上,接种好的培养皿放在黑暗中,进行预培养。选取饱满无损伤的大蒜作为实验材料,配置含pi和naa的gamborgb5培养皿:向蒸馏水中添加gamborgb5basalmedium(g3982)3.21g/l、2ip0.05毫克/l、naa0.01毫克/l、蔗糖30g/l、琼脂6.5克/l,取长势较好的愈伤组织接入在含有gamborgb5基础培养基+naa+2ip的培养皿上,用封口膜封好,将接种好的培养皿放在黑暗中,进行预培养,将愈伤组织接种在培养皿放在黑暗中5℃的条件下,分别进行预培养2天。步骤s2、pvs2作为低温保护剂进行装载、脱水、玻璃化。提前配制加载介质的培养皿为msbasalsaltmixture5(m5242)2.165g/l、甘油184.2g/l、蔗糖205.4g/l、ms-g625ml和ms-vitamins610ml,其中ms-g6和ms-vitamins6。将预培养的愈伤组织转移到加载介质的培养皿中,让愈伤组织浸泡二十分钟,二十分钟后用取出愈伤组织,用冷冻(0℃)过的pvs2玻璃化溶液替代,将茎尖置于pvs2溶液中,置于冰上十五分钟;十五分钟后,用镊子将4~5个茎尖放在无菌的箔条上(0.5*15mm)。不需要从铝箔上去除多余的pvs2,立即将箔条插入含有液氮的浅容器中。步骤s3、pvs2处理后茎尖的复温。一旦盖子受热到可以打开,立即从低温瓶中取出冰冻的箔条。将箔条浸入1.2m蔗糖+1/2ms培养基中浸泡二十分钟,十分钟后换新的溶液,一旦加热到愈伤组织脱落,立即从介质中移除箔条。二十分钟后,将组织转移到含有gamborgb5基本培养基+naa+2ip的新培养皿中,将培养皿用铝箔包起来(防止暴露在光线下),放置在生长室24小时。步骤s4、pvs2处理后茎尖的恢复。24小时后,将组织头移入含有gamborgb5基本培养基+naa+2ip的新培养皿中,用锡纸包起来,将培养皿放置在生长室四天,然后取下箔纸,在昏暗的灯光下再放置五天,五天之后,移至全光,将组织放在培养皿中,直到其生长超过培养皿的空间,然后将其移至含有gamborg+naa+2ip的培养皿中。步骤s5、将恢复后的愈伤组织接入培养基进行初代培养及扩繁。愈伤诱导培养通过正交实验确定,以b5培养基为基本培养基,对预培养时间、装载时间和pvs2处理时间共3种成分进行3个水平的设计,再通过正交实验设计开展实验,统计愈伤成活率,各水平实验设置如表1所示。表1确定愈伤诱导培养基的正交实验各处理时间水平预培养时间(d)装载时间(min)pvs2处理时间(min)101010212015323020正交实验分为品种8n1279、品种t141和品种t167共3个品种进行实验,并分为ⅰ、ⅱ、ⅲ共3种不同的等级,每个品种分为9组,共27组实验数据,3个品种的实验数据如表2、表3和表4所示。表2品种8n1279愈伤诱导培养基的正交实验数据由实验数据可知,品种8n1279在预培养时间为3天,装载时间及pvs2处理时间为2分钟时,成活率为最佳;在预培养时间为1天,装载时间及pvs2处理时间为1分钟时,成活率为最差。表3品种t141愈伤诱导培养基的正交实验数据由实验数据可知,品种t141在预培养时间为3天,装载时间及pvs2处理时间为3分钟时,成活率为最佳;在预培养时间为1天,装载时间及pvs2处理时间为1分钟时,成活率为最差。表4品种t167愈伤诱导培养基的正交实验数据由实验数据可知,品种t167在预培养时间为3天,装载时间及pvs2处理时间为2分钟时,成活率为最佳;在预培养时间为2天,装载时间及pvs2处理时间为1分钟时,成活率为最差。表5愈伤诱导培养基的正交实验数据通过对表2、表3和表4的汇总,得出不同处理时间各个品种存活率的平均值,将实验数据整理如表5所示。可以得出当预培养时间为3天、装载及pvs2处理时间为3分钟时平均成活率为最佳;当预培养时间为1天、装载及pvs2处理时间为3分钟时平均成活率为最差。在本发明中,图2是本发明实施例提供的愈伤诱导培养基正交实验分析的主效应图。图3是本发明实施例提供的传统的方法与本发明方法对比图。图中:a,传统的茎尖方法效果图;b本发明的愈伤组织途径效果图。以下是传统的茎尖方法与本发明方法对比表格。以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本
技术领域:
的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1