一种植物诱导剂的制备方法与流程
本发明涉及农业生物技术技术领域,尤其涉及一种植物诱导剂的制备方法。
背景技术:
近年来,全球粮食供需平衡所决定的粮食安全日益成为共同关注的话题。人口的持续增长,加大了对粮食的需求。然而,农业用地面积的持续下降导致了粮食产量的下降。虽然产量下降的原因多种多样,但病虫害是造成全球农作物减产的重要原因。病原体感染造成的作物损失在20%到40%之间。对作物进行病害检测和预防,可以最大限度地减少作物在生长、收获和收获后加工过程中受到病原菌的危害,并最大限度地提高生产力和确保农业可持续发展。这就说明了了解植物病害和抗性对食品安全和农业的可持续性的重要性。
植物受到各种微生物的攻击后,依靠自己一系列复杂的响应系统来保护自己不受感染。天然免疫是植物抵御微生物入侵的第一道防线。内在的免疫系统帮助植物感知病原体并迅速产生防御反应,如果没有它,植物就不能生存。病原体或微生物相关分子模式(pamp/mamp)触发的植物免疫机制可以有效的防御微生物对植物细胞的攻击。这种防御是通过识别来自微生物的“诱导分子”来启动的。科学家对几种植物中存在的诱导分子和受体进行了鉴定。
例如:fls2是一种位于细胞膜上的受体样激酶,它可以被鞭毛蛋白识别进而诱导拟南芥(a.thaliana)的先天免疫反应。诱导拟南芥防御反应的受体efr能够识别原核延伸因子ef-tu。几丁质是一种常见的真菌分子,它被细胞表面受体cebip识别,从而触发拟南芥的先天免疫。细菌细胞壁成分脂多糖(lps)和肽聚糖也可以诱导植物的防御反应。
利用抗性诱导剂防治植物病害是近年来新兴起的一种方法。总的来说,除了提供符合环境法规的新型疾病控制策略外,天然诱导剂还是有助于揭示诱导抗性现象背后复杂机制的宝贵工具。植物受到的各种不利其生长发育的外部影响因素通常分为生物(昆虫食草动物和微生物病原体)和非生物(极端温度、不适当的水供应等)。植物适应这些环境压力对其生存和繁衍至关重要。在植物进化出的众多防御策略中,有些是先天性的,但大多数是对刺激的反应,因此它们具有特异性的特点。
不同诱导子的识别导致防御反应的不同子集的激活。虽然乙烯和脱落酸(aba)等也起关键作用,但中心调控激素为水杨酸(sa)和茉莉酸(ja)。对于植物来说,成功地应对一定的胁迫或同时应对一组胁迫是一项复杂的任务,反应大部分是交叉的,可以是主动的,也可以是被动的。
诱导抗性会使植物获得各种类型的系统抗性。诱导抗性主要有两个作用机制:一种是当病原体到达某些作用位点,对植物局部刺激和启动后,直接激活系统组织中防御反应。另一种诱导抗性,也是最佳特征类型是系统获得性抗性(sar),它主要依赖于水杨酸,而不像人们了解较少的依赖于茉莉酸的防御。
启动是一种机制,它是在植物暴露于生物或非生物胁迫后能够更快和/或更有力地作出反应的一种生理状态。“启动”状态与增强、更有效的激活防御反应以及增强逆境抵抗力有关。这种灵敏性与基因诱导与否和强弱相关。启动状态是由于感知能力的提高和/或防御反应诱导信号的增强,而不是由于这些防御反应的直接激活。
诱导抗性使植物能够在一定的情况下激活适当的防御系统,既可以减少资源的浪费又能有效的战胜病原菌的侵袭。然而,执行响应所需的时间可能意味着在防御响应行动之前,植物遭受了相当大的破坏。为了克服这一缺陷,植物进化出了一种感知环境信号变化时,以一种战时状态,在受到病原体攻击时能够做出快速、强烈的反应的机制。
许多天然化合物被认为是植物生长促进剂、植物激活剂或植物防御诱导剂等。它们中的很大一部分已经与植物免疫的启动有关,包括低聚糖、糖苷、酰胺、维生素、羧酸和芳香化合物。一般来说,天然化合物比大多数经过测试的合成化合物更容易被植物所接受,但是其对植物的毒性问题要引起重视。
肽聚糖是细菌所特有的成分。它是一种由n-乙酰基葡萄糖胺(glcnac)和n-乙酰胞壁酸(murnac)通过短肽交联形成的聚合物。这种结构有利于增强细菌的细胞壁。作为潜在病原体的组成部分,它不仅是哺乳动物先天免疫系统的一个极好的靶点,还能够触发植物的先天免疫反应。作为一种pamp/mamp,肽聚糖能够触发拟南芥的防御反应。
细胞质膜赖氨酸基序结构域蛋白lym1和lym3被认为是识别肽聚糖的受体,而lysm受体cerk1激酶介导的信号可以开启拟南芥先天免疫的应答。肽聚糖还可以触发烟草、番茄和水稻的先天免疫。
另一方面,革兰氏阴性细菌细胞表面的脂多糖(lps)已被证明可以激活植物和动物的先天免疫反应。据报道,细菌lps分子也会在植物中引起防御相关的反应。lps处理已被证明可诱导植物产生活性氧自由基(ros)和表达病原菌相关蛋白(pr)。
lps处理拟南芥(arabidopsisthaliana)可以激活其一氧化氮(no)合酶,其生成的no对拟南芥防御基因的激活和病原菌的抗性起重要作用。而且,据报道,lps可诱导几种植物产生系统抗性,并“增强”接种病原体之后所引起的防御反应。
摆在世界范围内的一个重要课题就是对植物病害的控制不足,限制了全世界每年的农业生产。虽然对植物病害的控制已经取得了一些进展,但仍很有必要寻找新的化合物来诱导植物对病害的抗性,从而实现对病害的更有效控制。
技术实现要素:
本发明提出了一种植物诱导剂的制备方法。
为了实现上述目的,本发明采用了如下技术方案:
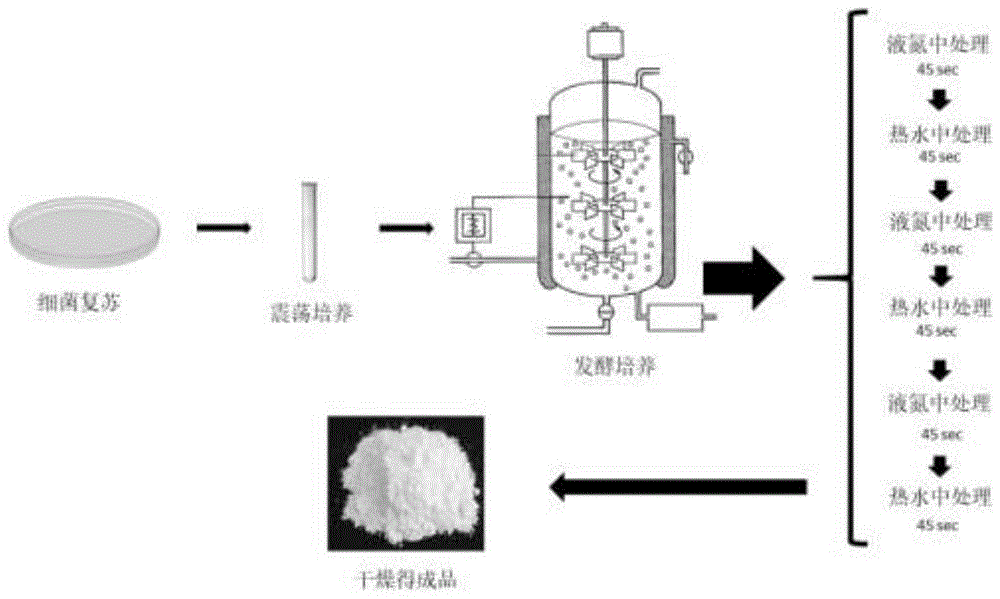
一种植物诱导剂的制备方法,包括以下步骤:
步骤一:培养短小芽孢杆菌和阿氏芽孢杆菌菌株;
步骤二:接种后发酵;
步骤三:物理法处理培养滤液,干燥后制得诱导剂。
进一步地,所述物理法为首先再液氮中处理一段时间,再在热水中处理一段时间,并循环重复2-5次。
进一步地,所述在液氮中的处理时间为40-50秒。
进一步地,所述在热水中的处理时间为40-50秒。
一种刺激植物防御力和提高抗性的诱导剂的应用,所述诱导剂至少每周一次喷施在植物上。
进一步地,喷施诱导剂的同时还施用农药。
进一步地,喷施时,所述诱导剂的浓度不大于1%。
本发明具有以下有益之处:
本发明通过应用引发植物防御途径相关基因的化合物,提供了一种有效的启动植物抗性的方法,有助于解决上述问题。利用植物体内已有的生化和分子机制进行病害防治,是目前一种非常重要和有前景的方法。植物对疾病的防御反应包括了一系列与植物先天免疫的识别、信号传递和反应相关的事件。植物的这种先天免疫可以被许多对植物重要疾病因子激活。众多被激活的植物防御机制中,包含抗菌植物毒素、防御素和致病相关蛋白。本发明首次对来自于短小芽孢杆菌和阿氏芽孢杆菌中化合物激活防御基因进行研究,这些化合物是利用微生物相关分子模式(mamp)进行植物防御的信号通路的一部分。此外,本发明还首次利用来自短小芽孢杆菌和阿氏芽孢杆菌的mamp实现了植物防御信号通路中部分防御基因的激活。
这种激活与植物对细菌、卵菌和真菌的防护有关。我们还通过rna测序对这些基因进行了鉴定,证实了这一理论。在本发明所述化合物可以是脂多糖、低聚糖、肽聚糖或次级代谢物,以及通过hplc/ms分析鉴定的其他化合物。
本发明的一个实例从短小芽孢杆菌和阿氏芽孢杆菌中提取的化合物应用于植物后,通过激活与植物免疫相关的基因来激发植物的自然防御和诱导植物对疾病的抗性。在本发明所涉及到的任何通过hplc/ms从短小芽孢杆菌和阿氏芽孢杆菌中识别出来的化合物类似物,都是从天然分子环结构的变化开始合成,来增加其活性。本发明提供了一种通过激活植物免疫相关基因来预防和治疗由细菌、卵菌和真菌引起的植物病害的方法。
本发明还首次揭露了能够有效控制植物病害所用的从短小芽孢杆菌和阿氏芽孢杆菌中提取的化合物的使用浓度和频率。在本发明的一个实例中,利用浓度在1%到10%之间的来自于短小芽孢杆菌和阿氏芽孢杆菌的化合物处理病害植株,可以较大程度的减少细菌、卵菌和真菌引起的植物病害。本发明所提出的方法可以通过定期应用来自于短小芽孢杆菌和阿氏芽孢杆菌的化合物来预防健康植物的病原菌感染。在本发明的具体实例中,来自短小芽孢杆菌和阿氏芽孢杆菌的化合物在病害植物中的应用频率为每周至少一次。来自于短小芽孢杆菌和阿氏芽孢杆菌的化合物浓度范围和应用技术因植物种类而异。当使用低用量或超低用量时,该化合物的有效浓度可显著降低。在本发明的一个实例中,利用来自短小芽孢杆菌和阿氏芽孢杆菌的化合物与农药联用的方法刺激植物的自然防御和诱导抗病。
本发明的另一目的是发现由短小芽孢杆菌和阿氏芽孢杆菌产生的一种能够激活植物自然防御和诱导抗病的天然诱导剂,该诱导剂由可激活与植物免疫途径相关的基因的化合物组成。在本发明的优选实例中,所述合成物包含来自短小芽孢杆菌和阿氏芽孢杆菌的化合物。在本发明特定的具体实例中,通过化学合成获得了来自短小芽孢杆菌和阿氏芽孢杆菌的化合物。本发明所述的来自短小芽孢杆菌和阿氏芽孢杆菌的化合物可以通过溶液、悬浮液、乳剂、粉末、颗粒、浓缩乳化物、气溶胶、浸渍颗粒、佐剂、膏体或通过包装最终形成。
在本发明中,所述化合物可以由悬浮液、溶液、乳液、粉末、颗粒、浓缩乳液、气溶胶、浸渍颗粒、佐剂、膏体或通过包装配制成。所述的配方是通过已知的方法生产的,例如,将活性成分与扩展剂、表面活性剂、乳化剂和/或分散剂以及适当的载体混合。在本发明的具体实例中,激活分子,即来自短小芽孢杆菌和阿氏芽孢杆菌化合物中的至少一种,在该组合物中的浓度为1μg。目前,植物抗病诱导是一种非常重要和有效的方法,利用植物中已经存在的生化和分子机制来进行病害控制。植物对疾病的防御反应包括了一系列与植物先天免疫的识别、信号传递和反应相关的事件。植物的这种先天免疫可以被许多对植物重要疾病因子激活。众多被激活的植物防御机制中,包含抗菌植物毒素、防御素和致病相关蛋白。在被植物激活的可能的防御机制是一些合成的抗菌化合物,如植物抗毒素、防御素和致病相关蛋白等。这些反应是由激活与水杨酸、茉莉酸/乙烯和超敏反应相关的基因介导的。本发明利用短小芽孢杆菌和阿氏芽孢杆菌的化合物处理植物后,gst1,pr1y-pdf1.2基因被激活,这些基因是水杨酸、茉莉酸/乙烯和超敏反应的标记物。因此,本发明还包括使用具有细胞壁碎片、菌体蛋白和培养滤液的化合物来用于预防或治疗植物疾病。预防或治疗上述疾病也是通过激活与水杨酸、茉莉酸/乙烯的途径和超敏反应相关的基因实现的。在另一个实例中,本发明提供了一种由细菌、卵菌和真菌引起的植物病害的预防和治疗方法。在更优选的实例中,来自短小芽孢杆菌和阿氏芽孢杆菌的化合物中的分子是通过化学合成获得的。
附图说明
图1为本发明的诱导剂的制备过程示意图;图2(a)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的2'-羟基金雀异黄素质谱图;图2(b)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的5-甲氧基水杨酸质谱图;图2(c)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的乙酰乌头碱质谱图;图2(d)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的荷包牡丹碱质谱图;图2(e)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的鹰嘴豆芽素a质谱图;图2(f)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的氟他米特质谱图;图2(g)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的京尼平甙质谱图;图2(h)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的染料木素质谱图;图2(i)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的龙胆酸质谱图;图2(j)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的银杏内酯c质谱图;图2(k)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的鸟嘌呤核苷质谱图;图2(l)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的异荭草素质谱图;图2(m)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的山奈酚-7-o-葡萄糖苷质谱图;图2(n)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的钩吻碱子质谱图;图2(o)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的珍珠梅种甙质谱图;图2(p)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的鹰爪豆碱质谱图;图3为本发明以浓度1%来自诱导剂处理拟南芥植株24小时后与疾病防御反应相关基因的表达图;图4为本发明以浓度1%来自诱导剂处理拟南芥植株48小时后与疾病防御反应相关基因的表达图;图5为本发明以浓度1%来自诱导剂处理番茄植株48小时后与疾病防御反应相关基因的表达图;图6(a)为本发明以浓度1%来自诱导剂处理拟南芥植株24小时与疾病防御反应相关基因的表达图;图6(b)为本发明以浓度1%来自诱导剂处理拟南芥植株24小时与疾病防御反应相关基因的表达图;图6(c)为本发明以浓度1%来自诱导剂处理拟南芥植株24小时与疾病防御反应相关基因的表达图;图7(a)为本发明用浓度1μg的来自诱导剂中存在的不同分子处理拟南芥植物24小时后每种测试化合物在五株植物中的平均值的标准偏差图;图7(b)为本发明用浓度1μg的来自诱导剂中存在的不同分子处理拟南芥植物24小时后每种测试化合物在五株植物中的平均值的标准偏差图;图7(c)为本发明用浓度1μg的来自诱导剂中存在的不同分子处理拟南芥植物24小时后每种测试化合物在五株植物中的平均值的标准偏差图;图8为本发明来自诱导剂对减少拟南芥病害的作用实验时每处理10个植物的平均值的标准偏差图;图9为本发明来自诱导剂对减少烟草病害的作用实验时每处理10个植物的平均值的标准偏差图;图10为本发明来自诱导剂对减少番茄病害的作用实验时每处理10个植物的平均值的标准偏差图;图11为本发明来自诱导剂应用频率对减少拟南芥病害的影响实验时每棵植物每次测试10片叶子的平均值的标准差图;图12为本发明来自诱导剂对拟南芥病害的保护作用实验时每种处理10个植株的平均值的标准差图;图13为本发明来自诱导剂对接种不同疾病的拟南芥突变体的影响实验时每处理10个植物的平均值的标准偏差图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
在本发明的描述中,需要理解的是,术语“上”、“下”、“前”、“后”、“左”、“右”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
实施例1:
一种植物诱导剂的制备方法,包括以下步骤:
步骤一:将保存在甘油里的细菌复苏,在药瓶中37℃,转速为100rpm的黑暗条件下震荡1天,培养培养短小芽孢杆菌和阿氏芽孢杆菌菌株;
步骤二:将培养物接种在发酵罐中,并在37℃下发酵48小时;
步骤三:物理法处理培养滤液,培养滤液采用物理法处理,分别在液氮中处理45秒,在热水中处理45秒,重复三次;干燥后制得诱导剂。
实施例2:
一种植物诱导剂的制备方法,包括以下步骤:
步骤一:将保存在甘油里的细菌复苏,在药瓶中37℃,转速为100rpm的黑暗条件下震荡1天,培养培养短小芽孢杆菌和阿氏芽孢杆菌菌株;
步骤二:将培养物接种在发酵罐中,并在37℃下发酵48小时;
步骤三:物理法处理培养滤液,培养滤液采用物理法处理,分别在液氮中处理40秒,在热水中处理50秒,重复四次;干燥后制得诱导剂。
实施例3:
一种植物诱导剂的制备方法,包括以下步骤:
步骤一:将保存在甘油里的细菌复苏,在药瓶中37℃,转速为100rpm的黑暗条件下震荡1天,培养培养短小芽孢杆菌和阿氏芽孢杆菌菌株;
步骤二:将培养物接种在发酵罐中,并在37℃下发酵48小时;
步骤三:物理法处理培养滤液,培养滤液采用物理法处理,分别在液氮中处理50秒,在热水中处理40秒,重复五次;干燥后制得诱导剂。
实施例4:
利用液相色谱-质谱联用技术(hplc/ms联用技术)对短小芽孢杆菌和阿氏芽孢杆菌的化合物进行分子鉴定。
样品粉末溶于1ml甲醇-水(1:1)水溶液中,加入3倍体积的乙酸乙酯萃取,然后真空干燥乙酸乙酯相,乙酸乙酯相干燥后的残渣用甲醇:水(1:1)溶解。两种样品均取20μl注入到hplcrp-c18柱中,进行hplc分析。hplc/ms条件:流动相:甲醇:水(7:3);检测波长:254nm。检测器:飞行时间和离子源:ei。根据m/z值,利用massbanknorman方法对短小芽孢杆菌和阿氏芽孢杆菌发酵产生的不同化合物进行了鉴定。采用高效液相色谱-质谱联用技术,对短小芽孢杆菌和阿氏芽孢杆菌产生的的不同化合物进行了生物化学表征和鉴定。它们中的大多数是在这些细菌中首次鉴定的(参照图2),这些物质就是化合物中存在的活性分子。
图2(a)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的2'-羟基金雀异黄素质谱图;
图2(a)的纵坐标为esi质谱扫描(2.743min)frag=120.0vs3a.dsubtrac,横坐标为数量:质荷比(m/z)。
图2(b)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的5-甲氧基水杨酸质谱图;
图2(b)的纵坐标为esi质谱扫描(3.871min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(c)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的乙酰乌头碱质谱图;图2(c)的纵坐标为esi质谱扫描(5.343min)frag=120.0vs3a.dsubtrac,横坐标为数量:质荷比(m/z)。
图2(d)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的荷包牡丹碱质谱图;图2(d)的纵坐标为esi质谱扫描(16.284min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(e)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的鹰嘴豆芽素a质谱图;图2(e)的纵坐标为esi质谱扫描(11.416min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(f)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的氟他米特质谱图;图2(f)的纵坐标为esi质谱扫描(5.852min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(g)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的京尼平甙质谱图;图2(g)的纵坐标为esi质谱扫描(2.711min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(h)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的染料木素质谱图;图2(h)的纵坐标为esi质谱扫描(5.355min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(i)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的龙胆酸质谱图;图2(i)的纵坐标为esi质谱扫描(4.702min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(j)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的银杏内酯c质谱图;图2(j)的纵坐标为esi质谱扫描(3.010min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(k)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的鸟嘌呤核苷质谱图;图2(k)的纵坐标为esi质谱扫描(7.545min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(l)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的异荭草素质谱图;图2(l)的纵坐标为esi质谱扫描(3.121min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(m)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的山奈酚-7-o-葡萄糖苷质谱图;图2(m)的纵坐标为esi质谱扫描(7.511min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(n)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的钩吻碱子质谱图;图2(n)的纵坐标为esi质谱扫描(5.852min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(o)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的珍珠梅种甙质谱图;图2(o)的纵坐标为esi质谱扫描(18.463min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
图2(p)为本发明的诱导剂的利用液相色谱-质谱联用技术得出的鹰爪豆碱质谱图;图2(p)的纵坐标为esi质谱扫描(3.020min)frag=120.0vs3a.dsubtract,横坐标为数量:质荷比(m/z)。
实施例5:
拟南芥、烟草和番茄防御基因经过短小芽孢杆菌和阿氏芽孢杆菌化合物处理后被激活
拟南芥:用短小芽孢杆菌和阿氏芽孢杆菌化合物对植物进行处理。在喷施该化合物24小时后,收集10株植物的叶片。按照rneasy试剂盒(qiagen,valencia,calif.)说明书(包括dnase处理)从叶子中提取总rna。cdnas是由寡核苷酸-dt引物和按照反转录试剂盒(invitrogen,carlsbad,calif.)说明书合成的。实时定量pcr使用rotorgene3000pcr仪和quantitectsybrgreenpcr试剂盒(qiagen)进行。与植物防御相关基因的引物序列如表1所示。real-timepcr的反应条件为:预变性温度为95℃,15min;然后95℃,15s;退火温度为60℃,30s;72℃,30s,延伸;40个循环。用graphpadprism(lajolla,ca,usa)软件对实验结果进行单因素方差分析并进行tukey多重比较,p<0.001,确定平均值之间的显著性差异。每个样本有5个重复,实验重复两次。
烟草:用短小芽孢杆菌和阿氏芽孢杆菌的化合物对烟草进行处理。在喷施24小时后收集10株植物的叶片。rna分离、cdna制备和qpcr条件与上述方案相似。
番茄:用短小芽孢杆菌和阿氏芽孢杆菌的化合物对番茄进行处理。在喷施24小时后收集10株植物的叶片。rna分离、cdna产生和qpcr条件与上述方案相似。
图3显示的是拟南芥经过短小芽孢杆菌和阿氏芽孢杆菌的化合物处理后基因被激活的分析。pdf1.2基因表达量与其他基因相比有显著性差异。该基因表达与茉莉酸途径有关。在烟草中,所有基因均被诱导,其中葡聚糖酶基因的表达量高于其他基因(图4)。同时,番茄中也出现了相似的反应,pal基因表达量较高(图5)。
图3以浓度1%来自短小芽孢杆菌和阿氏芽孢杆菌的化合物处理拟南芥植株24小时后,与疾病防御反应相关基因的表达。条形表示均值的标准差。每个处理使用10个植株。
图4以浓度1%来自短小芽孢杆菌和阿氏芽孢杆菌的化合物处理烟草植株48小时后,与疾病防御反应相关基因的表达。条形表示均值的标准差。每个处理使用10个植株。
图5以浓度1%来自短小芽孢杆菌和阿氏芽孢杆菌的化合物处理番茄植株48小时后,与疾病防御反应相关基因的表达。条形表示均值的标准差。每个处理使用10个植株。
实验中使用的引物列表:
实施例6:
不同浓度短小芽孢杆菌和阿氏芽孢杆菌化合物处理的拟南芥植株防御反应
本实验的目的是评估诱导防御基因高表达所需的最低浓度。分别用浓度为0.1、1、5和10%的短小芽孢杆菌和阿氏芽孢杆菌化合物对植物进行处理。喷施不同浓度化合物24小时后,分别采集10株的叶片。使用rneasy试剂盒(qiagen,valencia,calif.),根据说明书(包括dnase处理)从叶片中提取总rna。cdnas是按照反转录试剂盒superscriptiii(invitrogen,carlsbad,calif.)合成的。实时定量pcr使用rotorgene3000pcr仪和定量sybrgreenpcr试剂盒(qiagen)进行操作。与植物防御相关基因的引物序列如表1所示。实时定量pcr的反应条件为:95℃变性15min,95℃反应15s,60℃反应30s,72℃延伸30s,重复40个循环。用graphpadprism(lajolla,ca,usa)软件对实验结果进行单因素方差分析并进行tukey多重比较,p<0.001,确定平均值之间的显著性差异。每个样本有5个重复。实验重复两次。
从图6可以看出,1%浓度的短小芽孢杆菌和阿氏芽孢杆菌化合物溶液处理条件下,基因的表达量较高。在1%的浓度下,所有被评价的基因都有高表达。接下来的实验继续使用1%浓度进行处理。
图6以不同浓度的来自短小芽孢杆菌和阿氏芽孢杆菌的化合物处理拟南芥植株24小时后,与疾病防御反应相关基因的表达。条形表示均值的标准差。每个处理使用10个植株。参与植物免疫的基因:图6(a)超敏反应(gst1:谷胱甘肽s转移酶);图6(b)水杨酸(pr1:发病相关蛋白);图6(c)茉莉酸/乙烯(pdf1.2:防御素)。
实施例7:
使用短小芽孢杆菌和阿氏芽孢杆菌不同成分处理拟南芥,评估其防御反应相关基因的表达情况
本实验的目的是了解短小芽孢杆菌和阿氏芽孢杆菌化合物中不同成分在诱导防御基因高表达中的作用。采用每个成分1μg浓度的溶液处理植物,喷施24小时后采集10株不同处理植株的叶片。使用rneasy试剂盒(qiagen,valencia,calif.),根据产品说明书(包括dnase处理)从叶子中提取总rna。cdnas是按照反转录试剂盒superscriptiii(invitrogen,carlsbad,calif.)合成的。实时定量pcr使用rotorgene3000pcr仪和定量sybrgreenpcr试剂盒(qiagen)进行操作。与植物防御相关基因的引物序列如表1所示。实时定量pcr的反应条件为:95℃变性15min,95℃变性15s,60℃退火30s,72℃延伸30s,40个循环。用graphpadprism(lajolla,ca,usa)软件对实验结果进行单因素方差分析并进行tukey多重比较,p<0.001,确定平均值之间的显著性差异。每个样本有5个重复。实验重复两次。
不同成分在植物防御基因的激活中起着重要的作用。而龙胆草酸、高金雀花碱和高金雀花苷在所有被测基因中均产生了较高的表达值。这些基因在防御基因表达中可能起着重要的作用。这是第一次发现这些类型的基因参与植物防御基因的激活(图7)。
图7用浓度1μg的来自短小芽孢杆菌和阿氏芽孢杆菌的化合物中存在的不同分子处理拟南芥植物24小时后,与疾病防御反应相关的基因的表达。条形图代表每种测试化合物在五株植物中的平均值的标准偏差。参与植物免疫的基因:图7(a)超敏反应(gst1:谷胱甘肽s转移酶);纵坐标为gst相对表达量;图7(b)水杨酸(pr1:发病相关蛋白);纵坐标为pr1相对表达量;图7(c)茉莉酸/乙烯(pdf1.2:防御素)。纵坐标为pdf1.2相对表达量。横坐标从左到右依次为2'-羟基金雀异黄素、5-甲氧基水杨酸、乙酰乌头碱、荷包牡丹碱、鹰嘴豆芽素a、氟他米特、京尼平甙、染料木素、龙胆酸、银杏内酯c、鸟嘌呤核苷、异荭草素、山奈酚、钩吻碱子、珍珠梅种甙、鹰爪豆碱、混合物、对照组。
实施例8:
评价短小芽孢杆菌和阿氏芽孢杆菌的化合物处理拟南芥、烟草和番茄等植物病害的应用效果。
为了比较化合物对不同植物病害防治效果,选取灰霉病菌、丁香假单胞菌和透明小孢子菌三种植物病原菌预先接种的拟南芥、烟草和番茄植物上,24小时后用1%浓度的该化合物处理植株,每24小时喷洒一次,连续喷洒一周。用水处理植物作为对照。以拟南芥感染灰霉病菌为例,测量病变直径。每组处理包含10株。
拟南芥-灰霉病菌:灰霉病菌在合成培养基上分离培养,并对4~5周龄的拟南芥叶片进行侵染试验。每片叶子接种浓度为5×105cfu/ml的灰霉病菌5μl。植物在高湿度环境下培养直至进行病害检测。
拟南芥-丁香假单胞菌:丁香假单胞菌在含有50μg/ml利福平的king’sb培养基上28℃培养过夜。将细菌收集、清洗并用无菌水稀释至所需的浓度。用无针注射器以5×105cfu/ml浓度的丁香假单胞菌对4周龄植株叶片进行侵染。用70%乙醇表面灭菌法对6片叶片(3次重复)进行灭菌,进行细菌计数。
拟南芥-透明小孢子菌:拟南芥感染透明小孢子菌时,用5×104cfu/ml的孢子悬浮液喷雾接种至拟南芥叶片上。在一个16℃的生长箱中,在10小时光照条件下,用透明的盖子覆盖植物以保持高湿度(90-100%)。为了评估分生孢子的产生,将植物收集在1毫升水中。涡旋混合后,用血球计测定分生孢子的量。
烟草-灰霉病菌:分离的灰霉病菌在合成培养基上培养,用于5周龄的烟草叶片进行侵染试验。每片叶子接种浓度为5×105cfu/ml的灰霉病菌5μl。植物在高湿度环境下培养直至进行病害检测。
番茄-灰霉病菌:分离的灰霉病菌在合成培养基上培养,用于4-5周龄的番茄叶片进行侵染试验。每片叶子接种浓度为5×105cfu/ml的灰霉病菌5μl。植物在高湿度环境下培养直至进行病害检测。
试验结果显示拟南芥对真菌、细菌和卵菌引起的不同病害防控效果较好(图8)。另外,从图9和图10可以看出,短小芽孢杆菌和阿氏芽孢杆菌的化合物对烟草和番茄植株病害的控制水平较高。本发明有助于解决上述公开的关于激发天然防御和诱导植物抗病有效化合物的问题。
图8为来自短小芽孢杆菌和阿氏芽孢杆菌的化合物对减少拟南芥病害的作用。图8(a)拟南芥(at)-灰霉病(bc)相互作用。图8(a)的纵坐标为病变尺寸;图8(b)拟南芥(at)-丁香假单胞菌(ps)相互作用。图8(a)的纵坐标为数量/cm2;图8(c)拟南芥(at)-透明孔孢拟南芥(ha)相互作用。条形图表示每处理10个植物的平均值的标准偏差。图9来自短小芽孢杆菌和阿氏芽孢杆菌的化合物对减少烟草病害的作用。烟草(nt)-灰霉病(bc)相互作用。条形图表示每处理10个植物的平均值的标准偏差;图9的纵坐标病变尺寸(mm)。
图10来自短小芽孢杆菌和阿氏芽孢杆菌的化合物对减少番茄病害的作用。番茄(对)-灰霉病菌(bc)相互作用。条形图表示每处理10个植物的平均值的标准偏差。图10的纵坐标病变尺寸(mm)。
实施例9:
测定短小芽孢杆菌和阿氏芽孢杆菌的化合物在抗病中的应用频率。
本试验的目的是确定短小芽孢杆菌和阿氏芽孢杆菌化合物的喷施频率对控制病株病害的影响。每个处理10个植物,使用频率分别为12、24、48、72、96、120和144小时,浓度为1%,1周后进行病原菌水平测定。该分离的灰霉病菌培养于合成培养基上,用于4~5周龄拟南芥叶片的感染检测。每片叶子接种浓度为5×105cfu/ml的灰霉病菌5μl。植物在高湿度环境下培养直至进行病害检测。用水处理植物作为对照进行研究。以植物感染灰霉病菌为例,测量病变直径。
从图11可以看出,化合物使用频率为12~96小时时可以得到有效的控制病原菌。增加频率超过96小时,影响病原菌的控制。
图11(a)和图11(b)来自短小芽孢杆菌和阿氏芽孢杆菌的化合物的应用频率对减少拟南芥病害的影响。拟南芥-灰霉病相互作用。曲线上的条形表示每棵植物每次测试10片叶子的平均值的标准差。图11(a)和图11(b)的纵坐标为病变尺寸(mm)。
实施例10:
短小芽孢杆菌和阿氏芽孢杆菌化合物对拟南芥病害保护作用的测定。
本试验旨在研究短小芽孢杆菌和阿氏芽孢杆菌化合物对拟南芥病害的保护作用。处理组的10个植株喷施了该化合物,其他10个植株没有喷洒任何东西。喷洒浓度为1%,72小时后进行病原菌水平测定。分离的灰霉病菌培养于合成培养基上,用于4~5周龄拟南芥叶片的感染检测。每片叶子接种浓度为5×105cfu/ml的灰霉病菌5μl。植物在高湿度环境下培养直至进行病害检测。以植物感染灰霉病菌为例,测量病变直径。
如图12(a)和图12(b)所示,未染病植物施用该化合物可以保护其不受病原菌感染,而没有使用这些化合物的植物会增加疾病的症状,这是另一个令人惊讶和意想不到的结果,可以使用这种方法来保护植物免受这种重要病原体的侵害。图12来自短小芽孢杆菌和阿氏芽孢杆菌的化合物对拟南芥病害的保护作用。拟南芥-灰霉病相互作用。每48小时涂抹一次。曲线上的条形表示每种处理10个植株的平均值的标准差。图12(a)和图12(b)的纵坐标为病变尺寸(mm)。
实施例11:
短小芽孢杆菌和阿氏芽孢杆菌的化合物对接种了灰霉病菌的拟南芥突变体的功能评价。
本试验测定了短小芽孢杆菌和阿氏芽孢杆菌的化合物对不同拟南芥突变体的防御反应。处理组的10个突变体植株喷施了该化合物,其他10个突变体植株没有喷洒任何东西。喷洒浓度为1%,72小时后进行病原菌水平测定。该分离的灰霉病菌培养于合成培养基上,用于4~5周龄拟南芥叶片的感染检测。每片叶子接种浓度为5×105孢子/ml的灰霉病菌5μl。植物在高湿度环境下培养直至进行病害检测。以植物感染灰霉病菌为例,测量病变直径。
图13(a)和图13(b)显示了不同拟南芥突变体的应用效果。结果表明,当化合物作用到拟南芥植株时,bak1基因破坏了拟南芥的防御反应,这表明该基因是防御基因表达的关键因素。图13来自短小芽孢杆菌和阿氏芽孢杆菌的化合物对接种不同疾病的拟南芥突变体的影响。拟南芥-灰霉病相互作用。条形图表示每处理10个植物的平均值的标准偏差。图13(a)和图13(b)的纵坐标为病变尺寸(mm)。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:奥兰多·鲍里斯·伊达尔戈;徐洪利;高祥友
- 技术所有人:山东元泰生物工程有限公司
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、李老师:1. 木质生物质转化利用 2. 绿色包装材料
- 2、刘老师:1. 木质生物质化学及材料 2. 纸基功能材料
- 3、温老师:1. 纤维素纳米纤维材料的制备、改性及应用 2. 造纸法再造烟叶、新型烟草开发 3.生物质资源基油田助剂(封堵、驱油和钻井) 4. 改性植物纤维开发
- 4、张老师:1.合成生物学 2. 微生物代谢工程
- 5、李老师:1.水平基因转移的分子机制及应用研究 2.植物细胞工厂构建
- 如您是高校老师,可以点此联系我们加入专家库。
- 还没有人留言评论。精彩留言会获得点赞!