一种圆锥绣球的离体芽培养方法与流程
本发明涉及植物培养技术,特别涉及一种圆锥绣球的离体芽培养方法。
背景技术:
圆锥绣球(hydrangeapaniculatasieb.etzucc)是虎耳草科绣球属植物,落叶灌木。枝暗红褐色或灰褐色。叶纸质,2-3片对生或轮生,卵形或椭圆形,叶缘有细锯齿且叶背具毛。圆锥绣球花大且美丽,花形奇特,长达30-40cm,花期7-10月,花期长,颜色可人。原产于日本及中国四川一带。从18世纪引入欧洲以来被广泛应用和研究,是一种高档花卉,但在国内还未普及。可种植于庭院中做花篱、花镜,也可将花球剪下,瓶插室内,具极高观赏价值。不仅如此,经相关研究表明圆锥绣球提取物还有一定的药用价值。圆锥绣球种子极微小,存在复杂休眠机制,由于用种子繁殖难度较大,大多采用扦插和压条等传统的繁殖方式,但繁殖系数不高。而组培技术是利用少量的外植体在人工配制的培养基上,给予适当培养条件从而获得大批优质苗的过程。
对于绣球离体培养方面的研究主要有:陆乙卜等(2015)报道了圆锥绣球种子离体萌发的培养条件,试验材料为野生圆锥绣球的种子,种子繁殖的苗木为实生苗,离体芽培养得到的是无性繁殖苗,所以组培方法不同。李奕萱等(2017)报道了大花木绣球组织培养体系,大花木绣球虽名为绣球,实则为忍冬科荚迷属植物,与圆锥绣球为不同科的植物;蒋梦烟(2017)报道了绣球品种‘蓝尼康’快繁技术研究,以茎尖为外植体,适宜的腋芽诱导培养基为ms+6-ba1.0mg/l,出芽率为92.5%,平均出芽个数为3.3个。适宜的生根培养基为ms+iba1.0mg/l,平均生根时间为6.7d,生根长度为2.0cm。而‘蓝尼康’为大花绣球,在分类学上大花绣球与圆锥绣球为不同种,无论植株的表型特征还是生长特性、抗逆性等方面差异均较大。
关于圆锥绣球‘粉色精灵’的离体芽培养技术研究目前未见相关报道。
技术实现要素:
发明目的:本发明目的是提供一种灭菌效果好、腋芽诱导率高、繁殖系数高、生根率高的圆锥绣球的离体芽培养方法。
技术方案:本发明提供一种圆锥绣球的离体芽培养方法,包括如下步骤:
(1)外植体的采集:于4-6月份,选取幼嫩带芽茎段作外植体,进行修剪,保留顶芽和腋芽;
(2)外植体消毒灭菌:外植体分别在洗衣粉中浸泡、流水下冲洗、多菌灵和链霉素混合液中浸泡、无菌水冲洗,后进行表面消毒:75%酒精浸泡、无菌水冲洗、hgcl2溶液浸泡、无菌水冲洗;
(3)启动培养:将经过消毒灭菌的外植体两端切口处做修剪,剪成带芽茎段,直立式接种于启动培养基上;
(4)增殖培养:将经过启动培养的组培苗,剪成带芽茎段,减掉可接触到培养基的叶片,垂直接种于增殖培养基中;
(5)生根培养:增殖培养后,将组培苗基部进行修剪,转入生根培养基进行根的诱导。
进一步地,所述步骤(1)中的外植体取自粉色精灵品种。
进一步地,所述步骤(1)中的外植体为当年生幼嫩内膛枝。
进一步地,所述步骤(2)外植体消毒灭菌:将外植体在洗衣粉中浸泡15min,流水下冲1.5-2h,2g/l多菌灵和0.6g/l链霉素浸泡8min,用无菌水冲净;再进行表面消毒:75%酒精浸泡1min,无菌水冲1-2次,0.1%hgcl2浸泡5min,无菌水冲洗3-5次。灭菌效果最好,褐化率为0%,污染率为5%。
进一步地,
所述步骤(3)的启动培养基的配方为:ms+6-ba0.5mg/l+naa0.1-0.2mg/l+琼脂6.8g/l+蔗糖30g/l,ph值为5.8。萌芽率可达100%。
进一步地,所述步骤(4)的增殖培养基的配方为:ms+6-ba1.0-1.5mg/l+naa0.1-0.15mg/l+琼脂6.8g/l+蔗糖30g/l,ph值为5.8。增殖系数最高可达7,且苗生长健壮。
进一步地,
所述步骤(5)生根培养基为:1/2ms+6-ba0.05mg/l+iba0.1mg/l+naa0.1mg/l+琼脂6.8g/l+蔗糖20g/l,ph值为5.8。
有益效果:本发明的圆锥绣球‘粉色精灵’的离体芽培养技术具有褐化率低,污染率低,灭菌效果好的特点:褐化率可达0%,污染率可低至5%。启动效果好:萌芽诱导率达100%,增殖阶段繁殖率高:增殖系数达7,生根苗健壮:生根率达100%,平均根量达22条,平均根长3.10cm。
附图说明
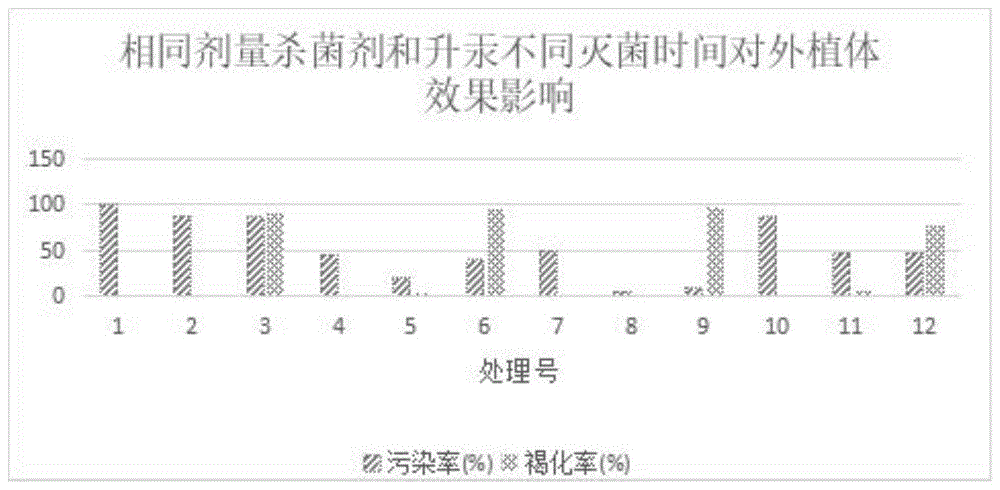
图1为相同剂量杀菌剂和升汞不同处理时间对外植体消毒效果柱状图;
图2为启动培养过程图,其中a图为接种、b图为芽诱导、c图为培养后期状况;
图3为增殖培养过程图,其中a图为健壮苗、b图为高增殖系数图;
图4为生根培养过程图,其中a图为前期、b图为后期。
具体实施方式
1.材料:圆锥绣球品种之一‘粉色精灵’,选择当年生幼嫩茎段的顶芽和腋芽。
2.方法与步骤:
2.1外植体采集:时间选择在4-6月份,天气晴朗湿度适宜条件下,选择品种为‘粉色精灵’。选择生长健壮、无病虫害和腋芽饱满的春梢枝段为材料。采集外植体时最好采取当年生幼嫩內膛枝,这样避免对植株造成不必要的损失。采集完后立即把剪口部分放进装水的容器中,防止失水失活,之后应及时进行处理、接种。
2.2材料预处理:将采集来的‘粉色精灵’枝段进行修整,去掉叶片留些叶柄,剪切成2cm左右小段,每段至少保留1-2个腋芽。事先准备好干净的烧杯,然后将剪好的小段放在洗衣粉中浸泡15min,流水下冲洗1.5-2h,2g/l多菌灵和0.6g/l链霉素浸泡8min左右,之后用无菌水冲净。
2.3材料表面灭菌:对材料进行预处理之后,将茎段放入超净工作台中。75%酒精处理1min左右,无菌水冲洗1-2次,0.1%hgcl2处理5min左右,无菌水冲洗3-5次。处理时应不断摇晃无菌瓶,使灭菌更加彻底。试验采用双因素完全随机组合试验设计,试验因素分别为:杀菌剂2g/l多菌灵和0.6g/l链霉素混合溶液的处理时间(0、5、8、12min),hgcl2的处理时间(3、5、10min),ph值调整为5.8,共12个处理,每个处理20瓶培养基,每瓶接2个外植体,重复4次。
2.4培养条件:培养室中培养温度为(25±2)℃,室内相对湿度70-80%,光照强度保持在2000-3000lx,培养时间控制在每天12h。
2.5启动培养:用酒精擦拭双手进行灭菌,将经过表面灭菌处理的茎段两端切口处稍做修剪,修剪成1.5cm左右的带芽茎段,垂直接种到培养基,接种深度以插到培养基中部为宜,不宜插入过深。基本培养基选用ms培养基,激素种类和浓度采用双因素完全随机组合试验设计,6-ba(0、0.5、1.0、2.0mg/l)和naa(0、0.15、0.2、0.5mg/l),ph值调整为5.8,浓度搭配16个处理,每个处理15瓶,每瓶接种2个外植体,重复4次。
2.6增殖培养:将经过启动培养25d生长的组培苗,截取成1.5cm左右的带芽茎段,稍作修剪,将茎段下部分有可能接触到培养基的部分减掉,垂直接种于增殖培养基中。培养基选用ms基本培养基,并采用双因素完全随机试验,加入不同浓度的6-ba(1.0、1.5、2.0mg/l)和naa(0.1、0.15、0.5mg/l),ph值调整为5.8,总共9个处理,每个处理20瓶,每瓶接种2个外植体,重复3次。
2.7生根培养:增殖培养20d后,将较健壮的组培苗取出,转入到生根培养基中进行组培最后一步根的诱导。培养基选用1/2ms基本培养基,采用三因素试验设计,6-ba(0、0.05、0.1mg/l),iba(0、0.1、0.2mg/l),naa(0.05、0.1、0.2mg/l),ph值调整为5.8,共5个处理,每个处理10瓶,每瓶接种2个外植体,重复3次。
2.8数据记录及分析:对灭菌、启动培养、增殖培养、生根培养四个阶段的生长情况进行记录,并对数据进行处理。
2.8.1相同剂量杀菌剂和升汞不同处理时间对外植体灭菌效果影响:接种25d左右后观察记录污染率和褐化率(见表1)。
表1相同剂量杀菌剂和升汞不同处理时间对外植体灭菌效果影响表
使用excel对上述数据进行分析,见图1。
由图1可见当处理号8时,污染率和褐化率都是最低,分别为5%和0%,此时的杀菌剂混合溶液灭菌时间为8min,升汞灭菌时间为5min。
2.8.2不同浓度激素配比对腋芽诱导影响:25d左右后记录生长状况和计算腋芽萌发率(见表2)。
表2不同浓度生长激素配比对腋芽诱导影响表
使用spss25.0对上述数据进行分析,结果见表3。
表3不同浓度生长激素配比对腋芽诱导影响方差分析表
对上述结果进行多重比较,结果见表4。多重比较结果得出:6-ba浓度对腋芽诱导影响极显著,naa浓度对腋芽诱导显著。在不同的激素配比的方差分析和多重比较结果中得出,在比较萌芽率的各处理间差异性时,当6-ba浓度为0.5mg/l效果最好,naa0.5mg/l时效果最差,而naa浓度在0.1mg/l-0.2mg/l之间差异不显著,因此,适宜腋芽诱导的启动培养基为ms+6-ba0.5mg/l+naa0.1-0.2mg/l,萌芽率最高可达100%。
表46-ba与naa对腋芽诱导效果的多重比较表
2.8.3不同浓度激素配比对增殖效果影响:20d左右后记录生长状况和计算增殖系数(见表5)。
表5不同浓度生长激素配比对增殖效果影响表
使用spss25.0对上述数据进行分析,结果见表6。
表6不同浓度生长激素配比对增殖效果影响方差分析表
对上述结果进行多重比较(见表7)得出:6-ba浓度对增殖影响显著,naa浓度对增殖影响较显著。在不同的激素配比中可以发现,在比较增殖系数的各处理间差异性时可以发现:当6-ba浓度为1.0-1.5mg/l,naa为0.1-0.15mg/l时效果最好,增殖系数最高为7。当naa浓度为0.5mg/l时,增殖系数低,愈伤组织膨大,说明该浓度不利于芽的增殖。
表76-ba与naa对增殖的影响的多重比较表
2.8.4不同浓度激素配比对生根效果影响:30d后统计和计算生根率,记录根数和根长(见表8)。
表8不同浓度生长激素配比对生根效果影响表
由表8可得:6-ba对叶片健康状况有影响,当浓度为0mg/l时,叶片极其枯黄。iba对生根长度有影响,当浓度较低时,根长较短。naa对生根率以及生根长度均有影响,当浓度较低,生根不明显,浓度较高时,愈伤组织膨大,根系粗壮,但萌芽极差。
综上所述:洗衣粉中浸泡15min,流水冲洗1.5-2h,2g/l多菌灵和0.6g/l链霉素浸泡8min左右,用无菌水冲净,将茎段放入超净工作台进行表面消毒,75%酒精浸泡1min左右,无菌水冲1-2次,0.1%升汞浸泡5min左右,无菌水冲洗3-5次,灭菌效果最好,褐化率为0%,污染率为5%。启动培养基配方为:ms+6-ba0.5mg/l+naa0.1-0.2mg/l+琼脂6.8g/l+蔗糖30g/l,萌芽率达100%。最适增殖培养配方为:ms+6-ba1.0-1.5mg/l+naa0.1-0.15mg/l+琼脂6.8g/l+蔗糖30g/l,增殖系数最高可达7。最适生根培养基为:1/2ms+6-ba0.05mg/l+iba0.1mg/l+naa0.1mg/l+琼脂6.8g/l+蔗糖20g/l,生根率达100%,平均根量达22条,平均根长3.10cm。
- 还没有人留言评论。精彩留言会获得点赞!