一种琼岛杨组培快繁方法与流程
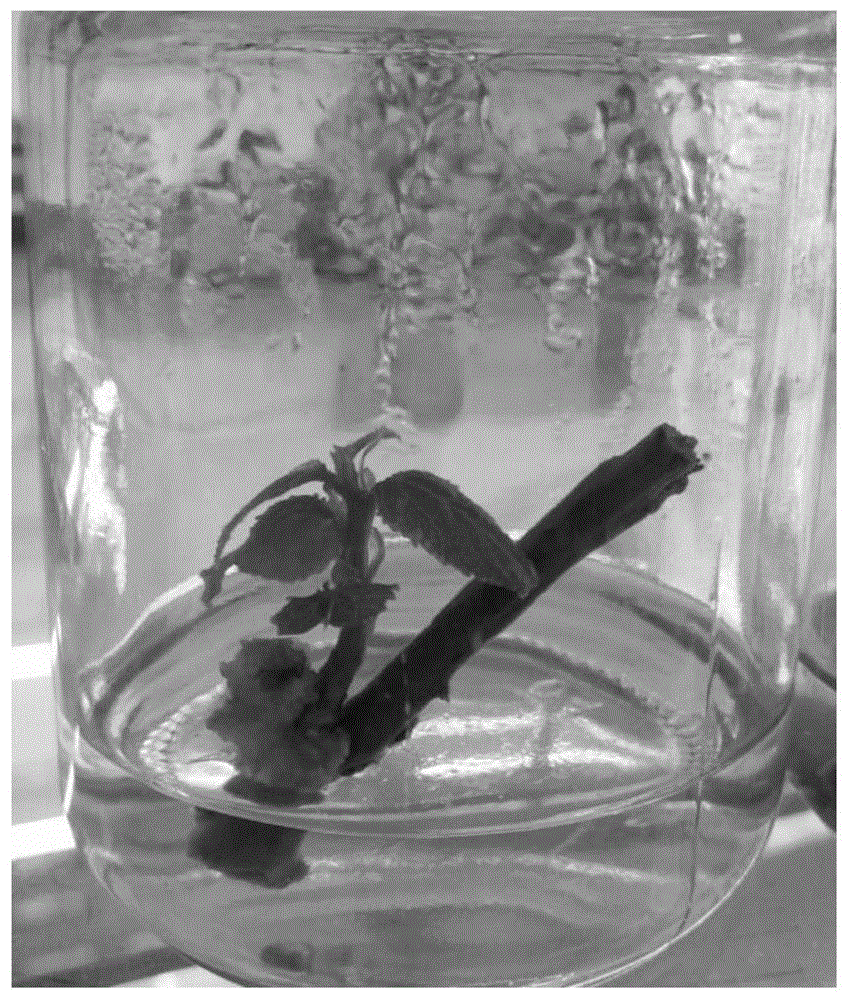
本发明涉及植物组织培养的技术领域,特别涉及一种琼岛杨组培快繁方法。
背景技术:
琼岛杨(populusqiongdaoensist.hongetp.luo)为杨柳科、杨属,落叶大乔木,喜光、速生、萌芽力强,木材适作纸浆、木丝、人造丝、纤维板、胶合板、火柴杆、火柴盒、牙签等原料,尤适作食品(蛋类、肉质)及衣服包装箱,也可供建筑、制饮料桶、器具等,具有重要的经济价值。琼岛杨是海南特有树种,省级重点保护陆生野生植物名录树种(2006),目前仅见于海南岛白沙县智在岭及昌江县霸王岭,属濒危树种。
目前国内外对琼岛杨的研究主要集中在标本的采集、资源调查,关于琼岛杨的育苗技术未见相关报道,因此,为后续保护和利用这一珍贵乡土树种,急需建立琼岛杨的再生体系,从而可解决了琼岛杨的种苗繁育问题。
技术实现要素:
本发明意在提供一种琼岛杨组培快繁方法,解决了琼岛杨种苗培育缓慢的问题。
为了达到上述目的,本发明的技术方案如下:一种琼岛杨组培快繁方法,包括如下步骤:
s102、剪除多年生琼岛杨母树的半质化新生枝条,切取所述新生枝条茎尖以下的茎段作为外植体,备用;
s104、将s102中的外植体进行清洗和消毒处理,然后将外植体放入1.5%hgcl2溶液中浸泡12~13min,最后用无菌水冲洗4~5次;
s106、将经s104处理后的外植体接入芽诱导培养基中培养15~20d;
s108、切取经s106处理后外植体上的单个腋芽,切取长度不大于3cm单个腋芽并转接至增殖培养基中,培养25-30d后获得长度不大于2cm的丛生不定芽,按照上述步骤循环培养以获得大量的不定芽;
s110、从s108处理后得到的丛生芽中切下单芽高度不小于3cm的嫩茎,将嫩茎转入生根苗培养基,在自然光照和恒温条件下进行生根诱导培养15~20d,从而获得生根苗;
s112、将步骤s110中获得的生根苗移至室外大棚中培养30d后得到组培苗,再将组培苗进行炼苗处理,炼苗处理后将组培苗移植至由椰糠、河沙和红壤组成的混合基质上,即可快速获得琼岛杨幼苗。
进一步的,步骤s104中所述消毒处理依次采用75%酒精清洗30秒,无菌水冲洗3~4次。
进一步的,步骤s104中外植体放入浓度为1.5%的hgcl2溶液消毒处理前向该溶液中加入1-2滴吐温80,所述吐温80的浓度为0.1%。
通过上述设置,酒精可初步消杀外植体表面的细菌,而hgcl2溶液是使细菌蛋白质变性,消毒更彻底,同时吐温-80为表面活性剂,使hgcl2溶液充分与外植体表面微生物接触,提高消毒效果。
进一步的,步骤s110的温度为26~28℃。
进一步的,步骤s112中组培苗在炼苗处理后用浓度为0.1%的高锰酸钾消毒1-3分钟,清洗晾干后移入由椰糠、河沙和红壤组成的混合基质上。
进一步的,所述芽诱导培养基是在1/2ms的基础培养基中加入0.5mg/l6-ba,将其ph值调至5.8。
进一步的,所述增殖培养基是在3/4ms的基础培养基中添加浓度为0.3mg/l的6-ba和0.5mg/l的naa,将其ph至调节至5.8。
进一步的,所述生根苗培养基是在1/2ms的基础培养基中同时加入1.0mg/l的iba和0.5mg/l的naa,将其ph值调节至5.8。
与现有技术相比,本方案的有益效果:
本方案以琼岛杨枝条茎段为外植体开展的一种快繁技术,具有腋芽诱导快速、诱导率高、增殖倍数大、丛生芽生长快、生根率高、根系发达、生根苗粗壮、移栽成活率高、苗木生长健壮、育苗成本低等特点,提供了一套高效、稳定的琼岛杨组培快繁技术体系;本方案可适用于琼岛杨幼苗工厂化生产,实现琼岛杨种苗的快速繁育,保护了该珍贵乡土树种野生种质资源,缓解此树种濒危及种质资源稀少的问题,丰富了海南乡土树种野生资源的多样性,为今后育种工作奠定了前期基础及提供材料保障。
附图说明
图1是本发明一种琼岛杨组培快繁方法中腋芽诱导示意图;
图2是本发明一种琼岛杨组培快繁方法中腋芽增殖示意图;
图3是本发明一种琼岛杨组培快繁方法中腋芽生根示意图;
图4是本发明一种琼岛杨组培快繁方法中组培苗炼苗示意图;
图5是本发明一种琼岛杨组培快繁方法中组培苗移栽20天示意图。
具体实施方式
下面通过具体实施方式对本发明作进一步详细的说明:
实施例
如附图1和图2所示:一种琼岛杨组培快繁方法,包括如下步骤:
s102、天气晴朗早上9:00-10:00内剪除多年生琼岛杨母树上半质化的新生枝条,切取新生枝条茎尖以下长5-10cm且腋芽饱满无病虫害的茎段作为外植体,备用。
s104、将s102中的外植体先用自来水清洗15分钟,再将其放置在无菌超净台内依次用75%的酒精清洗30s,无菌水冲洗3-4次,然后将清洗消毒的外植体放入添加有1-2滴0.1%吐温80的hgcl2溶液中浸泡12~13min,其中hgcl2溶液的浓度为1.5%,最后用无菌水冲洗4~5次。
s106、如附图1所示,将经s104处理后的外植体接入芽诱导培养基中培养15~20d,其中芽诱导培养基是在1/2ms基础培养基中加入0.5mg/l6-ba,将其ph值调至5.8。上述芽诱导培养基的成分中大量元素减半、其他营养成分不变,添加了0.5mg/l6-ba,从而增强了芽诱导效果(腋芽诱导率达到90%以上),缩短了出芽时间,并且腋芽绿色、粗壮。
s108、切取经s106处理后外植体上长度大于3cm的单个腋芽,将其转接至增殖培养基内培养(如附图2所示),上述增殖培养基是在3/4ms基础培养基中添加浓度为0.3mg/l的6-ba和0.5mg/l的naa,将其ph至调节至5.8,培养25-30d后获得嫩茎长度大于2cm的丛生不定芽,按照上述步骤循环培养以获得大量的丛生芽。上述增殖培养基采用3/4ms基本培养基,同时添加0.3mg/l的6-ba和0.5mg/l的naa,大量元素减少1/4,其他不变,可以带来增殖倍数高(5.0-8.0),同时具备产生丛芽、丛芽生长快等效果。
s110、从s108处理后得到的丛生芽中切下单芽高度不小于3cm的嫩茎,将嫩茎转入生根苗培养基中培养(如附图3所示),上述生根苗培养基是在1/2ms基础培养基中同时加入1.0mg/liba和0.5mg/lnaa,将其ph值调节至5.8,在自然光照和26-28℃的恒温条件下培养15~20d以诱导不定芽生根,从而获得生根苗。上述生根苗培养基采用1/2ms基本培养基,同时添加了两种生根激素(1.0mg/l的iba和0.5mg/l的naa),在两种激素相互作用下使得生根率达95%以上,其根系数量达到4-5条、并且还具有生根苗粗壮等效果。
s112、将步骤s110中获得的生根苗移至室外大棚中培养30d后得到组培苗,再将接种生根的组培瓶瓶盖拧松进行炼苗一天(如附图4所示),然后再将组培瓶瓶盖拧至半打开状态一天,第三天后向组培瓶内加入少量自来水并完全打开瓶盖炼苗两天,在炼苗期间需保持组培苗叶片不失水,若出现失水时需盖上组培瓶瓶盖,待组培苗恢复后再打开瓶盖进行炼苗,重复上述的操作几次,待组培苗适应室外环境后将其取出,用浓度为0.1%的高锰酸钾消毒1-3分钟,然后采用清水冲洗并晾干,晾干后的组培苗移植至由椰糠、河沙和红壤组成的混合基质上(如附图5所示),上述混合基质中椰糠、河沙、红壤的质量占比为1:1:2,移栽过程中需边移植边浇水,然后覆盖薄膜和遮阳网,移栽20d后降低遮阴度并按照常规幼苗管理方式进行管理,即可获得琼岛杨幼苗。
目前现有的育苗方法或体系中未发现成熟的育苗方法,种子从开花到成熟时间短吗,种子细小容易随杨絮随处飘扬,种子收集困难,种子成苗率低,分化严重,育苗周期长以及成活率低。而本方案建立的组培快繁技术,可以全年培育苗木,育苗周期短,在组培瓶内一个月生长时间超过3个月的播种苗,移栽成活率大于80%。
以上的仅是本发明的实施例,方案中公知的具体结构和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明结构的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本申请要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
- 还没有人留言评论。精彩留言会获得点赞!