一种小鼠原位移植性肝癌模型的制备方法与流程
[0001]
本发明属于生物医学技术领域,具体涉及一种适用于肝癌发生发展机制及抗肿瘤相关研究的小鼠原位移植性肝癌模型的制备方法。
背景技术:
[0002]
我国是肝癌的重灾区,每年肝癌的新发例数占全球总发病人数的55%以上,且有逐年增加的趋势。肝癌起病隐匿,早期多无明显症状,临床诊断时多已是中晚期,失去手术根治的机会。尽管近年来医疗技术和手术技艺不断提高,但肝癌的根治切除率仍仅在30%左右,且术后易复发转移。因此,肝癌的防治是我国医疗卫生工作中的重大课题之一。建立一个优良的肝癌动物模型是研究肝癌发生发展机制及抗肝癌研究中必不可少的一部分,对肝癌相关的基础和临床转化医学研究有着极为重要的价值和意义。
[0003]
目前常用的原位肝癌动物模型主要有以下三类:诱发性肝癌模型、转基因小鼠肝癌模型和移植性小鼠肝癌模型。模型动物以鼠最常见。
[0004]
诱发性肝癌模型指用化学、物理或者生物因素作用于实验动物,诱发动物形成肝癌。目前应用最多的是化学诱癌剂诱发,如黄曲霉素和二乙基亚硝胺。该方法可模拟人群中“肝炎-肝硬化-肝癌”的“肝癌三部曲”,但诱导成瘤时间长,平均需4到6个月,有时甚至1年,成瘤率不稳定且个体差异大。
[0005]
转基因肝癌模型指动物接受外源基因后,外源基因稳定整合到染色体基因组中并能遗传给后代,使其形成肝癌。该方法可获得稳定的原位肝癌动物,但技术要求极高,初代转基因肝癌动物培育极为困难。
[0006]
移植性肝癌模型包括瘤块接种和细胞悬液注射这两种移植方式。其成瘤时间短,1周即可见肝癌生长,且技术要求相对较低,易实施,成功率较高,是目前较为常用的一种原位肝癌模型。但接种完成后接种位点的持续性出血(严重者会导致实验动物的失血性休克死亡)及癌组织(或细胞)外漏至腹腔造成腹腔播散是该技术亟待解决的两大问题。
[0007]
综上,目前存在的三种原位肝癌动物模型均存在一定的不足,不能完全满足当前肝癌基础和临床转化研究的需求。
技术实现要素:
[0008]
本发明主要解决了如何建立一种稳定、可靠的小鼠原位移植性肝癌模型,通过肝门阻断这一技术,有效控制了接种位点的出血;肝门阻断后输注瘤细胞使得种植的瘤细胞在肝内局部驻留,极大的避免了瘤细胞随肝脏血流流出肝脏或者导致广泛播散的弊端;通过电凝笔凝固接种位点,阻止了肿瘤细胞的外漏和腹腔播散,提高了造模的成功率。可满足肝癌发生发展机制及抗肿瘤相关研究的需求。
[0009]
本发明小鼠原位移植性肝癌模型的建立方法,按以下步骤进行:
[0010]
一、选用对数生长期的h22细胞株,pbs洗涤三遍后,再以pbs调整细胞悬液浓度至2
×
108/ml,置于冰盒中备用。
[0011]
二、小鼠麻醉后,仰卧位固定,上腹正中切口逐层开入腹腔,第一肝门处游离肝动脉和门静脉,无损伤止血钳同时钳夹肝动脉和门静脉,施行肝门阻断。该技术应用的优势特点是:1.可显著减少针头拔出后针眼的出血量,降低了因针眼出血过多导致实验动物失血性休克死亡;2.肝门阻断后入肝血流被阻断,使得种植的瘤细胞在肝内局部驻留,避免了瘤细胞随肝脏血流流出肝脏或者导致广泛播散的弊端,显著提高肝脏局部成瘤率。
[0012]
三、以1ml注射器抽取50μl步骤一中配置好的肿瘤细胞悬液,将针头折30度弯曲,刺入肝被膜下1-2mm,缓慢注入肝癌细胞悬液至肝实质内,肉眼可见注入的肿瘤细胞在肝内呈局灶性,范围3-5mm。
[0013]
四、退针后棉签压迫止血,电凝笔凝固针眼,该操作可防止植入的肿瘤细胞外渗入腹腔,造成腹腔种植性转移,引起造模失败;
[0014]
五、无活动性出血后松解止血钳,逐层关腹。待小鼠苏醒后,送返动物房,饲养如旧。
[0015]
本发明的优势在于:(1)、注射细胞悬液前预先施行肝门阻断,显著减少了针头拔出后针眼的出血,减少了因针眼出血过多导致实验动物失血性休克死亡,提高了造模的成功率。(2)、退针后,针眼处用电凝笔凝固,可防止肿瘤细胞外渗入腹腔,造成腹腔种植性转移,降低了造模的失败率。(3)、肝门阻断后输注瘤细胞使得种植的瘤细胞在肝内局部驻留,避免了瘤细胞随肝脏血流流出肝脏或者导致广泛播散的弊端,显著提高成瘤率。(4)、肿瘤位于小鼠肝原位,生长环境符合机体真实情况,且成瘤时间短,肿瘤生长快。(5)、操作简便安全,由操作导致的动物死亡显著减少,模型稳定性好、成功率高。
[0016]
故本模型是一种用于肝癌发生发展机制及抗肿瘤相关研究的较为理想的模型。
附图说明
[0017]
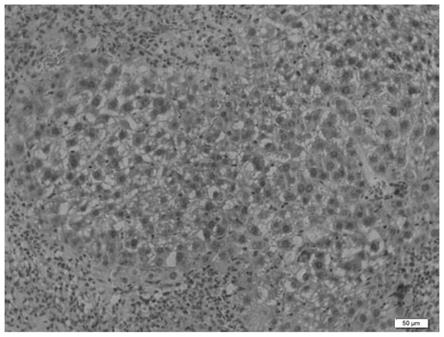
附图1:肿瘤组织h&e染色光镜下所见肝脏组织结构消失、肝细胞弥漫增生伴异型、细胞核增大见核分裂像,符合肝癌组织学改变。
具体实施方式
[0018]
一、h22细胞(吉林大学白求恩医学部基础医学院药理学系惠赠)由1640完全培养基(即1%青霉素-链霉素溶液,10%胎牛血清,89%1640培养基)置于37℃、5%co2浓度的二氧化碳培养箱中培养,待培养细胞在对数生长期时(培养基颜色由红色转为深黄色时)进行传代培养。取一盘h22细胞,反复吹打培养皿使悬浮细胞均匀后(因h22细胞呈悬浮生长,故不需要胰酶消化)转入15ml离心管内,1000rpm离心5分钟,弃上清,于白色沉淀中加入2ml pbs吹打、重悬并洗涤细胞,1000rpm离心5分钟,弃上清,再如上重复洗涤细胞2遍。应用适量pbs调整细胞悬液浓度至2
×
108/ml,备用。
[0019]
二、应用小动物麻醉机,昆明小鼠异氟烷吸入麻醉(具体操作过程中需按小鼠具体情况调整给予麻醉药的流量),麻醉生效后,小鼠仰卧位固定,电动剃毛器全腹部备皮,上腹部碘伏消毒,75%酒精脱碘。取上腹正中切口,逐层开入腹腔,切口长约1cm,用0.9%生理盐水湿润的棉签显露肝叶,暴露第一肝门,于第一肝门处游离肝动脉和门静脉,无损伤止血钳同时钳夹肝动脉和门静脉,施行肝门阻断。
[0020]
三、1ml无菌注射器,配以30
1/2
g针头,抽取50μl步骤一中配置好的细胞悬液(细胞
浓度已调整至2
×
108/ml),将针头折30度弯曲,于肝左叶边缘进针,与左肝叶呈水平,深度约1-2mm,将50μl肿瘤细胞缓慢全部种植入肝实质内。肉眼可见注入的肿瘤细胞在肝内呈局灶性聚集驻留,范围3-5mm。
[0021]
四、退针后立即用干棉签压迫针眼止血,随后电凝笔凝固针眼,无活动性出血后松解止血钳。
[0022]
五、再次确认无活动性出血后,以0.9%生理盐水湿润的棉签将肝叶轻柔还纳恢复原位,3-0带针慕丝线逐层连续缝合关腹。碘伏擦拭切口。去除异氟烷麻醉,待小鼠苏醒后送返动物房,饲养如前。
[0023]
六、瘤细胞种植后不同时间(3天、7天、10天、14天、21天)在全麻下剖开小鼠腹腔探查肝脏,观察肿瘤的生长情况,并取肿瘤组织行病理学检查。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1