一种人源性肿瘤异种移植模型的构建方法与流程
[0001]
本发明涉及异种肿瘤移植技术领域,具体而言,涉及一种人源性肿瘤异种移植模型的构建方法。
背景技术:
[0002]
恶性肿瘤的治疗是全世界面临的难题。目前,临床肿瘤化学治疗可以结合基因组测序进行展开,但是靶向药物的实际效用仍具有不确定性。因此,在临床治疗的过程中,使用动物模型测试选择最佳靶向药物、测试药物实际疗效是解决这一问题的最佳途径。
[0003]
人源肿瘤异种移植模型(patient-derived tumor xenograft,pdx)将病人的肿瘤组织直接移植到免疫缺陷鼠而建立的人源异种移植模型,在组织病理学、分子生物学和基因水平上保留了大部分原代肿瘤的特点,同时能够模拟肿瘤生长微环境,是药物筛选最有效的工具之一。
[0004]
然而,传统的pdx模型制作周期较长,且成功率较低,不利于恶性肿瘤患者的治疗参考依据。
[0005]
鉴于此,特提出本发明。
技术实现要素:
[0006]
本发明的目的在于提供一种人源性肿瘤异种移植模型的构建方法。
[0007]
本发明是这样实现的:
[0008]
本发明实施例提供了一种人源性肿瘤异种移植模型的构建方法,其包括:将含源自供体患者的肿瘤组织碎块的注射液注射于目标动物皮下。
[0009]
优选地,所述肿瘤组织碎块中每一块碎块的体积≤1mm3。
[0010]
优选地,所述目标动物皮下注射液中含有的所述肿瘤组织碎块的体积为30~70mm3。
[0011]
优选地,所述目标动物皮下注射液中含有的所述肿瘤组织碎块的体积为40~60mm3。
[0012]
优选地,所述注射液中还包括有组织保护液,每100μl组织保护液,加入30~70mm3的所述肿瘤组织碎块。
[0013]
优选地,所述组织保护液还包括:基质胶和生理盐水中的至少一种。
[0014]
优选地,当所述组织保护液包括基质胶和生理盐水时,基质胶和生理盐水的体积比为1:(1~3)。
[0015]
优选地,所述组织保护液中还包括有抗生素;
[0016]
优选地,抗生素的添加量为:每1ml组织保护液,加入50~150μl抗生素;
[0017]
优选地,所述抗生素为青链霉素双抗。
[0018]
优选地,所述肿瘤组织是肺癌组织;
[0019]
优选地,所述肿瘤组织是指:肺腺癌、肺鳞癌和肺腺鳞癌组织中的至少一种。
[0020]
优选地,所述目标动物为小鼠;
[0021]
优选地,所述目标动物为ncg小鼠。
[0022]
本发明具有以下有益效果:
[0023]
本发明实施例提供了一种人源性肿瘤异种移植模型的构建方法,其包括:将含源自供体患者的肿瘤组织碎块的注射液注射于目标动物皮下。该构建方法结合原发肿瘤生长微环境的概念,创造了一种更有效快捷的构建途径,该构建方法构建出的模型可以与供体患者保持高度的遗传一致性,与传统的构建方法相比,模型的构建周期和成功率有了显著提高。
附图说明
[0024]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
[0025]
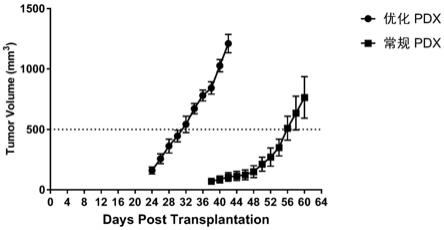
图1为试验例1中实施例和对比例的pdx结果对比图;
[0026]
图2为试验例1中小鼠肿瘤组织的生长曲线图。
具体实施方式
[0027]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0028]
本发明实施例提供了一种人源性肿瘤异种移植模型(pdx)的构建方法,其包括:将含源自供体患者的肿瘤组织碎块的注射液注射于目标动物皮下。
[0029]
发明人通过一系列创造性劳动的付出,结合原发肿瘤生长微环境的概念,创造了上述的构建方法,该构建方法构建的模型可以与供体患者保持高度的遗传一致性,与传统的pdx模型相比,大大提高了制作效率和成功率。
[0030]
优选地,所述肿瘤组织碎块中每一块碎块的体积≤1mm3。
[0031]
在该体积设置范围下,肿瘤组织可以通过注射的方式进入目标动物体内,而无需对小鼠进行麻醉和外科手术,有效缩短了肿瘤组织在体外的暴露时间,同时对小鼠的创伤更小。
[0032]
优选地,所述肿瘤组织碎块的体积可以为0.01~1mm3。
[0033]
具体可以为0.05mm3、0.10mm3、0.15mm3、0.20mm3、0.25mm3、0.30mm3、0.35mm3、0.40mm3、0.45mm3、0.50mm3、0.55mm3、0.60mm3、0.65mm3、0.70mm3、0.75mm3、0.80mm3、0.85mm3、0.90mm3、0.95mm3和1mm3中的任意体积。
[0034]
优选地,所述目标动物皮下注射液中含有的所述肿瘤组织碎块的体积为30~70mm3。
[0035]
所述目标动物皮下注射液中含有的所述肿瘤组织碎块的体积可以为30mm3、32mm3、34mm3、36mm3、38mm3、40mm3、42mm3、44mm3、46mm3、48mm3、50mm3、52mm3、54mm3、56mm3、58mm3、
60mm3、62mm3、64mm3、66mm3、68mm3、70mm3中的任意体积。
[0036]
优选地,所述目标动物皮下注射液中含有的所述肿瘤组织碎块的体积为40~60mm3。
[0037]
往目标动物皮下注射40~60mm3的肿瘤组织碎块能够保证较高成瘤率,若低于该范围可能会导致成瘤率的显著下降。
[0038]
优选地,所述注射液中还包括有组织保护液,每100μl组织保护液,加入30~70mm3的所述肿瘤组织碎块。组织保护液一方面能够保护肿瘤组织碎块,另一方面能够使肿瘤组织碎块以注射的方式进入目标动物体内,进行模型的构建。
[0039]
优选地,所述组织保护液还包括:基质胶和生理盐水中的至少一种。
[0040]
优选地,当所述组织保护液包括基质胶和生理盐水时,基质胶和生理盐水的体积比为1:(1~3)。该特定的组织保护液能够提高上述构建方法的成功率,在有效保护肿瘤组织的同时,使注射过程更加的顺利。
[0041]
优选地,所述组织保护液中还包括有抗生素;
[0042]
优选地,抗生素的添加量为:每1ml组织保护液,加入50~150μl抗生素;
[0043]
优选地,所述抗生素为青链霉素双抗。
[0044]
优选地,所述肿瘤组织是肺癌组织;
[0045]
优选地,所述肿瘤组织是指:肺腺癌、肺鳞癌和肺腺鳞癌组织中的至少一种。
[0046]
优选地,所述目标动物为小鼠;
[0047]
优选地,所述目标动物为ncg小鼠。
[0048]
优选地,所述构建方法还包括获取肿瘤组织样本,并将肿瘤组织样本剪碎至肿瘤组织碎块中每一块碎块体积≤1mm3的状态。
[0049]
本发明不对具体的注射方式做具体的限定,可通过常规的注射方式进行。优选地。选用1ml注射器,注射器针头可采用尺寸大小为20g的针头。
[0050]
本发明实施例提供饿构建方法在原有的人源性肿瘤异种移植模型的制作基础上,对供体患者的肿瘤组织使用专用的基质胶成分进行支撑,使其在被接种至小鼠皮下后可以更好生长,同时更快的吸收营养成分,促进肿瘤周围微血管的形成,可以将改模型制作的成功率提高至90%,有效缩短制作周期。
[0051]
本发明独创的使用了注射器注射移植物的接种方法,此方法无需对小鼠进行麻醉和手术,且移植操作更为便捷和快速,缩短了肿瘤组织在体外的暴露时间,同时对免疫缺陷小鼠造成的创伤更小。获得的模型小鼠可以快速的进行临床治疗药物的筛选和疗效验证,以便让患者更快的获得最优的治疗方案,提高预后。
[0052]
以下结合实施例对本发明的特征和性能作进一步的详细描述。
[0053]
实施例1
[0054]
本实施例提供了一种人源性肿瘤异种移植模型的构建方法,其包括以下步骤。
[0055]
(1)获取肿瘤组织:
[0056]
获取源自供体患者的肿瘤组织(在收集后可以储存于组织保护液中,在低温的保存条件下保存运输至实验室)。
[0057]
组织保护液由以下方式配置而成:将基质胶matrigel和灭菌后的生理盐水以体积比为1:2混合而成。
[0058]
然后在组织保护液中加入1%(体积百分比:每1ml组织保护液,加入100μl抗生素)的青链霉素双抗。
[0059]
(2)破碎肿瘤组织:
[0060]
在生物安全柜中,将新鲜的肿瘤组织使用物理消化的方式将其剪碎至每一块碎块体积小于1mm3以下,直至肉眼看不到明显的碎块为止。
[0061]
(3)注射:
[0062]
选择目标动物进行局部物理去毛,皮下充分暴露以后进行消毒;在本实施例中,目标动物为三重重度免疫缺陷ncg小鼠。
[0063]
将获取的肿瘤组织碎块与组织保护液混合,每100μl组织保护液,加入50mm3的所述肿瘤组织碎块,获得注射液。
[0064]
然后,采用1ml的注射器(针头大小为20g),将含肿瘤组织碎块的注射液注射100μl于目标动物皮下。需要说明的是,注射100μl是指注射液中液体的体积,注射液中含有的肿瘤组织碎块为固体,本实施例中,每100μl中含有50mm3的所述肿瘤组织碎块,因此,注射100μl是指在目标动物皮下注射了50mm3的所述肿瘤组织碎块,其他实施例依次类推。
[0065]
实施例2
[0066]
本实施例提供了一种人源性肿瘤异种移植模型的构建方法,具体包括以下步骤。
[0067]
(1)获取肿瘤组织:
[0068]
获取源自供体患者的肿瘤组织(在收集后可以储存于组织保护液中,在低温的保存条件下保存运输至实验室)。
[0069]
组织保护液由以下方式配置而成:将基质胶matrigel和灭菌后的生理盐水以体积比为1:1混合而成。
[0070]
然后在组织保护液中加入1%(体积百分比:每1ml组织保护液,加入100μl抗生素)的青链霉素双抗。
[0071]
(2)破碎肿瘤组织:
[0072]
在生物安全柜中,将新鲜的肿瘤组织使用物理消化的方式将其剪碎至中每一块碎块的体积小于1mm3以下,直至肉眼看不到明显的碎块为止。
[0073]
(3)注射:
[0074]
选择目标动物进行局部物理去毛,皮下充分暴露以后进行消毒;在本实施例中,目标动物为三重重度免疫缺陷ncg小鼠。
[0075]
将获取的肿瘤组织碎块与组织保护液混合,每100μl组织保护液,加入50mm3的所述肿瘤组织碎块,获得注射液。
[0076]
然后,采用1ml的注射器(针头大小为20g),将含肿瘤组织碎块的注射液注射100μl于目标动物皮下。
[0077]
实施例3
[0078]
本实施例提供了一种人源性肿瘤异种移植模型的构建方法,具体包括以下步骤。
[0079]
(1)获取肿瘤组织:
[0080]
获取源自供体患者的肿瘤组织(在收集后可以储存于组织保护液中,在低温的保存条件下保存运输至实验室)。
[0081]
组织保护液由以下方式配置而成:将基质胶matrigel和灭菌后的生理盐水以体积
比为1:3混合而成。
[0082]
然后在组织保护液中加入1%(体积百分比:每1ml组织保护液,加入100μl抗生素)的青链霉素双抗。
[0083]
(2)破碎肿瘤组织:
[0084]
在生物安全柜中,将新鲜的肿瘤组织使用物理消化的方式将其剪碎至中每一块碎块的体积小于1mm3以下,直至肉眼看不到明显的碎块为止。
[0085]
(3)注射:
[0086]
选择目标动物进行局部物理去毛,皮下充分暴露以后进行消毒;在本实施例中,目标动物为三重重度免疫缺陷nsg小鼠。
[0087]
将获取的肿瘤组织碎块与组织保护液混合,每100μl组织保护液,加入50mm3的所述肿瘤组织碎块,获得注射液。
[0088]
然后,采用1ml的注射器(针头大小为20g),将含肿瘤组织碎块的注射液注射100μl于目标动物皮下。
[0089]
实施例4
[0090]
本实施例提供了一种人源性肿瘤异种移植模型的构建方法,具体包括以下步骤。
[0091]
(1)获取肿瘤组织:
[0092]
获取源自供体患者的肿瘤组织(在收集后可以储存于组织保护液中,在低温的保存条件下保存运输至实验室)。
[0093]
组织保护液由以下方式配置而成:将基质胶matrigel和灭菌后的生理盐水以体积比为1:2混合而成。
[0094]
然后在组织保护液中加入1%(体积百分比:每1ml组织保护液,加入100μl抗生素)的青链霉素双抗。
[0095]
(2)破碎肿瘤组织:
[0096]
在生物安全柜中,将新鲜的肿瘤组织使用物理消化的方式将其剪碎至中每一块碎块的体积小于1mm3以下,直至肉眼看不到明显的碎块为止。
[0097]
(3)注射:
[0098]
选择目标动物进行局部物理去毛,皮下充分暴露以后进行消毒;在本实施例中,目标动物为三重重度免疫缺陷ncg小鼠。
[0099]
将获取的肿瘤组织碎块与组织保护液混合,每100μl组织保护液,加入30mm3的所述肿瘤组织碎块,获得注射液。
[0100]
然后,采用1ml的注射器(针头大小为20g),将含肿瘤组织碎块的注射液注射100μl于目标动物皮下。
[0101]
实施例5
[0102]
本实施例提供了一种人源性肿瘤异种移植模型的构建方法,具体包括以下步骤。
[0103]
(1)获取肿瘤组织:
[0104]
获取源自供体患者的肿瘤组织(在收集后可以储存于组织保护液中,在低温的保存条件下保存运输至实验室)。
[0105]
组织保护液由以下方式配置而成:将基质胶matrigel和灭菌后的生理盐水以体积比为1:2混合而成。
[0106]
然后在组织保护液中加入1%(体积百分比:每1ml组织保护液,加入100μl抗生素)的青链霉素双抗。
[0107]
(2)破碎肿瘤组织:
[0108]
在生物安全柜中,将新鲜的肿瘤组织使用物理消化的方式将其剪碎至中每一块碎块的体积小于1mm3以下,直至肉眼看不到明显的碎块为止。
[0109]
(3)注射:
[0110]
选择目标动物进行局部物理去毛,皮下充分暴露以后进行消毒;在本实施例中,目标动物为三重重度免疫缺陷ncg小鼠。
[0111]
将获取的肿瘤组织碎块与组织保护液混合,每100μl组织保护液,加入70mm3的所述肿瘤组织碎块,获得注射液。
[0112]
然后,采用1ml的注射器(针头大小为20g),将含肿瘤组织碎块的注射液注射100μl于目标动物皮下。
[0113]
对比例1
[0114]
对比例提供一种人源性肿瘤异种移植模型的构建方法,其与实施例1的主要区别在于,将肿瘤组织直接以外科手术的方式置于目标动物体内,而非以注射的方式,其具体包括以下步骤。
[0115]
(1)收集患者来源的新鲜的人肺腺鳞癌组织,放置于组织保护液中,低温条件下运送至实验室,该组织为10ml的组织保护液加入100μl的青链霉素双抗。
[0116]
(2)在生物安全柜中将新鲜的肿瘤组织使用物理消化的方式将其充分剪碎至1mm3以下,肉眼见不到明显的碎块为止。
[0117]
(3)选取6周龄雌性ncg小鼠物理去毛以后进行75%酒精消毒,注射麻醉剂将小鼠麻醉后,在皮下切口进行肿瘤组织移植,移植后缝合伤口。
[0118]
(4)待小鼠复苏后将小鼠送回鼠笼。小鼠成瘤至500mm3以上的平均时间为55天,成瘤率大概为60%。
[0119]
试验例1
[0120]
采用实施例1提供的构建方法进行构建,试验例中,肿瘤组织采用收集患者来源的新鲜的人肺腺癌组织,目标动物采用6周龄雌性ncg小鼠进行。
[0121]
注射后将小鼠送回鼠笼,经检测发现,小鼠成瘤至500mm3以上的平均时间为32天,成瘤率超过90%。
[0122]
将实施例1(optimized pdx)的结果与对比例1(conventional pdx)的结果相对比,实施例1和对比例1构建的模型大小比对结果请参照附图1,实施例1和对比例1中小鼠肿瘤的生长曲线图请参照附图2。由结果可知,本申请实施例1的构建方法构建模型的周期更短,且成功率更高。
[0123]
试验例2
[0124]
采用实施例1提供的构建方法进行构建,试验例中,肿瘤组织采用收集患者来源的新鲜的人肺鳞癌组织,目标动物采用6周龄雌性ncg小鼠进行。
[0125]
注射后将小鼠送回鼠笼,经检测发现,小鼠成瘤至500mm3以上的平均时间为36天,成瘤率为85%左右。
[0126]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技
术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1