一种动物脑干出血模型及其建立方法与流程
本发明涉及动物实验模型构建技术领域,特别涉及一种动物脑干出血模型及其建立方法。
背景技术:
脑干出血占临床脑出血病例的10%左右,发病率虽然不高,但脑干出血起病急,病情凶险,预后较差,是所有脑卒中中病死率最高,预后最差的疾病。脑干出血占脑出血的5.0%~13.4%,多发于脑桥,常于基底动脉供应脑桥的穿通动脉破裂所致。到目前为止,尚无有效的外科或保守治疗可以改善bsh的预后,尽管指南推荐参照基底神经节出血的支持治疗,但由于脑干与基底节完全分散的血液供应系统及神经元和内皮细胞对卒中的反应可能不同,基底神经节出血的研究成果并不完全适用于bsh,因此建立有效的动物bsh模型很有必要。
目前,主要有以下两种脑干出血模型:
(1)胶原酶诱导大鼠脑干出血模型:timlekic等于2013年通过立体定位仪将0.15uvii型胶原酶(0.2u/μl)注射到大鼠右侧腹侧脑桥基底被盖中,建立了脑干出血(brainstemhemorrhage,bsh)模型。该模型采用成年雄性大鼠(体重290-345g),注射速度为0.2μl/min。大鼠麻醉苏醒后30min内,表现出共济失调步态、头尾旋转、脑神经和肢体功能障碍。病理检查发现右侧腹侧被盖脑桥内有理想的血肿,无蛛网膜下腔(或硬膜下)出血及脑室出血。该模型可以很好的模拟人bsh的个别生理机制,比较适合用于bsh的临床研究中,但该模型24h的死亡率为8%,30d的死亡率为54%,较高的死亡率限制了该模型的应用。此外,啮齿动物脑结构与人类相差较大,脑白质缺乏,许多实验性治疗策略已在啮齿动物模型和体外试验中取得成功,但绝大多数此类治疗措施却在之后的临床试验中失败,削弱了此类模型的应用价值(参考文献:timlekic,williamrolland,anatolmanaenko,etal.evaluationofthehematomaconsequences,neurobehavioralprofiles,andhistopathologyinaratmodelofpontinehemorrhage:laboratoryinvestigation.jneurosurg,2013(118):465–477.)。
(2)脑内自体血注入建立兔基底节区出血模型:guofengwu等在2013年的关于血肿周围谷氨酸水平与ich兔模型血脑屏障的破坏有关的研究中,通过向兔左侧基底节区注入0.3ml自体血建立了ich模型。该实验采用雄性新西兰大白兔(体重2.8-3.4kg),麻醉后固定于立体定位装置中,在注血前从耳中央动脉抽取动脉血,不采取抗凝措施,注血速度为0.3ml/min。在兔头的固定过程中,调整头部使囟门高出人字缝高1.5mm。在立体定位仪中,穿过囟门中心的冠状面为ap0平面a1为距ap01mm的吻侧冠状面,根据兔脑图谱,内囊大概在a5~p2平面之间。该实验的注射位点为囟门左6mm处,前1mm,深12mm。实验兔苏醒后,无法站立或爬行,对注射部位对侧肢体对有害刺激的反应较弱,脑ct显示基底神经节区呈椭圆形或圆形高密度,检测发现ich后早期即出现了血脑屏障破坏,并逐渐加重,表明该ich模型是成功的。目前关于ich的动物实验研究最多的是基于基底神经节区出血来进行的,基底节区出血虽然常见,但其死亡率小于50%,反之,bsh的死亡率高达65%,明显高于基底节区出血,关于动物bsh模型的研究鲜有报道,关于脑干在神经保护、神经可塑性、干细胞的应用或药理学方法方面的潜力,人们所知甚少。此外,自体血注入可以产生血肿,其血肿形成过程与人类相似,但是其仅形成血肿,并没有再现自然出血的过程,实验动物的脑血管也未发生脑血管粥样硬化、脑血管破裂等临床上导致人类ich的病变(参考文献:guofengwu,shujiesun,feisheng,etal.perihematomalglutamatelevelisassociatedwiththeblood–brainbarrierdisruptioninarabbitmodelofintracerebralhemorrhage.springerplus,2013(2):358.)。
技术实现要素:
有鉴于此,本发明提供了一种动物脑干出血模型及其建立方法。本申请采用胶原酶通过破坏特定注射点周围血管基底膜,引起出血,导致血液渗入周围的脑组织,从而形成血肿,其原理更好的模仿了自发性ich的病理生理过程。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种动物脑干出血模型的建立方法,包括如下步骤:
将vii型胶原酶导入动物脑右侧脑干部位的皮质脊髓束,20~30h后获得动物脑干出血模型。
作为优选,vii型胶原酶的剂量为0.4~0.6u/只。
优选地,vii型胶原酶的剂量为0.5u/只。
作为优选,导入速度为0.22~0.28u/μl。
优选地,导入速度为0.25u/μl。
作为优选,动物为兔。
作为优选,脑右侧脑干部位的导入点为前囟后8mm、中线右侧旁2mm坐标点。
作为优选,脑右侧脑干部位的导入深度为20.0mm。
作为优选,兔为健康成年新西兰大白兔,体重3.0~3.6kg。
作为优选,24h后获得动物脑干出血模型。
作为优选,导入结束后留针8~12min,然后缓慢退针。
优选地,导入结束后留针10min,然后缓慢退针。
本发明还提供了一种动物脑干出血模型,采用上述建立方法获得。
本发明提供了一种动物脑干出血模型及其建立方法。该建立方法包括如下步骤:将vii型胶原酶导入动物脑右侧脑干部位的皮质脊髓束,20~30h后获得动物脑干出血模型。本发明的技术效果为:
该动物模型首次采用vii型胶原酶诱导脑干出血的方法建立了兔脑干出血模型,弥补了大动物脑出血模型在脑干出血模型方面的空缺,不仅可用于脑干出血的病理生理机制及治疗方法的研究,也为建立灵长类动物等与人类脑结构更接近的大动物脑干出血模型奠定了基础。该模型的胶原酶注射位点及剂量是经过反复试验和探索选取的,根据兔脑在立体定位仪中的图谱,发现损伤皮质脊髓束(囟门旁2mm,后8mm,深20mm)可引起明显的神经损伤症状,包括向对侧扭颈、对侧肢体偏瘫、无法站立、意识下降以及单侧或双侧眼球向外膨出、充血等症状。注射0.5u的胶原酶可造成明显的神经损伤,并具有较小的死亡率,是理想的注射剂量。注射速度为0.25u/μl可减少反流。
附图说明
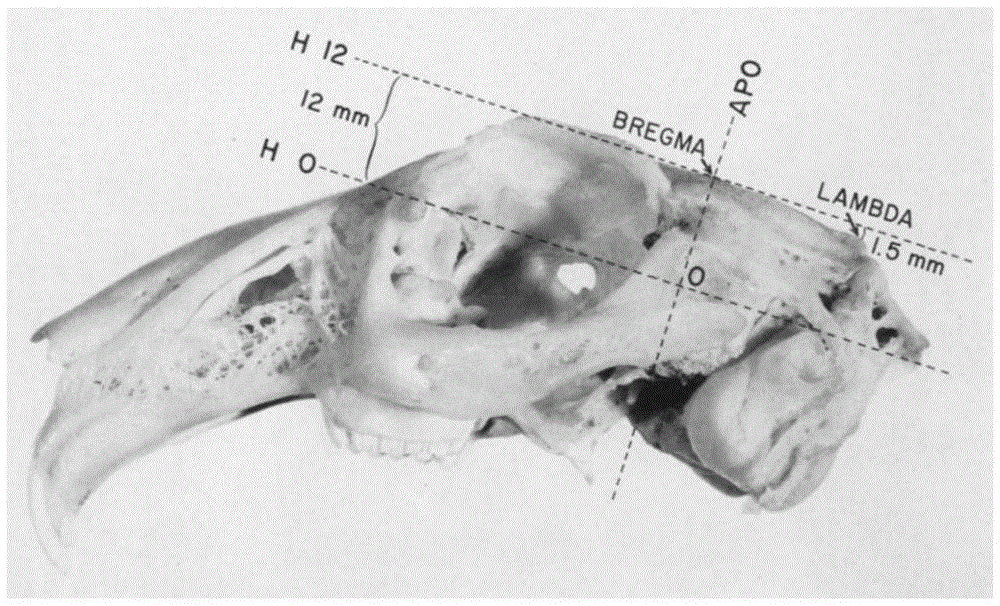
图1前囟位置高于后囟1.5mm;
图2皮质脊髓束(corticospinaltract,cs)在兔脑图谱中的定位;
图3颅骨右侧骨洞的立体定位;
图4兔脑血肿演变过程的mri成像;(a)24h;(b)3d;(c)7d;(d)14d;(e)30d;(a-e代表五个时间点,横向表示同一兔脑在同一时间不同层面的mri图像)。
具体实施方式
本发明公开了一种动物脑干出血模型及其建立方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明提供的动物脑干出血模型及其建立方法中所用试剂或仪器均可由市场购得。
下面结合实施例,进一步阐述本发明:
实施例1
本实验选择健康成年新西兰大白兔25只,雌雄不限,体重为3.0-3.6kg,均由苏州大学动物实验中心提供。
造模过程:将兔俯卧位固定在立体定位仪上,调整兔头位置,使前囟位置高于后囟1.5mm,兔头适配器固定兔头,如图1。根据兔脑在立体定位仪中的坐标图谱,如图2、3,在立体定位仪下,以囟门为原点,用微量注射器抽取0.5uvii型胶原酶(0.25u/μl),用微量注射泵注射到右侧脑干部位的皮质脊髓束,坐标位点为:前囟后8mm,中线右侧旁2mm坐标点,深度为20.0mm,注射速度为0.25μl/min。注入结束后留针10min,然后缓慢退针。
造模结果:实验兔术后24h内即出现向左侧扭颈、左侧肢体偏瘫、无法站立、意识下降以及单侧或双侧眼球向外膨出、充血等症状,神经功能评分(purdy评分)为7.32±1.49,术后24h进行头颅磁共振扫描可见右侧脑干部位存在低信号影,证明颅内血肿形成,造模成功,如图4。
解剖兔脑可见右侧脑干部位血肿形成,进一步证明颅内血肿形成,造模成功。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!