溶质载体39成员5的功能丧失啮齿动物模型的制作方法
溶质载体39成员5的功能丧失啮齿动物模型
1.相关申请的交叉引用
2.本技术要求2019年3月15日提交的美国临时申请号62/818,872和2020年2月14日提交的美国临时申请号62/976,437的优先权权益,这两个临时申请的全部内容以引用的方式并入本文。
技术领域
3.本公开涉及一种啮齿动物模型。更具体而言,本公开涉及溶质载体39成员5(slc39a5)啮齿动物模型的功能丧失。具体而言,本文公开了携带内源性slc39a5基因中的功能丧失突变的经遗传修饰的啮齿动物以及此类啮齿动物在阐明slc39a5在锌稳态、血糖调节和脂质代谢中的作用中的用途。
4.序列表以引用的方式并入
5.序列表为2020年3月11日创建的名称为36843pct_10535wo01_sequencelisting、大小为23kb的ascii文本文件,其经由efs
‑
web提交给美国专利及商标局,并且以引用的方式并入本文。
背景技术:
6.贯穿本说明书引用各种参考文献,包括专利、专利申请、登录号、技术文章和学术文章。每一参考文献以全文引用的方式并入本文中且用于所有目的。
7.锌稳态是受到严格控制的,这反映了锌在大量蛋白质功能中的重要作用。锌代谢受损在包括心血管疾病和糖尿病在内的慢性疾病中尤为突出。在人类中进行的随机安慰剂对照锌补充试验表明ii型糖尿病患者的血糖特征有所改善。锌补充剂还显示出可以逆转啮齿动物的脂肪肝疾病。
8.锌的摄入和流出涉及两个锌转运蛋白家族:据信slc39a或zip家族的成员使锌转运至细胞的细胞质中(从胞外环境或从囊泡区室),并且据信slc30a或znt家族的成员使锌从胞质溶胶中流出(进入胞外环境或进入囊泡区室)。
技术实现要素:
9.本文公开了基因组包含内源性slc39a5基因的功能丧失突变的啮齿动物(例如,小鼠和大鼠),以及包含内源性slc39a5基因的功能丧失突变的分离的啮齿动物细胞(例如,es细胞)或组织。本文还公开了用于产生基因组包含内源性slc39a5基因的功能丧失突变的啮齿动物的组合物(例如,靶向载体)和方法。本文还公开了使用啮齿动物作为锌稳态、血糖调节和脂质代谢的动物模型的方法。
10.在一个方面,本文公开了一种基因组包含内源性啮齿动物slc39a5基因座处的内源性slc39a5基因中的功能丧失突变的啮齿动物。内源性啮齿动物slc39a5基因座处的内源性slc39a5基因的功能丧失突变导致从slc39a5基因座表达的功能性slc39a5多肽的缺乏,以及啮齿动物的循环锌水平的升高。
11.在一些实施方案中,功能丧失突变包括内源性啮齿动物slc39a5基因的外显子中的点突变。在一些实施方案中,功能丧失突变包括内源性啮齿动物slc39a5基因的编码序列的全部或部分缺失。在一些实施方案中,缺失包含内源性啮齿动物slc39a5基因的全部或部分外显子1和/或全部或部分外显子2。在一些实施方案中,缺失包含内源性啮齿动物slc39a5基因的外显子1的编码部分和外显子2的一部分。在一些实施方案中,缺失包含从外显子1中的atg起始密码子之后的核苷酸至内源性啮齿动物slc39a5基因的外显子2的3'末端之前的第五个核苷酸的核酸序列。
12.在一些实施方案中,在内源性slc39a5基因中包含功能丧失突变的啮齿动物slc39a5基因座还包含报告基因。
13.在一些实施方案中,报告基因在slc39a5基因座处可操作地连接至内源性slc39a5启动子。在具体实施方案中,slc39a5基因座包含从外显子1中的atg起始密码子之后的核苷酸开始至内源性啮齿动物slc39a5基因的外显子2的3'末端之前的第五个核苷酸的缺失,并且包含框内融合至slc39a5基因座的起始(atg)密码子的报告基因编码序列。
14.在一些实施方案中,报告基因是lacz。在一些实施方案中,报告基因选自由以下项组成的组:荧光素酶、绿色荧光蛋白(gfp)、增强型gfp(egfp)、青色荧光蛋白(cfp)、黄色荧光蛋白(yfp)、增强型黄色荧光蛋白(eyfp)、蓝色荧光蛋白(bfp)、增强型蓝色荧光蛋白(ebfp)、dsred和mmgfp。
15.在一些实施方案中,啮齿动物对于内源性slc39a5基因中的功能丧失突变是纯合的。在一些实施方案中,啮齿动物对于内源性slc39a5基因中的功能丧失突变是杂合的。
16.在某个实施方案中,啮齿动物是雄性啮齿动物。在一些实施方案中,啮齿动物是雌性啮齿动物。
17.在一些实施方案中,啮齿动物是小鼠。在一些实施方案中,啮齿动物是大鼠。
18.在一些实施方案中,啮齿动物是雌性啮齿动物,例如雌性小鼠,所述雌性啮齿动物对于内源性slc39a5基因中的功能丧失突变是纯合的。与在内源性slc39a5基因中无功能丧失突变的野生型啮齿动物相比,这种雌性啮齿动物表现出循环锌水平的升高。在一些实施方案中,与同窝仔对照相比,这种雌性啮齿动物表现出空腹血糖水平的降低。在一些实施方案中,诸如与高脂肪饮食的野生型啮齿动物相比,高脂肪饮食的雌性啮齿动物表现出肝锌水平的升高和血清丙氨酸氨基转移酶(alt)和天冬氨酸氨基转移酶(ast)(肝损伤的生物标志物)水平的改善。
19.在一些实施方案中,基因组包含内源性slc39a5基因中的功能丧失突变的啮齿动物还包含内源性啮齿动物瘦蛋白受体基因(lepr)中的功能丧失突变。内源性啮齿动物lepr基因中的功能丧失突变导致功能性瘦蛋白受体表达的缺乏。瘦蛋白受体缺陷啮齿动物已经被建立为肥胖诱导的ii型糖尿病的啮齿动物模型。将内源性slc39a5基因中的功能丧失突变引入瘦蛋白受体缺陷啮齿动物挽救了瘦蛋白受体缺陷导致的慢性高血糖。
20.在一些实施方案中,内源性啮齿动物lepr基因中的功能丧失突变包括内源性啮齿动物瘦蛋白受体基因的外显子中的点突变。在一些实施方案中,功能丧失突变包括内源性啮齿动物瘦蛋白受体基因的编码序列的全部或部分缺失。在一些实施方案中,缺失包括编码全部或部分胞外结构域的内源性啮齿动物lepr基因的核苷酸序列。在一些实施方案中,缺失包含内源性啮齿动物lepr基因的外显子1、外显子2、外显子3、外显子4、外显子5和/或
外显子6各自的全部或部分。在一些实施方案中,缺失包含内源性啮齿动物lepr基因的外显子1的编码部分和外显子2
‑
6。
21.本文还提供了本文公开的啮齿动物中的任一者的子代。
22.在另一个方面,本文公开了一种基因组包含内源性啮齿动物slc39a5基因座处的内源性啮齿动物slc39a5基因中的功能丧失突变的分离的啮齿动物细胞或组织。
23.在一些实施方案中,所述分离的啮齿动物细胞是啮齿动物胚胎干细胞或啮齿动物卵。
24.在另一个方面,本文公开了一种基因组包含内源性啮齿动物slc39a5基因座处的内源性啮齿动物slc39a5基因中的功能丧失突变的啮齿动物胚胎。
25.在又一个方面,本文公开了一种制备基因组包含内源性啮齿动物slc39a5基因座处的内源性啮齿动物slc39a5基因中的功能丧失突变的啮齿动物的方法。所述方法包括修饰啮齿动物基因组,以使得经修饰的啮齿动物基因组包含内源性啮齿动物slc39a5基因座处的内源性啮齿动物slc39a5基因中的功能丧失突变,以及获得包含经修饰的基因组的啮齿动物。
26.在一些实施方案中,通过将核酸序列引入啮齿动物胚胎干细胞的基因组来修饰啮齿动物基因组,所述核酸序列包含与内源性啮齿动物slc39a5基因座处的核酸序列同源的多核苷酸序列,以使得经修饰的基因组包含在slc39a5基因座处的内源性啮齿动物slc39a5基因中的功能丧失突变,从而获得经遗传修饰的啮齿动物胚胎干细胞,以及使用所述经遗传修饰的啮齿动物胚胎干细胞来制作啮齿动物。
27.在一些实施方案中,功能丧失突变是通过这样的方法制备的啮齿动物:所述方法包括内源性啮齿动物slc39a5基因的外显子中的点突变。在一些实施方案中,功能丧失突变包括内源性啮齿动物slc39a5基因的编码序列的全部或部分缺失。在一些实施方案中,缺失包含内源性啮齿动物slc39a5基因的全部或部分外显子1和/或全部或部分外显子2。在一些实施方案中,缺失包含内源性啮齿动物slc39a5基因的外显子1的编码部分和外显子2的一部分。在一些实施方案中,缺失包含从外显子1中的atg起始密码子之后的核苷酸至内源性啮齿动物slc39a5基因的外显子2的3'末端之前的第五个核苷酸的核酸序列。
28.在一些实施方案中,通过本方法制备的啮齿动物还包含报告基因。例如,报告基因可以包含在被引入啮齿动物胚胎干细胞的基因组的核酸序列中。在一些实施方案中,报告基因在经修饰的基因组中的slc39a5基因座处可操作地连接至内源性slc39a5启动子。在具体实施方案中,经修饰的基因组的slc39a5基因座包含从外显子1中的atg起始密码子之后的核苷酸开始至内源性啮齿动物slc39a5基因的外显子2的3'末端之前的第五个核苷酸的缺失,并且包含框内融合至slc39a5基因座的起始(atg)密码子的报告基因编码序列。
29.在一些实施方案中,报告基因是lacz。在一些实施方案中,报告基因选自由以下项组成的组:荧光素酶、绿色荧光蛋白(gfp)、增强型gfp(egfp)、青色荧光蛋白(cfp)、黄色荧光蛋白(yfp)、增强型黄色荧光蛋白(eyfp)、蓝色荧光蛋白(bfp)、增强型蓝色荧光蛋白(ebfp)、dsred和mmgfp。
30.在一些实施方案中,通过本方法制备的啮齿动物还包含选择性标记。例如,选择性标记基因可以包含在被引入啮齿动物胚胎干细胞的基因组的核酸序列中。在一些实施方案中,核酸序列可以另外包含侧接选择性标记基因的位点特异性重组酶识别位点,所述位点
特异性重组酶识别位点被定向为引导由重组酶进行的选择性标记的切除。
31.在一些实施方案中,通过本方法制备的啮齿动物对于内源性slc39a5基因中的功能丧失突变是杂合的。对于内源性slc39a5基因中的功能丧失突变杂合的啮齿动物可以彼此繁育,以获得对于内源性slc39a5基因中的功能丧失突变纯合的啮齿动物。
32.在某个实施方案中,通过本方法制备的啮齿动物是雄性啮齿动物。在一些实施方案中,通过本方法制备的啮齿动物是雌性啮齿动物。
33.在一些实施方案中,通过本方法制备的啮齿动物是小鼠。在一些实施方案中,通过本方法制备的啮齿动物是大鼠。
34.在另一个方面,本文公开了一种靶向核酸构建体,所述靶向核酸构建体包含待整合进内源性啮齿动物slc39a5基因座处的啮齿动物slc39a5基因的核酸序列,所述核酸序列侧接有与啮齿动物slc39a5基因座处的核苷酸序列同源的5'核苷酸序列和3'核苷酸序列,其中所述核酸序列整合进啮齿动物slc39a5基因中导致如本文所述的内源性啮齿动物slc39a5基因中的功能丧失突变。可以设计靶向核酸构建体以将所述核酸序列整合进内源性小鼠或大鼠slc39a5基因座处的小鼠或大鼠slc39a5基因中。在一些实施方案中,待整合进内源性啮齿动物slc39a5基因座处的啮齿动物slc39a5基因的核酸序列包含报告基因。在一些实施方案中,待整合进内源性啮齿动物slc39a5基因座处的啮齿动物slc39a5基因的核酸序列包含选择性标记基因。
35.在另一个方面,本文公开了一种繁育方法,所述繁育方法包括使基因组包含内源性啮齿动物slc39a5基因中的功能丧失突变的第一啮齿动物与第二啮齿动物进行繁育,以产生基因组包含内源性啮齿动物slc39a5基因中的功能丧失突变的子代啮齿动物。
36.在一些实施方案中,第二啮齿动物包含内源性啮齿动物瘦蛋白受体基因(lepr)中的功能丧失突变。在一些实施方案中,内源性啮齿动物lepr基因中的功能丧失突变包括内源性啮齿动物lepr基因的外显子中的点突变。在一些实施方案中,功能丧失突变包括内源性啮齿动物lepr基因的编码序列的全部或部分缺失。在一些实施方案中,缺失包含编码全部或部分胞外结构域的内源性啮齿动物lepr基因的核苷酸序列。在一些实施方案中,缺失包含内源性啮齿动物lepr基因的外显子1、外显子2、外显子3、外显子4、外显子5和/或外显子6各自的全部或部分。在一些实施方案中,功能丧失突变包含内源性啮齿动物lepr基因的外显子1至外显子6的编码部分的缺失和报告基因的插入。
37.在另一个方面,本文公开了使用基因组包含内源性slc39a5基因中的功能丧失突变的啮齿动物作为动物模型的用途,所述动物模型允许阐明slc39a5在血糖调节背景下的作用机制,并且提供测试和开发在代谢和心血管疾病的治疗中靶向slc39a5的疗法的机会。
38.在一些实施方案中,将基因组包含内源性slc39a5基因中的功能丧失突变的啮齿动物用于测试、筛选或鉴定抑制slc39a5蛋白活性的药剂的方法。根据这种方法,将基因组包含内源性slc39a5基因中的功能丧失突变的啮齿动物与无突变的野生型啮齿动物一起使用,并且将候选药剂施用于野生型啮齿动物。检查野生型啮齿动物和具有功能丧失突变的啮齿动物,以测量血清锌水平以及一种或多种代谢和心血管性状,包括一种或多种肝脏、脂质或血糖性状。将药剂施用后野生型啮齿动物、施用前野生型啮齿动物(或未施用药剂的另一种野生型啮齿动物)以及具有丧失功能突变的啮齿动物的测量结果彼此比较,以确定所述药剂是否抑制slc39a5蛋白的活性。
39.在一些实施方案中,所测量的性状中的至少一种是在用高脂肪饮食喂养啮齿动物后丙氨酸氨基转移酶和/或天冬氨酸氨基转移酶的血清水平,在一些实施方案中,所述高脂肪饮食是高脂肪高果糖饮食(“hffd”)。在一些实施方案中,所测量的性状中的至少一种是在用高脂肪饮食(例如hffd)喂养啮齿动物后肝脏切片的肝性脂肪变性。在一些实施方案中,所测量的性状中的至少一种是血清中的空腹血糖水平。在一些实施方案中,所测量的性状中的至少一种是体重。在一些实施方案中,所测量的性状中的至少一种是低密度脂蛋白(ldl)的水平或高密度脂蛋白(hdl)的水平。在一些实施方案中,另外检查啮齿动物,以测量血清中的锌水平。
40.已经鉴定的抑制slc39a5蛋白的活性的药剂可用于治疗代谢和心血管疾病,包括例如血清葡萄糖水平的升高、高血糖、2型糖尿病、肥胖、低密度脂蛋白(ldl)的升高、高密度脂蛋白(hdl)的降低、酒精性脂肪肝疾病、非酒精性脂肪肝疾病、非酒精性脂肪性肝炎和肝性脑病。
附图说明
41.本专利文件含有至少一个用彩色表现的附图。本专利带有彩色附图的副本将会根据要求且在支付必要的费用后由专利及商标局提供。
42.图1a
‑
b描绘了人类slc39a5蛋白的结构域和拓扑结构。跨膜结构域(tm)被标记为跨越前20个氨基酸的信号肽。拓扑胞外和胞质结构域分别以红色和黄色呈现。
43.图2列出了人类、小鼠和大鼠slc39a5蛋白序列(分别为seq id no:2、4和6)的比对。星号(*)表示全部三个序列共有的氨基酸残基。
44.图3描绘了用于产生slc39a5基因消除缺失的示例性靶向策略,在该消除缺失中
·
‑
半乳糖苷酶(lacz)报告基因盒插入小鼠的野生型slc39a5等位基因中。星号(*)表示用于基因分型的等位基因丧失(loa)或等位基因获得(goa)。
45.图4a
‑
c描绘了在12周龄时,slc39a5功能丧失小鼠的体重、空腹血糖和血清锌水平。(a)在12周时,与杂合功能丧失小鼠和野生型小鼠相比,雄性和雌性纯合功能丧失小鼠的体重略有减轻。(b)在12周龄时,与杂合功能丧失小鼠和野生型小鼠相比,雌性纯合功能丧失小鼠的空腹血糖水平降低。在该龄时,未观察到雄性小鼠中的差异。(c)在12周龄时,与野生型小鼠相比,雄性和雌性杂合和纯合功能丧失小鼠的血清锌水平显著升高。
46.图5a
‑
b描绘了对于高脂肪饮食方案,在40周时,slc39a5功能丧失小鼠的血清锌、肝锌、丙氨酸氨基转移酶和天冬氨酸氨基转移酶水平。(a)对于正常饮食(nc)或高脂肪饮食(hfd),与野生型小鼠相比,雌性纯合功能丧失小鼠的血清锌和肝锌水平升高。此外,对于高脂肪饮食(hfd),与野生型小鼠相比,雌性纯合功能丧失小鼠的丙氨酸氨基转移酶和天冬氨酸氨基转移酶水平降低。(b)在40周时,对于正常饮食(nc)或高脂肪饮食(hfd),与野生型小鼠相比,雄性纯合功能丧失小鼠的血清锌水平升高。对于正常饮食(nc)或高脂肪饮食(hfd),与野生型小鼠相比,未观察到雄性纯合功能丧失小鼠中的肝锌、丙氨酸氨基转移酶和天冬氨酸氨基转移酶水平的统计学显著性差异。
47.图6a
‑
b显示了对于高脂肪饮食方案,在40周时,slc39a5功能丧失小鼠的肝脏的组织学分析。(a)苏木精和伊红染色的肝脏切片的组织化学比较表明,对于高脂肪饮食(hfd),与野生型小鼠相比,高脂肪饮食的雌性纯合功能丧失小鼠的肝性脂肪变性减少。(b)苏木精
和伊红染色的肝脏切片的组织化学比较表明,对于高脂肪饮食(hfd),与野生型小鼠相比,高脂肪饮食的雄性纯合功能丧失小鼠之间无明显差异。
48.图7a
‑
b描绘了在20周龄时,对于正常饮食,slc39a5和瘦蛋白受体(lepr)功能丧失突变纯合的雌性小鼠的血清化学和口服葡萄糖耐量测试结果。(a)在20周时,与lepr功能丧失小鼠相比,slc39a5和lepr功能丧失突变纯合的小鼠的丙氨酸氨基转移酶、天冬氨酸氨基转移酶、低密度脂蛋白胆固醇和空腹血糖水平降低。(b)此外,在20周时,与lepr功能丧失小鼠相比,slc39a5和lepr功能丧失突变纯合的雌性小鼠显示出葡萄糖耐量的改善。
49.图8.slc39a5功能丧失改善了高脂肪高果糖饮食挑战后的空腹血糖。高脂肪高果糖饮食挑战导致两种性别、所有基因型的体重显著增加。slc39a5的功能丧失改善了肝功能,如通过在16周时两种性别的血清alt和ast所评估。重要的是,slc39a5功能丧失显著改善了通过终点(29周)的空腹血糖水平评估的高血糖。“nc”:正常饮食(nc);“hffd”:高脂肪高果糖饮食。体重
‑
27周;血糖测量:喂食
‑
25周和禁食(16小时禁食)
‑
29周;锌34ppm;*p<0.05,**p<0.01;误差棒:sem。
50.图9.slc39a5功能丧失改善了高脂肪高果糖饮食挑战的小鼠的胰岛素敏感性。与通过口服葡萄糖耐量测试(“gtt”)评估的野生型小鼠相比,slc39a5功能丧失(无论性别)纯合的小鼠显示出胰岛素敏感性显著改善。高脂肪高果糖(hffd)或正常饮食(nc)18周;锌34ppm;o禁食16小时后gtt,2mg/g体重;*p<0.05,**p<0.01。
51.图10.slc39a5功能丧失改善了高脂肪高果糖饮食(“hffd”)挑战后的肝性脂肪变性。slc39a5功能丧失雌性小鼠比雄性小鼠受到更多的保护。nafld综合评分(由两名独立病理学者评估)表示大囊泡性脂肪变性、微囊泡性脂肪变性、肝细胞肥大、炎症和纤维化的综合评分,该评分显示,与野生型小鼠相比,雌性slc39a5敲除小鼠的显著改善;而在雄性小鼠中,对于正常饮食,slc39a5丧失改善了肝性脂肪变性,并且当通过高脂肪高果糖饮食挑战时无保护作用,如通过组织病理学和nafld评分所展示。肝脏组织学
‑
29周;nafld综合评分:大囊泡性脂肪变性、微囊泡性脂肪变性、肝细胞肥大、炎症、纤维化;*p<0.05,**p<0.01;误差棒:sem。
52.图11a
‑
11b.slc39a5功能丧失导致肝锌水平升高,进而导致肝金属硫蛋白(“mt1”和“mt2”)表达升高。此外,slc39a5功能丧失不会显著影响肝铁、铜、钴、钙和镁的水平。11a:雌性小鼠;11b:雄性小鼠。肝脏离子定量和taqman分析
‑
29周;*p<0.05,**p<0.01;误差棒:sem。
53.图12a
‑
12b.在人类肝癌hepg2细胞(12a)和人类原代肝细胞(12b)中,锌以剂量依赖性方式急性活化lkb1/ampk和akt信号传导通路。10hu肝细胞*(5个供体的库):hm cpp5,thermofisher。
54.图13a.slc39a5功能丧失改善了高脂肪高果糖饮食挑战的雌性小鼠的肝性脂肪变性。此外,在高脂肪高果糖饮食挑战的雌性小鼠中,slc39a5功能丧失导致肝锌水平升高,同时活化肝脏ampk和akt信号传导。为支持这些观察结果,肝甘油三酯水平随着肝β
‑
羟丁酸水平的升高而降低,这表明β
‑
氧化增加。此外,slc39a5功能丧失分别导致与从头脂肪生成和肝脏糖异生相关的fasn和g6pc基因的下调。肝脏裂解物
‑
29周;*p<0.05,**p<0.01;误差棒:sem。
55.图13b.slc39a5功能丧失改善了正常饮食喂食的雄性小鼠的肝性脂肪变性。此外,
在高脂肪高果糖饮食挑战的雄性小鼠中,slc39a5的丧失导致肝锌水平的升高不显著,同时适度活化肝脏ampk信号传导。随着肝β
‑
羟丁酸水平的升高,肝甘油三酯水平略有降低。此外,slc39a5功能丧失分别导致与从头脂肪生成和肝脏糖异生相关的基因fasn的适度抑制和g6pc的显著下调。肝脏裂解物
‑
29周;*p<0.05,**p<0.01;误差棒:sem。
56.图14.slc39a5功能丧失改善了瘦蛋白受体缺陷小鼠的肝功能和空腹血糖。先天性瘦蛋白受体缺陷导致两种性别的lepr
‑
/
‑
和slc39a5
‑
/
‑
;lepr
‑
/
‑
小鼠的体重显著增加。slc39a5功能丧失改善了瘦蛋白受体缺陷小鼠(两种性别)的肝功能,如通过22周时的血清alt和ast所评估。重要的是,slc39a5功能丧失显著改善了瘦蛋白受体缺陷小鼠(两种性别)的高血糖,如通过34周时空腹血糖水平降低所展示。正常饮食(锌87ppm);空腹血糖:32周(喂食)和34周(16小时/禁食);*p<0.05,**p<0.01;误差棒:sem。
57.图15.与瘦蛋白受体缺陷(lepr
‑
/
‑
)小鼠相比,瘦蛋白受体缺陷小鼠(两种性别)的
slc39a5
功能丧失导致胰岛素敏感性改善,如通过口服葡萄糖耐量测试(“gtt”)所评估。正常饮食;锌87ppm;o禁食16小时后gtt(20周)
–
2mg/g体重;*p<0.05,**p<0.01;误差棒:sem。
58.图16.slc39a5功能丧失改善了瘦蛋白受体缺陷小鼠(两种性别)的肝性脂肪变性。
59.图17.slc39a5功能丧失导致肝锌水平升高,进而导致瘦蛋白受体缺陷小鼠(两种性别)的肝金属硫蛋白(“mt1”和“mt2”)表达升高。此外,slc39a5功能丧失不会显著影响这些小鼠的肝铁水平。肝脏离子定量和taqman分析
‑
29周;*p<0.05,**p<0.01;误差棒:sem。
60.图18a
‑
18b.slc39a5功能丧失改善了两种性别(18a雌性;18b雄性)的瘦蛋白受体缺陷小鼠的肝性脂肪变性。此外,slc39a5功能丧失导致瘦蛋白受体缺陷小鼠(两种性别)的肝锌水平升高,同时活化肝脏ampk信号传导。为支持这些观察结果,肝甘油三酯水平随着肝β
‑
羟丁酸水平的升高而降低,这表明β
‑
氧化增加。此外,slc39a5丧失导致fasn下调,这表示从头脂肪生成减少。肝脏裂解物
‑
29周;*p<0.05,**p<0.01;误差棒:sem。
具体实施方式
61.本文公开了一种slc39a5功能丧失的啮齿动物模型。具体而言,本文公开了携带内源性啮齿动物slc39a5基因中的功能丧失突变的经遗传修饰的啮齿动物。与人类的观察结果(即欧洲血统的杂合功能丧失携带者与血清锌水平升高和ii型糖尿病预防相关)一致的是,本文已经展示出内源性slc39a5基因的纯合和杂合失活均导致啮齿动物中的循环锌水平升高。此外,本文已经显示,与高脂肪饮食的野生型啮齿动物相比,高脂肪饮食的slc39a5功能丧失纯合的雌性小鼠表现出(i)与同窝仔对照相比空腹血糖水平降低,以及(ii)肝锌水平升高以及血清alt和ast(肝损伤的生物标志物)水平的改善。此外,本文已经显示,瘦蛋白受体缺陷小鼠(肥胖诱导的ii型糖尿病的小鼠模型)中的slc39a5的功能丧失挽救了慢性高血糖。因此,本文提供的经工程化的啮齿动物模型重现了人类slc39a5功能丧失表型,从而提供了一个阐明和开发治疗血糖失调、代谢和心血管疾病的slc39a5抑制疗法的有价值的模型。
62.下文详细描述了本公开的各个方面。
63.slc39a5编码溶质载体39成员5,它是一种对于控制细胞锌水平至关重要的锌转运蛋白。slc39a5主要在小肠、肾脏、肝脏和胰腺中表达,并且被认为可调节锌稳态。
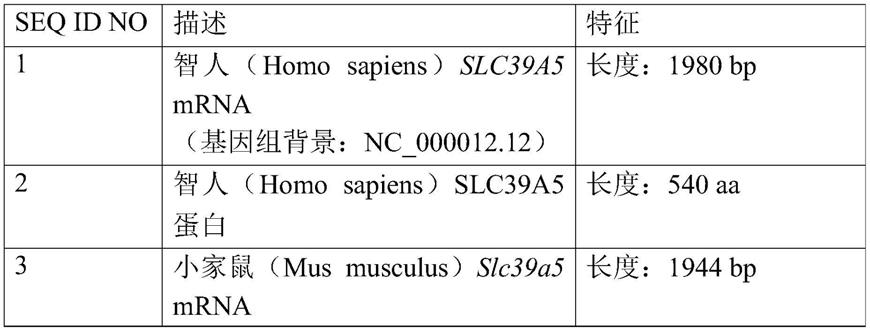
64.来自人类、小鼠和大鼠的示例性mrna和蛋白质序列可在genbank中从以下登录号
获得,并且在序列表中也示为seq id no:1
‑
6。
65.表1
[0066][0067][0068]
蛋白质结构在物种间非常保守。如图1a
‑
1b所示,slc39a5蛋白含有一个信号肽、一个n
‑
末端胞外区段和六个跨膜区段,它们通过三个胞质结构域(环)和两个胞外结构域(环)彼此连接。
[0069]
基因组结构在物种间也是保守的。为了展示,图3描绘了由十个编码外显子组成的小鼠slc39a5基因的基因组结构,其中第一编码外显子被命名为外显子1。
[0070]
本文公开了基因组包含内源性slc39a5基因中的功能丧失突变的啮齿动物(例如,小鼠和大鼠)。
[0071]
术语“突变”包括基因中一个或多个核苷酸的添加、缺失或取代。如本文所用,术语“突变”、“改变”和“变异”可互换使用。突变基因(或基因的突变等位基因)在本文中被理解为包括相对于野生型基因或参照基因的突变、改变或变异。在一些实施方案中,突变是单个核苷酸的取代。在其他实施方案中,突变是一个或多个核苷酸,例如基因的编码序列中的一个或多个核苷酸的缺失。在一些实施方案中,基因中的突变包括连续核酸序列,例如一个或多个外显子或所有外显子、基因的全部或部分编码序列的缺失。在一些实施方案中,基因中的突变导致编码蛋白中的一个或多个氨基酸的添加、缺失或取代。
[0072]
在一些实施方案中,突变是功能丧失突变。如本文所用,术语“功能丧失”包括完全功能丧失和部分功能丧失。在一些实施方案中,基因的改变导致相对于由不具有改变的参考基因编码的多肽具有至少减少的功能性并且在一些情况下具有显著减少的功能性或完全缺乏功能性的多肽的表达。因此,遗传改变可以导致完全功能丧失或部分功能丧失。
[0073]
在一些实施方案中,slc39a5基因中的功能丧失突变包括第一编码外显子(即,外显子1)的全部或部分,例如从atg密码子之后的核苷酸开始的外显子1的编码部分的缺失。在一些实施方案中,slc39a5基因中的功能丧失突变包括第二或后续编码外显子的全部或部分的缺失。在一些实施方案中,slc39a5基因中的功能丧失突变包括从atg密码子之后的核苷酸开始的外显子1的编码序列的缺失和第二编码外显子的全部或部分的缺失。在一些实施方案中,slc39a5基因中的功能丧失突变包括编码一个或多个或所有跨膜结构域的一个或多个序列的缺失。
[0074]
在一些实施方案中,基因组包含内源性slc39a5基因中的功能丧失突变的啮齿动物还包含报告基因的插入,并且其中报告基因可操作地连接至基因座处的内源性啮齿动物slc39a5启动子。
[0075]
在一些实施方案中,从第一编码外显子中的起始密码子之后的核苷酸开始至后续编码外显子(例如,第二、第三、第四、第五、第六、第七、第八、第九或第十编码外显子)的全部或部分的基因组片段已经缺失,并且报告基因紧接着内源性啮齿动物slc39a5基因的起始密码子的下游插入。在这种连接中,预期报告基因的表达类似于未经修饰的内源性啮齿动物slc39a5基因的表达模式。
[0076]
多种报告基因是所属领域中已知的并且适合用于本文中。在一些实施方案中,报告基因为lacz基因。在一些实施方案中,报告基因为编码选自由以下项组成的组的蛋白质的基因:荧光素酶、绿色荧光蛋白(gfp)、增强型gfp(egfp)、青色荧光蛋白(cfp)、黄色荧光蛋白(yfp)、增强型黄色荧光蛋白(eyfp)、蓝色荧光蛋白(bfp)、增强型蓝色荧光蛋白(ebfp)、dsred和mmgfp。
[0077]
对于本文所述的任何实施方案,啮齿动物可包括例如小鼠、大鼠和仓鼠。
[0078]
在一些实施方案中,啮齿动物为小鼠。在一些实施方案中,啮齿动物为c57bl品系的小鼠,例如选自c57bl/a、c57bl/an、c57bl/grfa、c57bl/kalwn、c57bl/6、c57bl/6j、c57bl/6byj、c57bl/6nj、c57bl/10、c57bl/10scsn、c57bl/10cr和c57bl/ola的c57bl品系。在其他实施方案中,啮齿动物是129品系的小鼠,例如选自129p1、129p2、129p3、129x1、129s1(例如,129s1/sv、129s1/svim)、129s2、129s4、129s5、129s9/svevh、129/svjae、129s6(129/svevtac)、129s7、129s8、129t1、129t2的129品系(参见例如festing等人(1999),mammalian genome 10:836;auerbach等人(2000),biotechniques 29(5):1024
‑
1028,1030,1032)。在一些实施方案中,啮齿动物是其为前述129品系和前述c57bl/6品系的混合物的小鼠。在某些实施方案中,小鼠是前述129品系的混合物(即杂种)、或前述c57bl品系的混合物、或c57bl品系和129品系的混合物。在某些实施方案中,小鼠是c57bl/6品系与129品系的混合物。在具体实施方案中,小鼠是vgf1品系,也称为f1h4,其为c57bl/6和129的杂种。在其他实施方案中,小鼠是balb品系,例如balb/c品系。在一些实施方案中,小鼠是balb品系和另一个前述品系的混合物。
[0079]
在一些实施方案中,啮齿动物为大鼠。在某些实施方案中,大鼠选自wistar大鼠、lea品系、sprague dawley品系、fischer品系、f344、f6和dark agouti。在其他实施方案中,大鼠是选自以下的两个或更多个品系的混合物:wistar、lea、sprague dawley、fischer、f344、f6和dark agouti。
[0080]
本文还公开了分离的啮齿动物细胞或组织,其包含本文所述的内源性slc39a5基
因中的功能丧失突变。在一些实施方案中,分离的啮齿动物细胞是胚胎干(es)细胞。还提供了在内源性slc39a5基因中包含功能丧失突变的啮齿动物胚胎和卵。
[0081]
本文公开了用于产生在内源性slc39a5基因中具有功能丧失突变的啮齿动物的方法。
[0082]
所述方法包括修饰啮齿动物基因组,以使得经修饰的啮齿动物基因组包含内源性啮齿动物slc39a5基因座处的内源性啮齿动物slc39a5基因中的功能丧失突变,以及获得包含经修饰的基因组的啮齿动物。
[0083]
在一些实施方案中,啮齿动物基因组通过例如采用锌指核酸酶(zfn)、转录激活因子样效应物核酸酶(talen)或cas蛋白(即,crispr/cas系统)来修饰,以使得经修饰的基因组包含内源性啮齿动物slc39a5基因座处的内源性啮齿动物slc39a5基因中的功能丧失突变。
[0084]
在一些实施方案中,啮齿动物基因组通过将核酸序列引入啮齿动物胚胎干(es)细胞的基因组来修饰,其中所述核酸序列包含与内源性啮齿动物slc39a5基因座处的核酸序列同源的多核苷酸序列,以便能够介导核酸序列至es细胞的基因组的同源重组,从而使得经修饰的基因组包含slc39a5基因座处的内源性啮齿动物slc39a5基因中的功能丧失突变,从而获得经遗传修饰的啮齿动物胚胎干细胞,以及使用经遗传修饰的啮齿动物胚胎干细胞来制作啮齿动物。
[0085]
在一些实施方案中,在靶向核酸构建体(即,靶向载体),优选地dna载体中提供待引入啮齿动物es细胞的基因组中的核酸序列(即,插入核酸)。在一些实施方案中,插入核酸还含有选择性标记基因(例如,含有选择性标记基因的自缺失盒,如美国专利号8,697,851、8,518,392和8,354,389中所述,这些专利全部以引用的方式并入本文),所述基因可以侧接有或包含位点特异性重组位点(例如,loxp、frt等)。可以将选择性标记基因置于突变附近的载体上,以使转染子易于选择。在一些实施方案中,插入核酸还含有报告基因。
[0086]
在一些实施方案中,可以通过例如电穿孔将靶向载体(例如,bac载体)引入啮齿动物胚胎干(es)细胞中。本领域已经描述了小鼠es细胞和大鼠es细胞。参见,例如us 7,576,259、us 7,659,442、us 7,294,754和us2008
‑
0078000a1(所有所述专利均以引用的方式并入本文)描述了小鼠es细胞和用于制备经基因修饰的小鼠的方法;并且us2014/0235933a1和us 2014/0310828 a1(所有所述专利均以引用的方式并入本文)描述了大鼠es细胞和制备经基因修饰的大鼠的方法。
[0087]
通过在整合位点引入染色体dna的断裂可以促进受体细胞中的同源重组,这可以通过将某些核酸酶靶向整合的特异性位点来实现。在目标基因座识别dna序列的dna结合蛋白是本领域中已知的。在一些实施方案中,利用识别靶序列中特定的3
‑
核苷酸序列的锌指核酸酶(zfn)。在一些实施方案中,将转录活化因子样(tal)效应子核酸酶(talen)用于位点特异性基因组编辑。在其他实施方案中,利用由组分(cas9和tracrrna)和靶标特异性crispr rna(crrna)组成的rna引导核酸内切酶(rgen)。
[0088]
在一些实施方案中,将侧接有5'和3'同源臂的携带所关注的核酸(例如,待引入的突变啮齿动物slc39a5基因序列)的靶向载体与一种或多种另外的载体或mrna一起引入细胞中。在一个实施方案中,所述一个或多个额外载体或mrna含有编码位点特异性核酸酶的核苷酸序列,所述位点特异性核酸酶包括(但不限于)锌指核酸酶(zfn)、zfn二聚体、转录活
化因子样效应子核酸酶(talen)、tal效应子结构域融合蛋白和rna指导的dna核酸内切酶。
[0089]
可以选择具有整合在基因组中的突变型基因序列的es细胞。选择之后,可以修饰阳性es克隆,例如,在必要时除去自缺失盒。随后可以将具有整合在基因组中的突变的es细胞用作供体es细胞以通过使用方法(参见例如us 7,576,259、us 7,659,442、us 7,294,754和us 2008/0078000 a1)或us 2014/0235933 a1和us 2014/0310828 a1中描述的方法注射到桑椹胚前期胚胎(例如,8细胞期胚胎)中。孵育包含供体es细胞的胚胎直至胚泡期,然后植入到代理孕母体中以产生完全源自供体es细胞的f0啮齿动物。使用检测突变序列或选择性标记基因的存在的等位基因修饰(moa)测定法(valenzuela等人,同上),通过对从剪尾分离的dna进行基因分型,可以鉴定出具有突变等位基因的啮齿动物幼崽。
[0090]
本文还提供了将如本文所述的经遗传修饰的啮齿动物与另一种啮齿动物进行繁育的方法,以及从这种繁育获得的子代。
[0091]
在一些实施方案中,提供了一种包括使如上文所述的第一经遗传修饰的啮齿动物(例如,基因组包含内源性啮齿动物slc39a5基因座处的功能丧失slc39a5突变的啮齿动物)与第二啮齿动物进行繁育,以产生基因组包含功能丧失slc39a5突变的子代啮齿动物的方法。子代可以具有从繁育中所用的第二啮齿动物遗传的其他所期望的表型或遗传修饰。在一些实施方案中,子代啮齿动物对于功能丧失slc39a5突变是杂合的。在一些实施方案中,子代啮齿动物对于功能丧失slc39a5突变是纯合的。
[0092]
在一些实施方案中,提供了一种基因组包含内源性啮齿动物slc39a5基因座处的功能丧失slc39a5突变的子代啮齿动物,其中所述子代啮齿动物通过包括使如上文所述的第一经遗传修饰的啮齿动物(例如,基因组包含内源性啮齿动物slc39a5基因座处的功能丧失slc39a5突变的啮齿动物)与第二啮齿动物进行繁育的方法来产生。在一些实施方案中,子代啮齿动物对于功能丧失slc39a5突变是杂合的。在一些实施方案中,子代啮齿动物对于功能丧失slc39a5突变是纯合的。
[0093]
在一些实施方案中,第二啮齿动物包含内源性啮齿动物瘦蛋白受体基因(lepr)中的功能丧失突变。
[0094]
瘦蛋白受体属于i类细胞因子受体家族,以五种不同的同种型存在。五种同种型中的四种具有相同的胞外结构域(负责配体结合)和跨膜结构域,但是其细胞内c
‑
末端结构域的长度和序列不同。第五同种型,称为“可溶性”或“分泌”同种型,不含有跨膜结构域,并且由啮齿动物中的第五可变剪接转录变体编码,同时由人类跨膜同种型的蛋白水解切割产生。蛋白质结构、lepr基因的基因组组织、作用机制以及瘦蛋白受体缺陷与肥胖之间的关联在本领域中有所记载(参见,例如,dam等人,载于leptin:regulation and clinical applications,s.dagogo
‑
jack(编),springer international publishing switzerland 2015)。
[0095]
在一些实施方案中,内源性啮齿动物lepr基因中的功能丧失突变包括内源性啮齿动物lepr基因的外显子中的点突变。在一些实施方案中,功能丧失突变包括内源性啮齿动物lepr基因的编码序列的全部或部分缺失。在一些实施方案中,缺失包含编码全部或部分胞外结构域的内源性啮齿动物lepr基因的核苷酸序列。在一些实施方案中,缺失包含内源性啮齿动物lepr基因的外显子1、外显子2、外显子3、外显子4、外显子5和/或外显子6各自的
全部或部分。在一些实施方案中,功能丧失突变包含内源性啮齿动物lepr基因的外显子1至外显子6的编码部分的缺失和报告基因(例如,lacz)的插入。
[0096]
在另一个方面,本文公开了使用基因组包含内源性slc39a5基因中的功能丧失突变的啮齿动物作为动物模型的用途,所述动物模型允许阐明slc39a5在血糖调节背景下的作用机制,并且提供测试和开发在代谢和心血管疾病的治疗中靶向slc39a5的疗法的机会。
[0097]
在一些实施方案中,将基因组包含内源性slc39a5基因中的功能丧失突变的啮齿动物用于测试、筛选或鉴定抑制slc39a5蛋白活性的药剂的方法。根据这种方法,将基因组包含内源性slc39a5基因中的功能丧失突变的啮齿动物与无突变的野生型啮齿动物一起使用,并且将候选药剂施用于野生型啮齿动物。检查具有功能丧失突变的啮齿动物和野生型啮齿动物,以测量血清锌水平以及一种或多种代谢和心血管性状,包括一种或多种肝脏、脂质或血糖性状。将药剂施用后野生型啮齿动物、施用前野生型啮齿动物(或未施用药剂的另一种野生型啮齿动物)以及具有丧失功能突变的啮齿动物的测量结果彼此比较,以确定所述药剂是否抑制slc39a5蛋白的活性。相对于施用前的野生型啮齿动物(或未施用药剂的另一种野生型啮齿动物),导致血清锌水平升高和与具有功能丧失突变的啮齿动物相同方向的一种或多种性状改善的药剂被认为可抑制slc39a5蛋白的活性。
[0098]
在一些实施方案中,使用对于内源性slc39a5基因中的功能丧失突变纯合的啮齿动物。在一些实施方案中,使用对于内源性slc39a5基因中的功能丧失突变杂合的啮齿动物。
[0099]
在一些实施方案中,在内源性slc39a5基因中具有功能丧失突变的啮齿动物是雌性啮齿动物。在一些实施方案中,在内源性slc39a5基因中具有功能丧失突变的啮齿动物是雄性啮齿动物。
[0100]
在特定实施方案中,在内源性slc39a5基因中具有功能丧失突变的啮齿动物是对于功能丧失突变纯合的雌性啮齿动物(例如,小鼠或大鼠)。
[0101]
在一些实施方案中,候选药剂是对slc39a5蛋白(例如,人类slc39a5蛋白)具有特异性的抗体。
[0102]
如本文所公开,内源性slc39a5基因的纯合和杂合失活均导致啮齿动物血清锌水平的升高。导致血清锌水平升高和一种或多种性状的改善的药剂被认为是抑制slc39a5蛋白的活性的药剂。在一些实施方案中,相对于未施用药剂的野生型啮齿动物,药剂导致与药剂一起施用的野生型啮齿动物的血清锌水平升高至少10%、11%、12%、13%、14%、15%、20%、25%或更多。
[0103]
在一些实施方案中,所测量的性状中的至少一种是血糖性状,例如血清中的空腹血糖水平。本文已经显示,与同窝仔对照相比,对于slc39a5功能丧失纯合的雌性小鼠表现出空腹血糖水平的降低。因此,相对于未施用药剂的野生型啮齿动物,在施用药剂的野生型啮齿动物中导致空腹血糖水平降低的药剂被认为是抑制slc39a5蛋白的活性的药剂。在一些实施方案中,减少是至少5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%或更多。
[0104]
在一些实施方案中,所测量的性状中的至少一种是肝脏性状,例如丙氨酸氨基转移酶和/或天冬氨酸氨基转移酶的血清水平,或者高脂肪饮食喂养后啮齿动物的肝性脂肪变性的程度,并且在一些在实施方案中,高脂肪饮食是高脂肪高果糖饮食。本文已经显示,
与高脂肪饮食的野生型啮齿动物相比,高脂肪饮食的slc39a5功能丧失纯合的雌性小鼠表现出肝性脂肪变性减少和血清alt和ast水平的改善。相对于未施用药剂的野生型啮齿动物,在施用药剂的野生型啮齿动物中导致肝性脂肪变性减少的药剂被认为是抑制slc39a5蛋白的活性的药剂。与未施用药剂的高脂肪饮食的野生型啮齿动物相比,在高脂肪饮食和施用药剂的野生型啮齿动物中导致血清alt和/或ast水平的改善(即,降低)的药剂被认为是抑制slc39a5蛋白的活性的药剂。在一些实施方案中,改善(即,alt和/或ast水平的降低)是至少10%、15%、20%、25%、30%、35%、40%、45%、50%或更多。
[0105]
在一些实施方案中,所测量的性状中的至少一种是体重。slc39a5功能丧失纯合的雄性和雌性小鼠均在本文中显示出体重减轻。导致体重减轻的药剂被认为是抑制slc39a5蛋白的活性的药剂。已经鉴定的抑制slc39a5蛋白的活性的药剂可用于治疗代谢和心血管疾病,包括例如血清葡萄糖水平的升高、高血糖、2型糖尿病、肥胖、低密度脂蛋白(ldl)的升高、高密度脂蛋白(hdl)的降低、酒精性脂肪肝疾病、非酒精性脂肪肝疾病、非酒精性脂肪性肝炎和肝性脑病。
[0106]
本说明书通过下述实施例进一步示出,这些实施例不应以任何方式解释为限制性的。所有引用文献(包括贯穿本技术所引用的参考文献、发布的专利和公布的专利申请)的内容特此以引用的方式明确并入。
[0107]
实施例1.slc39a5功能丧失小鼠的产生。
[0108]
经基因工程改造的slc39a5
‑
/
‑
小鼠品系使用regeneron的技术来产生(valenzuela等人,nat biotechnol.2003;21(6):652
‑
9;poueymirou等人,nat biotechnol.2007;25(1):91
‑
9)。图3描述了策略。简而言之,c57bl/6ntac胚胎干细胞(esc)被靶向以消除slc39a5基因座的一部分,在起始atg密码子之后开始和在编码外显子2的3'末端之前的最后5个碱基对。该区域含有slc39a5信号肽和大部分n
‑
末端胞外结构域。lacz报告基因模块被插入slc39a5起始框内,然后是flox化的新霉素抗性盒,以便在esc中进行选择。在显微注射之前使用自缺失技术使抗性盒缺失。将靶细胞显微注射到来自charles river laboratories swiss webster白化病小鼠的8细胞胚胎中,产生100%来源于靶细胞的f0 (poueymirou等人,2007)。这些小鼠随后被繁育为纯合子。如本文所示使用slc39a5
‑
/+
杂合小鼠和c57bl/6ntac野生型同窝仔。
[0109]
实施例2.slc39a5功能丧失小鼠的代谢表型分型。
[0110]
slc39a5功能丧失小鼠的血清锌和空腹血糖水平。将slc39a5缺陷小鼠与杂合子和野生型同窝仔一起在受控环境中共同饲养(12小时光/暗周期,22
·
1℃,60
‑
70%湿度)并且随意饲喂含有87ppm锌的标准饮食(picolab rodent diet 20,产品目录#5053)。本研究中使用雄性和雌性小鼠。通过每月记录体重两次来监测小鼠的生长动力学。在禁食过夜(持续16小时)后,当小鼠为8周龄时,通过下颌下切口采集血液样品。血清锌使用如上文所述的火焰原子吸收光谱法测量(prasad等人,j lab clin.med.1963;61:537
‑
49),并且使用alphatrak血糖监测系统(zoetis united states,parsippany nj)来评估空腹血糖。
[0111]
长期高脂肪饮食(hfd)的slc39a5功能丧失小鼠的肝功能。将slc39a5功能丧失纯合的小鼠与野生型同窝仔一起在受控环境中共同饲养(12小时光/暗周期,22
·
1℃,60
‑
70%湿度)并且在6周龄开始随意饲喂含有35ppm锌的高脂肪饮食(测试饮食,产品目录#9gwp)。本研究中使用雄性和雌性小鼠。在禁食过夜(持续16小时)后,在高脂肪饮食挑战40
周时评估血清和肝锌水平以及alt和ast(肝损伤的生物标志物)(图5a
‑
b)。从jackson实验室获得一个单独的年龄匹配的野生型c57blk/6小鼠队列作为对照,它们用含有85ppm锌的正常饮食(实验室饮食,产品目录#5k52)维持。如上文所讨论,使用火焰原子吸收光谱法测量血清和肝脏锌的水平。使用advia chemistry xpt系统(siemens healthineers)来测量血清alt和ast水平。外植的肝脏样品在10%磷酸盐缓冲的福尔马林醋酸盐溶液中在4℃下固定过夜,在磷酸盐缓冲盐水中彻底冲洗并包埋在石蜡中。使用标准组织化学技术对5
·
m厚石蜡切片进行苏木精和伊红染色。使用evos fl auto显微镜(thermo fisher scientific)通过40
×
物镜对切片进行成像。
[0112]
slc39a5和瘦蛋白受体(lepr)功能丧失纯合的小鼠的肝脏、脂质和血糖性状。将slc39a5和lepr功能丧失纯合的雌性小鼠与同窝仔对照(野生型,slc39a5
‑
/
‑
,lepr
‑
/
‑
)一起在受控环境中共同饲养(12小时光/暗周期,22
·
1℃,60
‑
70%湿度)并且随意饲喂含有87ppm锌的正常饮食(picolab rodent diet 20,产品目录#5053)。定期监测小鼠的健康和生长动力学。在禁食过夜(持续16小时)后,当小鼠为22周龄时,测量血清alt和ast(肝损伤的生物标志物)以及ldl
‑
c和空腹血糖的水平。在22周龄时,口服葡萄糖耐量测试在禁食过夜(持续16小时)后通过口服管饲法施用2g/kg体重的葡萄糖(hospira inc,ndc 0409
‑
4902
‑
34)来进行。使用alphatrak血糖监测系统(zoetis united states,parsippany nj),通过从尾侧静脉采集血液样品,在定义的时间点(0、15、30、60和120分钟)评估血糖。
[0113]
数据分析。数据以平均值
·
sem报告。使用prism 6.0(graphpad软件)进行统计学分析。通过双因素anova或student t检验来分析所有参数。*p<0.5,**p<0.01。
[0114]
结果。与野生型和杂合同窝仔相比,slc39a5功能丧失纯合的小鼠在8周龄时体重减轻(图4a)。此外,无论性别如何,与野生型和杂合子同窝仔相比,slc39a5功能丧失纯合的小鼠在8周龄时血清锌水平显著升高(图4c)。有趣的是,与同窝仔对照相比,slc39a5功能丧失纯合的雌性小鼠的空腹血糖降低(图4b,左图)。在该龄时,未观察到雄性小鼠中的差异。
[0115]
为了研究空腹血糖水平的表观性别二态性,用高脂肪饮食方案(60%kcal来自脂肪)挑战slc39a5功能丧失纯合的小鼠(雄性和雌性)40周,并且与高脂肪饮食或正常饮食的野生型小鼠进行比较。虽然血清锌水平类似地增加(图5a
‑
b,最左图),但是与高脂肪饮食的野生型小鼠相比,只有雌性小鼠显示出肝锌水平的升高和血清alt和ast水平(肝损伤的生物标志物)的改善。与血清化学数据一致的是,外植的肝脏样品的定性组织化学分析表明,与高脂肪饮食的野生型小鼠相比,slc39a5功能丧失纯合的雌性小鼠的肝性脂肪变性减少。(图6a)。未观察到slc39a5功能丧失纯合的雄性小鼠和高脂肪饮食的野生型小鼠之间的差异(图6b,中图和右图)。
[0116]
为了进一步描绘这种表型,在同步实验中,将slc39a5功能丧失纯合的雌性小鼠繁育为瘦蛋白受体缺陷背景(肥胖诱导高血糖和ii型糖尿病的常用啮齿动物模型)。正如预期的那样,瘦蛋白受体缺陷小鼠是高血糖的并且表现出血清ldl
‑
c水平升高(图7a,下图)。此外,这些小鼠在22周龄时血清alt和ast水平升高,这表明肝功能受损。雌性lepr受体缺陷小鼠的slc39a5功能丧失使空腹血糖、血清ldl
‑
c、血清alt和ast水平显著降低,这潜在地改善了瘦蛋白受体缺陷小鼠的肥胖诱导的代谢失调(图7a)。与这些观察结果一致的是,slc39a5和lepr功能丧失纯合的雌性小鼠在用口服葡萄糖负荷挑战时表现出改善的葡萄糖耐量(图7b)。
[0117]
实施例3.slc39a5功能丧失小鼠的另外的代谢表型分型。
[0118]
代谢表型分型:
[0119]
将slc39a5功能丧失纯合或杂合的小鼠与野生型同窝仔一起在受控环境中共同饲养(12小时光/暗周期,22
·
1℃,60
‑
70%湿度)并且在10周龄开始随意饲喂高脂肪高果糖饮食(测试饮食,产品目录#5wk9)或含有35ppm锌的对照饮食(测试饮食,产品目录#58y2)。本研究中使用雄性和雌性小鼠。在禁食过夜(持续16小时)后,对血清锌、空腹血糖以及丙氨酸氨基转移酶(alt)和天冬氨酸氨基转移酶(ast)(肝损伤的生物标志物)进行纵向评估。在开始禁食之前测量进食血糖。如下文所讨论,使用火焰原子吸收光谱法进行血清和肝锌(终点)分析。
[0120]
将slc39a5和lepr功能丧失纯合的小鼠(slc39a5
‑
/
‑
;lepr
‑
/
‑
)与同窝仔对照(野生型,slc39a5
‑
/
‑
,lepr
‑
/
‑
)一起在受控环境中共同饲养(12小时光/暗周期,22
·
1℃,60
‑
70%湿度)并且随意饲喂含有87ppm锌的正常饮食(picolab rodent diet 20,产品目录#5053)。定期监测小鼠的健康和生长动力学。在禁食过夜(持续16小时)后,当小鼠为22周龄时,测量血清alt和ast(肝损伤的生物标志物)以及dldl和空腹血糖。使用alphatrak血糖监测系统(zoetis united states,parsippany nj),通过从尾侧静脉采集血液样品评估血糖。如下文所述,使用siemens advia chemistry xpt来测量肝脏和脂质性状。
[0121]
口服葡萄糖耐量测试:
[0122]
口服葡萄糖耐量测试在20周龄时禁食过夜(持续16小时)后通过口服管饲法施用2g/kg体重的葡萄糖(hospira inc,ndc 0409
‑
4902
‑
34)来进行。使用alphatrak血糖监测系统(zoetis united states,parsippany nj),通过从尾侧静脉采集血液样品,在定义的时间点(0、15、30、60和120分钟)评估血糖。
[0123]
肝脏和脂质性状:
[0124]
所有肝脏和脂质性状均使用advia chemistry xpt系统(siemens healthineers)来测量,该系统是fda批准的根据siemens的指南维护和操作的临床分析仪。肝脏和脂质谱含有以下试剂:丙氨酸氨基转移酶(alt,siemens ref 03036926)、天冬氨酸氨基转移酶(ast,siemens ref07499718)、胆固醇(chol,siemens ref 10376501)、直接hdl胆固醇(dhdl,siemens ref 07511947)、直接ldl胆固醇(dldl,siemens ref 09793248)、非酯化的脂肪酸(nefa,wako 999
‑
34691、995
‑
34791、991
‑
34891、993
‑
35191)、甘油三酯(trig,siemens ref 10335892)。当这些试剂与样品混合时,发生所关注的分析物特异性氧化还原反应,产生与分析物浓度成比例的颜色变化(比色测定法)。测量以分析物特异性波长为单位的吸光度(来自卤素光源)并且确定浓度。每套试剂均根据制造商的推荐进行校准,并且每天测量具有已知值(多级质量控制)的样品。绝不允许参数偏离已知平均值超过一个标准偏差。样品通常在未稀释的情况下进行测定,虽然它们可以稀释至1.5
×
而不影响结果。将样品加入分析仪中的0.6ml微量离心管中,所有试剂混合、测定计时、吸光度和浓度计算均由分析仪进行。
[0125]
金属离子定量:
[0126]
所有离子测量均使用agilent technologies 240 fs原子吸收光谱仪在火焰模式下进行。血清样品在去离子水中定量稀释并且随后进行分析。对于血清样品,seronorm痕量元素血清(l
‑
2)被用作参考。组织、骨骼和其他材料首先在硝酸中消化。将样品称重并且在
85℃下在硝酸中温育过夜。第二天,将样品冷却至室温,并且用去离子水定量转移至聚苯乙烯管中。随后对它们进行分析。对于所有组织样品,均使用来自美国国家标准与技术研究所的牛肝脏标准参考材料(srm 1577c)作为参考。
[0127]
肝脏组织学和免疫印迹:
[0128]
外植的肝脏样品在10%磷酸盐缓冲的福尔马林醋酸盐溶液中在4℃下固定过夜,在磷酸盐缓冲盐水中彻底冲洗并包埋在石蜡中。对于苏木精和伊红染色,使未染色的5
·
m厚石蜡切片在二甲苯中脱蜡,然后通过分级醇水合至水。切片用carazzi苏木精染色,在自来水中冲洗,然后放入95%乙醇中。自此开始,将它们放入伊红
‑
焰红染料溶液中,然后通过分级醇运行至二甲苯。在二甲苯之后,给染色的载玻片盖上盖玻片,并且使用aperio at2载玻片扫描仪(leica biosystems inc.)通过20
×
或40
×
物镜进行图像染色和成像。
[0129]
使用ripa缓冲液(cell signaling technology,产品目录#9806)和halt蛋白酶和磷酸酶抑制剂混合物(thermofisher scientific,产品目录#78440)来提取肝脏蛋白质。将每个样品的五微克蛋白质在nupage 4
‑
12%bis
‑
tris蛋白质凝胶(invitrogen,产品目录#wg1403box)中分离,并且使用转移系统(biorad)转移至硝酸纤维素膜。使用以下cell signaling technology抗体进行印迹:phospho
‑
ampkα(thr172)(cell signaling technology,产品目录#2535)、ampkα(cell signaling technology,产品目录#5831)、β
‑
肌动蛋白(sigma,产品目录#5441)、phospho
‑
akt(ser473)(cell signaling technology,产品目录#4060)、akt(cell signaling technology,产品目录#9272)、phospho
‑
lkb1(ser428)(cell signaling technology、产品目录#3482)、lkb1(cell signaling technology、产品目录#3050)、缀合至辣根过氧化物酶(hrp)的兔igg(cell signaling technology,产品目录#7074)和缀合至hrp的小鼠igg(cell signaling technology,产品目录#7076)。使用supersignal west femto底物(thermofisher scientific,产品目录#34095)对印迹进行显影。使用imagequant las4000(ge healthcare)来捕获信号。结果在图8
‑
18b中示出。
[0130]
[0131]
[0132]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1