芳樟醇在防治疫霉菌中的应用
1.本发明涉及植物源杀菌剂技术领域,具体涉及芳樟醇在防治疫霉菌中的应用。
背景技术:
2.大豆疫霉根腐病是由大豆疫霉菌引起,疫霉属菌物是属于卵菌门下腐霉科,绝大部分是兼性寄生物,许多疫霉菌的寄主范围很广,能侵染植物的各个部分。
3.大豆疫霉菌营半活体营养,在大豆的所有生育阶段均可侵染,给病害防治增加难度。近年来大豆疫霉根腐病的发生面积和危害程度越来越大,主要是田间管理不当、抗药性的产生、不科学种植等原因。大豆疫霉菌可在大豆任何生育阶段侵染,在大豆不同的生长时期,受到大豆疫霉侵染发病的部位不同。在播后苗前和苗期,大豆疫霉主要侵染大豆的地下部,引起种子腐烂或死苗。大豆疫霉病菌以抗逆性强的卵孢子在土壤、病残体、种子内越冬。
4.目前,生产上为了减轻该病造成的损失,不断尝试综合运用化学防治、农业防治、抗病育种、生物防治等多种方法控制大豆疫病,目前,防治卵菌的药剂甚少,市面上防治真菌病害的药剂由于卵菌和真菌亲缘关系较远,常用的杀真菌剂对防治大豆疫霉根腐病效果不佳,目前生产上主要依靠推广抗病品种进行防治。
5.另一方面,疫霉菌对大多数化学农药已经产生抗药性。因此,高效、低毒、低残留且对环境友好的植物源杀菌剂开始成为研究热点。
6.许多研究表明,很多植物具有抑制或杀死真菌等微生物的特性,实际上是植物精油起了真正作用。目前,有很多关于植物精油抑菌机理的研究,通常是认为精油的疏水性成分能够直接作用于微生物细胞膜,导致细胞膜的流动性增加,破坏了细胞膜结构,重要离子和内溶物从细胞内部渗出,最终导致细胞死亡。据研究报道,化感物质对微生物抑制方面的机制主要是直接作用于微生物,抑制菌丝或菌体以及产孢和孢子萌发,如胜红蓟所产生的胜红蓟素及黄酮类物质对柑橘炭疽病菌、水稻纹枯病菌、油菜菌核病菌等多种病原真菌的菌丝生长都有较强的抑制作用。利用精油对植物病原真菌进行防治是当今农药研究的热点之一。从总体来说,国内外对于植物源杀菌剂的应用开发研究还是比较落后,真正投入到市场上的植物源杀菌剂品种不多,这有待于加大研究,开发出具有市场竞争力的植物源杀菌剂品种。
7.如果找到具有新的具有药效的化合物,对防治大豆疫病有巨大意义,目前没有关于将芳樟醇用于防治疫霉菌的相关报道。
技术实现要素:
8.针对上述现有技术,本发明的目的是提供芳樟醇在防治疫霉菌中的应用,本发明研究发现,芳樟醇对大豆疫霉菌的菌丝径向生长、大豆疫霉菌游动孢子囊及游动孢子产生及游动孢子、大豆疫霉菌游动孢子的萌发均具有明显的抑制作用,对防治大豆疫病有巨大意义。
9.为实现上述目的,本发明采用如下技术方案:
10.本发明的第一方面,提供芳樟醇在防治疫霉菌中的用途。
11.优选的,所述疫霉菌为大豆疫霉。
12.优选的,芳樟醇通过如下(1)
‑
(3)至少一项途径防治大豆疫霉:
13.(1)抑制大豆疫霉菌菌丝径向生长;
14.(2)抑制大豆疫霉菌游动孢子囊及游动孢子产生;
15.(3)抑制大豆疫霉菌游动孢子的萌发。
16.优选的,所述芳樟醇的化学结构式如式:
[0017][0018]
本发明的第二方面,提供利用芳樟醇防治疫霉菌的方法,包括采用芳樟醇对土壤进行处理的步骤和采用芳樟醇对大豆种子进行浸种处理的步骤。
[0019]
优选的,芳樟醇对土壤的处理是在休耕期,将芳樟醇按照400
‑
500ml/亩的用量均匀与土壤混合,防治土壤内疫霉菌。
[0020]
优选的,芳樟醇对土壤的处理是在播种前3
‑
5天,翻土时,将芳樟醇按照400
‑
500ml/亩的用量均匀与土壤混合。
[0021]
优选的,芳樟醇对大豆种子的处理是在播种前,每千克种子中加入15
‑
20ml的芳樟醇,将大豆种子浸种5
‑
10分钟,防治土壤内疫霉菌。
[0022]
优选的,所述疫霉菌为大豆疫霉。
[0023]
本发明的第三方面,提供芳樟醇在制备疫霉菌杀菌剂中的用途。
[0024]
本发明的第四方面,提供一种疫霉菌杀菌剂,所述疫霉菌杀菌剂以有效量的芳樟醇为活性成分。
[0025]
本发明的有益效果:
[0026]
1、芳樟醇对大豆疫霉菌菌丝径向生长、对大豆疫霉菌游动孢子囊产生及游动孢子的产生和萌发具有明显的抑制作用,芳樟醇能够对土壤中的大豆疫霉菌起到有效的防治作用,对防治大豆疫病有巨大意义。
[0027]
2、芳樟醇生产原料成本极低,生产工艺简单、生产周期短,有利于工业化生产、运输,为杀菌剂新制剂发开应用提供了新的方法。
[0028]
3、芳樟醇是天然植物提取物,用于食品领域,对环境友好,不易产生抗性可有效抑制土传病害的发生,同时也不会造成传统防治方法的3r现象(残留量、抗药性、再增猖獗)。
附图说明
[0029]
图1为本发明抗病大豆气态挥发物中芳樟醇的质量色谱图。
[0030]
图2为本发明感病大豆气态挥发物中芳樟醇的质量色谱图。
[0031]
图3为本发明芳樟醇对大豆疫霉菌菌丝径向生长的抑制图。
[0032]
图4为本发明芳樟醇对大豆疫霉菌游动孢子萌发的抑制图。
[0033]
图5为本发明芳樟醇对大豆疫病防效盆栽实验的防效图。
[0034]
图6为本发明芳樟醇对大豆种子处理后疫病盆栽实验的防效图。
具体实施方式
[0035]
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
[0036]
正如背景技术部分介绍的,目前,防治卵菌的药剂甚少,市面上防治真菌病害的药剂由于卵菌和真菌亲缘关系较远,常用的杀真菌剂对防治大豆疫霉根腐病效果不佳,目前生产上主要依靠推广抗病品种进行防治。另一方面,疫霉菌对大多数化学农药已经产生抗药性。因此,高效、低毒、低残留且对环境友好的植物源杀菌剂开始成为研究热点。
[0037]
本发明经过实验发现,在抗病和感病大豆挥发物中测得芳樟醇(如图1和2所示)。本发明又研究进一步发现,芳樟醇对大豆疫霉菌菌丝径向生长、对大豆疫霉菌游动孢子囊产生及游动孢子的产生萌发具有明显的抑制作用,对防治大豆疫病有巨大意义。
[0038]
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
[0039]
本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。其中:芳樟醇购自上海源叶生物科技有限公司;大豆疫霉菌菌株r2(p6497)、大豆疫霉菌菌株r6(p7063)、大豆疫霉菌菌株r7(p7064)、大豆疫霉菌菌株r17(p7074)、大豆疫霉菌菌株r19(p7076)均来自南京农业大学。
[0040]
实施例1:芳樟醇对大豆疫霉菌菌丝径向生长的影响
[0041]
菌种活化:将低温保存的大豆疫霉菌r2、r6、r7、r17、r19切块置于v8固体培养基平板上25℃培养7d后,将其大豆疫霉菌菌落r2、r6、r7、r17、r19切成小块于v8固体或液体培养基平板上,25℃培养3d。
[0042]
固体v8培养基配方:v8饮料100.0ml,琼脂15.0g,水900.0ml。
[0043]
液体v8培养基配方:v8饮料100.0ml,水900.0ml。
[0044]
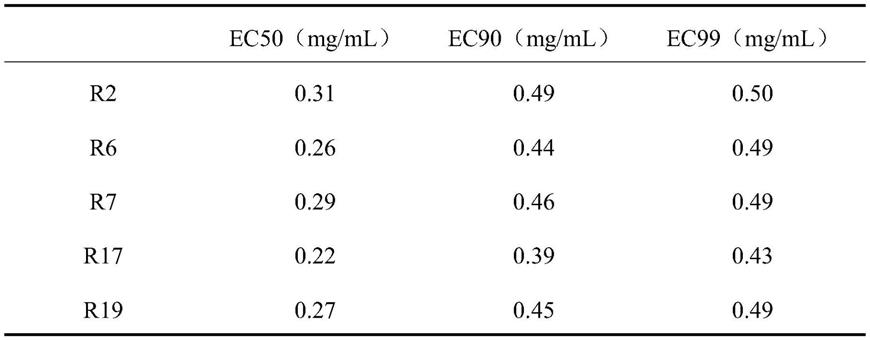
将一定量芳樟醇加入到10%的固体v8培养基,配制成芳樟醇终浓度为0mg/ml、0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml的含药培养基,将菌种活化后的大豆疫霉菌打若干菌饼放置培养基上,以芳樟醇终浓度为0mg/l的培养基作为对照,放置在25℃培养箱中黑暗培养,如图3所示。实验中各个处理的菌落直径,我们采用十字交叉法来测量。计算各浓度芳樟醇对大豆疫霉菌菌丝半最大效应浓度(ec50)、90%最大效应浓度(ec90)、99%最大效应浓度(ec99)见表1。
[0045]
疫霉菌菌丝生长抑制率(%)=[(对照菌落直径
‑
菌饼直径)
‑
(处理菌落直径
‑
菌饼直径)]/(对照菌落直径
‑
菌饼直径)
×
100%
[0046]
表1:芳樟醇对菌丝径向生长ec50、ec90、ec99
[0047][0048]
实施例2:芳樟醇对大豆疫霉菌r2游动孢子囊及游动孢子产生的影响
[0049]
取活化后相同菌丝量的液培,用无菌的自来水漂洗3~4次,最后分别加入芳樟醇至终浓度为0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml,每个处理3个重复,以芳樟醇浓度为0mg/ml的v8培养基作为对照,25℃培养4h后,在10倍显微镜下随机取5个视野,观察记录游动孢子囊数量。记录芳樟醇对大豆疫霉菌游动孢子囊形成的抑制情况。
[0050]
取活化后相同菌丝量的液培,用无菌的自来水漂洗3~4次,最后加入等体积的无菌自来水,每个处理3个重复,25℃培养3h后,加入芳樟醇至终浓度为0mg/ml、0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml,静置3h后,在每个处理中取5μl游动孢子悬浮液,在显微镜下观察记录游动孢子数量,记录芳樟醇对大豆疫霉菌游动孢子产生的抑制情况,见表2。
[0051]
表2:芳樟醇对游动孢子囊及游动孢子产生的抑制情况
[0052][0053]
实施例3:芳樟醇对大豆疫霉菌r2游动孢子萌发的影响
[0054]
游动孢子悬浮液的制备:取活化的大豆疫霉菌液培,将液体v8培养基全部吸出,弃掉,向培养皿中加入灭菌的自来水,浸没菌丝块,每隔10min用灭菌自来水冲洗,冲洗3次后,最后一次换水,水不要加太多,能够刚刚浸没菌丝即可,将平板于25℃黑暗放置6h。
[0055]
通过血球计数板计数的方法来控制游动孢子悬浮液浓度达到4
×
103/ml,配制使芳樟醇终浓度为0mg/ml、0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml的含药培养基,加入1ml游动孢子悬浮液,用涂布器均匀涂布,观察所有处理培养基的孢子萌发情况,如表3、图4所示。可知,当芳樟醇浓度达0.4mg/ml时,明显抑制了游动孢子的萌发。
[0056]
表3:芳樟醇对游动孢子萌发的影响
[0057]
[0058]
注:“+”有游动孢子萌发;
“‑”
无游动孢子萌发
[0059]
实施例4:芳樟醇对大豆疫病防效盆栽实验
[0060]
模拟病土:将活化后的液培大豆疫霉菌菌丝与土壤混匀,分装到多个小盆。
[0061]
土壤处理:将装有模拟病土的小盆中加入不同体积的芳樟醇混匀,配置成100μl/dm2、200μl/dm2、300μl/dm2、400μl/dm2、500μl/dm2,分别记为1、2、3、4、5,处理盆中土壤3~5d;
[0062]
将装有模拟病土的小盆中不加入芳樟醇处理,记为ck。
[0063]
将装有无大豆疫霉菌的普通土壤的小盆,记为ck0作为对照。
[0064]
种植大豆:打破大豆休眠状态后,将大豆种在处理过的土壤中,5d后,观察大豆生长状况,如图5所示。
[0065]
综上可知,芳樟醇作为土壤处理剂,对大豆疫霉菌具有明显的抑制作用,可以广泛应用防治大豆疫霉菌中。
[0066]
实施例5:芳樟醇对大豆种子处理后疫病盆栽实验
[0067]
模拟病土:将活化后的液培大豆疫霉菌菌丝与土壤混匀,分装到多个小盆。
[0068]
种子处理:打破大豆休眠状态后,利用不同浓度芳樟醇0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml浸种5
‑
10分钟后种入小盆,分别记为
①
、
②
、
③
、
④
、
⑤
。
[0069]
将装有模拟病土的小盆中种入不经过芳樟醇处理的大豆,记为ck。
[0070]
将装有无大豆疫霉菌的普通土壤的小盆,记为ck0作为对照。
[0071]
5d后,观察大豆生长状况,如图6所示。
[0072]
综上可知,芳樟醇作为种子处理剂,对土壤中的大豆疫霉菌具有明显的抑制作用,可以广泛应用防治大豆疫霉菌中。
[0073]
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1