一种怀地黄的脱毒方法
本发明属于药用植物组培脱毒培养
技术领域:
,具体涉及一种怀地黄的脱毒方法。
背景技术:
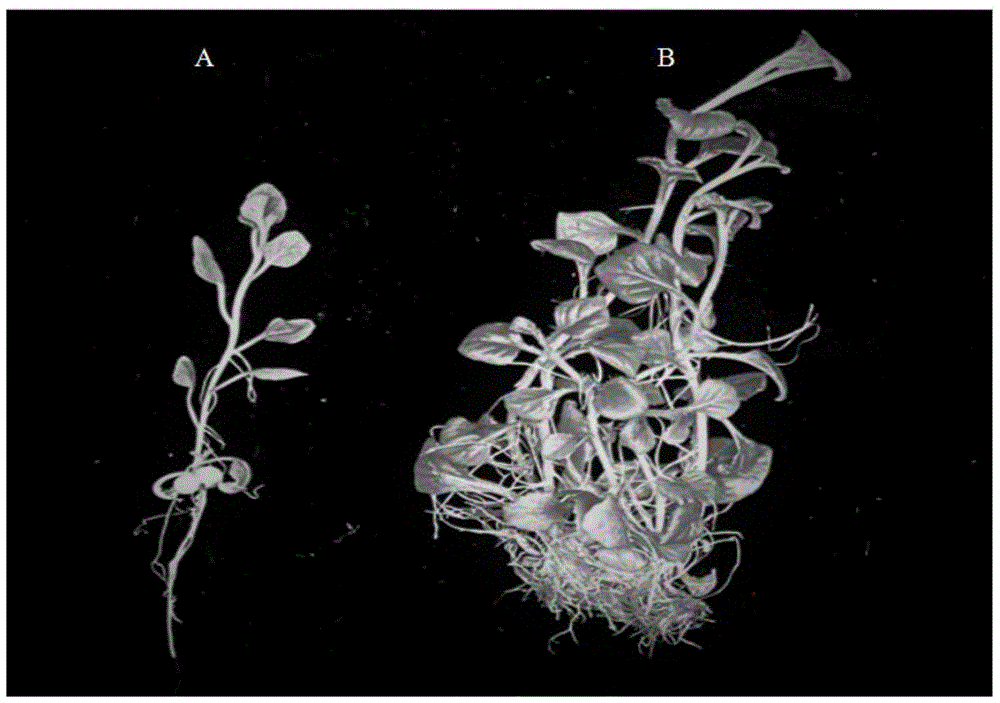
:地黄(rehmanniaglutinosalibosch.)是我国著名的“四大怀药”之一,长期营养繁殖致使其病毒感染严重,导致产量下降,品质退化。据调查,烟草花叶病毒(tmv)、黄瓜花叶病毒(cmv)常单一或混合感染河南焦作地区的地黄,从而引起地黄产量降低、种性退化和品质下降,严重影响了怀地黄的种植效益和临床用药,为提高怀地黄产量,改善其品质,并使其良种长期推广种植,生产健康无病毒的种苗是控制和防止这些病原体传播的主要途径。传统的怀地黄无病毒培养主要采用茎尖培养或热处理结合茎尖培养,这也是目前解决怀地黄最常用的两种方法,但单纯茎尖培养的脱毒效率较低,仅为36%(李明军等,河南师范大学学报,2008),而热处理又会对怀地黄植株造成一定程度的伤害,且仅热处理的时间就大约需要几周,脱毒时间较长,培养方法繁琐、生产成本高,不适合工业化生产。因此,如何尽快去除怀地黄的病毒,建立一种快速、简单、经济有效的方法来生产脱毒怀地黄种苗,已成为怀地黄脱毒苗生产中急需解决的一个重要问题。技术实现要素:为了解决上述现有技术的问题,本发明提供了一种怀地黄的脱毒方法,本发明提供了一种快速、简单、经济有效的方法对怀地黄进行脱毒,为怀地黄脱毒种苗工厂化生产提供前期的技术支持,同时也为其他植物脱毒技术的研究提供了一定的参考。本发明是通过如下技术方案来实现的:一种怀地黄的脱毒方法,包括如下步骤:步骤1、茎尖剥离无菌条件下,将感染病毒的地黄无菌苗剥去幼叶,切取带2个叶原基的茎尖;步骤2、茎尖脱毒培养:s1、茎尖电流刺激处理:将步骤1切取的茎尖浸泡于无菌水中,然后进行弱电流刺激处理;其中,弱电流刺激处理的条件为:于体积分数为1%的tae电泳缓冲液中,在5-30ma电流条件下刺激处理1-10min,得电流刺激茎尖;s2、茎尖培养:将步骤s1的电流刺激茎尖接种于培养基内,并培育30-45d,经脱毒检测后得脱毒怀地黄。优选的,所述电流刺激的条件为:于15ma电流条件下刺激处理1-10min。优选的,所述电流刺激的条件为:于15ma电流条件下刺激处理5min。优选的,所述叶原基茎尖的尺寸为0.3×(0.05-0.1)mm2。优选的,所述步骤s2的培养基以ms液体培养基为溶剂,向其中加入0.5mg·l-1的6-苄氨基嘌呤、0.1mg·l-1萘乙酸、0.1mg·l-1赤霉素、30g·l-1蔗糖和6g·l-1琼脂粉,混匀。优选的,将所述培养基的ph值调至5.8-6.0,并于高温高压下灭菌20min。优选的,所述高温高压的条件为121℃蒸汽灭菌。优选的,所述步骤s2的培养条件为:于(24±2)℃,光照强度50-60μmol·m-2·s-1条件下照射14h·d-1。本发明与现有技术相比具有如下有益效果:1、品质退化是地黄大田栽培过程中一个主要的瓶颈问题,而品质退化的原因之一为:地黄大田栽培过程中极易被病毒所感染,虽然热处理结合茎尖以及二次茎尖剥离的脱毒方法明显提高了地黄的脱毒效率,但是处理周期长,较为费时。目前地黄脱毒苗的栽培已经初见规模,并且表现出产量高、品质好的优势。因此脱毒苗的推广种植将是地黄优质种苗获取的主要来源之一,鉴此,本发明采用“电”疗法对怀地黄的脱毒技术进行了系统的研究,旨在探索一种快速、高效且适合工业化生产的怀地黄脱毒技术,以满足怀地黄大田脱毒苗日益增长的需求。2、现有技术公开了外源“电流”刺激是一种高效、环保的植物生长发育调控技术,并且在某种程度上来讲,它可以改善产品质量,有可能获得更高的产量,符合当前种植中药材“减肥增效的理念”,也可缓解化肥带来的一些危害,它将是种植行业一种重要和有前途的技术,对建立一个绿色环保的中药材技术体系,促进中药材可持续发展的意义非凡。但目前电流疗法对病毒粒子的作用仍然知之甚少,本申请创造性的采用弱电流刺激茎尖,并通过研究证实了:外源“电流”刺激能够对怀地黄进行脱毒;并提出了于条件为:15ma、5min电流刺激处理后,怀地黄内黄瓜花叶病毒(cmv)、烟草花叶病毒(tmv)脱毒率分别达到87%,80%,明显优于现有技术,本研究也表明了“电”疗法是怀地黄去除tmv、cmv的有效技术方法。附图说明图1为单纯茎尖培养与电流刺激对地黄茎尖再生情况的影响,其中,a:未经电流刺激的茎尖再生地黄苗;b:15ma刺激5min的茎尖再生地黄苗;图2为植株生长情况对照图;其中,a:病毒苗;b:15ma刺激5min的茎尖再生地黄苗;c:未经电流刺激的茎尖再生地黄苗;图3为生长健壮的、15ma刺激5min的茎尖再生怀地黄苗,其中,左图为侧视图,右图为俯视图;图4为不同电流强度和时间条件对怀地黄的脱毒影响图;其中,d0的条件为:无电流刺激;d2的条件为:电流强度5ma条件下刺激5min;d5的条件为:电流强度15ma条件下刺激5min;d7的条件为:电流强度30ma条件下刺激1min。具体实施方式为了使本领域技术人员更好地理解本发明的技术方案能予以实施,下面结合具体实施例和附图对本发明作进一步说明,但所举实施例不作为对本发明的限定。下述各实施例中所述实验方法和检测方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可在市场上购买得到;实施例1一种怀地黄的脱毒方法,包括如下步骤:步骤1、茎尖的剥离在超净工作台上,40倍的双目实体解剖镜下,将感染病毒的地黄无菌苗用解剖针剥去幼叶,切取带2个叶原基的茎尖;步骤2、茎尖脱毒培养:s1、茎尖电流刺激处理:切取的茎尖迅速转移到盛装有无菌水的铝盒(70×38mm)中,盖上铝盒,然后将铝盒浸泡于1%电泳缓冲液(tae)的电泳槽中,进行弱电流刺激处理,处理条件为:15ma、5min,经电流刺激后的茎尖接种于ms+0.5mg·l-1的6-苄氨基嘌呤(6-ba)+0.1mg·l-1萘乙酸(naa)+0.1mg·l-1赤霉素(ga3)培养基中,每瓶接种5个茎尖,5个重复;s2、茎尖培养:培养条件:以上培养基均添加30g·l-1蔗糖,6g·l-1琼脂粉,ph值调至5.8-6.0;高温高压下灭菌20min;培养条件为温度(24±2)℃,光照强度为50μmol·m-2·s-1,光照时间为14h·d-1。实施例2与实施例1的制备步骤相同,不同之处仅在于,步骤2中,将处理条件由15ma、5min,替换为5ma、1min。实施例3与实施例1的制备步骤相同,不同之处仅在于,步骤2中,将处理条件由15ma、5min,替换为5ma、5min。实施例4与实施例1的制备步骤相同,不同之处仅在于,步骤2中,将处理条件由15ma、5min,替换为5ma、10min。实施例5与实施例1的制备步骤相同,不同之处仅在于,步骤2中,将处理条件由15ma、5min,替换为15ma、1min。实施例6与实施例1的制备步骤相同,不同之处仅在于,步骤2中,将处理条件由15ma、5min,替换为15ma、10min。实施例7与实施例1的制备步骤相同,不同之处仅在于,步骤2中,将处理条件由15ma、5min,替换为30ma、1min。实施例8与实施例1的制备步骤相同,不同之处仅在于,步骤2中,将处理条件由15ma、5min,替换为30ma、5min。实施例9与实施例1的制备步骤相同,不同之处仅在于,步骤2中,将处理条件由15ma、5min,替换为30ma、10min。对比例1步骤1、茎尖的剥离在超净工作台上,40倍的双目实体解剖镜下,将感染病毒的地黄无菌苗用解剖针剥去幼叶,切取带2个叶原基的茎尖;步骤2、茎尖培养:将切取的茎尖接种于ms+0.5mg·l-1的6-苄氨基嘌呤(6-ba)+0.1mg·l-1萘乙酸(naa)+0.1mg·l-1赤霉素(ga3)培养基中,每瓶接种5个茎尖,5个重复,45d后检测病毒;培养条件:以上培养基均添加30g·l-1蔗糖,6g·l-1琼脂粉,ph值调至5.8-6.0;高温高压下灭菌20min;培养条件为温度(24±2)℃,光照强度约50μmol·m-2·s-1,光照时间为14h·d-1。下面对采用实施例1-9脱毒方法后得到的怀地黄进行对比研究,研究中采用逆转录聚合酶链式反应(rt-pcr)方法检测烟草花叶病毒(tmv)、黄瓜花叶病毒(cmv),并与对比例1进行对比研究,实施例与对比例1的区别仅在于,实施例1-9进行了弱电流刺激处理,而对比例1为单纯茎尖培养,研究对比结果如下所示:1、茎尖再生苗的形成及病毒检测:表1两种情况下怀地黄茎尖脱毒苗的再生及脱毒率情况两种情况下怀地黄茎尖脱毒苗的再生及脱毒率情况如表1所示,经电流刺激的茎尖,2d后开始萌发,茎尖苗增殖5倍,10d后陆续生根,生长成小植株,成苗率为96%,30d左右能长成5cm左右的小苗,45d后苗长势健壮,茎粗,新生叶片多且颜色深绿,叶片较大,生根数多;而未经电流刺激的茎尖,5d后才开始萌发,10d后长出新叶,14d陆续生根,生长成小植株,成苗率为48%,苗瘦弱,茎细,叶片颜色浅绿且小,生根数少且根细长,且未见茎尖有增殖现象;二者生长45d的实物对照示意图如图1所示,由图1看出,经弱电流刺激处理后的怀地黄增殖现象极其明显。培育45d后,对茎尖脱毒苗进行检测,发现电流刺激后的茎尖苗的脱毒率明显高于单纯茎尖培养(未经电流刺激),单纯茎尖培养(未经电流刺激)的黄瓜花叶病毒(cmv)、烟草花叶病毒(tmv)脱毒率分别为43.3%,而电流刺激后的黄瓜花叶病毒(cmv)、烟草花叶病毒(tmv)脱毒率则分别为87%,80%。2、继代培养将通过单纯茎尖培养获取的脱毒苗、通过电流刺激获取的脱毒苗、带病毒苗切成一茎一叶的茎段,分别接种在ms培养基上继代培养,培养一个月左右后,观察统计这三种材料的生长情况。结果如表2和图2所示,结果表明,电流刺激后脱毒植株与带病毒植株及单纯茎尖培养(未经电流刺激)获取的脱毒植株相比,通过电流刺激获取的脱毒植株生长较为健壮,具体表现为茎粗、叶片较大、浓绿且生根数较多。表2经继代繁殖后怀地黄脱毒苗及带病毒植株的生长情况项目组培苗株高/cm生根数根长/cm茎粗/cm病毒组培苗6.99±0.80b11.5±5.00b1.21±0.50b0.09±0.01b实施例1电流+茎尖继代组培脱毒苗5.46±0.79c22.7±6.14a4.11±1.38a0.18±0.03a对比例1单纯茎尖继代组培脱毒苗8.86±0.69a9.18±2.404c2.11±0.71b0.11±0.01b3.驯化移栽将接种电流刺激获取的脱毒苗(5cm)的三角甁移至温室(其上覆盖一层遮阴网),并去除封口膜进行炼苗,5d后,从培养基中取出电流刺激获取的脱毒苗,洗净苗根部残留的培养基,移栽至营养土:园土(1:1)的基质中,自来水浇透,之后根据具体情况适量浇水,两周后的长势如图3所示。电流强度和时间对怀地黄的脱毒影响:如表3所示:表3电流强度和时间对怀地黄脱毒影响表结果表明,怀地黄感染病毒植株茎尖通过弱电流刺激后实现了脱毒,且怀地黄感染病毒植株茎尖通过15ma、5min弱电流刺激后(最佳条件),其茎尖增殖倍数与未经刺激的相比增加5倍左右,脱毒率达到80%,经继代繁殖后,电流刺激的脱毒植株生长较为健壮,且驯化成活率较高,相对于常规的脱毒方法(茎尖、高温热处理),本发明简单、快速且对怀地黄的脱毒率较高,并且同时增加了茎尖苗的增殖倍数,为怀地黄脱毒苗大规模生产利用提供一种快速、高效的方法,具有显著的经济和社会效益。显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内也意图包含这些改动和变型在内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1