红细胞膜碎片冻干保护液和冻干方法及应用与流程
1.本发明涉及红细胞膜碎片冻干保护液,以及利用该冻干保护液对红细胞膜碎片进行冻干处理的冻干方法。本发明还涉及该冻干方法制备的冻干细胞膜碎片及其在血型反定型检测方面的应用。
背景技术:
2.目前,临床上进行血型检测主要采用微柱凝胶血型卡,其本质为利用凝集技术检测抗原抗体反应。其中,进行正定型检测是用血型单克隆抗体试剂检测红细胞膜上血型抗原,反定型检测则是用红细胞试剂检测血清中相应抗体。该红细胞试剂采用红细胞保存液来保存红细胞。由于不同单位使用的红细胞保护液的成份及理化性质的差异,会造成反定型用红细胞试剂的质量不稳定,导致血清抗体检测结果不准确,影响到临床输血安全。
3.一些研究者考虑采用其他在表面带有血型抗原的颗粒物来代替红细胞进行反定型检测。例如,中国专利公开cn101387648a描述了在表面包被血型抗原的磁珠,试图代替红细胞用于血型的反定型检测。然而,已知的是血型抗原为膜蛋白,其在体外难以维持体内环境下所具有的三维结构,会逐渐失去抗原性(与相应血型抗体的反应能力)。因此,这种包被血型抗原的磁珠并不能解决红细胞难以长期保存以及反定型检测难以标准化的问题。
4.另一些反定型方法利用红细胞膜碎片采用酶联免疫反应进行检测(灵敏度高于凝集技术),但同样存在血型抗原难以保存的问题。红细胞膜碎片大多为现用现配,少数放在4摄氏度和
‑
20摄氏度短期保存。使用新鲜制备的血型抗原造成工艺复杂,人力过多地消耗于抗原制备中。膜碎片的短期保存方法存在很多缺点,如保存天数不足一周,并且随着保存天数增长,抗原性下降,不适合将红细胞膜碎片作为原料进行大批量生产,造成批间差严重。因而,在血型检测或膜蛋白应用相关领域,一直在探寻适合的原料保存方法。
技术实现要素:
5.在一方面,本文提供了一种红细胞膜碎片冻干保护液,其包括:10mm
‑
20mm的葡萄糖、6mm
‑
12mm的乳糖、121mm
‑
141mm的海藻糖、29mm
‑
39mm的nacl、4.3mm
‑
5.3mm的kcl、0.115mm
‑
0.125mm的kh2po4和0.6mm
‑
1.2mm的na2hpo4。
6.在一些实施方案中,所述红细胞膜碎片冻干保护液包括:20mm的葡萄糖、10mm的乳糖、140mm的海藻糖、39mm的nacl、5.3mm的kcl、0.125mm的kh2po4和1.2mm的na2hpo4;10mm的葡萄糖、12mm的乳糖、141mm的海藻糖、31mm的nacl、4.3mm的kcl、0.115mm的kh2po4和1.1mm的na2hpo4;或者15mm的葡萄糖、10mm的乳糖、131mm的海藻糖、35mm的nacl、5.0mm的kcl、0.115mm的kh2po4和1.1mm的na2hpo4。
7.另一方面,本文提供了一种冻干红细胞膜碎片的方法,其包括:1) 制备新鲜红细胞膜碎片;以及2) 将所述新鲜红细胞膜碎片与上述红细胞膜碎片冻干保护液混合后进行冻干处理。
8.在一些实施方案中,该方法步骤2)包括:i) 将所述新鲜红细胞膜碎片与所述红细
胞膜碎片冻干保护液混合,将所得的混合物置于4摄氏度至
‑
20摄氏度的温度下预冷,接着进一步降温使其冻结;以及ii) 对冻结的所述混合物进行冻干处理。
9.在一些实施方案中,步骤i)中所述预冷在
‑
20摄氏度下进行30分钟。
10.在一些实施方案中,步骤i)中所述降温为以10摄氏度/分钟的速率降至
‑
70摄氏度,所述冻结在
‑
70摄氏度进行2小时以上。
11.在一些实施方案中,步骤i)中所述新鲜红细胞膜碎片与所述红细胞膜碎片冻干保护液以体积比1:9混合。
12.在一些实施方案中,步骤ii)中所述冻干处理包括一次干燥和二次干燥,在所述一次干燥过程中让冻干机的隔板温度和压力分别保持在
‑
50摄氏度和2
‑
4帕,处理时间18小时;在所述二次干燥过程中让冻干机的隔板温度和压力分别保持在20摄氏度和2
‑
4帕,处理时间为10小时。
13.另一方面,本文提供了采用上述方法制备的冻干红细胞膜碎片。
14.另一方面,本文提供了上述冻干红细胞膜碎片在血型反定型检测中的应用。
15.本文提供的红细胞膜碎片冻干保护液和冻干方法可用于制备冻干红细胞膜碎片,该冻干红细胞膜碎片可用于血型检测,有利于反定型过程的标准化。
附图说明
16.图1显示了新鲜制备的、不同保存温度下保存7天时的红细胞膜碎片以及经不同冻干保护液冻干制备的红细胞膜碎片常温保存7天时的抗原性检测结果。横坐标显示标准品抗体的稀释倍数,纵坐标显示od450值(以下各图坐标轴同此说明)。
17.图2显示了新鲜制备的、不同保存温度下保存14天时的红细胞膜碎片以及经不同冻干保护液冻干制备的红细胞膜碎片常温保存14天时的抗原性检测结果。
18.图3显示了新鲜制备的红细胞膜碎片以及经不同冻干保护液冻干制备的红细胞膜碎片常温保存21天时的抗原性检测结果。
19.图4显示了新鲜制备的红细胞膜碎片以及经不同冻干保护液冻干制备的红细胞膜碎片常温保存28天时的抗原性检测结果。
20.图5显示了新鲜制备的红细胞膜碎片以及经不同预冷温度处理所制备的冻干红细胞膜碎片当天的抗原性检测结果。
21.图6显示了新鲜制备的红细胞膜碎片以及经不同预冷温度处理所制备的冻干红细胞膜碎片保存7天时的抗原性检测结果。
22.图7显示了新鲜制备的红细胞膜碎片以及经不同预冷温度处理所制备的冻干红细胞膜碎片保存14天时的抗原性检测结果。
23.图8显示了新鲜制备的红细胞膜碎片以及经不同预冷温度处理所制备的冻干红细胞膜碎片保存21天时的抗原性检测结果。
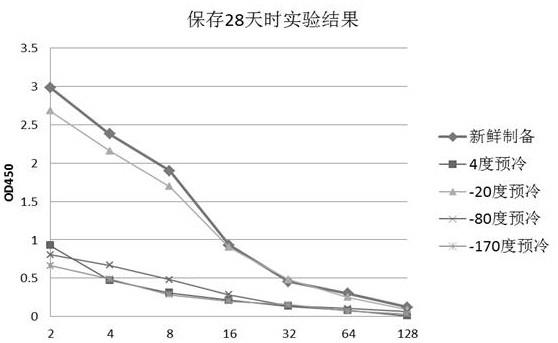
24.图9显示了新鲜制备的红细胞膜碎片以及经不同预冷温度处理所制备的冻干红细胞膜碎片保存28天时的抗原性检测结果。
具体实施方式
25.除非另有说明,本文使用的所有技术和科学术语具有本领域普通技术人员所通常
理解的含义。
[0026]“红细胞膜碎片”在本文中指非完整状态的红细胞膜。一般可通过低渗或反复冻融等方式处理红细胞,使红细胞膜破碎,接着通过离心将膜碎片与与其他成分(如血红蛋白)分开,获得沉淀物形式的红细胞膜碎片。红细胞膜碎片的成分包括脂类和膜蛋白,例如各种血型抗原。“新鲜红细胞膜碎片”指新制备的红细胞膜碎片,通常在制备后保存时间不超过1天。
[0027]“冻干保护液”,也可称为“冻干保护剂”, 在本文中指在冻干处理时与红细胞膜碎片混合,能够在冻干(和随后的保存和复溶)过程中尽量维持红细胞膜碎片本身的生物学性质(如抗原性)的试剂。
[0028]
本文提供的红细胞膜碎片冻干保护液包括葡萄糖、乳糖、海藻糖、nacl、kcl、kh2po4以及na2hpo4。优选地,该红细胞膜碎片冻干保护液包括10mm
‑
20mm的葡萄糖、6mm
‑
12mm的乳糖、121mm
‑
141mm的海藻糖、29mm
‑
39mm的nacl、4.3mm
‑
5.3mm的kcl、0.115mm
‑
0.125mm的kh2po4和0.6mm
‑
1.2mm的na2hpo4。更优选地,该红细胞膜碎片冻干保护液包括20mm的葡萄糖、10mm的乳糖、140mm的海藻糖、39mm的nacl、5.3mm的kcl、0.125mm的kh2po4和1.2mm的na2hpo4。
[0029]
将新鲜制备的红细胞膜碎片与本文提供的冻干保护液混合,经冷冻干燥而制得冻干的红细胞膜碎片。这些冻干的红细胞膜碎片在使用前,采用水或缓冲液复溶,即可应用于抗原抗体亲和力检测实验(例如用于检测血清中的血型抗体)。红细胞膜碎片在本文提供的冻干保护液存在下冻干后,可常温保存相当长的时间,并且在抗原抗体亲和力检测实验中,灵敏度与新鲜制备的细胞膜碎片的抗原性类似。对冻干前预处理温度进行优化,可进一步延长冻干红细胞膜碎片的保存期。
[0030]
采用本文提供的冻干保护液对红细胞膜碎片进行冻干后保存,有利于血型反定型检测的标准化。
[0031]
以下通过具体实施例来进一步说明本发明。
[0032]
实施例中使用的部分仪器和耗材:酶标仪:德铁酶标仪,hbs
‑
1096a冻干机:压盖型硅油加热系列冷冻干燥机, 型号cientaz
‑
50f包被缓冲液:0.2m磷酸缓冲液(ph7.4),macklin ,货号c11249963标准品抗体:anti
‑
a, 密理博, 货号 jh
‑
1l
‑
bkhrp
‑
酶标二抗:anti
‑
human igm,sigma,货号a6907
‑
1ml 实施例1 红细胞膜碎片的制备红细胞碎片制备过程如下:1) 取3 ml抗凝混合全血(取自6
‑
10个a型(或其他血型)血样),加入装有10 ml 0.01mol/l pbs (ph7.2)的15 ml离心管中,以3000r/min离心5min,弃上清和上清下的白细胞、血小板层,获得约1.5ml压积红细胞;2) 用相当于压积红细胞3倍体积的4℃预冷0.01 mol/l pbs (ph7.2)洗涤3次,每次在4℃下以5000 r/min离心15min;3) 以v: v = 40: 1的比例加4℃预冷的0.01 mol/l pbs (ph7.2)与沉淀物混合,4℃放置2 h,再以9000r/min离心20 min,弃上清;
4) 再重复步骤3) 4次,直至无肉眼可见的红细胞,所获得的约800 μl沉淀物即为携带膜抗原的红细胞膜碎片样品。
[0033]
以此方式进行多次制备,获得的红细胞膜碎片或者立即使用(用于膜抗原检测或冻干),或者直接分装后分别在4摄氏度或
‑
20摄氏度下保存。
[0034]
实施例2 冻干保护液的配制使用注射用水,按照下列组分和浓度分别配制3种冻干保护液:1#: 20mm的葡萄糖、10mm的乳糖、140mm的海藻糖、39mm的nacl、5.3mm的kcl、0.125mm的kh2po4、1.2mm的na2hpo4;2#: 10mm的葡萄糖、12mm的乳糖、141mm的海藻糖、31mm的nacl、4.3mm的kcl、0.115mm的kh2po4、1.1mm的na2hpo4;3#: 15mm的葡萄糖、10mm的乳糖、131mm的海藻糖、35mm的nacl、5.0mm的kcl、0.115mm的kh2po4、1.1mm的na2hpo4。
[0035]
在下文的描述中以相应编号(1#、2#或3#)表示对应的冻干保护液。
[0036]
实施例3 红细胞膜碎片的冻干处理取实施例1制备的新鲜红细胞膜碎片和实施例2配制的各冻干保护液按照体积比1: 9混合,加入容积为5 ml的西林瓶中,使得每只西林瓶液体含量为1ml。将西林瓶放入4摄氏度冰箱预冷30分钟,再按照10摄氏度/分钟的降温速率降到
‑
70摄氏度,并在此温度下保持2小时以上使冻干物冻结。然后开始抽真空,一次干燥,使冻干机的隔板温度和压力分别保持在
‑
50摄氏度和2
‑
4帕左右,时间为18小时。最后,二次干燥,过程中设定隔板温度为20摄氏度,压力为2
‑
4帕左右,持续时间为10小时,制得冻干的红细胞膜碎片。
[0037]
冻干的红细胞膜碎片在常温保存。使用前以等体积(与冻干前的新鲜红细胞膜碎片体积相同)注射用水复溶。
[0038]
实施例4 红细胞膜碎片抗原性检测检测原理:分别取100ul新鲜红细胞膜碎片、4摄氏度保存不同天数的红细胞膜碎片、
‑
20摄氏度保存不同天数的红细胞膜碎片、以及冻干后保存不同天数并复溶的红细胞膜碎片,包被于酶标板上,加入标准品抗体,该抗体会和红细胞膜碎片上的膜抗原特异性结合。在洗去游离成分后,加入辣根过氧化酶标记的二抗。膜抗原与标准品抗体、辣根过氧化酶标记的二抗结合而形成免疫复合物,游离的成分被洗去,加入显色液底物tmb,tmb在辣根过氧化物酶的催化下呈现蓝色,加入终止液后变成黄色。用酶标仪在450 nm波长处测od值,红细胞膜碎片上特定抗原的抗原性与od450值之间呈正比,通过与新鲜制备的红细胞膜碎片检测的od450值比较来确定其他方式保存的红细胞膜碎片的抗原性变化。
[0039]
具体检测过程如下:包被:用包被缓冲液将按实施例1和3描述制备的各100ul红细胞膜碎片稀释10000倍,按100ul/孔加入酶标板中,4摄氏度包被过夜;洗板:次日弃孔内液体,在纸巾上轻轻扣打以吸去残留液体,加入洗涤液(280
‑
300 ul/孔),洗涤2
‑
3次,每次3
‑
5min;封闭:按200
‑
250ul/孔加入封闭液,室温2小时,然后弃去孔内封闭液;标准品抗体处理:用洗涤液将标准品抗体进行倍比稀释,稀释倍比数为21,22,23,
24,25,26,和27。
[0040]
加样:按顺序以50 ul/孔依次加入稀释好的标准品抗体,室温孵育30min。
[0041]
洗板:弃孔内液体,在纸巾上轻轻扣打以吸去残留液体,加入洗涤液(280
‑
300ul/孔),洗涤2
‑
3次,每次3
‑
5min;加酶标抗体:按50ul/孔加入新配制的酶标抗体,室温孵育30min。
[0042]
洗板:弃孔内液体,在纸巾上轻轻扣打以吸去残留液体,加入洗涤液(280
‑
300ul/孔),洗涤2
‑
3次,每次3
‑
5min;加底物液显色:按100ul/孔加入tmb底物溶液,室温避光反应30min。
[0043]
终止反应:于各反应孔中加入50ul的终止液。
[0044]
结果判定:用酶标仪器测od值(以仅加入包被缓冲液的空白孔调零)。
[0045]
实验结果:新鲜红细胞膜碎片、4摄氏度保存不同天数的红细胞膜碎片、
‑
20摄氏度保存不同天数的红细胞膜碎片、以及冻干后保存不同天数(7天、14天、21天、和28天)并复溶的红细胞膜碎片的抗原性检测结果(以od值表示)列在图1
‑
4中。图中,每个检测值均为三次重复实验(从新鲜红细胞膜碎片与冻干保护液混合开始)的均值。从图1和图2中可看出,新鲜制备的红细胞膜碎片,无论是4摄氏度还是
‑
20摄氏度保存,保存7
‑
14天时抗原性已明显减弱,甚至难以检测出。因此,在14天后未继续对其进行抗原性检测(图3和图4中未显示检测结果)。从图1
‑
4可看出,以本文提供的冻干保护液冻干保存一段时间并复溶后的红细胞膜碎片,在一定时间内具有与新鲜制备的红细胞膜碎片类似的抗原性。保存7天时,3种冻干保护液均使得红细胞膜碎片保持了与新鲜制备的红细胞膜碎片相同的抗原性;保存14天时,2#和3#冻干保护液制备的冻干红细胞膜碎片抗原性降低,而1#冻干保护液制备的冻干红细胞膜碎片抗原性仍与新鲜制备的红细胞膜碎片抗原性相同;保存21天时,2#和3#冻干保护液制备的冻干红细胞膜碎片抗原性继续降低,1#冻干保护液制备的冻干红细胞膜碎片抗原性开始降低;保存28天时,3种冻干保护液制备的冻干红细胞膜碎片抗原性均继续降低。总体上,3种冻干保护液制备的冻干红细胞膜碎片,采取常温保存方式,可以在一定时间内(7
‑
14天)保持与新鲜制备的红细胞膜碎片相似的抗原性。
[0046]
实施例5 红细胞膜碎片冻干方式研究为了延长冻干红细胞膜碎片的保存时间,我们进一步对冻干方式进行了研究,意外地发现,改变冻干前预处理温度可显著影响制备的红细胞膜碎片的抗原性。
[0047]
使用1#冻干保护液,采用实施例3描述的方法制备冻干红细胞膜碎片,不同的是将冻干前预处理温度分别设置为4摄氏度、
‑
20摄氏度、
‑
80摄氏度和
‑
170摄氏度,当预处理温度为
‑
80摄氏度和
‑
170摄氏度时无降温过程,直接各自在
‑
80摄氏度和
‑
170摄氏度下保持2小时以上使待冻干物冻结。以新鲜制备的红细胞膜碎片作为对照,对比不同冻干前预处理温度对冻干红细胞膜碎片抗原性的影响。
[0048]
按实施例4中描述的方法进行红细胞膜碎片抗原性的检测。
[0049]
图5
‑
9分别显示冻干后保存了0天(即冻干完成后的当天)、7天、14天、21天和28的检测结果。从图中可看出,4摄氏度和
‑
20摄氏度预处理得到的冻干产物的抗原性一直优于
‑
80度和
‑
170预处理得到的冻干产物,而
‑
20摄氏度预处理得到的冻干产物的抗原性优于4摄氏度预处理得到的冻干产物,基本上与新鲜制备的红细胞膜碎片的相同,在常温保存28天
后依然具有良好的检测灵敏度。
[0050]
利用本文提供的冻干保护液制备的冻干红细胞膜碎片可用于血型抗体检测。由于这种冻干红细胞膜碎片可在常温下保存长至14或28天而依然保持了其抗原性,适用于例如作为标准品检测同一个体内的抗体水平随时间的变化,或者作为标准品运输和分发到不同检测点(如医院)进行检测,便于这些检测结果之间的比较。与红细胞膜碎片的现用现配方式相比,本文提供的冻干方式可在简化操作的同时提高检测结果的准确性和一致性。
[0051]
本文中对冻干保护液的组成进行描述时给出了具体的浓度或浓度范围,并且给出了冻干时红细胞膜碎片与冻干保护液的体积比为具体的1: 9,本领域技术人员应理解,该体积比可在一定范围内变化(例如至少可为1:8至1:10),相应地,冻干保护液的浓度或浓度范围可随该体积比的变动而进行相应变化,这些变化后的冻干保护液也应落入本发明的保护范围内。另外,由于我们对冻干过程中预处理温度的研究目前仅选择了少数几个温度,但可预期的是,在
‑
20摄氏度附近进行预冷处理也应具有类似的效果,因此这些温度范围(如
‑
10摄氏度至
‑
30摄氏度,如
‑
15摄氏度和
‑
25摄氏度)也应包括在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1