一种含百里酚的白蚁防治药物及其应用
技术领域:
本发明属于白蚁防治领域,具体涉及一种含百里酚的白蚁防治药物及其应用。
背景技术:
:
白蚁是一种世界性的害虫,被国际昆虫生理生态研究中心列为世界性的五大害虫之一,对房屋、建筑、水库堤坝、交通和农业生产等各个领域均能造成严重危害,在热带、亚热带地区发生尤为严重(黄复生等,2000)。昆虫病原线虫(entomopathogenicnematodes,epns)由于其能够主动搜寻寄主、杀虫广谱性、不易产生抗药性,是重要的生物防治制剂之一。20世纪70年代研究者已开始利用昆虫病原线虫防治白蚁,有潜力作为白蚁防治剂,但因白蚁社会性行为、生理生化防御响应等因素,使得线虫在实际白蚁防治应用中效果欠佳(chouvencetal.,2011;al-zaidawietal.,2020)。而目前对白蚁免疫防御机制的研究主要集中于对白蚁防御细菌和真菌的研究,白蚁生存环境复杂及免疫防御机制尚未阐明,对白蚁防御线虫的免疫机制知之甚少。
技术实现要素:
:
本发明的第一个目的是提供一种提高昆虫病原线虫对台湾乳白蚁的防效的含百里酚的白蚁防治药物。
本发明的含百里酚的白蚁防治药物,其含有百里酚和昆虫病原线虫。
优选,所述的昆虫病原线虫是steinernemacarpocapsaeall。
优选,所述的含百里酚的白蚁防治药物,其含昆虫病原线虫13333ij/ml以上,百里酚的浓度为0.186mg/ml以上。
进一步优选,所述的含百里酚的白蚁防治药物,其含昆虫病原线虫13333ij/ml~26667ij/ml,百里酚的浓度为0.186mg/ml。
本发明的第二个目的在于提供百里酚联合昆虫病原线虫在防治白蚁中的应用。
优选,所述的昆虫病原线虫是steinernemacarpocapsaeall。
优选,所述的百里酚的施用量为百里酚对白蚁的ld30以上,所述的昆虫病原线虫施用量是100ij/只白蚁以上。
进一步优选,所述的百里酚的施用量为百里酚对白蚁的ld30,所述的昆虫病原线虫施用量是200ij/只白蚁。
为了加强白蚁的生物防治,提高昆虫病原线虫在白蚁防治中的应用,利用低毒、可再生及不易产生抗性的植物源活性物质作为干扰抑制剂,联合昆虫病原线虫防控有害白蚁。本发明对我国最主要的有害白蚁台湾乳白蚁为测试对象,基于植物源活性物质百里酚(5-methyl-2-isopropylphenol)对白蚁免疫防御响应的干扰,联合昆虫病原线虫steinernemacarpocapsaeall品系的侵染,提高了昆虫病原线虫对台湾乳白蚁的防效,为进一步加强昆虫病原线虫在白蚁绿色防控中的应用推广具有重要意义。
附图说明
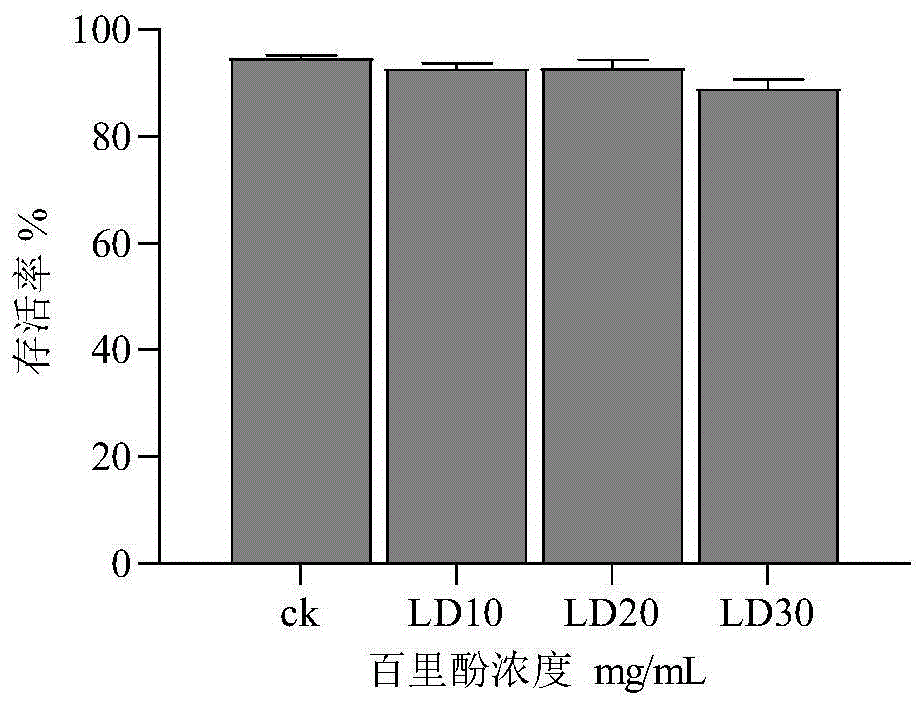
图1为不同浓度百里酚对steinernemacarpocapsaeall存活的影响。
图2为白蚁在不同处理条件下的位移(ck:对照;all:线虫处理;ty:百里酚处理;tym:混合处理)。
图3为白蚁在不同处理条件下的速度(ck:对照;all:线虫处理;ty:百里酚处理;tym:混合处理)。
图4为不同处理时间乳白蚁cd1(左)和hpc88(右)基因的表达量变化(ck:对照;all:线虫处理;ty:百里酚处理;tym:混合处理)。
图5为不同处理时间乳白蚁p4506a(左)和p450g(右)基因的表达量变化(ck:对照;all:线虫处理;ty:百里酚处理;tym:混合处理)。
图6为不同处理时间乳白蚁中肠中酪氨酸酶活性变化(ck:对照;all:线虫处理;ty:百里酚处理;tym:混合处理)。
图7为不同时间各处理乳白蚁后肠中β-1,3-葡聚糖酶活性变化(ck:对照;all:线虫处理;ty:百里酚处理;tym:混合处理)。
图8为乳白蚁不同组织液的抗菌活性(ck:对照;all:线虫处理;ty:百里酚处理;tym:混合处理)。
具体实施方式
为了具体阐明本发明所采取的手段及实施效果,以下结合实施例及附图对本发明作进一步说明。
1、以下实施例使用的昆虫病原线虫是steinernemacarpocapsaeall,白蚁是台湾乳白蚁。
2、百里酚对白蚁的毒力水平
(1)母液配制:将600mg百里酚溶于10ml乙醇中,配制成浓度为60mg/ml的母液备用,4℃保存。
(2)将百里酚母液用乙醇稀释成浓度为0、0.1、0.15、0.20、0.25mg/ml这5个浓度。用移液枪吸取500μl药物稀释液自外缘向内均匀点在滤纸
ld10=0.141mg/ml,95%的置信区间为0.119~0.158mg/ml;
ld20=0.166mg/ml,浓度95%的置信区间为0.146~0.181mg/ml;
ld30=0.186mg/ml,浓度95%的置信区间为0.169~0.201mg/ml;
ld50=0.226mg/ml,浓度95%的置信区间为0.209~0.245mg/ml。
3、以下没有特殊说明,溶液和悬浮液的溶剂是水。
实施例1
一、试验方法
1、百里酚对线虫存活和侵染能力
百里酚与线虫液混合的悬浮液中,线虫浓度是200ij/只(26667ij/ml),百里酚浓度分别为0.141mg/ml、0.166mg/ml、0.186mg/ml(分别记为ld10、ld20、ld30),每个处理3个重复,以不加百里酚的线虫悬液(ck)作为对照。于25±1℃的黑暗培养箱中放置7d,每天观察,每个重复随机取100μl线虫悬液于计数板中于体视镜下检查线虫的存活情况。计算:存活率%=(活线虫数÷总线虫数)*100%。
在垫有两层滤纸的9cm培养皿中挑入10头大蜡螟幼虫,每皿滴入上述混合线虫悬液1.5ml,封口膜封口,25±1℃的黑暗培养箱中放置48h和72h后,检查大蜡螟死亡情况和是否有线虫后代产生,以不加百里酚的线虫悬液(ck);未加线虫的、不同浓度的百里酚溶液处理的大蜡螟作为对照,同时以清水处理的大蜡螟作为空白对照。
2、百里酚与线虫混合对白蚁致死效果的生物测定
空白对照组:将300μlddh2o滴加在培养皿中的直径6cm的滤纸上,再加入40只健康工蚁。
线虫感染组:将300μl浓度分别为3333ij/ml(25ij/只)、6667ij/ml(50ij/只)、13333ij/ml(100ij/只)和26667ij/ml(200ij/只)的线虫悬浮液滴加在培养皿中的直径6cm的滤纸上,再加入40只健康白蚁。
百里酚处理组:将500μl百里酚(浓度分别为0.141mg/ml、0.166mg/ml、0.186mg/ml)溶液滴加在直径6cm的滤纸上,晾干后装入培养皿中,加入300μlddh2o,再加入40只健康白蚁。
混合组:将线虫液配制成浓度分别为3333ij/ml(25ij/只)、6667ij/ml(50ij/只)、13333ij/ml(100ij/只)和26667ij/ml(200ij/只)(这4个浓度是在5d时对白蚁死亡率低于40%)的悬浮液。将500μl不同浓度的百里酚(浓度分别0.141mg/ml、0.166mg/ml、0.186mg/ml)溶液分别滴加在直径6cm的滤纸上,晾干后装入培养皿中,再在滤纸上滴入300μl不同浓度的线虫悬浮液,加入40只健康白蚁。
将各处理放入27±1℃,rh86%的培养箱黑暗连续培养10d,每天记录白蚁的死亡率。每个处理3个重复。
注:生测实验中每皿40只白蚁,加入线虫悬液均为0.3ml,以200ij/只为例,(200ij/只×40只)÷0.3ml=26667ij/ml,即200ij/只转换为成26667ij/ml。
3、白蚁行为测试
白蚁位移和速度测定。
空白对照组(ck):将300μlddh2o滴加在6cm的滤纸的培养皿中,再加入40只健康工蚁,处理6h。
百里酚处理组:将500μl百里酚(浓度为0.186mg/ml)溶液滴加在6cm的滤纸上,晾干后装入培养皿中,加入300μlddh2o,再加入40只健康白蚁,处理6h。
线虫处理组:将300μl浓度为26667ij/ml(200ij/只)的线虫悬浮液滴加在6cm的滤纸的培养皿中,再加入40只健康白蚁,处理6h。
混合组:将线虫液配制成浓度为26667ij/ml(200ij/只)的悬浮液。将500μl百里酚(浓度为0.186mg/ml)溶液滴加在直径6cm的滤纸上,晾干后装入培养皿中,再在滤纸上滴入300μl26667ij/ml(200ij/只)的线虫悬浮液,加入40只健康白蚁,处理6h。
在纸板上画20cm的直线,标好刻度(每0.5cm一个刻度),再把玻璃管放在直线上,固定在纸板。取出白蚁放置在玻璃管一端,即开始计时2min,用录像机录下每只白蚁两分钟内的位移和速度,设6个重复。
4、免疫水平的测定
蒸馏水、百里酚溶液(0.186mg/ml)、26667ij/ml(200ij/只)的线虫悬液、复合处理即0.186mg/ml的百里酚溶液和26667ij/ml(200ij/只)的线虫悬液复合处理后。
空白对照组:将300μlddh2o滴加在6cm的滤纸的培养皿中,再加入40只健康工蚁。
线虫感染组:将300μl浓度为26667ij/ml(200ij/只)的线虫悬浮液滴加在6cm的滤纸的培养皿中,再加入40只健康白蚁。
百里酚处理组:将500μl百里酚(浓度为0.186mg/ml)溶液滴加在6cm的滤纸上,晾干后装入培养皿中,加入300μlddh2o,再加入40只健康白蚁。
混合组:将线虫液配制成浓度为26667ij/ml(200ij/只)的悬浮液。将500μl百里酚(浓度为0.186mg/ml)溶液滴加在直径6cm的滤纸上,晾干后装入培养皿中,再在滤纸上滴入300μl26667ij/ml(200ij/只)的线虫悬浮液,加入40只健康白蚁。
将各处理放入27±1℃,rh86%的培养箱黑暗连续培养,0.5d、1d、5d和9d收样。并提取rna存于-80℃冰箱中。
(1)防御相关基因的表达量的测定
反转录(one-stepgdnaremovalandcdnasynthesissupermix)。rt-qpcr所有模板cdna用无菌ddh2o稀释10倍后混匀用于下面rt-qpcr反应体系中。使用的内参基因hsp70,反应体系(见表1-2):
表1防御响应相关基因及内参基因的qpcr引物序列
表2rt-qpcr反应体系
(2)酪氨酸酶活性测定。使用solarbio酪氨酸酶活性检测试剂盒(bc4055)参数,每只白蚁解剖取中肠部分,放入装有300μl酪氨酸酶提取液中,每管剖15只白蚁,酶标仪测定。蛋白浓度测定:solarbiobca蛋白浓度测定试剂盒(pc0020)样品稀释8倍后测定。酪氨酸酶活计算:酶活(u/mg.min)=270×kmax÷cpr(参照试剂盒公式及实验的参数)kmax:制作时间和吸光度的变化趋势线,选择测定时间区间内最大的斜率;cpr:样本蛋白浓度mg/ml。
(3)β-1,3-葡聚糖酶活性测定。白蚁解剖取后肠部分,后肠放入装有300μlsab提取液中,每管剖15只白蚁,40hz,研磨90s后离心15min,吸取上清液于新的灭菌离心管中后,540nm下测定吸光度a540。蛋白浓度测定:使用g250试剂盒测定样品浓度,在595nm下测定吸光度a595。β-1,3-葡聚糖酶活计算:酶活u(mg/ml.min)=葡萄糖浓度÷cpr÷60(60为反应时间60min。)
(4)白蚁组织液抗菌活性测定。将大肠杆菌(trans1-ti感受态细胞)接种于lb培养基中,37℃,220rpm,摇菌过夜,将1d的样品解剖成前肠、中肠和表皮三个部分,分别装于装有300μltris-nacl溶液,每管剖10只白蚁。提取组织液:将灭菌钢珠加入离心管中,40hz,研磨90s后离心15min,吸取上清液于新的灭菌离心管中后,置于冰上备用。酶标板中加入lb培养基150μl,浓度均一化后的组织液5μl,大肠杆菌接种量为体积分数0.5%,37℃,220rpm,摇菌4h后于600nm下测定吸光度。计算:组织液抗菌活性=(ack-a)÷ack×100,其中a表示吸光度值,ack表示对照吸光度值。
二、实验结果
1、百里酚对线虫存活和侵染能力的影响
线虫与百里酚混合培养7d后线虫的存活情况(图1),各处理组存活率都约为90%,说明这3种浓度的百里酚溶液对线虫的存活几乎没有影响。用剩余的线虫悬液感染大蜡螟,感染两周后解剖大蜡螟观察到有大母虫出现,说明了这3种浓度的百里酚溶液对线虫的侵染能力没有影响。
2、百里酚与线虫混合对白蚁致死效果
测定低浓度线虫悬液与低浓度百里酚溶液混合对白蚁进行混合计算其半数击倒时间kt50见表3。从表3可以看出,当线虫浓度为26667ij/ml(200ij/只)时,百里酚浓度为0.186mg/ml时,kt50最小,即kt50=14d。当线虫浓度为26667ij/ml(200ij/只)时,kt50>30d;百里酚浓度为0.186mg/ml时,kt50>30d。结果表明混合效果远高于单一处理效果。
表3百里酚线虫混合处理后的半数击倒时间
注:ty:百里酚。all:steinernemacarpocapsaeall。\:表示kt50>30,此处规定为无杀虫效果。空白对照击倒数量为0,未列入。
3、实验处理对白蚁行为的影响
白蚁在不同处理条件下的位移(图2)和速度(图3),线虫组白蚁在2min内的位移距离显著大于对照组(p=0.001),而百里酚组位移距离显著小于对照组(p=0.042)。从白蚁移动速度上看,感染线虫后白蚁的速度显著大于对照组(p<0.001),而百里酚组和混合组速度则与之相反。白蚁位移和速度的变化都说明了白蚁在感染线虫后行动能力增强,而百里酚对白蚁的运动能力起到了抑制作用,并能有效抑制线虫诱导的运动能力增强。
4、免疫水平的分析
(1)防御相关基因的表达量的测定
各处理对4个白蚁防御线虫防御响应基因表达的影响。图4各处理中cd1基因在5d~9d均显著下调(p<0.05),处理9d后,混合组中cd1均显著低于单一处理组(p<0.05);在0.5~9d,hpc88基因在线虫组和混合组中均表现为显著上调(p<0.05)。说明百里酚对两种相关基因的作用是不同的,百里酚对cd1有抑制作用,且能与线虫协同发挥作用;而hpc88基因受百里酚的诱导。
如图5显示,p4506a基因表达量,0.5~5d混合处理与线虫差异显著,混合处理显著抑制了白蚁p4506a基因的防御响应表达。各处理中p450g在处理5d及至之后,混合处理与各处理差异显著(p<0.05),抑制了对线虫的防御响应。这表明百里酚对两种血红素结合氧化还原酶基因的作用相似,百里酚对p4506a和p450g均有抑制作用,且能与线虫协同抑制。
(2)酪氨酸酶活性测定
中肠中酪氨酸酶活性变化见(图6),在1d~9d,混合组中酪氨酸酶活显著高于单一处理组(p<0.05);百里酚组在处理0.5d(p=0.026)和5d(p=0.015)后显著高于对照组;5d时,3个处理组酪氨酸酶活均高于对照组,且混合组显著高于单一处理组(p<0.05)。在处理1d~5d时,中肠酪氨酸酶同时受到百里酚和线虫显著诱导上调,混合处理具有协同增效作用。
(3)β-1,3-葡聚糖酶活性测定
不同时间各处理后肠中β-1,3-葡聚糖酶活性变化(图7)。处理0.5d后,线虫组中β-1,3-葡聚糖酶活性显著高于对照组(p=0.02)。在1d时,混合组中β-1,3-葡聚糖酶活显著低于线虫单一处理组(p=0.01);在5d时,各处理组中β-1,3-葡聚糖酶活均显著低于对照组(p<0.05);9d时,线虫组(p=0.021)和混合组(p=0.034)的β-1,3-葡聚糖酶活均显著低于对照组。说明百里酚对白蚁β-1,3-葡聚糖酶活性在处理5d时具有显著抑制作用,而线虫对白蚁β-1,3-葡聚糖酶抑制表现在处理1d时,二者存在一定的协同抑制防御作用。
(4)白蚁组织液抗菌活性
粗酶蛋白浓度:前肠0.18±0.01mg/ml、中肠0.27±0.02mg/ml、表皮5±0.18mg/ml。乳白蚁不同肠道部位的抗菌活性(图8)。在前肠中,线虫组组织液的抗菌活性与对照组没有显著差异;百里酚组中肠组织液抗菌活性显著低于对照组(p=0.005)和线虫组(p=0.006),混合组与对照组和线虫组中肠组织液抗菌活性没有显著性差异。在处理1d时,这表明百里酚能够抑制中肠组织液的抗菌活性。
- 还没有人留言评论。精彩留言会获得点赞!