一种贯叶金丝桃组培育苗的方法与流程
1.本发明涉及药物植物育苗工程技术领域,具体涉及一种贯叶金丝桃组培育苗的方法。
背景技术:
2.贯叶金丝桃(hypericum l.perforatum),又名贯叶连翘,为藤黄科植物贯叶金丝桃 hypericum perforatum l.的干燥地上部分。主要产于西南和西北各省。茎呈圆柱形,长 10-100cm,多分枝,茎和分枝两侧各具有一条纵棱。小枝细瘦,对生于叶腋。单叶对生,无 柄,抱茎;叶片披针形或长椭圆形,散布透明或黑色腺点。蒴果矩圆形,具泡状小突起。气 微,味微苦,涩。贯叶金丝桃含金丝桃素、伪金丝桃素、异金丝桃素和大黄素-蒽酮等萘并双 蒽酮类化合物,贯叶金丝桃素和加贯叶金丝桃素等间苯三酚类成分,金丝桃苷、槲皮素、萹 蓄苷、槲皮苷、异槲皮苷等黄酮类成分及挥发油等。现代药理研究表明,贯叶金丝桃提取物 具有显著的抗抑郁作用,金丝桃苷对心肌缺血及脑缺血再灌注损伤具有保护作用。
3.到目前为止,金丝桃素主要从野生贯叶金丝桃植株中提取分离,随着市场对金丝桃素需 求的逐渐增加,使得野生贯叶金丝桃资源过度被采挖,加上贯叶金丝桃自然繁殖率低,从而 造成资源的迅速减少。贯叶金丝桃的主要育苗方式以种子直接撒播的有性繁殖为主,该种方 式获得的种苗都是混杂种苗,遗传背景不一致;并且因种子细小,存在种子播种困难和成苗 率低的问题,且需要定期进行杂草清理、浇水施肥等管理,种苗生产管理难度较大。
4.为了保护野生资源,避免资源枯竭,因此很有必要开展贯叶金丝桃的组培研究。在国内, 贯叶金丝桃组培技术研究距今已有二十余年,陈霄鹏(“贯叶金丝桃的组培快繁”,植物杂 志,2000(03):27)使用幼嫩子房、嫩茎、叶片做为外植体,诱导产生愈伤组织,然后经过继 代、壮苗、生根环节再生植株获得贯叶金丝桃组培苗,总耗时约75-100天。陈全战和宋东杰 (“贯叶金丝桃组织培养的研究”,中国野生植物资源,2003,22(3):42-43)同样使用幼茎 做为外植体的间接器官发生途径方式获得贯叶金丝桃组培苗,技术环节同样包括愈伤诱导、 继代、壮苗和生根。周尧等(“贯叶金丝桃离体培养及植株再生体系的建立”,安徽农业科 学,2012,40(2):662-666)则使用幼芽做为外植体,通过启动培养、继代培养和生根培 养,直接获得组培苗,总耗时约85天。丁如贤(“贯叶连翘的组织培养和快速繁殖”,第二 军医大学学报,2000,21(10))使用根、带节茎段、叶作为外植体,诱导产生愈伤组织, 然后经过丛生芽诱导,生根诱导、炼苗移栽,其移栽成活率仅为64%。因此目前贯叶金丝桃 组培育苗还存在培养周期较长、成本高、移栽成活率低的问题。
技术实现要素:
5.本发明利用植物组织培养方式获得遗传背景一致的初代组培苗后,没有像传统组培方式一 样,在组培室继代、壮苗、生根,而是将初代组培苗,直接经过继代生根一体培养,同时实 现壮苗和生根获得组培瓶苗,在简化操作步骤的同时,减少了培养周期,相较传统
组培方式 耗时减少8-23天。该方法炼苗出苗、移栽成活率高,且能获得遗传基础一致的种苗,同时操 作简便且安全高效,降低了生产成本,为形成贯叶金丝桃规模化种苗快繁提供技术支持. 本发明是通过以下的技术方案实现的:
6.1)外植体的选取和处理:准备外植体,并采用消毒剂消毒;
7.2)初代培养:将消毒好的外植体,接入初代培养基,获得无菌丛生芽幼苗;
8.3)继代和生根一体培养:将诱导苗单芽,接入继代和生根一体培养基,获得生根组培苗;
9.4)炼苗移栽:将生根组培苗进行炼苗,然后移栽。
10.进一步的,所述准备外植体阶段,外植体选自贯叶金丝桃的芽,优选自腋芽和顶芽。
11.进一步的,所述无菌消毒阶段,消毒剂可以选择2-5%的次氯酸钠,优选2%的次氯酸钠。
12.进一步的,所述初代培育阶段,培养条件是:室温,湿度36-86%,光照12h/d,光照强度 1500-3500lx。
13.进一步的,所述初代培育阶段,培养基包含:ms、0.9-1.0mg/l6-卞氨基嘌呤、0.05-1.0mg/l萘 乙酸、蔗糖30g/l、琼脂7g/l。
14.进一步的,所述继代和生根一体培养阶段,培养条件是:室温,湿度36-86%,光照12h/d, 光照强度1500-3500lx。
15.进一步的,所述继代和生根一体培养阶段,培养基包含:ms、30-60g/l蔗糖、琼脂7g/l。
16.进一步的,所述继代和生根一体培养阶段,优选培养基包含:ms、40-60g/l蔗糖、琼脂7g/l。
17.进一步的,所述继代和生根一体培养阶段,更优选培养基包含:ms、蔗糖60g/l、琼脂7g/l。
18.进一步的,所述炼苗阶段,培养条件是:避免阳光直射放置2-3天,移栽入椰糠基质中进行 基质炼苗。
19.优选实施方式为:
20.(1)外植体的选取和处理:选取贯叶金丝桃的顶芽作为外植体,将外植体放置在烧杯中加入 2滴洗洁精,流水冲洗,在半开放式接种室,超净工作台上用75%酒精消毒,2%次氯酸钠 10-12min,无菌水冲洗。
21.(2)丛生芽培养:将经过步骤(1)处理后的外植体接种于包含:ms、0.9-1.0mg/l6-卞氨基 嘌呤、0.05-1.0mg/l萘乙酸、蔗糖30g/l、琼脂7g/l的培养基中。接种好后放置到培养室的 培养架上。培养条件为:室温,湿度36-86%,光照12h/d,光照强度1500-3500lx。20-30天 后得到丛生芽。
22.(3)继代和生根一体培养:将经步骤(2)培养的丛生芽转接到继代和生根一体培养基包含: ms、30-60g/l蔗糖、琼脂7g/l,ph值5.8的培养基中生长。接种好后放置到培养室的培养 架上。培养条件为:室温,湿度36-86%,光照12h/d,光照强度1500-3500lx。37或40天后 得到生根组培苗。
23.(4)炼苗移栽:将经过步骤(3)培养获得的生根组培苗带瓶移至炼苗场,避免阳光
直射放 置2-3天,移栽入椰糠基质中进行基质炼苗。21天后移栽到大田。
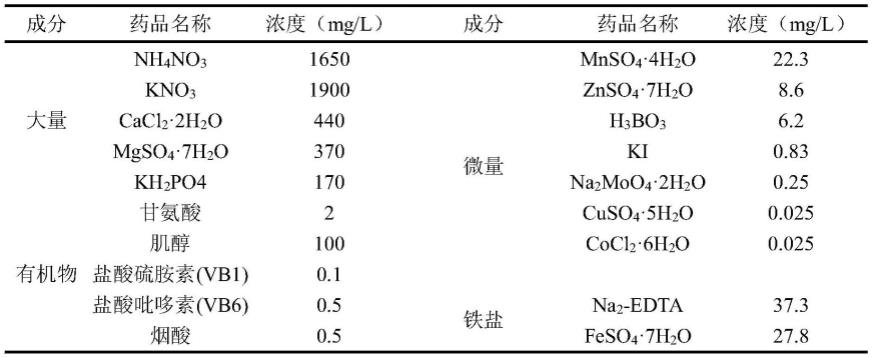
24.本发明与现有技术相比,其有益效果为:
25.1)本发明组培步骤少,流程简单,培养周期短,相较传统组培方式耗时减少20多天。
26.2)本发明炼苗出苗、移栽成活率高,解决了现有技术中移栽成活率低的问题。
27.3)扩繁周期短,操作简单,大大降低了种苗生产成本。
28.ms培养基为本领域所公知并且是最普遍使用的适用于组织培养的培养基,组成主要包括: nh4no3、kno3、cacl2·
2h2o、mgso4·
7h2o、kh2po4、甘氨酸、肌醇、盐酸硫胺素(vb1)、 盐酸吡哆素(vb6)、烟酸、mnso4·
4h2o、znso4·
7h2o、h3bo3、ki、na2moo4·
2h2o、 cuso4·
5h2o、cocl2·
6h2o、na
2-edta、feso4·
7h2o。
29.ms培养基包括但不限于自制、市售、改良ms培养基。
附图说明
30.图1和图2为植物生长调节剂处理组培苗培养29天生长情况;其中图1为多效唑处理培养 29天组培苗情况;图2为矮壮素处理培养29天组培苗情况图3为不同糖浓度处理贯叶组培苗30天生长图
31.为了加深对本发明的理解,下面将结合实施例对本发明作进一步详述,该实施例仅用于解释 本发明,并不构成对本发明保护范围的限定。
具体实施方式
32.实施例1
33.对照组:植物生长调节剂的考察,通过使用多效唑和矮壮素进行壮苗试验,每种植物生长调 节剂分别设置3个浓度梯度,0.1mg/l、0.5mg/l和1.0mg/l,每个浓度梯度单次重复培养6 瓶,每瓶转接12株苗,基础培养基包含:ms、30g/l蔗糖、7g琼脂。培养时间29天。 实验组:蔗糖浓度考察,通过调整培养基不同蔗糖浓度,设置s1包含:ms、20g/l蔗糖、7g 琼脂,s2包含:ms、30g/l蔗糖、7g琼脂,s3包含:ms、40g/l蔗糖、7g琼脂,s4包含: ms、60g/l蔗糖、7g琼脂,4种浓度梯度,每个浓度梯度单次重复培养8瓶,每瓶转接12 株苗。培养时间30天。
34.其中ms为自制,ms的配方如下:
[0035][0036]
表1矮壮素和多效唑处理浓度表
[0037][0038]
表2糖浓度处理设计表
[0039][0040]
实验结果:多效唑和矮壮素处理的组培苗基本不生长或轻微生长,见示例附图1、2;糖浓度 处理组生长良好,见示例附图3。
[0041]
表3
[0042][0043]
实施例2
[0044]
贯叶金丝桃传统组织培养方案:
[0045]
(1)外植体的选取和处理:通过筛选海南优势单株稳定继代4次后做为繁殖母株,排除母本 基因型对植株生长均势的影响,选取母株的顶芽作为外植体,将外植体放置在烧杯中加入2 滴洗洁精,流水冲洗,在半开放式接种室,超净工作台上用75%酒精消毒,2%次氯酸钠 10-12min,无菌水冲洗。
[0046]
(2)初代培养:将经过步骤(1)处理后的外植体接种于包含:ms、0.9-1.0mg/l6-卞氨基嘌 呤、0.05-1.0mg/l萘乙酸、蔗糖30g/l、琼脂7g/l,ph值5.8的培养基中。接种好后放置到 培养室的培养架上。培养条件为:室温,湿度36-86%,光照12h/d,光照强度1500-3500lx。 20-30天后得到丛生芽幼苗。
[0047]
(3)继代培养:将经过步骤(2)培养后的诱导苗单芽接种于包含ms、蔗糖30g/l、1g/l花 多多1号、琼脂7g/l,ph值5.8的培养基中。接种好后放置到培养室的培养架上。培养条件 为:室温,湿度36-86%,光照12h/d,光照强度1500-3500lx。30天后得到丛生芽。
[0048]
(4)生根培养:将经过步骤(3)培养后的继代苗单芽接种包含于1/2ms、蔗糖20g/l、琼脂 7g/l,ph值5.8的培养基中。接种好后放置到培养室的培养架上。培养条件为:室温,湿度 36-86%,光照12h/d,光照强度1500-3500lx。25天后得到生根组培苗。
[0049]
(5)炼苗:将经过步骤(4)培养获得的生根组培苗带瓶移至炼苗场,避免阳光直射放置2-3 天,移栽入椰糠基质中进行基质炼苗。25-30天后移栽到大田。
[0050]
其中ms为自制,ms的配方如下:
[0051][0052]
实施例3
[0053]
本发明采用的组织培养方案:
[0054]
(1)外植体的选取和处理:通过筛选海南优势单株稳定继代4次后做为繁殖母株,排除母本 基因型对植株生长均势的影响,选取母株的顶芽作为外植体,将外植体放置在烧杯中加入2 滴洗洁精,流水冲洗,在半开放式接种室,超净工作台上用75%酒精消毒,2%次氯酸钠消毒 10-12min,无菌水冲洗。
[0055]
(2)初代培养:将经过步骤(1)处理后的外植体接种于包含ms、0.9-1.0mg/l6-卞氨基嘌呤、 0.05-1.0mg/l萘乙酸、蔗糖30g/l、琼脂7g/l,ph值5.8的培养基中。接种好后放置到培养 室的培养架上。培养条件为:室温,湿度36-86%,光照12h/d,光照强度1500-3500lx。20-30 天后得到丛生芽幼苗。
[0056]
(3)继代和生根一体培养:将经步骤(2)培养的诱导苗单芽转接到继代和生根一体培养基 ms、30-60g/l蔗糖、琼脂7g/l,ph值5.8的培养基中生长。接种好后放置到培养室的培养 架上。培养条件为:室温,湿度36-86%,光照12h/d,光照强度1500-3500lx。40天后得到 生根组培苗。
[0057]
(4)炼苗:将经过步骤(3)培养获得的生根组培苗带瓶移至炼苗场,避免阳光直射放置2-3 天,移栽入椰糠基质中进行基质炼苗。21天后移栽到大田。
[0058]
其中ms为自制,ms的配方如下:
[0059][0060]
本发明的技术方案与贯叶金丝桃传统组培时间相比节约20多天,缩短了组培周期,节省了成 本。
[0061]
实施例4
[0062]
继代生根一体培养基中糖浓度对炼苗出苗率、移栽成活率的影响
[0063]
计算公式
[0064]
炼苗出苗率=炼苗完成移栽株数/炼苗株数*100%
[0065]
移栽成活率=移栽种植成活株数/炼苗完成移栽株数*100%
[0066]
总体成活率=移栽种植成活株数/炼苗株数*100%
[0067]
通过将原继代培养和生根培养两个阶段简化为继代(生根)一体培养,在培养基中添加不同 浓度的蔗糖,考察不同蔗糖浓度的培养基对炼苗出苗率、移栽成活率的影响。
[0068]
蔗糖糖浓度考察,通过调整培养基不同蔗糖浓度,设置4种浓度梯度的培养基,培养基s1 包含ms、20g/l蔗糖、7g琼脂;培养基s2包含ms、30g/l蔗糖、7g琼脂,培养基s3包含 ms、40g/l蔗糖、7g琼脂;培养基s4包含ms、60g/l蔗糖、7g琼脂。每个浓度梯度单次培 养4瓶,每瓶转接12株苗。
[0069]
其中ms为自制,ms的配方如下:
[0070][0071][0072]
培养结束,分别将3组培养周期平均株高约4cm、5cm和6cm的瓶苗移至走廊炼苗,避免阳 光直射。瓶苗炼苗2-3天后,移栽入椰糠基质中进行基质炼苗。各个处理分别炼苗21-28天, 观察炼苗出苗率。然后将平均株高约6cm,根系较发达成苗移栽至大田中,缓苗6天后观察 移栽成活率。
[0073]
表5糖浓度不同处理组培苗炼苗、移栽情况
[0074]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1