一种提高棉花活体基因转化效率的方法
1.本发明涉及基因工程技术领域,更具体地说是涉及一种提高棉花活体基因转化效率的方法。
背景技术:
2.目前棉花基因转化常用的方法主要是基于组织培养的农杆菌介导法,该方法存在转化周期长、成本高、效率较低等问题,长期以来制约着棉花基因工程研究的发展。因此改进棉花转基因方法,提高功能基因转化的效率是棉花基因工程及遗传育种研究中急需解决的主要问题之一。
3.模式植物拟南芥的农杆菌“浸花法”具有不受宿主专一性和受体材料基因型的限制、不需要经过漫长的植物组织培养过程、实验周期较短、操作简单等优点,适合大规模的农作物遗传转化。近年来农杆菌介导的棉花活体转化技术已有初步的尝试,但由于棉花的自身性状及大田生长条件的限制,农杆菌活体转化的效率依然很低,需要进一步的优化改良。
4.因此,如何提供一种提高棉花活体基因转化效率的方法是本领域技术人员亟需解决的问题。
技术实现要素:
5.有鉴于此,本发明提供了一种提高棉花活体基因转化效率的方法,通过延长柱头的保湿时间,提高了转化效率。
6.为了实现上述目的,本发明采用如下技术方案:
7.一种提高棉花活体基因转化效率的方法,在花瓣开放时,将含有目的基因的农杆菌菌液喷施于棉花花朵雄蕊及柱头上,花瓣闭合前在柱头顶端套上内含浸润过农杆菌菌液的脱脂棉球的套管,并在花柄处喷施赤霉素。
8.以上技术方案达到的技术效果是:目前已经公开的棉花喷花转化法仅是在棉花开花后进行简单的喷施,夏季炎热高温,菌液在短时间内容易蒸发,柱头浸染时间较短,影响转化效率,所以,在喷施农杆菌菌液后,对农杆菌进行套管处理,管中含有浸润过农杆菌菌液的脱脂棉,这样,可以起到对柱头和雄蕊保湿的作用,防止风干,显著提高了基因的转化效率。
9.作为本发明优选的技术方案,所述农杆菌菌液的制备过程包括:
10.1)将目的基因连接到pcambia2301载体的多克隆位点,然后将载体转入农杆菌菌株lba4404中,存放于
‑
70℃冰箱备用;转化前一周,将含pcambia2301载体质粒的农杆菌添加到含抗生素的yeb细菌培养基上培养2~3d后,挑单菌落接种于含抗生素的yeb液体培养基中,悬浮培养过夜,得储备菌液,4℃冰箱保存备用;
11.2)在转化前一天,将步骤1)所得储备菌液接种至含抗生素的yeb液体培养基中培养过夜,得菌液;
12.3)转化当天,将步骤2)所得菌液离心,弃上清,用含蔗糖50g/l和乙酰丁香酮100μmol/l的1/2ms液体培养基悬浮沉淀,调od
600
值为0.4~0.6,作为农杆菌菌液。
13.以上技术方案达到的技术效果是:本发明所采用的植物转基因载体为pcambia2301,该载体包含抗卡那霉素的nptii基因和gus报告基因,可用于转基因植株方便快捷检测。载体上多克隆位点含有多个酶切位点,可依据需要连接不同的启动子和需要转化的目的基因,加入乙酰丁香酮可以促进农杆菌的浸染,利用基因转化。
14.作为本发明优选的技术方案,步骤1)中,悬浮培养的条件为28℃,200rpm。
15.作为本发明优选的技术方案,步骤2)中,储备菌液和yeb液体培养基的体积比为1:10。
16.作为本发明优选的技术方案,步骤3)中,所述离心为在4000rpm下离心10min。
17.作为本发明优选的技术方案,喷施农杆菌菌液的时间为棉花盛花期。
18.作为本发明优选的技术方案,喷施农杆菌菌液的具体过程为:待花开放后,将农杆菌菌液对着柱头和雄蕊进行喷雾,确保柱头和雄蕊完全湿润。
19.作为本发明优选的技术方案,所述赤霉素的浓度为200μmol/l。
20.经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种提高棉花活体基因转化效率的方法,在喷施农杆菌菌液后,及时在柱头顶端套管保湿,防止了菌液的蒸发,转化效率提高了2倍,而且,该方法不依赖于组织培养,转化方法更加简洁和高效。
21.而且,本发明所采用的植物转基因载体不仅包含抗卡那霉素的nptii基因,而且包含gus报告基因,为后代转基因阳性苗的筛选提供了方便。gus检测效率与目的基因pcr检测效率相关性较高,在一定程度上其检测结果可代表目的基因pcr检测。且gus基因检测方法相对于常规的pcr检测方法来说,不需要专业的分子检测技术,易于操作,效果稳定,高效快速。因此在进行大规模的基因转化及后代筛选中采用卡那霉素检测与gus检测相结合的方法,可降低成本,节省时间,提高筛选效率。
22.综上所述,本研究所建立的棉花活体转化技术体系从田间转化到获得t1转基因阳性株用时约5个月(7月初至11月底),转化周期约为组织培养方法转化周期的1/3,且操作简单,成本较低,在棉花规模化转基因及功能基因研究方面具有明显的优势。
附图说明
23.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
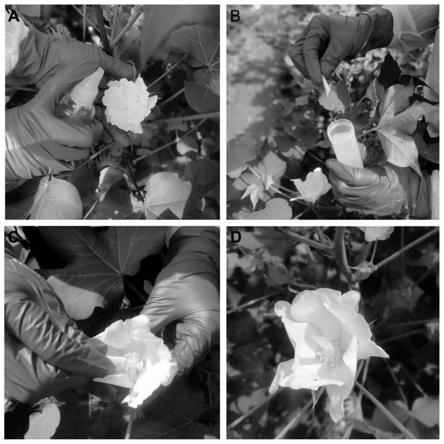
24.图1附图为本发明提供的农杆菌菌液浸染棉花柱头和雄蕊的操作图;其中,a为喷施菌液;b为用塑料管吸取菌液;c为套管于柱头;d为转化后的花朵;
25.图2附图为本发明提供的对t1代植株进行卡那霉素检测筛选的示意图;其中,a为第一次喷施卡那霉素前的t1幼苗,右下角为局部放大图;b为第一次喷施卡那霉素1周后的幼苗,右下角为局部放大图;c为第一次喷施卡那霉素后的阳性株(左)和阴性株(右);d和e分别为第二次喷施卡那霉素后的阴性株(d)和阳性株(e);
26.图3附图为以gus染色的方法对卡那霉素抗性植株进行了进一步的检测结果图;其
中,1
‑
8为组1获得的8株卡那霉素抗性株,其中2、4、7号gus检测呈阳性;9
‑
23为组2获得的15株卡那霉素抗性株,其中11、13、16、18、20、21、23号gus检测呈阳性;
27.图4附图为用目的基因h1的正向和反向引物进行pcr扩增的结果图;其中,marker为dna分子量标准;+为质粒模板阳性对照;1
‑
8为组1的8株卡那霉素抗性株;11
‑
23为组2的15株卡那霉素抗性株。
具体实施方式
28.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
29.本发明实施例提供了一种提高棉花活体基因转化效率的方法,包括:
30.1)农杆菌菌液的制备
31.田间试验前一周进行转化菌液的制备。将含载体质粒的农杆菌于添加卡那霉素50mg/l、利福平100mg/l、硫酸链霉素100mg/l(依据不同的载体及转化基因的需要,加入不同的抗生素)的yeb细菌培养基上培养2~3d后,挑单菌落接种于含相同抗生素的50mlyeb液体培养基中,28℃、200rpm悬浮培养过夜,4℃冰箱保存备用。在转化前一天,接种储备菌液20ml至200ml含相同抗生素的yeb液体培养基中培养过夜,转化当天,菌液4000rpm室温离心10min,弃上清,沉淀用含蔗糖50g/l和乙酰丁香酮100μmol/l(此处加入乙酰丁香酮可以促进农杆菌的浸染,利用基因转化)的1/2ms液体培养基重新悬浮,调od600值为0.4~0.6左右,作为感染液备用。
32.2)农杆菌介导的棉花花朵活体转化
33.7月中旬棉花处于盛花期时,于上午9:00始,在当天开放的花朵花苞打开后,将配制好的菌液用常规的小喷壶(100ml化妆水喷雾瓶)分装,对着柱头和雄蕊进行喷雾,确保柱头和雄蕊完全湿润,棉花授粉6h后,于当天下午15:00左右进行套管保湿,即用制备好的内含脱脂棉的管子,吸饱菌液,套在已经授粉的柱头上,继续浸润保湿,并在花柄处喷施200μmol/l赤霉素保铃;具体操作见图1;
34.3)t1代植株卡那霉素检测筛选
35.9月中旬收获t0代种子,9下旬将t0种子分区域种植于实验农场大棚内(气温低的区域以选择海南种植t1代进行筛选),出苗后待子叶展平至长出1~2片真叶时,用0.5%的卡那霉素喷施棉花幼苗,1周后观察棉花叶片的颜色变化,拔除叶片变黄或有黄斑的植株,保留叶片颜色无明显变化的植株,对剩余植株进行第二次卡那霉素检测,1周后观察统计棉株叶片反应情况,拔除阴性植株。对两次卡那霉素筛选表现为阳性的植株剪取小块叶片用冰盒保存带回实验室进行后续的检测分析,见图2;
36.4)t1代植株的gus检测分析
37.选取两次卡那霉素检测阳性株叶片,进行gus检测分析。检测液配方:100mm ph7.0磷酸缓冲液,50mm k3[fe(cn)6],50mm k4[fe(cn)6],10mm edta,1mm x
‑
gluc,0.1%triton x
‑
100,ph 7.0。临用前加入x
‑
gluc。具体方法:用镊子取一小片棉花嫩叶,放入gus染色反应液体中,抽真空使样品下沉,37℃保温过夜。待显色强度足够后,吸出gus反应缓冲液,加入
70%乙醇进行脱色,待叶片完全脱色后进行观察拍照。所有gus检测阳性植株移栽到花盆置于人工气候室继续生长直至成熟。
[0038]
5)t1代植株的pcr检测分析
[0039]
用ctab法提取棉花dna,进行pcr检测反应。
[0040]
实施例1
[0041]
以目的基因h1为转化对象,按照实施例1的方法进行转化验证:
[0042]
1)2019年夏天,在棉花盛花期进行田间农杆菌介导的活体转化实验,实验方法如实施例1所示,总计转化1400朵花,其中600朵进行了农杆菌喷花处理(组1),800朵在喷花后进行了套管保湿(组2)。9月中旬收获t0代种子,其中组1处理共收花254朵,成铃率42.3%,收获种子490克,约4140粒,单铃平均结籽16.3粒;组2处理共收花315朵,成铃率39.4%,收获种子415克,约3560粒,单铃结籽数11.3粒。
[0043]
2)将两种处理所获得的种子于实验大棚种植,待子叶展平并生长出第一片真叶时,喷施0.5%的卡那霉素进行第一次筛选。一周后观察棉花叶片的反应情况,叶片产生黄色斑点的为转基因阴性植株,予以拔除;叶片颜色保持绿色的植株初步判定为转基因阳性株,通过再次喷施卡那霉素进行确定。第一次检测后组1材料保留潜在的阳性株132株,组2保留173株。对所获得的植株进行第二次卡那霉素检测。经过两次的卡那霉素筛选,组1材料获得卡那霉素抗性株8株,组2获得15株。
[0044]
3)通过gus染色的方法对卡那霉素抗性植株进行了进一步的检测。结果见图3:组1(1
‑
8)的8株卡那霉素抗性株中,3株叶片可观察到蓝色;组2(9
‑
23)的15株卡那霉素抗性株中,7株叶片可观察到蓝色。通过gus检测方法的筛选,排除了部分卡那检测过程中筛选出的假阳性株,可进一步确定含有目的基因的载体已经导入到这10株t1代棉花基因组中。其中“喷花法”(组1)转化率为0.07%(t1阳性株/t0种子数),“喷花加套管保湿法”(组2)转化率提高了2倍左右,达0.2%;然后提取卡那霉素抗性植株的叶片dna,用目的基因h1的正向和反向引物进行了pcr扩增;
[0045]
引物序列:
[0046]
h1
‑
f:agagcaccaagaaaggctcattg,如seq id no.1所示;
[0047]
h1
‑
r:ggagaaggtactagaacatagttg,如seq id no.2所示;
[0048]
扩增片段大小约750bp;
[0049]
结果如图4所示。组1的8株卡那抗性株中仅3株检测到目的基因片段,且与gus检测阳性植株一致,而gus检测为阴性的植株中则没检测到目的基因片段。组2的15株卡那霉素抗性株的检测结果同组1相似,7株gus检测阳性株扩增出目的基因条带,而其余8株gus检测阴性的植株则未扩增出条带(其中组2的17号材料pcr检测条带相对较弱,视为阴性株)。这一结果表明,相对于田间卡那霉素的检测结果,gus基因检测结果与目的基因的pcr检测相关性较高,本实验达到100%。
[0050]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0051]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明
将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1