一种提高丹参盐胁迫抗性的方法
1.本发明涉及作物种植技术领域,尤其涉及一种提高丹参盐胁迫抗性的方法。
背景技术:
2.丹参(salvia miltiorrhiza bunge,lamiaceae)是一种中草药,广泛用于治疗心血管和脑血挂疾病,慢性肾功能衰竭,神经衰弱失眠,痛经和肝硬化,该植物还被开发成各种制剂,如着名的复方丹参滴丸,目前已在许多国家广泛使用。目前,对于丹参的抗性研究已有不少报道,例如:
3.植物生长调节剂(pgrs)广泛用于增强植物的抗逆性。其中一种pgrs是5
‑
氨基乙酰丙酸(ala),它是所有卟啉化合物生物合成的关键前体,如叶绿素、血红素等。作为一种新的植物生长调节剂,可以参与调节光合活性、离子含量、抗氧化代谢或代谢物积累,以减轻植物的损伤。
4.然而,现有的能够提高丹参对盐胁迫的抵抗力的植物生长调节剂极少,因此有必要探寻更多植物生长调节剂,以解决向盐胁迫对丹参所产生的生物逆境,提高对丹参缓解盐胁迫的效果。
技术实现要素:
5.本发明提供了一种利用5
‑
氨基乙酰丙酸提高丹参对盐胁迫抗性的方法有效缓解丹参种植过程中盐胁迫影响丹参生长的问题,将大大减少除草剂的使用,保护生态环境。
6.具体技术方案如下:
7.本发明首次发现了5
‑
氨基乙酰丙酸在提高丹参对其盐胁迫抗性中的新用途。
8.本发明用不同浓度的5
‑
氨基乙酰丙酸(ala)对丹参叶片进行喷施,并通过盆栽试验将丹参进行盐胁迫处理,模拟盐胁迫在田间的作用过程;试验发现,施用5
‑
氨基乙酰丙酸(ala)可以有效缓解丹参因盐胁迫而造成生长影响。
9.进一步地,所述5
‑
氨基乙酰丙酸通过促进丹参的生物量来提高丹参对盐胁迫的抗性;
10.进一步地,所述5
‑
氨基乙酰丙酸通过促进丹参植株中抗氧化酶的合成来提高丹参对盐胁迫的抗性;
11.所述抗氧化酶为超氧化物歧化酶(sod)、过氧化物酶(pod)、过氧化氢酶(cat)或抗坏血酸过氧化物酶(apx)。
12.进一步地,所述5
‑
氨基乙酰丙酸通过降低丹参植株中mda和ros的水平来提高丹参对盐胁迫的抗性。
13.本发明提供了一种提高丹参盐胁迫抗性的方法,该方法将5
‑
氨基乙酰丙酸施用于丹参叶片上。
14.具体地,将5
‑
氨基乙酰丙酸的水溶液喷施在丹参叶片上;所述5
‑
氨基乙酰丙酸的浓度为10
‑
20mg/l。
15.进一步地,所述5
‑
氨基乙酰丙酸的浓度为10mg/l。
16.与现有技术相比,本发明具有以下有益效果:
17.本发明提供了5
‑
氨基乙酰丙酸在提高丹参对盐胁迫的新用途,并进一步发现5
‑
氨基乙酰丙酸通过提高丹参的生物量、促进丹参植株中抗氧化酶的合成、降低丹参植株中mda和ros的水平来提高对盐的抗性,有效缓解丹参种植过程中盐胁迫影响丹参生长的问题,将大大减少除草剂的使用,保护生态环境。
附图说明
18.图1为不同浓度ala处理对盐胁迫后丹参植株叶和根中抗氧化酶(sod、pod、cat、apx)活性的影响;
19.其中,数值是三个生物学重复的平均值
±
se(n=9),不同小写字母表示差异显著(p≤0.05,lsd);a,b分别为叶和根的sod活性;c,d分别为叶和根的pod活性;e,f分别为叶和根的cat活性;g,h分别为叶和根的apx活性。
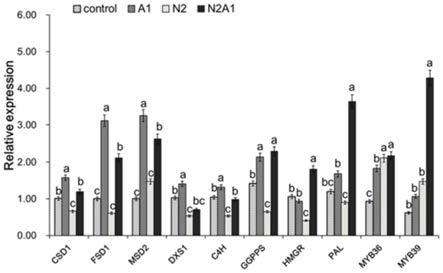
20.图2为ala对盐胁迫后丹参植株相关基因表达的影响;
21.其中,数值是三个生物学重复的平均值
±
se(n=9),不同小写字母表示差异显著(p≤0.05,lsd)。control表示对照组,;n2表示只有200mm nacl;a1表示只经10mg/l的ala处理;n2a1表示有200mm nacl胁迫并且外源施加10mg/l的ala;横坐标为不同的基因;纵坐标relative expression表示基因相对表达量的多少。
具体实施方式
22.下面结合具体实施例对本发明作进一步描述,以下列举的仅是本发明的具体实施例,但本发明的保护范围不仅限于此。
23.本发明中采用的材料:所述丹参的种子均由陕西商洛所提供。5
‑
氨基乙酰丙酸(ala)在上海臻励生物科技有限公司购买。
24.实施例1
25.1不同浓度5
‑
氨基乙酰丙酸的制备
26.将5
‑
氨基乙酰丙酸避光称量,与蒸馏水配置成0、10、20mg/lala调解液。
27.表1 5
‑
氨基乙酰丙酸的浓度梯度
[0028][0029]
注:推荐浓度指通过试验后获得的最佳浓度,即:每1l水中添加的ala含量。
[0030]
2材料与方
[0031]
2.1丹参种子的预处理和萌发
[0032]
选取饱满健康的丹参种子,用蒸馏水浸泡10min,然后将浸泡的种子用70%乙醇溶液表面灭菌30秒,洗净,然后在含有两层滤纸的培养皿中在在25℃黑暗条件下培养72h黑暗中发芽5天催芽、生根。
[0033]
2.2丹参与盐共培养体系的建立
[0034]
将已发芽的具有相同长度根的种子移栽到基质为泥炭土、蛭石和珍珠岩(质量比4∶3∶1)的育苗盆中培养5个月。
[0035]
培养条件如下:光照周期16/8h,光照强度300μmol m
‑2s
‑1,昼夜温度为24/20℃,相对湿度60%
‑
70%,每隔7d浇适量水一次。0mg/l ala与0mg/l nacl为空白对照。
[0036]
3.形态指标
[0037]
形态指标包括丹参的高度、根长,叶片鲜重和干重,根鲜重和干重。将鲜样置于70
±
5℃的烘箱中5天用于测量干重。
[0038]
结果如表2所示。
[0039]
表2 ala对盐胁迫后丹参植株生长的影响
[0040][0041]
注:每个值是三次重复的平均值,p≤0.05,相同小写字母后面的平均值没有显着差异。
[0042]
由表2可知,盐胁迫下,丹参植株的叶鲜重、叶干重、根鲜重和根干重分别下降了25
‑
33%,12
‑
23%,26
‑
33%,16
‑
24%。同样的处理在使用ala后盐胁迫的条件下却显著地提高了植株的生物量。在盐胁迫条件下,当使用20mg/l ala处理后,植株叶片出现萎蔫。高浓度的ala抑制丹参植株的生长,甚至产生毒害。
[0043]
实施例2抗氧化物酶测定
[0044]
抗氧化物酶的活性包括超氧化物歧化酶(sod)、过氧化物酶(pod)、过氧化氢酶(cat)和抗坏血酸过氧化物酶(apx),抗氧化酶活性用muti
‑
mode reader(synergyhtx)仪器根据以下的方法测量。
[0045]
1.sod酶的测定
[0046]
sod活性测定用nbt法(zhang等,2008)。反应体系共3ml,包含50mm磷酸缓冲液(ph 7.8),13mm l
‑
甲硫氨酸,75μmnbt,0.1mm edta,2μm核黄素和100μl酶提取液。反应混合液在4000lx条件下反应20min,在560nm波长下比色,以抑制nbt光化还原的50%为一个酶活性单位计算出sod活性。
[0047]
2.pod的测定
[0048]
pod活性测定采用愈创木酚氧化法(zhou和leul,1999)。反应体系共3m1,包含50mm的磷酸缓冲液(ph 6.0),0.3%愈创木酚,0.4%h2o2和100μl酶提取液。测定反应体系在470nm处1min内的吸光度的增加,消光系数为26.6mm
‑1cm
‑1。
[0049]
3.cat酶的测定
[0050]
cat活性通过h2o2的消耗来测定(消光系数为39.4mm
‑1cm
‑1)。反应体系共3ml,包含2.9ml 50mm磷酸钾缓冲液(ph 7.0,2mm edta
‑
na2,10mm h2o2)和100μl酶提取液。在240nm处测定反应混合液1min的吸光度的变化(aebi,1984)。
[0051]
4.apx酶的测定
[0052]
apx活性测定方法是根据nakano和asada(1981)的方法改良而来。反应体系为3ml,包括2.9ml100mm磷酸钾缓冲液(ph 7.0,含0.1mm edta
‑
na2,0.3mm抗坏血酸,0.06mm h2o2)和100μl酶提取液。在290nm处测定反应棍合液1min内的吸光度变化,消光系数为2.8mm
‑1cm
‑1。
[0053]
结果:
[0054]
图1显示的是盐处理及应用ala缓解下丹参叶和根中抗氧化酶活性的变化。
[0055]
与对照组相比,随盐浓度的增加,丹参的叶片中sod、pod和根中的pod的活性上升,其他酶活性均降低,说明盐胁迫能够影响抗氧化酶活性来调控ros等的产生。
[0056]
与100mm盐对照相比,sod、pod、cat和apx的活性,且10mg/l浓度的ala在丹参的叶和根中分别上升了58%和12%、21%和41%、30%和38%、78%和60%。
[0057]
进一步地,与200mm盐对照相比,sod、pod、cat和apx的活性,且10mg/l浓度的ala在丹参的叶和根中分别上升了48%和14%、13%和12%、36%和14%、79%和72%。
[0058]
总的来说,盐胁迫的逆境胁迫导致了抗氧化物酶活性的改变,而ala则促进抗氧化酶的合成来抵抗盐胁迫造成的伤害。
[0059]
实施例3 mda和ros的测定
[0060]
mda和ros的测定用分光光度计(uv
‑
5500,metash)。
[0061]
1.mda的测定
[0062]
丙二醛含量根据zhou and leul(1999)用硫代巴比妥酸显色法改良后测定。2ml上清酶液加入5ml 0.5%的硫代巴比妥酸(tba,10%三氯乙酸配制)溶液在95℃水浴反应30min,立即冰浴;5000g离心10min,取上清液在532nm和600nm处进行比色,差值用于计算mda含量,消光系数为155mm
‑1cm
‑1。
[0063]
2.ros的测定
[0064]
活性氧(ros)包括过氧化氢(h2o2)、超氧阴离子(o2‑
)、羟基自由基(
‑
oh)。
[0065]
2.1 h2o2的测定
[0066]
h2o2的测定根据velikova等的方法(2000),反应体系2ml,包含0.5ml上清液,0.5ml的10mm磷酸钾缓冲液(ph 7.0)和1ml的1m碘化钾。室温(28℃)反应1hr,390nm处吸光值。根据标曲计算。
[0067]
2.2
‑
oh的测定
[0068]
‑
oh的测定根据halliwell等(1987)的方法改良而来,0.7ml上清溶液,3ml0.5%(w/v)tba和1ml冰醋酸混合,沸水浴30min,冷却到41℃,10min后测550nm处的吸光度。消光系数为0.28mm
‑1cm
‑1。
[0069]
2.3 o2‑
的测定
[0070]
o2‑
的测定根据jiang和zhang(2001)的方法改良而来,0.5ml样品提取液与1ml50mm磷酸钠缓冲液(ph7.8)和0.5ml10mm盐酸羟胺,摇匀,25℃保温1h,加入2ml 17mm对氨基苯磺酸和2ml 7mm 1
‑
萘胺,混合,25℃保温20分钟,分光光度计测定530nm处的吸光值(以标准曲线1号试管液调零)。
[0071]
结果:
[0072]
表3 ala对盐胁迫后丹参植株mda和ros的影响。表3ala对不同盐度胁迫下丹参体
内丙二醛(mda)、过氧化氢(h2o2)、羟基自由基(
‑
oh)和超氧自由基(o2‑
)含量的影响。
[0073][0074]
注:每个值是三次重复的平均值,p≤0.05,相同小写字母后面的平均值没有显着差异。
[0075]
与对照组相比,在100mm盐胁迫下,丹参叶片与根中的mda和ros含量显著上升,而喷施10mg/lala显著降低了丹参叶片和根中mda和ros的含量,例如,h2o2分别降低了35%和12%。同样,单独喷施10mg/lala后,除了200mm盐胁迫下叶片中
‑
oh的含量上升,丹参叶片中的mda和ros的含量显著降低。而在100mm盐胁迫下,20mg/lala与10mg/lala相比,显著提高了丹参叶和根的mda和
‑
oh水平。
[0076]
总的来说,10mg/lala可有效降低盐度处理下丹参植株中的ros和mda含量。实施例4 rna的提取和qrt
‑
pcr
[0077]
总rna是用rnaiso plus(takara,japan)从液氮冷冻的叶片中提取。300ng总rna使用takara primescripttm rt reagent kit with gdna eraser(peffect for real time)来进行反转录。pcr是用tb green premix ex taq ii(tli rnaseh plus)(takara)试剂完成的,仪器是quantstudio 6 flex real
‑
time pcr system(thermo fisher)。rt
‑
pcr使用的引物如表4所示。每次处理重复3次。
[0078]
表4生长相关基因荧光定量pcr特异性引物序列。
[0079][0080]
结果:
[0081]
通过荧光定量pcr来检测10mg/lala与200mm盐处理下丹参根部sod酶相关基因(csd1、fsd1、msd1),代谢通路相关基因(dxs1、c4h、ggpps、hmgr、pal)及逆境相关基因(myb36、myb39)的影响。结果如图2所示,200mm盐处理显著抑制了丹参根部中的sod酶相关
基因csd1和与代谢产物相关的关键基因(dxs1、c4h、ggpps、hmgr)的表达。而在喷施10mg/lala后,与200mm盐胁迫下相比,除dxs1、myb36外,其他基因都显著上调。其中,fsd1、ggpps、hmgr和pal增加了249%、256%、345%和305%。同样,与对照组相比,单独喷施ala后,除了hmgr、pal和myb39,丹参根部的其他相关基因均显著上调,其中fsd1和msd2基因分别显著上调211%和225%。
[0082]
结果表明,10mg/laia可通过调节丹参sod酶基因,代谢通路关键基因及逆境相关基因来缓解盐胁迫。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1