新型植物源除草剂
1.本发明涉及除草剂领域。更具体地说,本发明涉及一种新型植物源除草剂。
背景技术:
2.除草剂广泛应用于农林业除草,可以节省大量人力,但现有除草剂大多数为化学合成制剂,其毒性及药害性较大,而且喷洒除草剂后,除草剂成分并不能被杂草全部吸收,绝大部分除草剂游离于土壤中,被土壤以及农作物吸收,破环土壤结构及农作物营养,甚至被牲畜以及人体吸收,造成机体免疫力降低或病变。因此,亟需开发出无毒无害、对环境友好的除草剂。
3.植物源除草剂是一种新型的天然除草剂,利用植物化感作用抑制杂草生长,对环境友好,无毒无害。植物化感作用是指植物或微生物的代谢活动对环境中其它植物或微生物所产生的有利作用或不利作用,研究表明植物主要通过茎和叶挥发和淋溶、根系分泌以及植物残株的腐烂分解等不同途径向环境中释放化感物质,影响周围植物的生长和发育。
4.南美蟛蜞菊(学名:sphagneticolatrilobata(l.)pruski)是菊科、泽菊属多年生草本植物,外侵物种,原产南美洲,具有强大的营养繁殖能力使之能不断地延伸其种群,因其具有强烈的化感作用,排斥异种,能在一定区域形成单纯的单一种群,是一种有害的潜在入侵种。另外,南美蟛蜞菊对某些病原微生物也具有较强的杀菌效果。
5.土荆芥(学名:ysphaniaambrosioides(l.)mosyakin et clemants)是一年生或多年生草本,高50
‑
80厘米,有强烈香味,外侵物种,原产于热带美洲,是杂草群落的优势种或建群种,种群数量大,对生长环境要求不严,极易扩散,对其他植物具有较强化感作用,且具有驱虫、杀虫作用。
6.肿柄菊(学名:tithoniadiversifolia a.gray)菊科肿柄菊属植物,外侵物种,原产墨西哥,具有抗菌抗病毒作用,且肿柄菊根际能产生有机酸和磷酸酶释放到土壤中,使磷的有效性增加,并可增加土壤湿度和改善土壤物理性状,肿柄菊即使在土壤肥力耗竭的情况下也能积累很高的磷和其它营养元素,该绿肥的加入可以补充土壤中所缺的磷,另外土壤中铝离子被肿柄菊吸收后与草酸盐螯合,可以避免铝对植物的毒害。
技术实现要素:
7.本发明的一个目的是解决至少上述问题,提供了一种新型植物源除草剂,该除草剂为天然植物提取物,无化学添加剂,无毒、易生物降解,兼具抗菌驱虫效果,且该除草剂植物成分均采用外来入侵物种,在充分利用外侵物种价值同时有效防治其泛滥,并且开发成本低,制备方法简单。
8.为了实现根据本发明的这些目的和其它优点,提供了一种新型植物源除草剂,该除草剂原材料包括南非蟛蜞菊,该除草剂制备方法包括:
9.首先,取南非蟛蜞菊的茎、叶部分,洗净,破碎后烘干;
10.然后,将烘干后的南非蟛蜞菊茎、叶部分加入蒸馏水,室温下浸泡48h后过滤得到
植物水浸提液。
11.一种新型植物源除草剂,该除草剂原材料包括南非蟛蜞菊,该除草剂制备方法包括:
12.首先,取南非蟛蜞菊根系部分,洗净,破碎后烘干;
13.然后,将烘干后的南非蟛蜞菊根系部分加入蒸馏水,室温下浸泡48h后过滤得到植物水浸提液。
14.一种新型植物源除草剂,该除草剂是以南非蟛蜞菊、肿柄菊以及土荆芥为原材料的植物水浸提液,所述原材料各组分质量份数为:南非蟛蜞菊5
‑
8份、肿柄菊1
‑
4份、土荆芥1
‑
3份;
15.所述植物水浸提液通过以下步骤获得:
16.首先,分别将南非蟛蜞菊、肿柄菊、土荆芥洗净,破碎后烘干;
17.然后,将烘干后的南非蟛蜞菊、肿柄菊、土荆芥按一定质量配比混合,加入蒸馏水,室温下浸泡48h后过滤得到植物水浸提液。
18.优选的是,上述原材料破碎成小于2cm的短节。
19.优选的是,上述烘干采用电热烘箱恒温烘干,烘干温度设置为85℃。
20.优选的是,所述南非蟛蜞菊、肿柄菊、土荆芥质量份数为:南非蟛蜞菊8份、肿柄菊1份、土荆芥1份。
21.优选的是,所述南非蟛蜞菊、肿柄菊、土荆芥质量份数为:南非蟛蜞菊6份、肿柄菊1份、土荆芥3份。
22.优选的是,所述南非蟛蜞菊、肿柄菊、土荆芥质量份数为:南非蟛蜞菊6份、肿柄菊3份、土荆芥1份。
23.优选的是,所述南非蟛蜞菊、肿柄菊、土荆芥的植物水浸提液浓度为0.100g/ml,除草效果显著。
24.本发明至少包括以下有益效果:
25.1、本发明的新型植物源除草剂以南非蟛蜞菊的茎、叶或根系为原材料,利用水浸提法制备得到植物水浸提液作为除草剂,利用植物的化感作用抑制杂草的生长发育从而达到除草的目的,该除草剂为天然植物提取物,无化学添加,无毒无害,易降解,对环境友好;该除草剂的组成成分南非蟛蜞菊为外侵物种,在充分利用外侵物种价值同时有效防治其泛滥,并且开发成本低,制备方法简单,易于推广。
26.2、本发明的新型植物源除草剂以南非蟛蜞菊、肿柄菊、土荆芥为原材料,利用水浸提法制备得到植物水浸提液作为除草剂,利用植物的化感作用抑制杂草的生长发育从而达到除草的目的,该除草剂为天然植物提取物,无化学添加,无毒无害,易降解,对环境友好;该除草剂原材料中,南非蟛蜞菊及肿柄菊兼具有抑菌杀菌作用,可抑制土壤中有害细菌,减轻病菌对种植作物的侵害,且该除草剂中土荆芥,有强烈香味,具有驱虫、杀虫作用,亦可驱除土壤中虫害,利于种植作物的生长;该除草剂的组成成分南非蟛蜞菊、肿柄菊、土荆芥均为外侵物种,在充分利用外侵物种价值同时有效防治其泛滥,并且开发成本低,制备方法简单,易于推广。
27.本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
具体实施方式
28.下面通过实施例来具体说明本发明的新型植物源除草剂。这些实例仅对本发明进行说明,而不对本发明进行限制。
29.实施例1
30.1、实验方法
31.1.1原材料及受体种子处理
32.选取生长发育良好的南非蟛蜞菊植株连根拔起,将地上部分与地下部分分离,其中地上部分包括茎、叶,地下部分为根系部分。取南非蟛蜞菊植株地上部分(茎、叶)清洗干净,再用剪刀剪碎成小于2cm的短节,剪碎后再使用电热烘箱恒温烘干,设置温度85℃。
33.选取黑麦草、白三叶种子作为受体植物。分别选取完整、大小相似的黑麦草和白三叶种子,预先用蒸馏水浸泡30min,再用5%高锰酸钾溶液浸泡消毒15min后,马上用蒸馏水反复清洗,直到清洗的蒸馏水为澄清无色,视作清洗干净,完成种子的消毒。
34.1.2植物水浸提液的制备
35.称取上述烘干的南非蟛蜞菊地上部分(茎、叶)50g,装入洗净并用蒸馏水润洗过的1000ml的玻璃烧杯中,再加入500ml的蒸馏水,室温(15—20℃)下浸泡48h后使用双层纱布过滤得到浓度为0.100g/ml的植物水浸提液母液,用蒸馏水将其稀释成0.025g/ml、0.050g/ml、0.075g/ml的浸提液,连同母液,设定为4种不同浓度的植物水浸提液:0.025g/ml、0.050g/ml、0.075g/ml、0.100g/ml,置于4℃冰箱内储存备用。
36.1.3种子的萌发试验
37.采用规格一样的80mm培养皿,垫2层滤纸,分别将上述4种浓度的南非蟛蜞菊地上部分(茎、叶)水浸提液取适量加入到对应培养皿中,使滤纸湿润,并以蒸馏水为对照组。滤纸上播种消毒处理后的种子,统一标准采用丰满且大小相似的黑麦草和白三叶作为受体植物,不同浓度处理每皿50粒。播种完成后,统一放入人工气候箱培养,设定温度25℃、光暗周期为l/d=12h/12h条件下培养。试验期间,统一记录时间,每隔24h统计一次发芽数,萌发标准为胚轴或胚根突破种皮达1mm至2mm。记录后要及时补充水浸提液或蒸馏水1
‑
2ml,每个处理设立3组重复。
38.1.4发芽指标测定
39.经7d种子发芽完成后,在每个培养皿中,随机选取测量10株幼苗的苗高和根长,取平均值。测量时,以根与茎的分隔处为起点,将尺子顺着植株主茎到叶尖,即为幼苗的株高;以根与茎的分隔处为起点,一直到主根根尖,即为幼苗主根根长。计算发芽势和发芽率。计算公式如下:
40.发芽势(%)=(前5d内正常发芽的种子数/供试种子总数)
×
100%
41.发芽率(%)=(7d内正常发芽的种子数/供试种子数)
×
100%
42.1.5化感效应指数(ri)分析
43.种子发芽率、发芽势及化感效应指数采用williamson提出的方法计算,公式如下:
44.当t≥c时,ri=1
‑
c/t;当t<c时,ri=t/c
‑
1。式中:c为对照种子发芽率,t为处理种子发芽率。ri表示化感作用强度,正值表示促进效应,负值表示抑制效应,其绝对值大小反映化感作用的强弱。
45.1.6数据的统计分析
46.数据采用spss22和excel2016进行系统分析,以“平均值
±
标准误”表示。进行单因素方差分析时,p<0.05时差异显著,p>0.05时表示差异不显著。
47.发芽率、发芽势、化感作用效应指数(ri)数据统计结果见表1、表2。
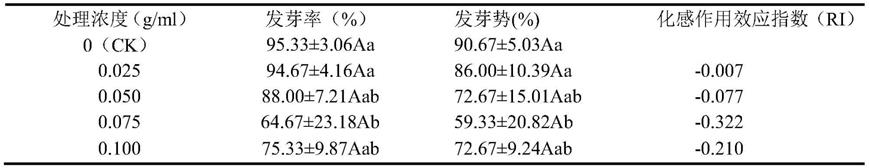
48.表1南美蟛蜞菊地上部分(茎、叶)水浸提液对黑麦草种子萌发的影响
[0049][0050]
注:0(ck):表示对照;同列不同字母表示差异显著(p<0.05);下同(表2
‑
表12)
[0051]
由表1可知:与对照相比,南美蟛蜞菊地上部分(茎、叶)水浸提液对黑麦草种子的萌发有着明显的抑制作用;0.075g/ml南美蟛蜞菊地上部分(茎、叶)水浸提液处理对黑麦草的抑制作用最明显,化感作用效应指数ri值为
‑
0.322。0.1g/ml南美蟛蜞菊地上部分(茎、叶)水浸提液处理下,黑麦草的发芽率和发芽势表现明显差异,差异显著(p<0.05)。
[0052]
表2南美蟛蜞菊地上部分(茎、叶)水浸提液对白三叶种子萌发的影响
[0053][0054]
由表2可知,南美蟛蜞菊水浸提液地上部分(茎、叶)对白三叶种子的萌发有着明显的抑制作用,高浓度0.075g/ml和0.1g/ml水浸提液处理的种子,无种子发芽,低浓度0.025g/ml和0.050g/ml南美蟛蜞菊水浸提液地上部分(茎、叶)水浸提液处理的种子,发芽率和发芽势同对照相比存在差异,差异显著(p<0.05)。
[0055]
实施例2
[0056]
1、实验方法
[0057]
1.1原材料及受体种子处理
[0058]
选取生长发育良好的南非蟛蜞菊植株连根拔起,将地上部分与地下部分分离,其中地上部分包括茎、叶,地下部分为根系部分。取南非蟛蜞菊植株地下部分(根系)清洗干净,再用剪刀剪碎成小于2cm的短节,剪碎后再使用电热烘箱恒温烘干,设置温度85℃。
[0059]
选取黑麦草、白三叶种子作为受体植物。分别选取完整、大小相似的黑麦草和白三叶种子,预先用蒸馏水浸泡30min,再用5%高锰酸钾溶液浸泡消毒15min后,马上用蒸馏水反复清洗,直到清洗的蒸馏水为澄清无色,视作清洗干净,完成种子的消毒。
[0060]
1.2植物水浸提液的制备
[0061]
称取上述烘干的南非蟛蜞菊地下部分(根系)50g,装入洗净并用蒸馏水润洗过的1000ml的玻璃烧杯中,再加入500ml的蒸馏水,室温(15—20℃)下浸泡48h后使用双层纱布过滤得到浓度为0.100g/ml的植物水浸提液母液,用蒸馏水将其稀释成0.025g/ml、0.050g/ml、0.075g/ml的浸提液,连同母液,设定为4种不同浓度的植物水浸提液:0.025g/ml、0.050g/ml、0.075g/ml、0.100g/ml,置于4℃冰箱内储存备用。
[0062]
1.3种子的萌发试验
[0063]
采用规格一样的80mm培养皿,垫2层滤纸,分别将上述4种浓度的南非蟛蜞菊地下部分(根系)水浸提液取适量加入到对应培养皿中,使得滤纸湿润,并以蒸馏水为对照组。滤纸上播种消毒处理后的种子,统一标准采用丰满且大小相似的黑麦草和白三叶作为受体植物,不同浓度处理每皿50粒。播种完成后,统一放入人工气候箱培养,设定温度25℃、光暗周期为l/d=12h/12h条件下培养。试验期间,统一记录时间,每隔24h统计一次发芽数,萌发标准为胚轴或胚根突破种皮达1mm至2mm。记录后要及时补充水浸提液或蒸馏水1
‑
2ml,每个处理设立3组重复。
[0064]
1.4发芽指标测定
[0065]
测定方法同实施例1。
[0066]
1.5化感效应指数(ri)分析
[0067]
分析方法同实施例1。
[0068]
1.6数据的统计分析
[0069]
分析方法同实施例1。
[0070]
发芽率、发芽势、化感作用效应指数(ri)数据统计结果见表表3、表4。
[0071]
表3南美蟛蜞菊地下部分(根系)水浸提液对黑麦草种子萌发的影响
[0072][0073]
由表3可知,南美蟛蜞菊水浸提液地下部分(根系)对黑麦草种子的萌发有着明显的抑制作用。0.1g/ml水浸提液处理时抑制作用最显著,化感作用效应指数ri值为
‑
0.635,发芽率和发芽势同对照相比存在差异,差异显著(p<0.05)。
[0074]
表4南美蟛蜞菊地下部分(根系)水浸提液对白三叶种子萌发的影响
[0075][0076]
由表4可知,南美蟛蜞菊地下部分(根系)水浸提液对白三叶种子的萌发有着明显的抑制作用,由化感作用效应指数数据可知,南美蟛蜞菊地下部分(根系)水浸提液浓度越大则抑制作用越大。0.075g/ml水浸提液处理时,发芽率和发芽势有着极显著差异(p<0.01),0.1g/ml南美蟛蜞菊地下部分(根系)水浸提液处理白三叶种子时,无种子发芽。
[0077]
实施例3
[0078]
1、实验方法
[0079]
1.1原材料及受体种子处理
[0080]
选取生长发育良好的南非蟛蜞菊、肿柄菊、土荆芥植株连根拔起,将植株分别清洗
干净,再用剪刀剪碎成小于2cm的短节,剪碎后再使用电热烘箱恒温烘干,设置温度85℃。
[0081]
选取黑麦草、白三叶种子作为受体植物。分别选取完整、大小相似的黑麦草和白三叶种子,预先用蒸馏水浸泡30min,再用5%高锰酸钾溶液浸泡消毒15min后,马上用蒸馏水反复清洗,直到清洗的蒸馏水为澄清无色,视作清洗干净,完成种子的消毒。
[0082]
1.2植物水浸提液的制备
[0083]
称取上述烘干的南非蟛蜞菊40g、肿柄菊5g、土荆芥5g(实验组1),共50g,装入洗净并用蒸馏水润洗过的1000ml的玻璃烧杯中,再加入500ml的蒸馏水,室温(15—20℃)下浸泡48h后使用双层纱布过滤得到浓度为0.100g/ml的植物水浸提液母液,用蒸馏水将其稀释成0.025g/ml、0.050g/ml、0.075g/ml的浸提液,连同母液,设定为4种不同浓度的植物水浸提液:0.025g/ml、0.050g/ml、0.075g/ml、0.100g/ml,置于4℃冰箱内储存备用。
[0084]
1.3种子的萌发试验
[0085]
采用规格一样的80mm培养皿,垫2层滤纸,分别将上述4种浓度的植物水浸提液取适量加入到对应培养皿中,使滤纸湿润,并以蒸馏水为对照组。滤纸上播种消毒处理后的种子,统一标准采用丰满且大小相似的黑麦草和白三叶作为受体植物,不同浓度处理每皿50粒。播种完成后,统一放入人工气候箱培养,设定温度25℃、光暗周期为l/d=12h/12h条件下培养。试验期间,统一记录时间,每隔24h统计一次发芽数,萌发标准为胚轴或胚根突破种皮达1mm至2mm。记录后要及时补充水浸提液或蒸馏水1
‑
2ml,每个处理设立3组重复。
[0086]
1.4发芽指标测定
[0087]
经7d种子发芽完成后,在每个培养皿中,随机选取测量10株幼苗的苗高和根长,取平均值。测量时,以根与茎的分隔处为起点,将尺子顺着植株主茎到叶尖,即为幼苗的株高;以根与茎的分隔处为起点,一直到主根根尖,即为幼苗主根根长。计算发芽势和发芽率。计算公式如下:
[0088]
发芽势(%)=(前5d内正常发芽的种子数/供试种子总数)
×
100%
[0089]
发芽率(%)=(7d内正常发芽的种子数/供试种子数)
×
100%
[0090]
1.5化感效应指数(ri)分析
[0091]
种子发芽率、发芽势及化感效应指数采用williamson提出的方法计算,公式如下:
[0092]
当t≥c时,ri=1
‑
c/t;当t<c时,ri=t/c
‑
1。式中:c为对照种子发芽率,t为处理种子发芽率。ri表示化感作用强度,正值表示促进效应,负值表示抑制效应,其绝对值大小反映化感作用的强弱。
[0093]
1.6数据的统计分析
[0094]
数据采用spss22和excel2016进行系统分析,以“平均值
±
标准误”表示。进行单因素方差分析时,p<0.05时差异显著,p>0.05时表示差异不显著。
[0095]
实验组1发芽率、发芽势、化感作用效应指数(ri)数据统计见表5及表6:
[0096]
表5实验组1植物水浸提液对黑麦草种子萌发的影响
[0097]
[0098]
表6实验组1水浸提液对白三叶种子萌发的影响
[0099][0100]
由表5及表6可知,实验组1发芽率和发芽势同对照相比存在差异,差异显著(p<0.05);实验组1植物水浸提液对黑麦草、白三叶种子的萌发有着明显的抑制作用,且浓度越高抑制效果越明显;0.100g/ml植物水浸提液处理对黑麦草种子抑制作用最显著;0.075g/ml植物水浸提液处理对白三叶种子抑制作用显著,0.1g/ml植物水浸提液处理白三叶种子时,无种子发芽。
[0101]
实施例4
[0102]
1、实验方法
[0103]
1.1原材料及受体种子处理
[0104]
实验步骤同实施例3。
[0105]
1.2植物水浸提液的制备
[0106]
称取上述烘干的南非蟛蜞菊30g、肿柄菊5g、土荆芥15g(实验组2),共50g,装入洗净并用蒸馏水润洗过的1000ml的玻璃烧杯中,再加入500ml的蒸馏水,室温(15—20℃)下浸泡48h后使用双层纱布过滤得到浓度为0.100g/ml的植物水浸提液母液,用蒸馏水将其稀释成0.025g/ml、0.050g/ml、0.075g/ml的浸提液,连同母液,设定为4种不同浓度的植物水浸提液:0.025g/ml、0.050g/ml、0.075g/ml、0.100g/ml,置于4℃冰箱下储存备用。
[0107]
1.3种子的萌发试验
[0108]
实验步骤同实施例3。
[0109]
1.4发芽指标测定
[0110]
测定方法同实施例3。
[0111]
1.5化感效应指数(ri)分析
[0112]
分析方法同实施例3。
[0113]
1.6数据的统计分析
[0114]
分析方法同实施例3。
[0115]
实验组2发芽率、发芽势、化感作用效应指数(ri)数据统计见表7及表8:
[0116]
表7实验组2植物水浸提液对黑麦草种子萌发的影响
[0117][0118]
表8实验组2植物水浸提液对白三叶种子萌发的影响
[0119][0120]
由表7及表8可知,实验组2发芽率和发芽势同对照相比存在差异,差异显著(p<0.05);实验组2植物水浸提液对黑麦草、白三叶种子的萌发有着明显的抑制作用,且浓度越高抑制效果越明显;0.100g/ml植物水浸提液处理对黑麦草种子抑制作用最显著;0.075g/ml植物水浸提液处理对白三叶种子抑制作用显著,0.1g/ml植物水浸提液处理白三叶种子时,无种子发芽。
[0121]
实施例5
[0122]
1、实验方法
[0123]
1.1原材料及受体种子处理
[0124]
实验步骤同实施例3。
[0125]
1.2植物水浸提液的制备
[0126]
称取上述烘干的南非蟛蜞菊30g、肿柄菊15g、土荆芥5g(实验组3),共50g,装入洗净并用蒸馏水润洗过的1000ml的玻璃烧杯中,再加入500ml的蒸馏水,室温(15—20℃)下浸泡48h后使用双层纱布过滤得到浓度为0.100g/ml的植物水浸提液母液,用蒸馏水将其稀释成0.025g/ml、0.050g/ml、0.075g/ml的浸提液,连同母液,设定为4种不同浓度的植物水浸提液:0.025g/ml、0.050g/ml、0.075g/ml、0.100g/ml,置于4℃冰箱下储存备用。
[0127]
1.3种子的萌发试验
[0128]
实验步骤同实施例3。
[0129]
1.4发芽指标测定
[0130]
测定方法同实施例3。
[0131]
1.5化感效应指数(ri)分析
[0132]
分析方法同实施例3。
[0133]
1.6数据的统计分析
[0134]
分析方法同实施例3。
[0135]
实验组3发芽率、发芽势、化感作用效应指数(ri)数据统计见表9及表10:
[0136]
表9实验组3植物水浸提液对黑麦草种子萌发的影响
[0137][0138]
表10实验组3植物水浸提液对白三叶种子萌发的影响
[0139][0140]
由表9及表10可知,实验组3发芽率和发芽势同对照相比存在差异,差异显著(p<0.05);实验组3植物水浸提液对黑麦草、白三叶种子的萌发有着明显的抑制作用,且浓度越高抑制效果越明显;0.100g/ml植物水浸提液处理对黑麦草种子抑制作用最显著;0.075g/ml植物水浸提液处理对白三叶种子抑制作用显著,0.1g/ml植物水浸提液处理白三叶种子时,无种子发芽。
[0141]
由实验组1、实验组2、实验组3的发芽率、发芽势、化感作用效应指数(ri)实验数据可知,三组实验的植物水浸提液均对黑麦草、白三叶种子的萌发有着明显的抑制作用,且植物水浸提液浓度越高抑制效果越明显,0.100g/ml植物水浸提液处理对黑麦草种子抑制作用最显著,0.075g/ml植物水浸提液处理对白三叶种子抑制作用显著,0.1g/ml植物水浸提液处理白三叶种子时,无种子发芽;另外由三组实验数据对比可知,实验组1植物水浸提液对黑麦草、白三叶种子生长发育抑制效果大于实验组2及实验组3,实验组2植物水浸提液对黑麦草、白三叶种子生长发育抑制效果大于实验组3,说明该新型植物源除草剂中南非蟛蜞菊添加量越多,对种子的抑制作用越强,当南非蟛蜞菊添加量一定时,肿柄菊添加量较土荆芥添加量多时抑制效果相对更好。
[0142]
对比实验:
[0143]
1、实验方法
[0144]
1.1原材料及受体种子处理
[0145]
选取生长发育良好的南非蟛蜞菊植株连根拔起,将植株清洗干净,再用剪刀剪碎成小于2cm的短节,剪碎后再使用电热烘箱恒温烘干,设置温度85℃。
[0146]
选取生长发育良好的肿柄菊植株连根拔起,将植株清洗干净,再用剪刀剪碎成小于2cm的短节,剪碎后再使用电热烘箱恒温烘干,设置温度85℃。
[0147]
选取生长发育良好的土荆芥植株连根拔起,将植株清洗干净,再用剪刀剪碎成小于2cm的短节,剪碎后再使用电热烘箱恒温烘干,设置温度85℃。
[0148]
选取黑麦草、白三叶种子作为受体植物。分别选取完整、大小相似的黑麦草和白三叶种子,预先用蒸馏水浸泡30min,再用5%高锰酸钾溶液浸泡消毒15min后,马上用蒸馏水反复清洗,直到清洗的蒸馏水为澄清无色,视作清洗干净,完成种子的消毒。
[0149]
1.2植物水浸提液的制备
[0150]
称取上述烘干的南非蟛蜞菊50g(对比组1),装入洗净并用蒸馏水润洗过的1000ml的玻璃烧杯中,再加入500ml的蒸馏水,室温(15—20℃)下浸泡48h后使用双层纱布过滤得到浓度为0.100g/ml的南非蟛蜞菊水浸提液母液,用蒸馏水将其稀释成0.075g/ml的浸提液,置于4℃冰箱下储存备用。
[0151]
称取上述烘干的肿柄菊50g(对比组2),装入洗净并用蒸馏水润洗过的1000ml的玻璃烧杯中,再加入500ml的蒸馏水,室温(15—20℃)下浸泡48h后使用双层纱布过滤得到浓
度为0.100g/ml的肿柄菊水浸提液母液,用蒸馏水将其稀释成0.075g/ml的浸提液,置于4℃冰箱下储存备用。
[0152]
称取上述烘干的土荆芥50g(对比组3),装入洗净并用蒸馏水润洗过的1000ml的玻璃烧杯中,再加入500ml的蒸馏水,室温(15—20℃)下浸泡48h后使用双层纱布过滤得到浓度为0.100g/ml的土荆芥水浸提液母液,用蒸馏水将其稀释成0.075g/ml的浸提液,置于4℃冰箱下储存备用。
[0153]
1.3种子的萌发试验
[0154]
采用规格一样的80mm培养皿,垫2层滤纸,分别将上述0.100g/ml的南非蟛蜞菊水浸提液、0.100g/ml的肿柄菊水浸提液、0.100g/ml的土荆芥水浸提液取适量加入到对应的培养皿中,使滤纸湿润,并以蒸馏水为对照组。滤纸上播种消毒处理后的黑麦草种子,统一标准采用丰满且大小相似的黑麦草为受体植物,不同浓度处理每皿50粒。播种完成后,统一放入人工气候箱培养,设定温度25℃、光暗周期为l/d=12h/12h条件下培养。试验期间,统一记录时间,每隔24h统计一次发芽数,萌发标准为胚轴或胚根突破种皮达1mm至2mm。记录后要及时补充水浸提液或蒸馏水1
‑
2ml,每个处理设立3组重复。
[0155]
采用规格一样的80mm培养皿,垫2层滤纸,分别将上述0.075g/ml的南非蟛蜞菊水浸提液、0.100g/ml的南非蟛蜞菊水浸提液、0.075g/ml的肿柄菊水浸提液、0.100g/ml的肿柄菊水浸提液、0.075g/ml的土荆芥水浸提液、0.100g/ml的土荆芥水浸提液取适量加入到一一对应的培养皿中,使滤纸湿润,并以蒸馏水为对照组。滤纸上播种消毒处理后的白三叶种子,统一标准采用丰满且大小相似的白三叶作为受体植物,不同浓度处理每皿50粒。播种完成后,统一放入人工气候箱培养,设定温度25℃、光暗周期为l/d=12h/12h条件下培养。试验期间,统一记录时间,每隔24h统计一次发芽数,萌发标准为胚轴或胚根突破种皮达1mm至2mm。记录后要及时补充水浸提液或蒸馏水1
‑
2ml,每个处理设立3组重复。
[0156]
1.4发芽指标测定
[0157]
测定方法同实施例3。
[0158]
1.5化感效应指数(ri)分析
[0159]
分析方法同实施例3。
[0160]
1.6数据的统计分析
[0161]
分析方法同实施例3。
[0162]
对比实验组发芽率、发芽势、化感作用效应指数(ri)数据统计见表11及表12:
[0163]
表11对比实验植物水浸提液对黑麦草种子萌发的影响
[0164][0165]
表12对比实验植物水浸提液对白三叶种子萌发的影响
[0166][0167]
由表5~表12可知,含南非蟛蜞菊、肿柄菊以及土荆芥三种植物原材料的水浸提液对黑麦草、白三叶种子萌发的抑制作用大于单一以南非蟛蜞菊为植物原材料的水浸提液、单一以肿柄菊为植物原材料的水浸提液、单一以土荆芥为植物原材料的水浸提液,南非蟛蜞菊中添加肿柄菊以及土荆芥后提高了其植物水浸提液的化感作用强度,增强了对黑麦草、白三叶种子萌发的抑制作用,植物水浸提液浓度为0.100g/ml时对黑麦草、白三叶除草效果最显著。
[0168]
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1