一种二氨基嘧啶类化合物在防治农业病原菌中的用途
1.本发明属于药物化学领域,公开了二氨基嘧啶类化合物在防治由农业病原细菌水稻白叶枯病病原菌xanthomonas oryzae、柑橘溃疡病病原菌xanthomonas axonopodis pv.citri以及马铃薯黑胫病病原菌pectobacterium atroseptica引起的植物性病害的新用途。
背景技术:
2.细菌病害是一种重要的植物病害,在全世界范围内,细菌病害每年都造成重大的农作物减产和经济损失。随着抗菌药物的长期使用,使细菌对多数上市抗菌药产生了耐药性,因此,迫切需要研发新型抗菌药。
3.大量研究表明二氨基嘧啶类化合物在抗菌方面用途广泛,这类化合物对革兰氏阴性菌和革兰氏阳性菌均有杀菌作用,包括临床意义重大的细菌病原体,如耐甲氧西林金黄色葡萄球菌(mrsa)、粪肠球菌、淋病奈瑟菌和鲍曼不动杆菌,且无耐药性迹象。
4.二氢叶酸还原酶(dhfr)是嘌呤从头合成途径的关键酶,而嘌呤是生物繁殖所需的 dna,rna和蛋白质的必需原料,因此,二氢叶酸还原酶是研发抗菌药物的一个重要的靶标。二氢叶酸还原酶抑制剂如甲氧苄氨嘧啶(tmp)长期以来在治疗细菌感染中发挥着重要作用,但经过几十年的使用,二氢叶酸还原酶通过各种分子机制获得对现有药物的耐药性,这就需要不断发现新的抗叶酸剂,开发新的抗菌药物,扩大抗菌谱。
5.在我们课题组前期进行先导化合物的筛选与优化的过程中,发现含二氨基嘧啶类化合物对植物病原细菌水稻白叶枯病病原菌xanthomonas oryzae accc 11602、柑橘溃疡病病原菌 xanthomonas axonopodis pv.citri以及马铃薯黑胫病病原菌pectobacterium atroseptica accc19901表现出优异的抑制作用。由此活性结果表明二氨基嘧啶类化合物在农药和医药方面具有广泛的市场和应用前景,具有进一步开发的潜力。
技术实现要素:
6.本发明的目的是提供一类二氨基嘧啶类化合物在抗植物病原细菌中的用途,用于防治由水稻白叶枯病病原菌、柑橘溃疡病病原菌、马铃薯黑胫病病原菌引起的植物病害中的用途。
7.为实现上述目的,本发明提供了如下技术方法:
8.一类二氨基嘧啶类化合物作为抗植物病原细菌药物的应用,该化合物的化学结构通式i 如下:
9.10.其中,
11.r选自结构
12.本发明提供的含二氨基嘧啶衍生物的抗菌用途的药物,其特征在于,选自以下结构的化合物:
[0013][0014]
其中,细菌包括水稻白叶枯病病原菌xanthomonas oryzae accc 11602、柑橘溃疡病病原菌xanthomonas axonopodis pv.citri、马铃薯黑胫病病原菌pectobacterium atroseptica accc19901。
[0015]
本发明提供的二氨基嘧啶类化合物作为新型杀菌剂,具有以下优势:
[0016]
1)本发明首次发现二氨基嘧啶类化合物对农业病原菌表现出优异的抑制作用,以此为先导模型可进一步开发其成为更高活性的先导分子。
[0017]
2)含二氨基嘧啶类化合物杀菌活性高。部分化合物在低于3.12μg/ml的给药浓度时,抑制率仍在90%以上,可作为先导化合物进一步设计与开发。
具体实施方式
[0018]
为了更好地理解本发明,通过以下具体实施例对本发明的上述内容做进一步的详细说明。但不应将此理解为对本发明的限制。下列实施例中所述实验方法,如无特殊说明,均为常规方法。
[0019]
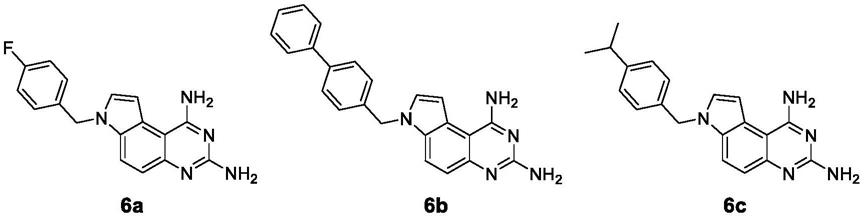
实施例1:化合物6a的合成:
[0020][0021]
本发明所述化合物6a的合成方法按如下反应式进行:
[0022]
实验部分:
[0023]
化合物3a合成:将5-硝基吲哚(1)(12.3mmol)加入无水dmf(n,n-二甲基甲酰胺)(30ml)中,氩气保护下分次加入60%的nah(14.76mmol),室温搅拌1h。再将化合物2a(14.76mmol)加入到混合液中,室温搅拌反应4h。反应结束后,向混合液中加入饱和氯化铵溶液猝灭,用乙酸乙酯萃取,酯层用蒸馏水洗涤,无水硫酸钠干燥,减压蒸发除去溶剂得粗产物3a。
[0024]
化合物4a合成:将化合物3a(3.7mmol)、铁粉(18.5mmol)和氯化铵(37mmol)加入到乙醇-水 (4:1)(50ml)中,80℃回流搅拌反应4h。反应结束后,过滤掉多余铁粉,旋蒸滤液,残渣中加入蒸馏水溶解,用无水碳酸氢钠调节ph至碱性,用二氯甲烷萃取,有机层用蒸馏水洗涤,无水硫酸钠干燥,减压蒸发除去溶剂得到粗品4a。
[0025]
化合物5a合成:将化合物4a(3.12mmol)溶于无水dmf(n,n-二甲基甲酰胺)(10ml)中,再加入对甲苯磺酸(3.12mmol)和nan(cn)2(二氰胺钠)(9.36mmol),50℃搅拌反应过夜。将反应液倒入大约溶剂4倍体积的水中,搅拌,抽滤,滤饼干燥得粗品5a。
[0026]
化合物6a合成:将化合物5a(2.6mmol)加入dme(乙二醇二甲醚)(15ml)中,冰浴条件下加入 bf
3-et2o(三氟化硼乙醚)(13mmol),60℃搅拌反应过夜。旋蒸反应液,残渣溶解在少量甲醇中,加入1mol/l的naoh溶液,搅拌,抽滤,滤饼干燥得粗品。经柱层析纯化,洗脱剂使用二氯甲烷:甲醇=20:1(v/v),得到产物6a。
[0027]
化合物6a
[0028]
淡黄色固体;产率92%。1h nmr(400mhz,dmso-d6)δ:12.23(s,2h),8.07(d,j=8.9hz,1h), 7.93(d,j=3.1hz,1h),7.38(m,3h),7.29(dd,j=8.5,5.5hz,2h),7.23(d,j=8.9hz,1h),7.16 (t,j=8.8hz,2h),5.57(s,2h);
13
c nmr(101mhz,dmso-d6)δ:163.32,163.20,160.78, 154.07,137.45,134.38(d,j=3.0hz),132.32(d,j=11.2hz),129.60(d,j=8.4hz),121.51, 120.04,115.91(d,j=21.4hz),111.25,101.81,101.70,49.11.;ms(esi)m/z:307.33(m
+
,100); hrms(esi)m/z[m+h]
+
calcd for c
17h14
fn5:307.3312,found:308.0886。
[0029]
实施例2:化合物6b的合成:
[0030]
合成方法与实施例1相同,仅以4-溴甲基联苯代替4-氟溴苄。
[0031][0032]
化合物6b
[0033]
褐色固体;产率85%。1h nmr(400mhz,dmso-d6)δ:8.05(d,j=8.9hz,1h),7.92(d,j=3.1 hz,1h),7.61(d,j=7.9hz,5h),7.44(t,j=7.6hz,3h),7.39
–
7.32(m,3h),7.30(d,j=8.0hz, 2h),7.20(d,j=9.0hz,1h),7.16(s,2h),5.62(s,2h);
[0034]
13
c nmr(101mhz,dmso-d6)δ:163.18,154.96,140.08,139.92,137.46,132.22,131.92, 129.38,128.01,127.96,127.39,127.29,127.07,121.50,119.80,112.50,101.91,101.84, 49.54;ms(esi)m/z;365.44(m
+
,100);hrms(esi)m/z[m+h]
+
calcd for c
17h14
fn5:365.4408, found:366.1775。
[0035]
实施例3:化合物6c的合成:
[0036]
合成方法与实施例1相同,仅以对异丙基溴苄代替4-氟溴苄。
[0037][0038]
化合物6c
[0039]
黄褐色固体;产率76%。1h nmr(400mhz,dmso-d6)δ:7.95(d,j=8.9hz,1h),7.79(d,j= 3.1hz,1h),7.65(s,2h),7.26(d,j=3.1hz,1h),7.21
–
7.03(m,6h),6.76(s,2h),5.50(s,2h), 2.82(t,j=6.9hz,1h),1.14(d,j=6.9hz,6h);
13
c nmr(101mhz,dmso-d6)δ162.95, 156.17,148.15,135.79,131.75,131.08,127.46,126.94,126.85,121.39,119.30,114.35, 102.18,101.77,49.57,33.54,24.30;ms(esi)m/z:331.42(m
+
,100);hrms(esi)m/z[m+h]
+ calcd for c
17h14
fn5:331.3012,found:332.1913。
[0040]
实施例4:含二氨基嘧啶类化合物抗菌活性测定
[0041]
本实验中所用的菌株为实验室-80℃含30%甘油冻存的菌株。将冻存菌株取出,分别在植物细菌的nb固体培养基(牛肉膏:3g,蛋白胨:5g,酵母粉:1g,蔗糖:10g,琼脂:15g,蒸馏水:1l,ph7.0;121℃灭菌20min)上面进行划线,在28℃(37℃)下恒温培养直到长出单菌落。分别挑取固体培养基上单菌落至植物细菌nb液体培养基(牛肉膏:3g,蛋白胨: 5g,酵母粉:1g,蔗糖:10g,蒸馏水:1l;121℃灭菌20min)中,在28℃(37℃)、180 rpm恒温摇床振荡培养到对数生长期。将处于对数生长期的菌株用相应的液体培养基稀释至约106cfu/ml备用。将化合物分别用dmso溶解,加入液体培养基中,混合均匀,配制成浓度为200μg/ml的含药液
体培养基。取50μl含药培养基和相同体积的含约106cfu/ml细菌培养物加入到96孔板的孔中,最终给药浓度为100μg/ml。含等量dmso的相同浓度100 μl菌液做对照。将96孔板在28℃(37℃)恒温培养箱中培养24-48h直至对照组菌液长出,在酶标仪上测定孔中菌液的od值(od
600
)。并且另外测定100μl液体培养基和浓度为100 μg/ml药剂的od值,对培养基和药剂本身造成的od值进行矫正。校正od值和抑制率的计算公式如下:
[0042]
校正od值=含菌培养基od值-无菌培养物od值;
[0043]
抑制率=(校正后对照培养基菌液od值-校正后含药培养基od值)/校正后对照培养基菌液od值
×
100%
[0044]
所有实验设置三个重复,将活性化合物的含药液体培养基在96孔板中通过二倍稀释法稀释得到系列浓度的50μl含药培养基,然后根据实施例2中相同的试验方法测定系列浓度对应的抑制率。测定得到化合物的抑制率见表1,mic值见表2。
[0045]
表1.含二氨基嘧啶类化合物对植物病原细菌的抗菌活性
[0046][0047][0048]
注:
“‑”
表示化合物的抗菌活性未测定
[0049]
表2.二氨基嘧啶类化合物对植物病原细菌的mic值
[0050][0051]
注:
“‑”
表示化合物的抗菌活性未测定
[0052]
由表1、2生测结果可知,本发明涉及的含二氨基嘧啶类化合物对测定菌株均表现出优异的抑制作用,其中化合物6a、6b、6c在100μg/ml时对测试菌株的抑制率均大于90%。降浓度后发现,6a、6b、6c在6.25μg/ml时对部分测试菌株的抑制率仍大于90%。其中化合物 6a对马铃薯黑胫病病原菌的mic值最小可达3.12μg/ml。
[0053]
综上所述,本发明所述的含二氨基嘧啶类化合物对植物病原细菌表现出一定的抑制作用,与商业化阳性药相比活性较强,且通过含二氨基嘧啶类化合物结构和活性发现,f原子取代的化合物结构活性较强。具有进一步研究和开发的价值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1