腹泻性大肠杆菌感染动物模型的构建方法及其应用
1.本发明涉及生物技术领域,具体地说,涉及一种腹泻性大肠杆菌感染动物模型的构建方法及其应用。
背景技术:
2.腹泻是奶牛常见的一种生理或病理性反应,以水样粪便、迅速脱水和自体中毒为主要症状,是一种危害较大的临床性疾病。奶牛腹泻的诱因主要包括大肠杆菌、轮状病毒、冠状病毒和隐孢子虫等病原微生物,以及营养、环境和饲养管理等外界因素。初生犊牛瘤胃尚未发育完全,免疫系统还不成熟,是奶牛腹泻的易感群体。在对我国45万头后备牛发病情况进行统计后发现,哺乳犊牛阶段发病占比51.4%,其中腹泻病占比高达72.8%。
3.研究证明,由腹泻性大肠杆菌(diarrheagenic e.coli,dec)引起的奶牛腹泻病的发病率和死亡率较高,其感染在奶牛中十分普遍,严重危害奶牛养殖业的发展。牛群感染dec后,主要表现为腹泻、毒血症和结肠炎等临床症状,并能导致继发感染,引起生长迟缓和发育不良。细菌携带的高致病性质粒或毒力基因往往能够编码特定的黏附素、毒素和铁载体等,导致机体免疫系统失衡,尤其dec感染引起的炎症反应是结肠损伤的关键因素。
4.当前研究表明结肠炎和奶牛大肠杆菌性腹泻病的发生和发展密切相关。大肠杆菌性腹泻病患牛往往伴有严重的结肠炎症反应,这就论证了结肠炎症反应在奶牛大肠杆菌性腹泻病的发生和发展中的重要作用,但是dec的致病机制和宿主免疫调控机制依然还不明确。因此,小鼠腹泻性大肠杆菌感染模型的构建为奶牛大肠杆菌性腹泻病的相关机制研究提供了成熟的动物模型。
技术实现要素:
5.本发明的目的是提供一种腹泻性大肠杆菌感染动物模型的构建方法及其应用。
6.本发明的另一目的是提供一株新分离腹泻性大肠杆菌,血清型为o101:h9。
7.为了实现本发明目的,第一方面,本发明提供腹泻性大肠杆菌(diarrheagenicescherichia coli)
‑‑
大肠埃希氏菌(escherichia coli)1587,该菌分离自临床患有大肠杆菌腹泻病的犊牛,能引发奶牛的急性腹泻病。该菌现已保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101,保藏编号cgmcc no.23694,保藏日期2021年10月29 日。
8.该菌的部分生理生化特性如下:乳糖发酵阳性,imvic试验结果为+、+、-、-。
9.经16s rdna测序(seq id no:1),根据测序结果以及上述微生物学特征及生理生化特性,将该菌鉴定为腹泻性大肠杆菌。
10.第二方面,本发明提供所述腹泻性大肠杆菌在构建腹泻性大肠杆菌感染动物模型中的应用。
11.第三方面,本发明提供一种腹泻性大肠杆菌感染动物模型的构建方法,所述方法包括:配制腹泻性大肠杆菌的菌悬液,菌悬液经腹腔注射给实验动物。
12.优选地,所述腹泻性大肠杆菌的保藏编号为cgmcc no.23694。
13.前述的方法,所述实验动物为小鼠,优选cd-1小鼠。
14.前述的方法,所述小鼠为出生后35-42天(优选42天)的母鼠。
15.前述的方法,所述菌悬液中腹泻性大肠杆菌的浓度为5
×
108~1
×
109cfu/ml,用 pbs溶液进行配制。
16.进一步地,所述方法包括:给小鼠腹腔注射1ml菌悬液,小鼠可自由采食,充足饮水,于通风干燥条件,饲养18~24h(优选24h)。
17.第四方面,本发明提供按照所述方法制备的腹泻性大肠杆菌感染动物模型的以下任一应用:
18.1)用于由腹泻性大肠杆菌感染所致疾病的防治药物筛选;
19.2)用于动物肠道健康机制的研究。
20.其中,1)中所述疾病包括结肠炎、腹泻。如由腹泻性大肠杆菌感染诱发的奶牛腹泻病。
21.所述药物可用于防治腹泻性大肠杆菌感染诱发的结肠炎和肠道菌群紊乱。
22.所述应用包括:所述动物模型给药后处死动物并分离结肠组织,比较药物干预组、健康动物组,以及未给药组动物结肠生长发育,促炎因子表达,结肠内容物中短链脂肪酸的产生情况,从而筛选合适的目标药物。
23.本发明采用dec菌株构建小鼠感染模型,可广泛应用于dec诱发的结肠炎防治相关药物的筛选,以及肠道健康维护的研究等相关领域,为奶牛腹泻病的防治提供合适的实验动物模型。
附图说明
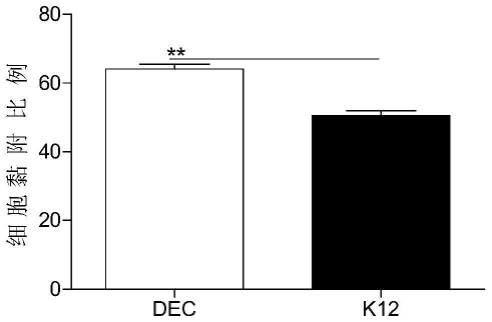
24.图1为本发明较佳实施例中caco-2细胞黏附示意图。其中,dec表示腹泻性大肠杆菌,k12表示细胞黏附大肠杆菌模式菌株。
25.图2为本发明较佳实施例中奶牛大肠杆菌性腹泻病模型小鼠的造模过程的示意图。
26.图3为本发明较佳实施例中小鼠感染dec和k12细菌后存活率示意图。
27.图4为本发明较佳实施例中小鼠感染dec后结肠组织苏木精&伊红染色法(h&e) 检测示意图。
28.图5为本发明较佳实施例中小鼠感染dec后结肠细菌载量示意图。
29.图6为本发明较佳实施例中小鼠血清炎性细胞因子含量示意图。其中,pbs表示接种磷酸盐缓冲液小鼠,dec表示接种dec菌株小鼠。
30.图7为本发明较佳实施例中小鼠结肠内容物丁酸含量示意图。其中,pbs表示接种磷酸盐缓冲液小鼠,dec表示接种dec菌株小鼠,k12表示接种大肠杆菌k12菌株小鼠。
31.图中,**和***表示不同处理组之间的差异具有统计学意义,**表示p《0.01,*** 表示p《0.001。
具体实施方式
32.以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例
中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
33.实施例1 dec菌株的分离纯化
34.dec菌株(大肠埃希氏菌1587)分离自临床患有大肠杆菌腹泻病的犊牛,该菌能引发奶牛的急性腹泻病。经16s rdna测序(seq id no:1),根据测序结果以及上述微生物学特征及生理生化特性,将该菌鉴定为腹泻性大肠杆菌(diarrheagenicescherichia coli),血清型为o101:h9,该菌具有典型的细胞黏附特性,携带asta细胞黏附毒力基因,属于多重耐药ctx-m-15阳性产超广谱β-内酰胺酶大肠杆菌。
35.实施例2 dec菌株具备良好的结肠细胞黏附性
36.使caco-2细胞在含10%胎牛血清的mem培养基中生长,按照2
×
106cell/孔接种到 6孔细胞培养板,37℃,5%co2细胞培养箱中培养12h使细胞完全贴壁。待细胞贴壁后,吸弃原培养液,并用mem完全培养基洗涤2次。配制含有dec的mem悬浮液,按10倍倍比稀释,将不同稀释度的稀释液滴于麦康凯固体培养基上,于37℃培养箱中倒置培养16h后进行细菌菌落计数,得到细菌总菌落数。按照moi=100的感染剂量,实验组中加入含有dec的mem完全培养基1ml,对照组加入含有等量大肠杆菌k12 菌株的mem完全培养基1ml,继续培养。感染后1~2h收获细胞,用mem清洗细胞2 次,收集细胞后裂解细胞,将细胞裂解液按10倍倍比稀释,将不同稀释度的稀释液滴于麦康凯固体培养基上,于37℃培养箱中倒置培养16h后进行细菌菌落计数。通过计算黏附到细胞上的细菌菌落数占总菌落数的比值,从而得出dec的细胞黏附比例。如图1所示dec菌株的细胞黏附比例显著高于k12菌株(p=0.0027)。
37.实施例3腹泻性大肠杆菌感染小鼠模型的构建
38.本实施例采用如图2所示的建模过程,包括以下步骤:
39.dec的培养和计数:采用肉汤(lb)培养基进行菌株传代,麦康凯琼脂培养基进行菌落计数,挑取单菌落接种于lb培养基中,37℃,200rpm条件下振荡培养16h。进行细菌计数时,菌液用pbs按照10倍倍比稀释,分别吸取各个稀释度对应稀释液 10μl均匀滴于麦康凯琼脂培养基中,每个稀释度倍数设置3个重复,在37℃培养箱中继续倒置培养16h后进行菌落计数,得到细菌cfu数值。
40.恒温通风干燥条件下,6周龄同群无特定病原体(spf)的cd-1雌性小鼠分组后饲养在单独的鼠笼内,自由采食和饮水,接着采用腹腔注射方式使小鼠感染通过腹腔注射方式感染dec菌株(1
×
108cfu),同时设立大肠杆菌k12菌株感染对照组和 pbs对照组,每组6只小鼠,感染后一周内统计小鼠的存活率。
41.cd-1小鼠感染亚致死剂量dec菌株(5
×
107cfu),设立pbs空白对照组,剖检细菌感染后小鼠和对照组小鼠,收集组织样本,10%甲醛溶液固定组织后制作石蜡切片,采用苏木精&伊红染色法(h&e)检测相应组织中病理变化,进行病理评分(双盲法)。接着,分别用三种剂量dec菌株(1
×
107cfu,1
×
108cfu和1
×
109cfu)感染c57bl/6小鼠。感染后第7天收获小鼠,引颈处死小鼠,观察小鼠内脏器官的大体形态,采集组织或器官,研磨结肠组织块使内部细菌充分释放,按10倍倍比稀释,将不同稀释度的稀释液滴于麦康凯固体培养基上,从而测定两个时间点不同器官内的细菌载量;试验结果如图3~图6所示。
42.如图3所示,dec的致死率明显高于k12菌株(p=0.0138)。dec组存活率为 16.67%,pbs组为100%。
43.大肠杆菌k12菌株是研究肠道细胞黏附和多重耐药特性的大肠杆菌模式菌株,其
在小鼠上具备致腹泻特性,本发明将其作为模式菌株。
44.如图4所示,剖检上述三组小鼠,发现pbs对照组和k12菌株感染对照组小鼠结肠色泽形态正常。dec感染组小鼠结肠肠壁水肿,肠道弹性差,易碎。镜检可见dec 感染组结肠内肠腺遭到严重破坏,炎性细胞浸润,部分组织结构坏死消失。
45.如图5所示,随着感染剂量的增加,结肠组织载菌量均呈上升趋势,说明该细菌能够很好地在结肠内定殖。
46.如图6所示,相较于pbs对照组,dec感染后能够显著增加血清中促炎因子白介素-1β(il-1β)表达量,同时也能显著降低血清中抑炎因子白介素-10(il-10)表达量。
47.小鼠结肠内容物中短链脂肪酸(丁酸)的表达量如图7所示,可以看出相较于pbs 对照组,dec感染后能够显著降低结肠内容物中丁酸的含量,且这种抑制现象强于 k12菌株。
48.实验表明,dec腹腔注射小鼠(6周龄cd-1雌性小鼠)的半数致死剂量为5
×ꢀ
107cfu/只。经口灌胃无法构建dec感染小鼠模型。
49.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1