植物体生产方法、天然橡胶生产方法、充气轮胎制造方法和橡胶制品制造方法与流程
1.本发明涉及生产植物的方法、生产天然橡胶的方法、制造充气轮胎的方法和制造橡胶制品的方法。背景领域
2.目前,工业橡胶制品中使用的天然橡胶(一种聚类异戊二烯)是通过培育产胶植物,使这些植物的乳管细胞生物合成天然橡胶,并从植物中人工采集而获得的,产胶植物如大戟科(euphorbiaceae)的巴西橡胶树(hevea brasiliensis)或桑科植物中的印度橡胶树(ficus elastica)。
3.目前工业应用的天然橡胶几乎全部来自巴西橡胶树(hevea brasiliensis)。此外,作为橡胶制品的主要原料,天然橡胶在很多应用场景得到了广泛、大量的使用。然而,巴西橡胶树是一种只能在东南亚和南美洲等有限区域生长的植物。此外,巴西橡胶树从种植到成熟至可以提取橡胶大约需要7年的时间,而且采集季节可能会受到限制。从成熟树中采集天然橡胶的期限也仅为20-30年。
4.未来,预计主要在发展中国家对天然橡胶的需求会增加,天然橡胶资源枯竭令人担忧。因此,需要稳定的天然橡胶供应来源。
5.在这种情况下,旨在增加巴西橡胶树的天然橡胶产量的努力已经出现。对于巴西橡胶树,树苗(sapling)繁殖是通过培养和繁育由播种提供的籽苗(seedling)以产生砧木并将从克隆树苗获得的芽嫁接到砧木上来进行的。但是,嫁接物可能会受到砧木的影响,因此不能成为真正的克隆幼苗。
6.此外,微繁殖作为利用组织培养的克隆树苗繁殖技术广为人知。在微繁殖技术中,树苗通过无菌组织培养进行繁殖。具体而言,可以培养取自待繁殖的个体植物的组织,例如芽或芽尖,以诱导芽,最终能够生根并产生幼苗。这种方法可以产生真正的克隆树苗。
技术实现要素:
技术问题
7.本发明人的大量研究表明,源自木本植物芽的幼苗可能缺乏充分的根系发育因而容易延缓生长。因此,在将源自木本植物芽的幼苗用于商业化时,其根系发育和生长延迟成了主要问题,因此在以高生产力由源自木本植物芽的幼苗生产植物方面存在改进的空间。本发明旨在解决本发明人发现的新问题,并提供一种生产植物的方法,其能够以高生产力由源自木本植物芽(shoot)的幼苗生产植物,以及一种生产天然橡胶的方法,一种制造充气轮胎的方法和一种制造橡胶制品的方法,其中每种方法都包括用于生产植物的方法。
8.此外,除上述基于芽的技术外,还有使用组织培养的克隆树苗繁殖技术,该技术包括培养从待繁殖的植物个体中取出的组织,例如芽或芽尖,以诱导愈伤组织,繁育诱导的愈伤组织,将繁育的愈伤组织分成愈伤组织片,并分化得到的愈伤组织片,产生植物。通过该
技术得到的幼苗易形成主根,并且不存在与源自木本植物芽的幼苗同样的根系发育不足(特别是主根形成)的问题。因此,与根系发育和生长延迟相关的主要问题是源自木本植物芽的幼苗所特有的。换言之,本发明人发现的新问题是源自木本植物芽的幼苗特有的。技术方案
9.为了解决发现的新问题,本发明人进行了大量的研究,发现如下:虽然通常将源自木本植物芽的幼苗转移到含有土壤的盆中进行土壤培养,但与土壤培养相比,水培法培育源自木本植物芽的幼苗可以促进地上部分的生根、根系发育和生长,从而极大促进幼苗的生长,进而能够以高生产力由源自木本植物芽的幼苗生产植物。该发现促成了本发明。
10.具体地,本发明涉及一种生产植物的方法,包括水培培养源自木本植物芽的幼苗。
11.优选地,在水培培养中,营养液的温度为20~36℃。
12.优选地,在水培培养中,营养液的溶解氧含量为2~20ppm。
13.优选地,在水培培养中,营养液的初始ph为5.6~5.8。
14.优选地,在水培培养中,营养液的ph保持在5.0~6.5。
15.优选地,在水培培养中,培养在叶片水平(leaf level)的照度为5000lx以上的光照环境中进行。
16.优选地,幼苗的离地高度为1m以下。
17.优选地,芽是属于橡胶树(hevea)属的植物的芽。
18.优选地,芽是巴西橡胶树(hevea brasiliensis)的芽。
19.本发明还涉及一种生产天然橡胶的方法,包括:通过所述生产植物的方法生产植物;和使用在植物生产中获得的植物生产天然橡胶。
20.本发明还涉及一种制造充气轮胎的方法,包括:通过所述生产天然橡胶的方法生产天然橡胶,将生产得到的天然橡胶与添加剂捏合,得到捏合的混合物,由捏合的混合物形成生胎,和对生胎进行硫化。
21.本发明还涉及一种制造橡胶制品的方法,包括:通过所述生产天然橡胶的方法生产天然橡胶,将生产得到的天然橡胶与添加剂捏合,得到捏合的混合物,由捏合的混合物形成生橡胶产品,和对生橡胶产品进行硫化。本发明的优势
22.本发明的生产植物的方法包括对源自木本植物芽的幼苗进行水培培养,因此能够以高生产力由源自木本植物芽的幼苗生产植物。
23.本发明的生产天然橡胶的方法包括通过生产植物的方法生产植物,因此能够以高生产力生产天然橡胶。
24.本发明的制造充气轮胎的方法包括通过制造天然橡胶的方法制造天然橡胶,因此能够以高生产力制造充气轮胎。
25.本发明的制造橡胶制品的方法包括通过制造天然橡胶的方法制造天然橡胶,因此
能够以高生产力制造橡胶制品。
附图说明
26.图1展示了实施例1和对比例1的结果。图2展示了植物地上部分的示例图。图3展示了根系的示例图。图4展示了实施例2的结果图。
具体实施方式
27.《生产植物的方法》本发明的生产植物的方法包括水培培养源自木本植物芽的幼苗。与土壤培养相比,水培培养可以促进地上部分的生根、根系发育和生长,从而大大促进幼苗的生长,从而能够以高生产力由源自木本植物芽的幼苗生产植物。此外,即使当源自木本植物芽的幼苗在土壤培养中表现出发育不良的倾向,转为水培培养也能够使具有发育不良倾向的幼苗的生长得到改善。此外,由于水培培养通常使用营养液,根系与营养液接触,在根系生长的方向上没有物理障碍,因而减少了因接触摩擦产生的应力。需要说明的是,本发明的生产植物的方法包括水培培养步骤,还可以包括其它步骤。
28.本发明具有上述有利效果的原因尚不明确,但初步认定如下:在水培培养中,植物能相对容易地从水溶液中吸收养分和水分,这使得生长状况较差的根部易于吸收养分和水分。因而,通过水培培养步骤,即使是源自木本植物芽的幼苗,也可以使其稳定生长,并促进其根部生长。
29.本文中,所述术语“芽(shoot)”指顶芽、腋芽或不定芽,还指由丛生芽或芽原基分化的芽或任意上述芽中伸长的芽。本文中,所述术语“幼苗(plantlet)”指生根的芽。在此,该术语“幼苗”除了包括生根的芽以外,还包括在土壤培养中表现出发育不良倾向的生根的芽。本文中,所述术语“水培培养(hydroponic cultivation)”指不使用土壤等固体培养基的培养方式,也称为溶液培养(hydroponics)或水培(aquiculture)。通常,使用培养液进行培养。本文中,所述术语“地上部分(above-ground part)”指茎或茎上的叶。
30.尽管本发明所述生产方法适用于任何植物(发芽植物),但该植物优选木本植物。木本植物的非限制性例子包括种类范围广泛的落叶树和常青树。特别优选能够收集作为资源的橡胶的橡胶树。更优选的是橡胶树属如巴西橡胶树(hevea brasiliensis),榕属如无花果(ficus carica)、橡皮树(ficus elastica)、薜荔(ficus pumila l.)、天仙果(ficus erecta thumb.)、菲律宾榕(ficus ampelas burm.f.)、黄果榕(ficus benguetensis merr.)、糙叶榕(ficus irisana elm.)、细叶榕(ficus microcarpa l.f.)、棱果榕(ficus septica burm.f.)、孟加拉榕(ficus benghalensis)和灰白银胶菊(parhenium argentatum)。还更优选属于大戟科的植物,例如橡胶树属,特别优选属于橡胶
树属的植物。其中最优选巴西橡胶树(hevea brasiliensis)。
31.可用于诱导芽的材料的例子包括植物组织,例如植物的叶柄、叶片、体细胞胚的下胚轴、节、腋芽或顶芽。其中优选包括节、腋芽或顶芽的组织,因为这些芽可以被稳定诱导。具体的例子包括来自成熟的树、幼树、树苗或克隆树苗的上述组织,以及来自籽苗体外培养的无菌籽苗的组织。
32.使用上述来自成熟的树、幼树、树苗或克隆树苗的组织时,可以在使用前将它们适当切割成所需的大小,并对表面进行消毒或灭菌。当使用上述来自籽苗体外培养的无菌籽苗的组织时,可以在使用前将它们适当切割成所需的大小。
33.当使用上述来自成熟的树、幼树、树苗或克隆树苗的组织时,首先清洁组织表面,然后在下述的诱导培养基中培养。例如,可用研磨粉或软海绵清洁表面,但优选用流水清洁。清洁用水可以含有大约0.1质量%的表面活性剂。
34.接着,对组织进行消毒或灭菌。消毒或灭菌可以使用已知的消毒剂或杀菌剂,优选乙醇、苯扎氯铵或次氯酸钠水溶液。本文中,消毒或灭菌处理之后,可以进一步用无菌水洗涤。
35.作为一个具体例子,清洁以及消毒或灭菌处理可以通过以下程序进行:用流水清洁组织表面,用乙醇清洁组织;随后使用次氯酸钠水溶液(可选地搅拌)对组织进行灭菌;然后用无菌水清洁组织。
36.尽管用于诱导芽的方法不受限制,但以下描述了诱导来自组织或其他材料的芽的示例性诱导步骤。
37.(诱导步骤)诱导步骤包括在含有植物激素和碳源的诱导培养基中培养组织以诱导并形成芽。本文中,虽然诱导培养基可以是液体或固体,但优选固体培养,因为当组织插入培养基中进行培养时能促进芽的诱导。不过,当诱导培养基为液体培养基时,可以静置培养或摇动培养。此外,当使用经过消毒或灭菌的组织时,优选在培养前切除切割端以消除消毒剂或杀菌剂的影响。
38.植物激素(植物生长激素)的例子包括生长素植物激素和/或细胞分裂素植物激素。其中优选细胞分裂素植物激素。
39.生长素植物激素的例子包括2,4-二氯苯氧乙酸、1-萘乙酸、吲哚-3-丁酸、吲哚-3-乙酸、吲哚丙酸、氯苯氧乙酸、萘氧乙酸、苯乙酸、2,4,5-三氯苯氧乙酸、对氯苯氧乙酸、2-甲基-4-氯苯氧乙酸、4-氟苯氧乙酸、2-甲氧基-3,6-二氯苯甲酸、2-苯酸、毒莠定和吡啶甲酸。其中,优选2,4-二氯苯氧乙酸、1-萘乙酸、吲哚-3-丁酸,更优选2,4-二氯苯氧乙酸或1-萘乙酸。
40.细胞分裂素植物激素的例子包括苄基腺嘌呤、激动素、玉米素、苄基氨基嘌呤、异戊烯基氨基嘌呤、噻苯隆、异戊烯基腺嘌呤、玉米素核苷和二氢玉米素。其中,优选苄基腺嘌呤、激动素和玉米素,更优选苄基腺嘌呤和激动素,进一步更优选苄基腺嘌呤。
41.可以使用任何碳源,包括糖,例如蔗糖、葡萄糖、海藻糖、果糖、乳糖、半乳糖、木糖、阿洛糖、塔罗糖、古洛糖、阿卓糖、甘露糖、艾杜糖、阿拉伯糖、芹菜糖、甘露糖醇、山梨糖醇、木糖醇、赤藓糖醇和麦芽糖。其中优选蔗糖。
42.诱导培养基优选进一步包含活性炭以防止生长抑制剂在组织中积累。此外,为了促进芽的形成,诱导培养基优选还含有硝酸银。此外,诱导培养基可以添加椰子水(椰奶)以促进芽的形成。
43.诱导培养基的例子包括通过将植物激素添加到基础培养基(base media)中制备的培养基,基础培养基(base media)包括:基础培养基(basal media),例如怀特培养基(white’s medium)(公开于第20-36页,shokubutsu saibo kogaku nyumon(introduction to plant cell engineering),japan scientific societies press)、海勒培养基(heller medium)(heller r,bot.biol.veg.paris 14,1-223(1953))、sh培养基(schenk and hildebrandt medium)、ms培养基(murashige and skoog medium)(公开于第20-36页,shokubutsu saibo kogaku nyumon(introduction to plant cell engineering),japan scientific societies press)、ls培养基(linsmaier and skoog medium)(公开于第20-36页,shokubutsu saibo kogaku nyumon(introduction to plant cell engineering),japan scientific societies press)、b5培养基(gamborg medium)、(公开于第20-36页,shokubutsu saibo kogaku nyumon(introduction to plant cell engineering),japan scientific societies press)、mb培养基(mb medium)(公开于第222-245页,biotechnology in agriculture and forestry volum5(treesii))和wp培养基(wp medium)(针对木本植物),以及通过改变上述基础培养基的组分得到的改良基础培养基。其中优选通过将植物激素添加到ms培养基、b5培养基、wp培养基或mb培养基中制备的培养基。更优选的是通过将植物激素添加到ms培养基、通过改变培养基组分得到的改良ms培养基、mb培养基或通过改变培养基组分得到的改良mb培养基中制备的培养基。
44.当诱导培养基以固体培养基形式应用时,可以使用固化剂来固化培养基。可以使用任意固化剂,包括日本明胶、结冷胶(gellan gum)、琼脂糖、gelrite、琼脂、phytagel。
45.诱导培养基的合适组成和培养条件因植物种类而异,也因培养基为液体培养基或固体培养基而异,但组成通常如下,特别是橡胶树的情况下。
46.诱导培养基中的碳源浓度优选为0.1质量%以上,更优选为1.0质量%以上,进一步优选为3.0质量%以上。碳源浓度优选为10质量%以下,更优选为9.0质量%以下,进一步优选为6.0质量%以下。本文中,术语“碳源浓度(carbon source concentration)”是指糖的浓度。
47.优选地,诱导培养基中基本不添加生长素植物激素。具体而言,诱导培养基中的生长素植物激素浓度优选为1.0mg/l以下,更优选为0.1mg/l以下,还更优选为0.05mg/l以下,特别优选为0.01mg/l以下。
48.在向诱导培养基中添加细胞分裂素植物激素时,诱导培养基中的细胞分裂素植物激素浓度优选为0.01mg/l以上,更优选为0.1mg/l以上,还更优选为0.5mg/l以上,特别优选为0.8mg/l以上,最优选3.0mg/l以上。细胞分裂素植物激素浓度优选不超过8.0mg/l,更优选不超过7.0mg/l,还更优选不超过6.0mg/l。特别地,当使用的细胞分裂素植物激素为苄基腺嘌呤时,苄基腺嘌呤浓度优选为4.0-6.0mg/l,最优选为5.0mg/l。此外,使用的细胞分裂素植物激素为激动素时,激动素浓度优选为0.8~1.2mg/l,最优选为1.0mg/l。
49.诱导培养基中活性炭浓度优选为0.01质量%以上,更优选为0.03质量%以上。活
性炭浓度优选为1.0质量%以下,更优选为0.1质量%以下。
50.诱导培养基中的硝酸银浓度优选为0.1mg/l以上,更优选为0.3mg/l以上,还更优选为0.5mg/l以上。硝酸银浓度优选为5.0mg/l以下,更优选为3.0mg/l以下。
51.诱导培养基的ph优选为4.0~10.0,更优选为5.0~6.5,还更优选为5.5~6.0。本文中,固体培养基的“ph”是指包含除固化剂以外的所有成分的培养基的ph。
52.诱导步骤通常在受控环境下进行,其中温度和光照周期等培养条件受到控制。可以根据适当的方式选择培养条件,但是,例如,培养温度优选为0~40℃,更优选20~40℃,还更优选25~35℃。培养可以在黑暗或光照下进行,但是,例如,光照条件可以包括以12.5μmol/m2/s光照14~16小时的光照循环。培养时间没有限制,优选培养1~10周,更优选培养3~5周。
53.当诱导培养基为固体培养基时,诱导培养基中的固化剂浓度优选为0.1质量%以上,更优选为0.2质量%以上。固化剂浓度优选为2.0质量%以下,更优选为1.1质量%以下,进一步优选为0.8质量%以下。
54.在上述条件中,特别优选使用的植物生长激素是细胞分裂素植物激素,特别是苄基腺嘌呤或激动素,浓度为3.0~8.0mg/l,培养温度为25~35℃。
55.如上所述,可以通过在诱导培养基中培养组织来诱导并形成芽。
56.虽然从芽得到幼苗的方法不受限制,但以下描述了从芽得到幼苗的示范性方法。形成的芽可以直接进入后续描述的培养步骤。优选地,在培养步骤前,对芽进行如下浸泡步骤。这种情况下倾向于更易于获得幼苗。
57.(浸泡步骤)浸泡步骤包括将芽浸泡在含有生长素植物激素的生长素溶液中。具体而言,可以将在诱导步骤或其他步骤中获得的芽(例如,约2cm的芽段)浸泡在生长素溶液中。优选地,将芽浸泡在生长素溶液中,使得芽段的末端(即芽的切割端)浸没在生长素溶液中。此外,可以将芽浸泡在生长素溶液中,同时可以静置或摇动。
58.浸泡步骤的时间优选为24小时以上,更优选为40小时以上,还更优选为60小时以上,特别优选为70小时以上,但优选为168小时以下,更优选为150小时以下,更优选130小时以下,特别优选100小时以下,最优选90小时以下,进一步最优选80小时以下。这样可以得到更好的生根率。
59.浸泡步骤优选在温度和光周期等条件受到控制的受控环境中进行。例如,浸泡步骤的温度优选为0~40℃,更优选为20~40℃,进一步优选为25~35℃。浸泡步骤可以在黑暗或光照下进行,但是,例如,光照条件可以包括以5~20μmol/m2/s光照14~16小时的光照循环。
60.待进行浸泡步骤的芽可以是任意的芽,并且可以通过任意方法形成。例如,可以是在诱导步骤或其它步骤中获得的芽。此外,待进行浸泡步骤的芽优选为芽段。例如,优选是从用作诱导芽的材料的组织(例如,腋芽)中切出的芽段。芽还优选为已经在诱导培养基中培养至多6个月的芽。
61.待进行浸泡步骤的芽(芽段)的长度优选为10mm以上,更优选15mm以上,进一步优选20mm以上,但优选为100mm以下,更优选80mm以下,还更优选50mm以下。这样可以得到更好的生根率。
62.生长素溶液中所含的生长素植物激素可以如针对用于诱导培养基中的生长素植物激素所描述的。其中,优选吲哚-3-丁酸和1-萘乙酸,优选吲哚-3-丁酸和1-萘乙酸的组合。
63.生长素溶液中的生长素植物激素的浓度优选为15mg/l以下,更优选为12mg/l以下,但优选为1.0mg/l以上,更优选为3.0mg/l以上,进一步优选5.0mg/l以上,特别优选8.0mg/l以上。这样可以得到更好的生根率。本文中,当使用多种生长素植物激素时,生长素植物激素的浓度是指生长素植物激素的总浓度。
64.当使用的生长素植物激素是吲哚-3-丁酸和1-萘乙酸的组合时,生长素溶液中的吲哚-3-丁酸的浓度优选为10mg/l以下,更优选为7.5mg/l以下,进一步优选为6.0mg/l以下,但优选1.0mg/l以上,更优选2.5mg/l以上,进一步优选3.0mg/l以上,特别优选4.0mg/l以上,和生长素溶液中的1-萘乙酸的浓度优选为10mg/l以下,更优选为7.5mg/l以下,进一步优选为6.0mg/l以下,但优选为1.0mg/l以上,更优选2.5mg/l以上,进一步优选3.0mg/l以上,特别优选4.0mg/l以上。这样可以得到更好的生根率。
65.生长素溶液含有生长素植物激素就足够了,可以使用任意分散介质来溶解生长素植物激素,包括水、等渗溶液、缓冲液和组织培养基。等渗溶液的例子包括通过添加无机盐如kcl、nacl、cacl2或mgcl2至浓度0.01~7m,优选0.5~2m制备的液体。缓冲剂的例子包括磷酸盐缓冲液、tris缓冲液和mes缓冲液。组织培养基的例子包括上述培养基。为了更适当地发挥有益效果,这些之中优选水,换言之,生长素溶液优选为生长素植物激素溶解在水中的水溶液。
66.尽管除生长素植物激素以外,可以将任意组分掺入生长素溶液中,但优选谷胱甘肽。这样可以得到更好的生根率。谷胱甘肽是由作为组成氨基酸的谷氨酸、半胱氨酸和甘氨酸组成的三肽,可以是还原型谷胱甘肽、氧化型谷胱甘肽(二硫化谷胱甘肽)或它们的混合物,优选还原型谷胱甘肽。
67.生长素溶液中的谷胱甘肽的浓度优选为10μmol/l以上,更优选为30μmol/l以上,进一步优选为40μmol/l以上,特别优选为60μmol/l以上,最优选为80μmol/l以上,但优选500μmol/l以下,更优选400μmol/l以下,还更优选300μmol/l以下,特别优选200μmol/l以下,最优选150μmol/l以下。这样可以得到更好的生根率。
68.除生长素植物激素之外的植物激素也可以用于生长素溶液中。如针对适用于诱导培养基中的细胞分裂素植物激素描述的细胞分裂素植物激素可以用于生长素溶液中,但优选在生长素溶液中不使用除了生长素植物激素以外的植物激素。
69.生长素溶液中除了生长素植物激素以外的植物激素的浓度优选2.0mg/l以下,更优选1.0mg/l以下,进一步优选0.1mg/l以下,特别优选0.08mg/l以下,最优选0mg/l。这样可以得到更好的生根率。
70.(培养步骤)培养步骤包括在生根诱导培养基中培养在浸泡步骤中浸泡过的芽以促其生根。本文中,虽然生根诱导培养基可以是液体或固体,但优选固体培养,因为当芽插入培养基中培养时生根容易。此外,当生根诱导培养基为液体培养基时,可以静置培养或摇动培养。
71.待进行培养步骤的芽可以是浸泡步骤中浸泡过的任意芽。特别地,优选通过在浸泡步骤中浸泡芽而在其基部形成组织块的芽。此外,更优选在浸泡步骤中使用在其基部已经形成组织块的芽。
72.生根诱导培养基含有碳源。
73.任意植物激素都可以用于生根诱导培养基,包括针对可用于诱导培养基中的植物激素(生长素植物激素、细胞分裂素植物激素)所描述的那些。
74.虽然任何碳源都可以用于生根诱导培养基,包括针对可用于诱导培养基中的碳源所描述的那些,但其中优选蔗糖。这样可以得到更好的生根率。
75.与诱导培养基一样,生根诱导培养基优选还含有活性炭和/或硝酸银。这样可以得到更好的生根率。
76.与生长素溶液一样,生根诱导培养基优选还含有谷胱甘肽。这样可以得到更好的生根率。谷胱甘肽可以是还原型谷胱甘肽、氧化型谷胱甘肽或它们的混合物,优选还原型谷胱甘肽。
77.生根诱导培养基的例子包括通过将碳源添加到基础培养基而制备的那些,基础培养基例如用作诱导培养基的基础培养基,以及通过改变基础培养基的组成而制备的改良基础培养基。其中优选的是通过向ms培养基、b5培养基、wp培养基或mb培养基中添加碳源制备的那些培养基。更优选的是通过向ms培养基、通过改变培养基的组成制备的改良ms培养基、mb培养基或通过改变培养基的组成制备的改良mb培养基中添加碳源制备的那些培养基。进一步优选的是通过向mb培养基或通过改变培养基的组成制备的改良mb培养基中添加碳源制备的那些培养基。
78.当生根诱导培养基用作固体培养基时,该培养基可以使用固化剂固化。可以使用任意固化剂,包括日本明胶、结冷胶(gellan gum)、琼脂糖、gelrite、琼脂、phytagel。
79.生根诱导培养基的适宜组成和培养条件因植物种类而异,也因培养基是液体培养基或固体培养基而异,但通常组成如下,特别是橡胶树的情况下。
80.生根诱导培养基中的碳源的浓度优选为0.1质量%以上,更优选为1.0质量%以上。碳源的浓度优选为10质量%以下,更优选为6.0质量%以下。
81.生根诱导培养基中的植物激素的浓度优选为2.0mg/l以下,更优选为1.0mg/l以下,进一步优选为0.1mg/l以下,特别优选为0.08mg/l以下,最优选为0mg/l。这样可以得到更好的生根率。
82.生根诱导培养基中的活性炭的浓度优选为0.005质量%以上,更优选为0.008质量%以上,活性炭的浓度优选为1.0质量%以下,更优选为0.1质量%以下。
83.生根诱导培养基中的硝酸银的浓度优选为0.1mg/l以上,更优选为0.3mg/l以上,进一步优选为0.5mg/l以上。硝酸银的浓度优选为5.0mg/l以下,更优选为3.0mg/l以下。
84.生根诱导培养基中的谷胱甘肽的浓度优选为10μmol/l以上,更优选为30μmol/l以上,进一步优选为40μmol/l以上,特别优选为60μmol/l以上,最优选为80μmol/l以上,但优选500μmol/l以下,更优选400μmol/l以下,还更优选300μmol/l以下,特别优选200μmol/l以下,最优选150μmol/l以下。
85.生根诱导培养基的ph优选为4.0~10.0,更优选为5.0~6.5,进一步优选为5.5~6.0。
86.培养步骤通常在受控环境中进行,其中,培养条件如温度和光照周期受到控制。可以适当地选择培养条件,但是,例如,培养温度优选为0~40℃,更优选20~40℃,进一步优选25~35℃。培养可以在黑暗或光照下进行,但是,例如,光照条件可以包括以5~20μmol/m2/s光照14~16小时的光照循环。培养时间没有限制,优选培养1~10周,更优选培养4~8周。
87.本文中,培养步骤中的培养时间限定如下:在浸泡步骤中浸泡的芽(芽段)移植到生根诱导培养基时开始培养(0小时);三周的培养期和九周的培养期分别指从培养开始算起的504小时和1512小时;如果将芽移植(重植)到新的生根诱导培养基中,培养时间不会重置,而是会继续累加。
88.生根诱导培养基为固体培养基时,生根诱导培养基中的固化剂浓度优选为0.1质量%以上,更优选为0.2质量%以上,固化剂的浓度优选为2.0质量%以下,更优选为1.1质量%以下,进一步优选为0.75质量%以下。
89.在上述条件中,优选培养基具有低的植物激素浓度(基本上不含植物激素)或含有谷胱甘肽。更优选培养基具有低的植物激素浓度(基本上不含植物激素)并进一步含有谷胱甘肽。
90.如上所述,浸泡步骤中浸泡的芽可以在生根诱导培养基中培养以引起生根,从而获得生根的芽(幼苗)。这样,可以形成完整的克隆树苗。
91.根据本发明,将在常规技术中直接移植到土壤中的获得的幼苗(源自木本植物芽的幼苗)进行如下的水培培养步骤。
92.(水培培养步骤)水培培养步骤包括水培培养源自木本植物芽的幼苗。
93.待进行水培培养步骤的幼苗可以是任意源自木本植物芽的幼苗。如上所述,待进行水培培养步骤的幼苗不仅包括生根的芽,还包括在土壤培养中显示出生长不良倾向的生根的芽。
94.待进行水培培养步骤的幼苗优选已完成叶片发育。本文中,“完成叶片发育”是指从伸长的芽中长出的叶的发育已经完成。
95.待进行水培培养步骤的幼苗的离地高度优选为1m以下,更优选为50cm以下,进一步优选为20cm以下,但优选为1.5cm以上,更优选为3.0cm以上,进一步优选4.5cm以上。当离地高度处于上述范围内时,有利效果能够更适当地实现。本文中,待进行水培培养步骤的幼苗的离地高度是指水培培养步骤开始时幼苗的离地高度。
96.在水培培养中,通常使用营养液进行培养。优选地,在植物的根部与营养液接触的情况下进行培养。此外,不使用土壤等固体介质。
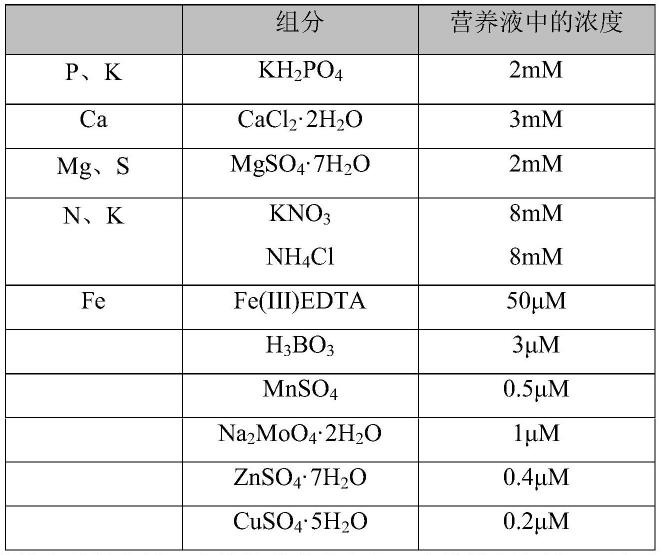
97.营养液是通过将含有植物生长所需营养的肥料溶解在水中制备而成的,可以是任意适合植物生长的营养液,包括常规的那些。例子包括用于营养液培养的kaneko肥料“farm ace no.1”(可从kaneko seeds co.,ltd.获得)、用于营养液培养的kaneko肥料“farm ace no.2”(可从kaneko seeds co.,ltd.获得)、用于营养液培养的“oat house no.1”(可从oat agrio co.,ltd.获得)、用于营养液培养的“oat house no.2”(可从oat agrio co.,ltd.获得)、hyponica液体肥料(可从kyowa co.,ltd.获得)和hoagland水培溶液。这些可以单独使用或两种以上组合使用。其中,优选hyponica液体肥料(可从kyowa co.,ltd.获得)和hoagland水培溶液,更优选hoagland水培溶液。
98.例如,oat house no.1是一种粉末肥料,其总氮含量为10.0质量%,水溶性磷酸盐含量为8.0质量%,水溶性钾含量为27.0质量%,水溶性镁含量为4.0质量%、水溶性锰含量为0.10质量%、水溶性硼含量为0.10质量%、铁含量为0.18质量%、铜含量为0.002质量%,锌含量为0.006质量%,钼含量为0.002质量%。另外,oat house no.2是一种粉末肥料,其总氮含量为11.0质量%、石灰含量为23.0质量%。
99.例如,当使用oat house no.1和oat house no.2制备营养液时,可以根据已知配方(例如,配方a或配方c)将oat house no.1溶解在水中制成溶液,然后在溶液中添加和溶解oat house no.2。下面描述了oat house no.1(购自oat agrio co.,ltd.)和oat house no.2(购自oat agrio co.,ltd.)的示例性配方a的组分。总氮(tn):260ppm(其中氨基氮(an):23ppm,硝酸盐氮(nn):233ppm)磷酸盐(p2o5):120ppm钾(k2o):405ppm石灰(cao):230ppm镁(mgo):60ppm锰(mno):1.5ppm硼(b2o3):1.5ppm铁(fe):2.7ppm铜(cu):0.03ppm锌(zn):0.09ppm钼(mo):0.03ppmec值(ds/m):2.6
100.例如,hoagland水培溶液具有以下组分。[表1]
[0101]
营养液中的氮含量、水溶性磷酸盐含量、水溶性钾含量、石灰含量、水溶性镁含量等不受限制。本领域技术人员可以容易地调整它们以提供适合植物生长的营养液。例如,营养液中的氮浓度优选为10~20mmol/l。例如,营养液中的水溶性磷酸盐浓度优选为1~6mmol/l。例如,营养液中的水溶性钾浓度优选为5~15mmol/l。
[0102]
营养液的温度和营养液的溶解氧含量对进一步促进生根、根系发育和地上部分的生长非常重要,这样可以进一步大大促进幼苗的生长,从而可以以更高的生产力由源自木本植物芽的幼苗生产植物。通过将营养液的温度和营养液的溶解氧含量调整到下述的适当范围内,能够更适当地发挥有益效果。其原因据认为如下。向根部提供所需的充足氧气可以避免缺氧,进一步保持适合生长的水温可以防止湿害。因此可以促进通过根部吸收养分和水分,更能够获得健康的植物。
[0103]
营养液的温度优选20℃以上,更优选22℃以上,进一步优选24℃以上,特别优选25℃以上,但优选36℃以下,更优选34℃以下,更优选32℃以下,特别优选30℃以下,最优选28℃以下,进一步最优选26℃以下。当温度在上述范围内时,有利效果能够更适当地实现。
[0104]
营养液的溶解氧含量优选为2ppm以上,更优选为4ppm以上,进一步优选为5ppm以上,特别优选为7ppm以上,最优选为9ppm以上,但优选为20ppm以下,更优选18ppm以下,进一步更优选15ppm以下,特别优选12ppm以下。当溶解氧含量在上述范围内时,有利效果能够更适当地实现。本文中,营养液的溶解氧含量是在25℃下使用溶解氧测量计测量的。此外,溶解氧含量可以通过任意方法调节到上述范围内,例如向营养液中加入空气或氧气,即曝气。在这种情况下,有利效果能够更适当地实现。
[0105]
营养液的初始ph优选为5.6~5.8。当初始ph在上述范围内时,有利效果能够更适当地实现。
另外,在水培培养步骤中,优选将营养液的ph维持在5.0~6.5进行培养。ph优选为5.2以上,更优选为5.5以上,但优选为6.3以下,更优选为6.0以下。当ph在上述范围内时,有利效果能够更适当地实现。此外,根据需要,可以通过向营养液中添加酸或碱,将ph调整到上述范围内。在此,ph值是在25℃下测量的。
[0106]
在水培培养步骤中,优选在叶片水平的照度为5000lx以上的环境下进行培养。照度优选为6000lx以上,更优选为7000lx以上,但优选为15000lx以下,更优选为10000lx以下。当照度在上述范围内时,有利效果能够更适当地实现。在此,叶面水平的照度根据jis c 7612进行测定。
[0107]
用于获得上述照度的光源不受限制,可以是自然光、人造光或它们的组合。当使用人造光时,例子包括发光二极管(led)、卤素灯、白炽灯、荧光灯、弧光灯、无电极放电灯、低压放电灯、冷阴极荧光管、外电极荧光灯、电致发光灯和hid灯。hid灯的例子包括高压汞灯、金属卤化物灯和高压钠灯。这些光源可以单独使用,也可以两种以上组合使用。
[0108]
水培培养步骤中的光周期(光照)没有限定,优选为12小时以上,更优选为14小时以上,但优选为22小时以下,更优选为20小时以下。当光周期在上述范围内时,有利效果能够更适当地实现。
[0109]
水培培养步骤中的培养温度优选为20℃以上,更优选为22℃以上,进一步优选为24℃以上,特别优选为26℃以上,但优选为36℃以下,更优选34℃以下,进一步优选32℃以下,特别优选30℃以下。当培养温度在上述范围内时,有利效果能够更适当地实现。
[0110]
虽然水培培养步骤中的培养时间没有限定,但优选为2个月以上,更优选为3个月以上,进一步优选为4个月以上,上限没有限定。当培养时间在上述范围内时,有利效果能够更适当地实现。
[0111]
其他水培培养条件不受限制,可以在适合植物生长的常规条件下进行培养。另外,对用于水培培养的系统等也没有限制,可以使用水培中通常使用的系统。
[0112]
在水培培养步骤中,优选将弹性材料附在幼苗的根的基部周围。由此,能够将幼苗固定在营养液中,从而能够更适当地发挥有益效果。弹性材料可以是任意具有弹性的材料。例子包括海绵和供水板。这些可以单独使用或两种以上组合使用。其中优选海绵。在此,根的基部是指观察到的生根的区域附近。
[0113]
在将弹性材料附在幼苗的根的基部时,优选不将基部过紧地固定。因此,优选地,在弹性材料中制造缝隙。弹性材料的抗拉强度优选为30kpa以上,更优选为40kpa以上,进一步优选为60kpa以上,但优选为1000kpa以下,更优选为500kpa以下,进一步优选为100kpa以下。当抗拉强度在上述范围内时,弹性材料不会过紧地固定基部,有利效果能够更适当地实现。在本文中,弹性材料的抗拉强度根据jis k6400-5通过用拉伸试验机拉断试样并将最大断裂强度除以试样的横截面积来确定。
[0114]
如上所述,与土壤培养相比,通过水培培养源自木本植物芽的幼苗的水培培养步骤,可以促进生根、根系发育和地上部分的生长,从而可以大大促进幼苗的生长,因此可以以高生产力由源自木本植物芽的幼苗生产植物(作为完整植物的克隆树苗)。
如有必要,可以将生产的植物移植到土壤中。此外,在水培培养步骤中也完成了驯化。因此,水培培养步骤可以同时地有效地促进驯化和初始生长,因此可以以高生产力由源自木本植物芽的幼苗生产植物(作为完整植物的克隆树苗),而无需进行单独的驯化步骤。
[0115]
《生产天然橡胶的方法》本发明的生产天然橡胶的方法包括:通过生产植物的方法生产植物;和使用在植物生产中获得的植物生产天然橡胶。本发明的天然橡胶的生产方法包括通过生产植物的方法生产植物,因此能够以高生产力生产天然橡胶。
[0116]
植物生产步骤包括通过生产植物的方法生产植物并且可以通过实施植物生产方法来进行。
[0117]
在天然橡胶生产步骤中,使用在植物生产步骤中得到的植物生产天然橡胶。具体地,可以通过培养在植物生产步骤中获得的植物以在植物的乳管细胞中生物合成天然橡胶来生产天然橡胶。
[0118]
天然橡胶可以通过常规已知的方法从植物中收集。例如,可以用诸如刀的工具物理切割植物以收集乳液(胶乳),随后可选地通过例如添加酸来固化胶乳,由此从植物收集作为固体的橡胶(天然橡胶)。由此获得的橡胶(天然橡胶)在使用前可以任选地进行洗涤、脱水和干燥。
[0119]
《制造橡胶制品的方法》本发明的制造橡胶制品的方法包括:通过生产天然橡胶的方法生产天然橡胶;将生产得到的天然橡胶与添加剂捏合,得到捏合的混合物;由捏合的混合物形成生橡胶产品;对生橡胶产品进行硫化。本发明的制造橡胶制品的方法包括通过生产天然橡胶的方法生产天然橡胶,因此能够以高生产力生产橡胶制品。
[0120]
本发明的橡胶产品可以是能够由橡胶(优选天然橡胶)生产的任意橡胶产品,例子包括充气轮胎、橡胶履带和橡胶护舷。
[0121]
在橡胶制品为充气轮胎的情况下,即在本发明的制造橡胶制品的方法为本发明的制造充气轮胎的方法的情况下,生橡胶制品的成型步骤对应于由捏合的混合物形成生胎,硫化步骤对应于对生胎进行硫化。因此,本发明的制造充气轮胎的方法包括:通过生产天然橡胶的方法生产天然橡胶;将生产得到的天然橡胶与添加剂捏合,得到捏合的混合物;由捏合的混合物形成生胎;对生胎进行硫化。本发明的制造充气轮胎的方法包括通过生产天然橡胶的方法生产天然橡胶,因此能够以高生产力制造充气轮胎。
[0122]
通过生产天然橡胶的方法生产天然橡胶的步骤可以通过实施生产天然橡胶的方法以生产天然橡胶来进行。
[0123]
《捏合步骤》在捏合步骤中,将通过生产天然橡胶的方法生产天然橡胶的步骤中得到的天然橡胶与添加剂进行捏合,得到捏合的混合物。
[0124]
可以使用任意添加剂,包括用于制造橡胶制品的那些。例如,当橡胶制品为充气轮胎时,添加剂的例子包括除由胶乳获得的橡胶之外的橡胶组分,增强填料,如炭黑、二氧化硅、碳酸钙、氧化铝、粘土和滑石;硅烷偶联剂;氧化锌;硬脂酸;加工助剂;各种抗氧化剂;软
化剂,如油;蜡;硫化剂,如硫;和硫化促进剂。
[0125]
捏合步骤中的捏合可以使用开炼机、班伯里密炼机(banbury mixer)或密炼机等橡胶捏合机进行。
[0126]
《生橡胶制品成型步骤(在轮胎的情况下为生胎成型步骤)》在生橡胶制品成型步骤中,生橡胶制品(在轮胎的情况下为生胎)由在捏合步骤中获得的捏合混合物形成。形成生橡胶制品的方法没有限制,可以适当地使用在生橡胶制品的成型中使用的方法。例如,当橡胶制品是充气轮胎时,可以将在捏合步骤中获得的捏合混合物挤出成轮胎部件的形状,然后在轮胎成型机上以通常的方式成型并与其他轮胎部件组装以形成生胎(未硫化轮胎)。
[0127]
《硫化步骤》在硫化步骤中,将在生橡胶制品成型步骤中获得的生橡胶制品硫化以制造橡胶制品。对生胶制品的硫化方法没有限制,可以适当使用在生胶制品的硫化中使用的方法。例如,橡胶制品为充气轮胎的情况下,将在生橡胶制品成型步骤中得到的生胎(未硫化轮胎)在硫化机中通过加热加压进行硫化,制造充气轮胎。实施例
[0128]
参照实施例具体描述了本发明,但本发明不限于此。
[0129]
以下对实施例中使用的化学品进行统一描述。ba:苄基腺嘌呤ki:激动素硝酸银:购自merck的硝酸银胶凝剂(固化剂):购自sigma-aldrich的phytagel
[0130]
《诱导步骤》从巴西橡胶树(hevea brasiliensis)的树苗中取出包括腋芽的组织。接下来,将取自树苗的包含腋芽的组织用流水清洗,然后用70质量%乙醇清洗,接着用以约5~10体积%稀释的次氯酸钠水溶液进行灭菌,并用无菌水清洗。
[0131]
接下来,将灭菌后的组织插入到诱导培养基(固体培养基)中进行培养(诱导步骤)。诱导培养基如下制备:在mb培养基中添加5.0mg/l的苄基腺嘌呤、1.0mg/l的硝酸银、3.0质量%的蔗糖和0.05质量%的活性炭,调节培养基的ph至5.7,然后加入胶凝剂至浓度为0.275质量%,然后在高压灭菌器中灭菌(121℃,20分钟),在超净台中冷却。
[0132]
将巴西橡胶树组织插入诱导培养基(固体培养基)中,在12.5μmol/m2/s光照16小时的光照循环和28℃的培养温度下进行培养,诱导出芽。此处,每4周将组织移植到具有相同组分的诱导培养基中进行传代培养。经诱导步骤诱导的芽用于以下步骤。
[0133]
将每个芽的切割端浸泡在生长素溶液(5.0mg/l 1-萘乙酸、5.0mg/l吲哚-3-丁酸和100μmol/l还原型谷胱甘肽)中72小时(浸泡步骤的光周期为以12.5μmol/m2/s光照16小时,温度为28℃)。接下来,将浸泡步骤中浸泡的每个芽的切断面插入到无激素固体培养基(植物激素浓度:0mg/l、ph5.7)中进行培养,该培养基为mb基础培养基,含有3.0质量%蔗
糖、0.01质量%活性炭、1.0mg/l硝酸银、100μmol/l还原型谷胱甘肽和0.275质量%固化剂(培养步骤)。在12.5μmol/m2/s光照16小时的光照循环和25~28℃的温度下培养8周。从开始培养起,在无激素培养基中培养至少两周后,在一些个体中观察到根,并且将个体再培养四个星期以获得幼苗(芽衍生的幼苗)。在此,生长素溶液通过将上述成分溶解在蒸馏水中来制备。此外,培养基如下制备:将除固化剂以外的所有上述成分添加到基础培养基中,将培养基的ph调节至5.7,然后加入固化剂至0.275质量%的浓度,然后在高压灭菌器中灭菌(121℃,20分钟)并在超净台中冷却。
[0134]
(实施例1)水培培养将具有缝隙的海绵(抗拉强度:80kpa)附在上述得到的每个幼苗(离地高度:5.0cm)的根的基部周围。然后,将幼苗置于基座(材料:聚苯乙烯泡沫塑料)上开设的孔中,并将基座漂浮在深容器中的营养液(初始ph:5.7)上,使幼苗的根部浸没在营养液中。用气泵向营养液供氧,使营养液的溶解氧含量保持在12ppm。然后,在营养液温度25℃、培养温度28℃的条件下,在16小时光照和8小时黑暗的循环下进行水培培养。在此,光照下的叶面水平的照度维持在5000~10000lx,黑暗下的叶面水平的照度维持在1lx以下。此外,进行培养的同时通过向营养液中添加硝酸溶液,将营养液的ph维持在5.6~5.8。
[0135]
本文中,使用的营养液是hoagland水培溶液。
[0136]
然后,在培养过程中,每月对幼苗进行观察并拍照,以确定是否生根,观察根系伸长、离地高度、茎围、叶枯发生情况等。观察结果用于评价地上部分的生长情况和根系形成。
[0137]
(对比例1)在相同条件下进行土壤培养,不同之处在于使用培养土(蛭石和观赏植物土壤的混合物)代替营养液。浇水通过使用浇水罐以营养液润湿培养土壤来进行,每天一次。
[0138]
图1显示了实施例和对比例的评价结果。在此,每个示例实施两次。图1(a)显示了各示例的离地高度的变化。图1(b)显示了每个示例的茎围的变化。图1中实施例与对比例的比较表明,与土壤培养相比,水培培养显著促进了地上部分的生长。此外,涉及土壤培养的对比例1-1和1-2在培养开始时表现出约六个月以上的延迟阶段(retarded stage)。相反,涉及水培培养的实施例1-1和1-2显示了从培养开始时地上部分的生长情况。此处,茎围在距地上部分和根部之间的边界1.0cm的位置测得。
[0139]
图2是实施例中培养3个月后的地上部分的照片。如图2所示,与土壤培养相比,水培培养促进了地上部分的生长和叶片的健康状况。
[0140]
图3是实施例中培养3个月后的根部的照片。如图3所示,涉及土壤培养的对比例的主根系呈螺旋状,而涉及水培培养的实施例的根不呈螺旋状且侧根发育良好。这表明,与土壤培养相比,水培培养促进了生根和根系发育。
[0141]
(实施例2)
首先,将如上所述获得的幼苗(地上高度:5.0cm)进行土壤培养。然后,幼苗表现出生长不良。在与实施例1相同的条件下对生长不良的幼苗进行2个月的水培培养。图4显示了水培开始时和水培两个月后的幼苗照片。如图4所示,即使当源自木本植物芽的幼苗在土壤培养中表现出生长不良的趋势时,改用水培培养使得具有生长不良趋势的幼苗表现出生长情况改善。相反,在与对比例1相同的条件下进行土壤培养时,生长不良的幼苗枯萎了。
[0142]
这些结果表明,与土壤培养相比,通过水培培养可以促进生根、根系发育和地上部分的生长,从而大大促进幼苗的生长。因而可以以高生产力由源自木本植物芽的幼苗生产植物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1