一种基于PEDF/LDLR双基因敲除的非酒精性脂肪性肝炎小鼠模型构建方法及应用
一种基于pedf/ldlr双基因敲除的非酒精性脂肪性肝炎小鼠模型构建方法及应用
技术领域
1.本发明属于医药技术领域,尤其涉及一种基于pedf/ldlr双基因敲除的非酒精性脂肪性肝炎小鼠模型构建方法及应用。
背景技术:
2.非酒精性脂肪肝(nonalcoholic fatty liver disease,nafld)是一种无过量饮酒史,以肝细胞脂肪变性和脂质贮积为特征的临床病理综合征,目前已成为全球慢性肝病的主要病因。其病理变化随病程的进展而表现有单纯性脂肪肝、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,nash)、肝纤维化,并最终发展成肝硬化和肝细胞癌。nash是非酒精性脂肪肝的一种极端发展形式,定义为伴随有炎症及肝细胞损伤的脂肪变性现象的出现,其特征在于肝脏脂肪变性、炎症、肝细胞损伤和不同程度的纤维化。据统计,目前,nafld的全球患病率约为25%,且以每年360万新增病例的速度在急剧增加。其中,约有20%的nafld患者进展为nash,20%的nash患者进展为肝硬化。因此,nafld及nash发病率的急剧增加已成为全球性的重大公共卫生问题。
3.nash病理机制复杂,代谢异常驱动的炎症反应仍被认是导致nash发生的关键步骤。然而,尽管关于nash病理机制研究近年来取得较大进展,但目前尚无经美国食品药品监督管理局(food and drug administration,fda)批准上市的用于临床治疗nash的药物,导致nash患者仍面临“无药可治”的局面。临床前研究中最重要的是通过动物试验测试靶点的合理性和药物的成药性。因此,新药研发成功的关键是选择正确的动物模型。nash药物临床不断受挫,临床前的动物数据难以转化为临床结果,说明当前的动物模型需要改进。当前的nash动物模型均不能够同时模拟nash的发病特征、发病进程及各阶段的病理特征。尤其值得关注的是,当前的nash动物模型存在一个共性的问题,即炎症反应轻微,难以诱导出严重的肝脏炎症反应。严重的肝脏炎症反应恰恰是nash区别于单纯性脂肪肝的显著标志,显然,当前的nash动物模型不利于临床前药物效果的评价。另外,临床有25%-40%的nash患者同时伴随心血管疾病,并且心血管疾病已成为nash患者死亡的主要因素。当前尚缺乏公认的能够反映nash患者心血管疾病共存特征的nash模型。因此,建立一种以严重的肝脏炎症反应和心血管疾病共存为显著特征的nash小鼠模型对于nash的药物研发具有重要意义。
技术实现要素:
4.为了解决上述技术问题,本发明提供一种基于pedf/ldlr双基因敲除的非酒精性脂肪性肝炎小鼠模型构建方法及应用。
5.为达上述目的,本发明采用如下的技术方案:
6.一种基于pedf/ldlr双基因敲除的非酒精性脂肪性肝炎小鼠模型的构建方法,其特征在于,包括以下构建步骤:
7.(1)利用pedf基因敲除小鼠与ldlr基因敲除小鼠进行交配,获得pedf/ldlr双基因
敲除小鼠;
8.(2)对pedf/ldlr双基因敲除小鼠进行高脂饲料诱导,获得非酒精性脂肪性肝炎小鼠模型。
9.进一步的,所述步骤(1)中pedf敲除小鼠和ldlr敲除小鼠均为c57bl/6j背景。
10.进一步的,所述步骤(2)中高脂饲料的营养素质量比组成为:蛋白质26.2%、碳水化合物26.3%、脂肪34.9%。
11.本发明还提供了上述非酒精性脂肪性肝炎小鼠模型的构建方法在动物模型构建领域的应用。
12.本发明还提供了上述非酒精性脂肪性肝炎小鼠模型的构建方法构建获得的小鼠模型在筛选或治疗代谢性疾病药物中的应用。
13.进一步的,所述代谢性疾病包括肥胖、高血脂、胰岛素抵抗、糖尿病、单纯性脂肪肝、非酒精性脂肪性肝炎、非酒精性脂肪肝相关肝纤维化、非酒精性脂肪肝相关肝癌和非酒精性脂肪肝伴随的心血管损伤。
14.进一步的,所述应用包括药物靶标的筛选、药物的筛选、药物的药效学评价和药物的安全性评价。
15.与现有技术相比,本发明具有如下有益效果:
16.本发明采用高脂饲料诱导,符合人类nash发病特征;早期发生肥胖、高血脂、胰岛素抵抗、高血糖、肝脏脂肪变性等单纯性脂肪肝表型,后期发生肝脏炎症反应、肝脏纤维化等nash表型,并有一定几率发生肝脏肿瘤,同时伴随严重的心血管损伤,尤其是肝脏炎症反应强烈,符合人类nash病变进程和病变特征。
17.本发明所述方法简单易行,能广泛推广。由于该模型能够更好的模拟人类nash的发病特征、病变进程和各阶段的病变特征,因此对于nash等代谢性疾病药物研发的临床前研究提供具有重要意义。
附图说明
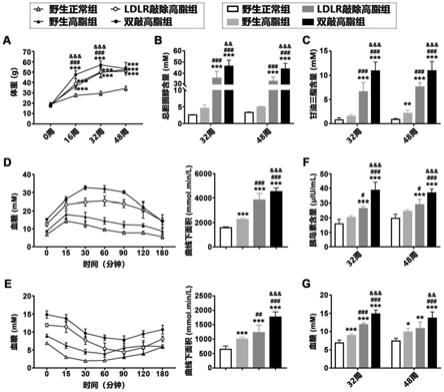
18.图1为实施例1中4组动物体重、血脂含量、葡萄糖耐量、胰岛素耐量、血清胰岛素含量及血糖检测结果图。
19.图2为实施例2中4组动物肝脏重量、肝体比、肝功酶水平、肝脏脂肪变性、肝脏炎症反应及肝脏纤维化评价结果图。
20.图3为实施例3中4组动物肝脏重量、肝体比、肝功酶水平、肝脏脂肪变性、肝脏炎症反应及肝脏纤维化评价结果图。
21.图4为实施例4中4组动物肝脏肿瘤发生数量统计及肿瘤的鉴定结果图。
22.图5为实施例5中4组动物主动脉内径、主动脉瓣血流峰、降支主动脉血流峰、主动脉斑块面积比例和心肌细胞大小检测结果图。
具体实施方式
23.以下实验用动物及饲养:
24.pedf敲除小鼠为c57bl/6j背景,由美国oklahoma university的马建兴教授课题组构建,并由中山大学中山医学院高国全教授课题组友情赠送。ldlr敲除小鼠为c57bl/6j
背景,引进于美国jackson实验室。pedf/ldlr双基因敲除小鼠由pedf敲除小鼠和ldlr敲除小鼠交配获得。
25.本发明所用实验动物均在中山大学疾病模式动物中心进行扩繁。本发明选用实验动物及分组如下:(1)野生正常组:雄性8周龄野生型c57bl/6j小鼠,常规饲料诱导;(2)野生高脂组:雄性8周龄野生型c57bl/6j小鼠,高脂饲料诱导;(3)ldlr敲除高脂组:雄性8周龄ldlr敲除小鼠,高脂饲料诱导;(4)双敲高脂组:雄性8周龄pedf/ldlr双基因敲除小鼠,高脂饲料诱导。动物于饲养期间自由饮水摄食,每12小时交替照明,温度18-21℃,湿度50%-70%。
26.动物血清及组织取材:
27.样本收集前,动物禁食不禁水12-16小时。样本收集时,小鼠称重,腹腔注射1%戊巴比妥钠,80mg/kg,待小鼠麻醉后,摘眼球取血并离心收集血清,随后将小鼠仰卧位固定于解剖板上,75%消毒酒精表面消毒。用手术剪剪开小鼠腹腔至胸腔,暴露内脏组织,剪开右心耳,于左心室进针灌注pbs至血液流净,剥离升支主动脉至髂动脉分支段的主动脉,剪下肝脏组织和/或肿瘤组织和/或心脏组织,将肝脏于pbs中漂洗至无血渍后称重。
28.病理组织处理:
29.取小鼠肝脏部分组织或肿瘤部分组织或心脏部分组织,于pbs中漂洗至无血渍,4%多聚甲醛中固定过夜;pbs洗3次,每次10分钟;25%乙醇、50%乙醇、75%乙醇、90%乙醇、无水乙醇(ⅰ)、无水乙醇(ⅱ)梯度脱水,各30分钟;二甲苯(ⅰ)、二甲苯(ⅱ)各15分钟;石蜡(ⅰ)、石蜡(ⅱ)各60分钟;脱水后,组织平放于石蜡中包埋;徕卡石蜡切片机切片,片厚5μm。
30.取小鼠主动脉,于pbs中漂洗至无血渍,4%多聚甲醛中固定过夜,后续行主动脉整体油红o染色。
31.实施例1
32.本实施例对上述4组动物的体重、血脂含量、葡萄糖耐量、胰岛素耐量、血清胰岛素含量及血糖进行测定。
33.上述4组动物分别在0周、16周、32周和48周时称重,称重前禁食12-16小时;在诱导32周时进行葡萄糖耐量试验和胰岛素耐量试验,具体操作为:动物禁食12-16小时,分别腹腔注射1g/kg的葡萄糖或1u/kg的胰岛素,并在注射后的0、15、30、60、90、120和180分钟时测定血糖,绘制血糖变化曲线并计算曲线下面积;在诱导32周和48时,对动物进行禁食12-16小时,利用血糖仪测定血糖,并解剖小鼠收集血清样本,利用商业化试剂盒检测血清总胆固醇、甘油三酯和胰岛素含量。
34.结果如图1所示,其中a:体重;b:血清总胆固醇含量;c:血清总甘油三酯含量;d:葡萄糖耐量试验的血糖变化曲线及曲线下面积统计;e:胰岛素耐量试验的血糖变化曲线及曲线下面积统计;f:血清胰岛素含量;g:血糖;*,p<0.05,vs野生正常组;**,p<0.01,vs野生正常组;***,p<0.001,vs野生正常组;#,p<0.05,vs野生高脂组;##,p<0.01,vs野生高脂组;###,p<0.001,vs野生高脂组;&&,p<0.01,vs ldlr敲除高脂组;&&&,p<0.001,vs ldlr敲除高脂组。
35.非酒精性脂肪性肝炎常伴随肥胖、血脂紊乱、胰岛素抵抗和高血糖。图1结果表明,诱导32周和48周时,相对于ldlr敲除高脂组,双敲高脂组小鼠表现出更严重的肥胖、脂代谢
紊乱、胰岛素抵抗和高血糖。
36.实施例2
37.本实施例在诱导32周时,对上述4组动物的肝脏重量、肝体比、肝功酶水平、肝脏脂肪变性、肝脏炎症反应及肝脏纤维化进行评价。
38.诱导32周时,动物禁食12-16小时后麻醉处死,收集血清和组织样本,并对肝脏组织进行称重;利用商业化试剂盒检测血清谷丙转氨酶和谷草转氨酶水平;并对肝脏组织石蜡切片进行he染色和masson染色,以评价肝脏病变情况。
39.结果如图2所示,其中a:肝脏大体图片;b:肝脏重量;c:肝体比;d:血清谷丙转氨酶水平;e:血清谷草转氨酶水平;f:he染色;g:肝脏脂肪变性打分;h:肝脏气球样变性打分;i:肝脏小叶内炎症打分;j:masson染色;k:肝脏纤维化打分;*,p<0.05,vs野生正常组;**,p<0.01,vs野生正常组;***,p<0.001,vs野生正常组;#,p<0.05,vs野生高脂组;##,p<0.01,vs野生高脂组;###,p<0.001,vs野生高脂组;&&,p<0.01,vs ldlr敲除高脂组;&&&,p<0.001,vs ldlr敲除高脂组。
40.肝脏石蜡切片he染色,主要步骤为:60℃烘烤30分钟
→
二甲苯(ⅰ)10分钟
→
二甲苯(ⅱ)10分钟
→
无水乙醇(ⅰ)3分钟
→
无水乙醇(ⅱ)3分钟
→
95%乙醇(ⅰ)1分钟
→
70%乙醇1分钟
→
蒸馏水2分钟
→
苏木素液5-10分钟
→
流水洗去苏木素1-3秒钟
→
1%盐酸酒精1-2秒钟
→
流水冲洗20分钟
→
蒸馏水过洗1-2秒钟
→
0.5%伊红2分钟
→
蒸馏水稍洗1-2秒钟
→
95%乙醇(ⅱ)2-3秒钟
→
无水乙醇(ⅲ)3-5秒钟
→
无水乙醇(ⅳ)5-10秒钟
→
二甲苯(ⅰ)2分钟
→
二甲苯(ⅱ)2分钟
→
中性树胶封片观察。
41.肝脏石蜡切片masson染色,主要步骤为:60℃烘烤30分钟
→
二甲苯(ⅰ)10分钟
→
二甲苯(ⅱ)10分钟
→
无水乙醇(ⅰ)3分钟
→
无水乙醇(ⅱ)3分钟
→
95%乙醇(ⅰ)1分钟
→
70%乙醇1分钟
→
蒸馏水2分钟
→
weigert氏铁苏木素染5分钟
→
流水洗去苏木素1-3秒钟
→
1%盐酸酒精1-2秒钟
→
流水冲洗20分钟
→
蒸馏水过洗1-2秒钟
→
丽春红酸性品红液染5-10分钟
→
蒸馏水快速漂洗数秒
→
磷钼酸水溶液处理约3-5分钟
→
苯胺蓝液复染分钟
→
1%冰醋酸处理分钟
→
95%乙醇(ⅱ)2-3秒钟
→
无水乙醇(ⅲ)3-5秒钟
→
无水乙醇(ⅳ)5-10秒钟
→
二甲苯(ⅰ)2分钟
→
二甲苯(ⅱ)2分钟
→
中性树胶封片观察。
42.组织学评价系统基于美国nash临床研究网络评分系统(nash-crn)进行了适当调整。脂肪变性评分标准为(按脂变肝细胞比例计算):0(<5%),1(5-33%),2(>33-66%),3(>66-80%),4(>80%);肝细胞气球样变评分标准为:0(无),1(少见),2(多见),3(极多见);小叶内炎症评分标准为(按200倍镜下炎症坏死灶数量和面积计算):0(无),1(<2),2(2-4),3(>4),4(含大面积炎症坏死灶);纤维化评分标准为:0(无),1(窦周纤维化或门脉周围纤维化),2(窦周纤维化合并门脉周围纤维化),3(桥接纤维化),4(肝硬化)。
43.非酒精性脂肪性肝炎常伴随肝脏肿大、肝功酶升高、肝脏脂肪变性、肝细胞气球样病变、肝脏小叶内炎症浸润和肝脏纤维化。图2结果表明,诱导32周时,相对于ldlr敲除高脂组,双敲高脂组小鼠表现出更严重的肝脏肿大、肝功酶升高、肝脏脂肪变性和肝细胞气球样病变,但肝脏小叶内炎症浸润和肝脏纤维化没有显著改变。
44.实施例3
45.本实施例在诱导48周时,对上述4组动物的肝脏重量、肝体比、肝功酶水平、肝脏脂肪变性、肝脏炎症反应及肝脏纤维化进行评价。
46.诱导48周时,动物禁食12-16小时后麻醉处死,收集血清和组织样本,并对肝脏组织进行称重;利用商业化试剂盒检测血清谷丙转氨酶和谷草转氨酶水平;并对肝脏组织石蜡切片进行he染色和masson染色,以评价肝脏病变情况。
47.结果如图3所示,其中a:肝脏重量;b:肝体比;c:血清谷丙转氨酶水平;d:血清谷草转氨酶水平;e:he染色;f:cd45免疫组化染色;g:肝脏脂肪变性打分;h:肝脏气球样变性打分;i:肝脏小叶内炎症打分;j:masson染色;k:肝脏纤维化打分;*,p<0.05,vs野生正常组;**,p<0.01,vs野生正常组;***,p<0.001,vs野生正常组;##,p<0.01,vs野生高脂组;###,p<0.001,vs野生高脂组;&&,p<0.01,vs ldlr敲除高脂组;&&&,p<0.001,vs ldlr敲除高脂组。
48.肝脏石蜡切片cd45免疫组化染色,主要步骤为:60℃烘烤30分钟
→
二甲苯(ⅰ)10分钟
→
二甲苯(ⅱ)10分钟
→
无水乙醇(ⅰ)3分钟
→
无水乙醇(ⅱ)3分钟
→
95%乙醇(ⅰ)1分钟
→
70%乙醇1分钟
→
蒸馏水2分钟
→
3%过氧化氢10分钟
→
pbs洗三次(10分钟/次)
→
95℃快速抗原修复液10分钟
→
pbs洗三次(10分钟/次)
→
5%bsa室温封闭30分钟
→
4℃一抗孵育过夜
→
pbs洗三次(10分钟/次)
→
二抗室温孵育60分钟
→
pbs洗三次(10分钟/次)
→
dab显色液室温孵育至显色适中
→
pbs洗三次(10分钟/次)
→
苏木素液5-10分钟
→
流水洗去苏木素1-3秒钟
→
1%盐酸酒精1-2秒钟
→
流水冲洗20分钟
→
中性树胶封片观察。
49.cd45是炎症标志物。图3结果表明,诱导48周时,相对于ldlr敲除高脂组,双敲高脂组小鼠的肝脏脂肪变性和肝细胞气球样病变没有显著差异,但仍表现出更严重的肝脏肿大和肝功酶升高,并且肝脏小叶内炎症浸润和肝脏纤维化显著而强烈的升高。
50.实施例4
51.本实施例在诱导48周时,对上述4组动物的肝脏肿瘤发生数量进行统计并对肿瘤进行鉴定。
52.在诱导48周时,随机选择双敲高脂组小鼠3只,禁食8小时,腹腔注射1%戊巴比妥钠,80mg/kg,待小鼠麻醉后,尾静脉注射5μci/g的18f-fdg,并于45分钟之后进行pet/ct检测,观察肝脏成瘤情况;诱导48周时,动物禁食12小时后麻醉处死,收集血清和组织样本,统计各组死亡及发生肝脏肿瘤的小鼠数量,并对发生肿瘤的肝脏组织进行大体拍照;对肝脏组织石蜡切片进行he染色以及afp、pcna、cd31的免疫组化染色,以进一步明确肿瘤病变。
53.结果如图4所示,其中a:肿瘤发生数量统计;b:肿瘤小鼠pet/ct结果;c:肿瘤组织大体图片;d:肿瘤组织he染色;e:肿瘤组织afp染色;f:肿瘤组织pcna免疫组化;g:肿瘤组织cd31免疫组化。
54.非酒精性脂肪性肝炎会有部分发展为肝细胞癌,表现出肿瘤部位糖摄取增高、肿瘤组织异常增生、afp阳性、血管增生等特征,pcna和cd31分别是细胞增殖和血管标志物,可用来评价细胞增殖和血管增生情况。图4结果表明,诱导48周时,相对于ldlr敲除高脂组,双敲高脂组小鼠表现出更高的肿瘤发生率,肿瘤组织表现出显著的糖摄取增高、异常增生、afp阳性以及血管增生等肿瘤特征。
55.实施例5
56.本实施例在诱导48周时,对上述4组动物的心血管损伤情况进行评价。
57.诱导48周时,利用vevo 2100小动物超声仪检测小鼠心脏功能。小鼠异氟烷吸入麻醉,在麻醉状态下用脱毛膏对小鼠胸部脱毛,仰卧位置于恒温加热板上,持续性吸入异氟
烷。小鼠四肢与心电图电极相连,用于检测心率并记录心电图。30mhz探头,于小鼠左胸骨部位探测。采用m型超声测量心脏舒张期和收缩期的流出道处主动脉内径。采用脉冲多普勒测定主动脉瓣出血流峰及降支主动脉血流峰。
58.诱导48周时,动物禁食12-16小时后麻醉处死,收集主动脉及心脏组织。对主动脉进行整体油红o染色,以评价主动脉粥样硬化斑块病变情况;对心脏组织石蜡切片进行he染色,以评价心肌肥大情况。
59.主动脉整体油红o染色,主要步骤为:取玻璃后的主动脉,于pbs中漂洗至无血渍,4%多聚甲醛中固定过夜,pbs洗3次,每次10分钟。将主动脉沿中轴剪开后固定于黑胶板上,油红o工作液染色10-15分钟,pbs洗至无残留油红o染液,于徕卡体式显微镜下拍照,并利用image j软件统计斑块面积比例。
60.心脏石蜡切片he染色,主要步骤为:60℃烘烤30分钟
→
二甲苯(ⅰ)10分钟
→
二甲苯(ⅱ)10分钟
→
无水乙醇(ⅰ)3分钟
→
无水乙醇(ⅱ)3分钟
→
95%乙醇(ⅰ)1分钟
→
70%乙醇1分钟
→
蒸馏水2分钟
→
苏木素液5-10分钟
→
流水洗去苏木素1-3秒钟
→
1%盐酸酒精1-2秒钟
→
流水冲洗20分钟
→
蒸馏水过洗1-2秒钟
→
0.5%伊红2分钟
→
蒸馏水稍洗1-2秒钟
→
95%乙醇(ⅱ)2-3秒钟
→
无水乙醇(ⅲ)3-5秒钟
→
无水乙醇(ⅳ)5-10秒钟
→
二甲苯(ⅰ)2分钟
→
二甲苯(ⅱ)2分钟
→
中性树胶封片观察。
61.结果如图5所示,其中a:主动脉内径超声图谱;b:舒张期主动脉内径统计;c:收缩期主动脉内径统计;d:主动脉瓣血流峰超声图谱;e:主动脉瓣血流峰统计;f:降支主动脉血流峰超声图谱;e:降支主动脉血流峰统计;f:主动脉整体油红o染色;g:主动脉斑块面积比例统计;h:心脏组织he染色;i:心肌细胞面积变化统计;*,p<0.05,vs野生正常组;**,p<0.01,vs野生正常组;***,p<0.001,vs野生正常组;#,p<0.05,vs野生高脂组;##,p<0.01,vs野生高脂组;###,p<0.001,vs野生高脂组;&&,p<0.01,vs ldlr敲除高脂组;&&&,p<0.001,vs ldlr敲除高脂组。
62.临床有25%-40%的nash患者同时伴随心血管疾病,并且心血管疾病已成为nash患者死亡的主要因素。图5结果表明,诱导48周时,相对于ldlr敲除高脂组,双敲高脂组小鼠表现出更严重的以动脉粥样硬化为特征的血管损伤。更重要的是,野生正常组、野生高脂组和ldlr敲除高脂组小鼠均没有表现出心肌肥大表型,而双敲高脂组则表现出显著的心肌肥大,提示有心肌损伤的存在。
63.以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1