一种原球茎途径的见血青快速繁殖方法
1.本发明涉及见血青栽培技术领域,尤其涉及一种原球茎途径的见血青快速繁殖方法。
背景技术:
2.见血青,多年生草本药材,可用于园林观赏植物,为兰科(orchidaceae)羊耳蒜属(liparis)植物脉羊耳兰(liparis nervosa(thunb.)lindl.)的全草,又名矮胖儿、羊耳蒜等。见血青为常用中药材,具有止血凝血、镇痛、抑菌抗炎、强抗氧化、降血糖、抗肿瘤等多种功效。见血青提取物质的止血活性与云南白药相近。目前市面上的见血青来源主要依赖于野生资源,由于人为过度采挖,野生资源遭破坏日益严重,已经面临枯竭,其已被收入《国家重点保护野生植物名录》第二批名单,被定为国家二级保护植物。
3.现有技术中已经记载的见血青繁殖方法当中,利用见血青茎段侧芽萌发诱导产生愈伤组织的快繁方式存在增殖倍数低、生产周期长的问题且培养基成分复杂,成本较高。利用野生见血青种子无菌培养萌发产生丛生芽,出现了种子萌发率低的问题,主要用于离体保存,未能用于大规模生产。
4.因此,如何通过原球茎途径实现见血青快速繁殖,以解决见血青的繁殖周期长,种植成本高的技术问题,是本领域技术人员亟需解决的问题。
技术实现要素:
5.本发明的目的在于提供一种原球茎途径的见血青快速繁殖方法,利用原球茎途径的组培扩繁方式生产见血青种苗。通过利用见血青果荚中种子数量多易获取,提高种子萌发率、原球茎诱导率及增殖率,提高增殖倍数、缩短生产周期、降低培养基成本,建立完善高效的种子原球茎扩繁体系,为实现工厂化育苗,大大解决资源短缺问题提供技术支持。
6.为了实现上述发明目的,本发明提供以下技术方案:
7.本发明提供了一种原球茎途径的见血青快速繁殖方法,包括如下步骤:
8.(1)将见血青种子接种至原球茎诱导培养基中,进行原球茎诱导培养,得到见血青原球茎;
9.(2)将步骤(1)得到的见血青原球茎接种至增殖分化培养基中,进行芽增殖培养,得到见血青增殖芽;
10.(3)将步骤(2)得到的见血青增殖芽接种至生根培养基中,进行生根培养,得到见血青生根苗;
11.(4)将步骤(3)得到的见血青生根苗炼苗、消毒、移栽至栽培基质。
12.优选的,步骤(1)所述原球茎诱导培养的时间为25~35d,所述原球茎诱导培养的温度为23~27℃。
13.优选的,步骤(2)所述芽增殖培养的时间为15~25d,温度为23~27℃,光照强度为2500~3500lx,光照时间为14~18h/d。
14.优选的,步骤(3)所述生根培养的时间为15~25d,温度为23~27℃,光照强度为2500~3500lx,光照时间为14~18h/d。
15.优选的,步骤(4)所述炼苗的时间为2~3d、所述炼苗的温度为23~27℃,所述炼苗的湿度为70~80%。
16.优选的,步骤(4)所述的消毒方法是用800倍多菌灵浸泡见血青根部2~4min。
17.优选的,步骤(1)所述原球茎诱导培养基为1/2ms+naa 0.3~0.7mg
·
l-1
+zt 0.8~1.2mg
·
l-1
+ac 0.8~1.2g
·
l-1
+ag 6.0~8.0g
·
l-1
+su 28.0~32.0g
·
l-1
。
18.优选的,步骤(2)所述增殖分化培养基为ms+6-ba1.8~2.2mg
·
l-1
+naa 0.23~0.27mg
·
l-1
+花宝1号0.8~1.2mg
·
l-1
+椰汁130~170ml
·
l-1
+香蕉泥15~25g
·
l-1
+土豆泥25~35g
·
l-1
+ac 0.8~1.2g
·
l-1
+ag 6.0~8.0g
·
l-1
+su 28.0~32.0g
·
l-1
。
19.优选的,步骤(3)所述生根培养基为1/2ms+6-ba 1.8~2.2mg
·
l-1
+naa 1.8~2.2mg
·
l-1
+椰汁45~55ml
·
l-1
+香蕉泥8~12g
·
l-1
+ac 0.8~1.2g
·
l-1
+ag 6.0~8.0g
·
l-1
+su 28.0~32.0g
·
l-1
。
20.优选的,步骤(4)所述栽培基质为泥炭土、蛭石和珍珠岩;所述泥炭土、蛭石和珍珠岩之间的质量比为3~5∶1~3∶1~3。
21.与现有技术相比,本发明具有如下的有益效果:
22.1、本发明方法原材料为见血青种子,一个见血青种荚中有几万至几百万粒种子,来源多易获取,可在短时间内解决资源短缺的问题,具有重要的生态保护意义,可为大规模生产提供技术支持。
23.2、野生见血青的种子萌发率低,生产缓慢,有关见血青原球茎途径的组培快速繁殖技术未见报道。本发明方法增殖倍数远远高于已有的茎段愈伤组织途径的快繁,且实现增殖、分化一步完成,生根率高,植株健壮、长势好,生长周期短,培养基成本低,可明显降低成本,可用于规模化、产业化生产。
24.3、本发明方法的快繁技术,可直接用于基地生产,具有十分广阔的产业化发展前景。本发明创新性强,技术含量高,公益性强,对于见血青的进一步药效研究及潜在新抗癌、新降糖药物开发提供物质基础。
25.4、本发明方法包括外植体的选择与消毒处理、原球茎诱导培养,不定芽增殖及分化培养,生根培养和驯化移栽。本发明是为了解决见血青种子自然条件下发芽率低、生长缓慢,目前组培技术增殖系数低、培养基成分复杂、生产周期长、成本高等问题,为工业化大规模生产提供技术支撑。本发明增殖倍数可达8.2倍,不定芽增殖和分化一步完成,扩繁周期短,从芽到成苗仅需20d左右,成活率高达96%以上,苗生长健壮、长势好。对解决见血青资源短缺问题,保护野生资源有重要意义。
26.5、本发明将将消毒后见血青种子接种至诱导培养基,原球茎诱导率高达96%
27.本发明将诱导产生的原球茎接种至增殖分化培养基,增殖倍数可达8.2倍,且不定芽多,生长快,培养后期叶片宽大,生长势旺;
28.本发明将长至2cm左右的不定芽接种至生根培养基,生根率可高达84%,生根条数平均可达6.2条,根粗壮、生长状态旺盛。
附图说明
29.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
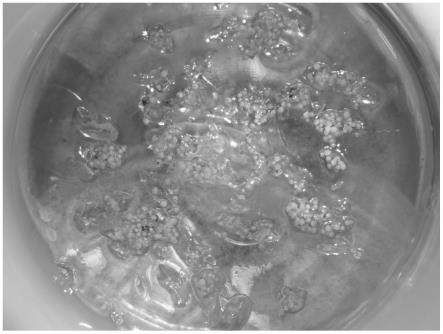
30.图1为见血青种子萌发图;
31.图2为见血青原球茎;
32.图3为见血青原球茎增殖图;
33.图4为见血青分化的芽(开始分化);
34.图5为见血青分化的芽(分化完成);
35.图6为见血青芽生根图。
具体实施方式
36.本发明提供了一种原球茎途径的见血青快速繁殖方法,包括如下步骤:
37.(1)将见血青种子接种至原球茎诱导培养基中,进行原球茎诱导培养,得到见血青原球茎;
38.(2)将步骤(1)得到的见血青原球茎接种至增殖分化培养基中,进行芽增殖培养,得到见血青增殖芽;
39.(3)将步骤(2)得到的见血青增殖芽接种至生根培养基中,进行生根培养,得到见血青生根苗;
40.(4)将步骤(3)得到的见血青生根苗炼苗、消毒、移栽至栽培基质。
41.在本发明中,步骤(1)所述原球茎诱导培养的时间为25~35d;优选为27~33d;进一步优选为29~31d;更优选为30d。
42.在本发明中,步骤(1)所述原球茎诱导培养的温度为23~27℃;优选为24~26℃;进一步优选为25℃。
43.在本发明中,步骤(1)所述原球茎诱导培养基为1/2ms+naa 0.3~0.7mg
·
l-1
+zt 0.8~1.2mg
·
l-1
+ac 0.8~1.2g
·
l-1
+ag 6.0~8.0g
·
l-1
+su 28.0~32.0g
·
l-1
;优选为1/2ms+naa 0.4~0.6mg
·
l-1
+zt 0.9~1.1mg
·
l-1
+ac 0.9~1.1g
·
l-1
+ag 7.0g
·
l-1
+su 29.0~31.0g
·
l-1
;进一步优选为1/2ms+naa 0.5mg
·
l-1
+zt 1.0mg
·
l-1
+ac 1.0g
·
l-1
+ag 7g
·
l-1
+su 30.0g
·
l-1
。
44.在本发明中,su为碳源蔗糖的缩写,ag为凝固剂琼脂粉的缩写;ac为活性炭缩写;基本培养基为ms,植物激素为ba、zt、naa,花宝1号;天然有机物为成熟度达80%以上的香蕉、土豆、椰汁。
45.在本发明中,步骤(2)所述芽增殖培养的时间为15~25d;优选为17~23d;进一步优选为19~21d;更优选为20d。
46.在本发明中,步骤(2)所述芽增殖培养的温度为23~27℃;优选为24~26℃;进一步优选为25℃。
47.在本发明中,步骤(2)所述芽增殖培养的光照强度为2500~3500lx;优选为2700~3300lx;进一步优选为2900~3100lx;更优选为3000lx。
48.在本发明中,步骤(2)所述芽增殖培养的光照时间独立为14~18h/d;优选为15~17h/d;进一步优选为16h/d。
49.在本发明中,步骤(2)所述增殖分化培养基为ms+6-ba1.8~2.2mg
·
l-1
+naa 0.23~0.37mg
·
l-1
+花宝1号0.8~1.2mg
·
l-1
+椰汁130~170ml
·
l-1
+香蕉泥15~25g
·
l-1
+土豆泥25~35g
·
l-1
+ac 0.8~1.2g
·
l-1
+ag 6.0~8.0g
·
l-1
+su 28.0~32.0g
·
l-1
;
50.优选为ms+6-ba1.9~2.1mg
·
l-1
+naa 0.24~0.26mg
·
l-1
+花宝1号0.9~1.1mg
·
l-1
+椰汁140~160ml
·
l-1
+香蕉泥17~23g
·
l-1
+土豆泥27~33g
·
l-1
+ac 0.9~1.1g
·
l-1
+ag 7.0g
·
l-1
+su 29.0~31.0g
·
l-1
;
51.进一步优选为ms+6-ba2.0 mg
·
l-1
+naa 0.25mg
·
l-1
+花宝1号1.0mg
·
l-1
+椰汁150ml
·
l-1
+香蕉泥19~21g
·
l-1
+土豆泥29~31g
·
l-1
+ac 1.0g
·
l-1
+ag 7.0g
·
l-1
+su 30.0g
·
l-1
;
52.更优选为ms+6-ba2.0 mg
·
l-1
+naa 0.25mg
·
l-1
+花宝1号1.0mg
·
l-1
+椰汁150ml
·
l-1
+香蕉泥20g
·
l-1
+土豆泥30g
·
l-1
+ac 1.0g
·
l-1
+ag 7.0g
·
l-1
+su 30.0g
·
l-1
。
53.在本发明中,步骤(3)所述生根培养的时间为15~25d;优选为17~23d;进一步优选为19~21d;更优选为20d。
54.在本发明中,步骤(2)所述生根培养的温度为23~27℃;优选为24~26℃;进一步优选为25℃。
55.在本发明中,步骤(2)所述生根培养的光照强度为2500~3500lx;优选为2700~3300lx;进一步优选为2900~3100lx;更优选为3000lx。
56.在本发明中,步骤(2)所述生根培养的光照时间独立为14~18h/d;优选为15~17h/d;进一步优选为16h/d。
57.在本发明中,步骤(4)所述炼苗的方法为将步骤(3)得到的见血青生根苗放入温室驯化;
58.在本发明中,步骤(4)所述炼苗的时间为2~3d;优选为3d。
59.在本发明中,步骤(4)所述炼苗的温度为23~27℃;优选为24~26℃;进一步优选为25℃。
60.在本发明中,步骤(4)所述炼苗的湿度为70~80%;优选为72~78%;进一步优选为74~76%;更优选为75%。
61.在本发明中,步骤(4)所述的消毒方法是用800倍多菌灵浸泡见血青根部2~4min;优选为3min。
62.在本发明中,步骤(3)所述生根培养基为1/2ms+6-ba 1.8~2.2mg
·
l-1
+naa 1.8~2.2mg
·
l-1
+椰汁45~55ml
·
l-1
+香蕉泥8~12g
·
l-1
+ac 0.8~1.2g
·
l-1
+ag 6.0~8.0g
·
l-1
+su 28.0~32.0g
·
l-1
;
63.优选为1/2ms+6-ba 1.9~2.1mg
·
l-1
+naa 1.9~2.1mg
·
l-1
+椰汁47~53ml
·
l-1
+香蕉泥9~11g
·
l-1
+ac 0.9~1.1g
·
l-1
+ag 7.0g
·
l-1
+su 29.0~31.0g
·
l-1
;
64.进一步优选为1/2ms+6-ba 2.0mg
·
l-1
+naa 2.0mg
·
l-1
+椰汁49~51ml
·
l-1
+香蕉泥10g
·
l-1
+ac1.0 g
·
l-1
+ag7.0 g
·
l-1
+su30.0g
·
l-1
;
65.更优选为1/2ms+6-ba 2.0mg
·
l-1
+naa 2.0mg
·
l-1
+椰汁50ml
·
l-1
+香蕉泥10g
·
l-1
+ac1.0 g
·
l-1
+ag 7.0g
·
l-1
+su 30.0g
·
l-1
。
66.在本发明中,步骤(4)所述栽培基质为泥炭土、蛭石和珍珠岩;所述泥炭土、蛭石和珍珠岩之间的质量比为3~5∶1~3∶1~3;优选为4∶1~3∶1~3;进一步优选为4∶2∶1~3;更优选为4∶2∶2。
67.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
68.在以下实施例中,su为碳源蔗糖的缩写,ag为凝固剂琼脂粉的缩写;ac为活性炭缩写;基本培养基为ms,植物激素为ba、zt、naa,花宝1号;天然有机物为成熟度达80%以上的香蕉、土豆、椰汁。
69.实施例1
70.一种原球茎途径的见血青快速繁殖方法,步骤如下:
71.(1)外植体的选取与消毒:选择生长发育良好、没有病虫害的见血青植株,在果荚成熟但未开裂之前采摘其果荚;在流动的自来水下冲洗干净表面附着物,在添加有洗洁精的洗涤液中用软毛刷轻轻搅拌10min,自来水冲洗干净,用吸水纸吸干表面水分;在超净工作台,将经过初步处理的蒴果用75%乙醇进行表面消毒30s,用无菌水冲洗3次,用10%次氯酸钠溶液消毒15min,再用无菌水反复水洗3次,用灭菌滤纸吸干果荚表面水分,备用;
72.(2)将步骤(1)灭菌后果荚用无菌镊子撕开,将里面的种子抖入无菌培养皿中,用无菌接种针轻点种子将见血青种子接种至原球茎诱导培养基23℃培养25d,要求均匀平铺,每瓶1个果荚,不直光照射,但有散射光,进行原球茎诱导培养,得到见血青原球茎;
73.(3)将步骤(2)得到的见血青原球茎接种至增殖分化培养基中,要求10个/瓶,进行芽增殖培养,得到见血青增殖芽;
74.(4)将步骤(3)得到的见血青增殖芽接种至生根培养基中,要求10个/瓶,进行生根培养,得到见血青生根苗;
75.(5)将步骤(4)得到的见血青生根苗打开瓶盖,23℃,湿度70%炼苗2d使其慢慢适宜自然环境,用镊子取出瓶苗,清洗干净残留的培养基,800倍多菌灵浸泡见血青根部消毒2min、移栽至栽培基质(泥炭土、蛭石和珍珠岩;三者的质量比为3∶1∶1);
76.(6)移栽后管理:打开遮阳网遮阴,温度控制在23℃,湿度保持在70%,土壤湿润即可,可不浇水,避免阳光直射,1周后可获得生长健壮的完整植株;
77.步骤(3)所述芽增殖培养和步骤(4)所述生根培养的时间独立为15d,温度独立为23℃;
78.步骤(3)所述芽增殖培养和步骤(4)所述生根培养的光照强度独立为2500lx,光照时间独立为14h/d;
79.步骤(2)所述原球茎诱导培养基为1/2ms+naa 0.3mg
·
l-1
+zt 0.8mg
·
l-1
+ac 0.8g
·
l-1
+ag 6.0g
·
l-1
+su 28.0g
·
l-1
;ph6.0;
80.步骤(3)所述增殖分化培养基为ms+6-ba1.8mg
·
l-1
+naa 0.23mg
·
l-1
+花宝1号0.8mg
·
l-1
+椰汁130ml
·
l-1
+香蕉泥15g
·
l-1
+土豆泥25g
·
l-1
+ac 0.8g
·
l-1
+ag 6.0g
·
l-1
+su 28.0g
·
l-1
;ph6.0;
81.步骤(4)所述生根培养基为1/2ms+6-ba 1.8mg
·
l-1
+naa 1.8mg
·
l-1
+椰汁45ml
·
l-1
+香蕉泥8g
·
l-1
+ac 0.8g
·
l-1
+ag 6.0g
·
l-1
+su 28.0g
·
l-1
;ph6.0;
82.培养基的消毒处理方法为:培养基分装于pc组培瓶中,每瓶培养基厚度为1.0cm;
将蒸馏水装于玻璃瓶中至2/3体积;将滤纸用信封包裹封口;121℃灭菌20min,自然冷却备用。
83.实施例2
84.一种原球茎途径的见血青快速繁殖方法,步骤如下:
85.(1)外植体的选取与消毒:选择生长发育良好、没有病虫害的见血青植株,在果荚成熟但未开裂之前采摘其果荚;在流动的自来水下冲洗干净表面附着物,在添加有洗洁精的洗涤液中用软毛刷轻轻搅拌20min,自来水冲洗干净,用吸水纸吸干表面水分;在超净工作台,将经过初步处理的蒴果用75%乙醇进行表面消毒60s,用无菌水冲洗5次,用10%次氯酸钠溶液消毒25min,再用无菌水反复水洗5次,用灭菌滤纸吸干果荚表面水分,备用;
86.(2)将步骤(1)灭菌后果荚用无菌镊子撕开,将里面的种子抖入无菌培养皿中,用无菌接种针轻点种子将见血青种子接种至原球茎诱导培养基27℃培养35d,要求均匀平铺,每瓶1个果荚,不直光照射,但有散射光,进行原球茎诱导培养,得到见血青原球茎;
87.(3)将步骤(2)得到的见血青原球茎接种至增殖分化培养基中,要求10个/瓶,进行芽增殖培养,得到见血青增殖芽;
88.(4)将步骤(3)得到的见血青增殖芽接种至生根培养基中,要求10个/瓶,进行生根培养,得到见血青生根苗;
89.(5)将步骤(4)得到的见血青生根苗打开瓶盖,27℃,湿度80%炼苗3d,使其慢慢适宜自然环境,用镊子取出瓶苗,清洗干净残留的培养基,800倍多菌灵浸泡见血青根部消毒4min、移栽至栽培基质(泥炭土、蛭石和珍珠岩;三者的质量比为5∶3∶3);
90.(6)移栽后管理:打开遮阳网遮阴,温度控制在27℃,湿度保持在80%,土壤湿润即可,可不浇水,避免阳光直射,1周后可获得生长健壮的完整植株;
91.步骤(3)所述芽增殖培养和步骤(4)所述生根培养的时间独立为25d,温度独立为27℃;
92.步骤(3)所述芽增殖培养和步骤(4)所述生根培养的光照强度独立为3500lx,光照时间独立为18h/d;
93.步骤(2)所述原球茎诱导培养基为1/2ms+naa 0.7mg
·
l-1
+zt 1.2mg
·
l-1
+ac 1.2g
·
l-1
+ag 8.0g
·
l-1
+su 32.0g
·
l-1
;ph6.0;
94.步骤(3)所述增殖分化培养基为ms+6-ba2.2 mg
·
l-1
+naa 0.27mg
·
l-1
+花宝1号1.2mg
·
l-1
+椰汁170ml
·
l-1
+香蕉泥25g
·
l-1
+土豆泥35g
·
l-1
+ac 1.2g
·
l-1
+ag 8.0g
·
l-1
+su 32.0g
·
l-1
;ph6.0;
95.步骤(4)所述生根培养基为1/2ms+6-ba 2.2mg
·
l-1
+naa 2.2mg
·
l-1
+椰汁55ml
·
l-1
+香蕉泥12g
·
l-1
+ac1.2 g
·
l-1
+ag 8.0g
·
l-1
+su 32.0g
·
l-1
;ph6.0;
96.培养基的消毒处理方法为:培养基分装于pc组培瓶中,每瓶培养基厚度为1.0cm;将蒸馏水装于玻璃瓶中至2/3体积;将滤纸用信封包裹封口;121℃灭菌20min,自然冷却备用。
97.实施例3
98.一种原球茎途径的见血青快速繁殖方法,步骤如下:
99.(1)外植体的选取与消毒:选择生长发育良好、没有病虫害的见血青植株,在果荚成熟但未开裂之前采摘其果荚;在流动的自来水下冲洗干净表面附着物,在添加有洗洁精
ba最优水平为0,naa的最优水平为0.5mg
·
l-1
,zt的最优水平为1.0mg
·
l-1
,所以可不添加6-ba。
117.表1不同激素配比对原球茎诱导影响的多重比较
[0118][0119]
注:++++:深绿色,健壮,长势快;+++:绿色,较健壮,长势较快;++:黄绿色,长势一般;+:黄绿色,细弱长势慢;不同小写字母代表差异显著(p《0.05)
[0120]
表2不同激素配比对原球茎诱导影响的极差分析和显著分析
[0121][0122][0123]
注:差异显著用“*”表示,差异极显著用“**”表示
[0124]
k是指水平1的和的平均值,数据分析的表示方法,r为极差,下同
[0125]
实施例5见血青种子原球茎增殖及分化培养基筛选
[0126]
对比试验:为建立扩繁体系,需进一步探索原球茎增殖方法。通过对比试验得到见血青最佳的原球茎增殖培养基。
[0127]
以实施例3为基础,在配制增殖分化培养基时,设置不同6-ba、zt、naa、花宝1号、椰汁、香蕉泥、土豆泥的添加浓度,其他试验条件均与实施例3相同。观察不同试验组对见血青的生长影响,具体方案见表3。将长至0.2~0.3cm大小的原球茎接种至添加不同试验组的培养基中,25d后观察其不定芽分化情况。
[0128]
增殖倍数=增殖后总数/有效接种总数(含新个体的总数)
[0129]
由表3所知,当6-ba浓度为2.0mg/l,zt浓度为0.5mg/l,naa浓度为0.25mg/l,花宝1号用量为1.0g/l,椰汁用量为150ml/l,香蕉泥用量为20g/l,土豆泥用量为30g/l时,原球茎
增殖倍数最高,可达8.2倍,显著高于其他处理,且分化芽数量多,叶片宽大,生长势旺。
[0130]
由表4进一步极差分析和显著性可知,促进见血青种子原球茎增殖及分化时,zt可不添加,6-ba添加量为2.0mg/l,naa添加量为0.25mg/l,花宝1号添加量为1.0mg/l,椰汁添加量为150ml/l,香蕉泥添加量为20g/l,土豆泥添加量为30g/l。
[0131]
表3不同处理对原球茎增殖影响的多重比较
[0132][0133][0134]
注:+++++:芽多,生长快,叶片宽大,生长势旺;++++:大芽较多,生长较快,生长势旺;+++:大芽少,小芽多,生长慢;++:小芽居多,生长慢;+:芽点少,生长慢;不同小写字母代表差异显著(p《0.05)
[0135]
表4不同因素对原球茎增殖影响的极差分析和显著性分析
[0136][0137]
注:差异显著用“*”表示,差异极显著用“**”表示
[0138]
实施例6不定芽生根培养基筛选
[0139]
对比试验:为获得完整再生植株,需将见血青不定芽接种至生根培养基。
[0140]
以实施例3记载的方法为基础,在配制生根培养基时将设置不同naa、6-ba、香蕉泥、椰汁、花宝2号的添加浓度,其他试验条件均与实施例3相同。观察不同试验组对见血青的生长影响,具体方案见表5。待分化产生不定芽长至0.2~0.3cm,将芽体接种至生根培养基中培养,定期观察,4周后统计结果。
[0141]
生根率=(生根苗数/总苗数)
×
100%
[0142]
生根条数=外植体生根总数/接种苗数
[0143]
由表5可知,当使用1/2ms培养基为基础培养基,6-ba浓度为2.0mg/l,naa浓度为2.0mg/l,椰汁用量为时50ml/l时,生根率最高,可达84%,且生根条数也相应最多,平均可达6.2条,根粗壮、生长状态旺盛。
[0144]
通过表6进一步极差分析和显著分析,诱导见血青不定茎生根时,1/2ms培养基中6-ba添加量为2.0mg/l,naa添加量为2.0mg/l,椰汁添加量为50ml/l,香蕉泥添加量10g/l。而添加花宝2号则不利于促进生根,可不添加。
[0145]
表5不同处理对不定芽生根影响的多重比较
[0146][0147][0148]
注:不同小写字母代表差异显著(p《0.05)
[0149]
表6不同因素对不定芽生根影响的极差分析和显著性分析
[0150][0151]
注:差异显著用“*”表示,差异极显著用“**”表示
[0152]
由上述三个对比试验的记载不难看出,在见血青培育的过程当中,培养基的选择是非常重要的,对见血青的繁殖速率影响显著,只有选择合适的组分添加及添加比例设置才能有效提高见血青的繁殖速率,并降低培养基的成本。
[0153]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1