一种降低乌菜小孢子再生植株褐化率的方法与流程
1.本发明涉及生物技术领域,尤其涉及一种降低乌菜小孢子再生植株褐化率的方法。
背景技术:
2.乌菜(brassica campesttris l.ssp.chinesis(l.)makino var.rosularis tsen et lee)又名塌菜、塌棵菜、塌地松、黑菜等,为十字花科二年生芸薹属白菜(b.campestris l.)的一个亚种,是十字花科的两年生草本植物。乌菜原产于我国,富含矿物质和维生素,在秋季播种后经过霜雪,味道甜美,口感最佳,是白菜中的珍品。
3.小孢子是高等植物雄配子体减数分裂后四分体释放出的单核细胞。游离小孢子培养是指直接从花蕾或花药中获得小孢子群体进行培养的方法。小孢子培养技术已经普遍应用在很多植物中,与传统育种方法相比,通过小孢子培养可快速获得各种纯合基因,因此对由多基因控制的特异性状的筛选能一步到位,大大提高选择机率,加快育种进程。小孢子培养技术还被广泛应用于诱变育种、种质创新、构建群体进行基因定位、作图及遗传分析领域当中。
4.目前,小孢子的游离培养在多种作物中获得成功,尤其是十字花科蔬菜的研究成绩斐然。然而,迄今为止,小孢子的游离培养在理论和实践中仍然存在一些问题,主要表现在“胚状体再生过程中褐化情况严重”这一方面。
技术实现要素:
5.本发明所要解决的技术问题在于提供一种降低乌菜小孢子再生植株褐化率的方法,其通过在小孢子培养基中同时添加类黄酮和角黄素这两种成分来提高小孢子抗氧化能力,从而使胚胎发育再生植株的褐化率有效降低。
6.本发明采用以下技术方案解决上述技术问题:
7.一种降低乌菜小孢子再生植株褐化率的方法,包括如下步骤:
8.(1)花序的选择
9.待乌菜植株现蕾后,摘取花序,备用;
10.(2)小孢子分离
11.选取花瓣长度与花药长度之比在0.5~1之间的花蕾,用70%酒精与0.1%hgcl2进行组合消毒,弃废液后再用无菌水冲洗;接着,在b5培养基中研碎花蕾释放出小孢子,并先后使用钢丝网筛和细胞网筛过滤;再接着,收集滤液于离心管进行离心;离心后,用b5培养基重悬沉淀后再次离心,所得沉淀即为所需的纯化小孢子;
12.(3)小孢子培养
13.将纯化小孢子用nln培养基稀释,并调整细胞密度为1
×
105~2
×
105个/ml;接着,将稀释后的纯化小孢子分装到培养皿中,并添加0.5mg/g~4mg/g浓度的类黄酮和5μg/100g~40μg/100g浓度的角黄素;最后,在33℃下热激处理24h后转至25℃下黑暗培养,待出现肉
眼可见的胚状体后,置于摇床上振荡培养;
14.(4)胚状体萌发及成苗
15.将培养好的子叶期胚状体转移到ms培养基上进行分化培养,直至培养成苗。
16.作为本发明的优选方式之一,所述步骤(1)中,选择的花序具体为盛花期无虫害且无裂蕾的植株主花序或一级分支的健康花序。
17.作为本发明的优选方式之一,所述步骤(1)中,选择对应花序后,将其置于自封袋中并喷清水,接着置于4℃冰箱中储存1~2天,备用。
18.作为本发明的优选方式之一,所述步骤(2)中,对花蕾进行组合消毒的具体方法为:先用70%酒精震荡消毒30s,再用0.1%hgcl2震荡消毒6min;待组合消毒完成,弃废液,再用无菌水冲洗3次,每次5min。
19.作为本发明的优选方式之一,所述步骤(2)中,待选取的花蕾完成消毒与清洗后,用玻璃棒在b5培养基中研碎花蕾释放出小孢子,并先后使用300目钢丝网筛和细胞网筛过滤;再接着,收集滤液于离心管中,并于1000r/min条件下离心5min;离心后,用b5培养基重悬沉淀,并将重悬液于1000r/min条件下再次离心5min,最终所得沉淀即为目标所需的纯化小孢子。
20.作为本发明的优选方式之一,所述步骤(3)中,将稀释后的纯化小孢子分装到培养皿中,并添加类黄酮和角黄素时,类黄酮的添加浓度具体为1mg/g,角黄素添加浓度为10μg/100g。
21.作为本发明的优选方式之一,所述步骤(4)中,转移到ms培养基上的子叶期胚状体的长度为2.5~3mm。
22.作为本发明的优选方式之一,所述步骤(4)中,分化培养的培养条件为:25℃,2000lux光照强度。
23.作为本发明的优选方式之一,所述b5培养基、nln培养基、ms培养基均为本领域常规培养基,其配方在此不再赘述。
24.本发明设计思路与原理:
25.类黄酮(flavonoid),又称黄酮类化合物,是所有植物次生代谢物中最主要的一类,来源于苯丙烷途径,被认为是植物界中最大、分布最广的一类植物成分,在自然界多种植物中广泛存在。抗氧化是类黄酮物质最重要的功能之一,在植物中类黄酮物质也常常参与氧化胁迫响应过程。氧化伤害是电子流变得不耦合产生自由基时会对机体的生长产生不利影响,如攻击细胞膜中的脂质、组织中的蛋白质等,从而导致膜和组织损伤。类黄酮作为植物多酚种类之一,是一类重要的防御性抗氧化剂,具有强大的自由基清除活性和抗氧化活性。
26.角黄素(canthaxanthin),亦称斑蝥黄、斑蝥黄质,是一种非维生素a源类胡萝卜素。角黄素作为一个二酮类类胡萝卜素,分子中有许多共轭双键和末端环状基团上的不饱和酮,这些结构都具有比较活泼的电子效应,能向自由基提供电子或吸引自由基未配对电子,使其极易与自由基反应而清除自由基,从而起到抗氧化作用。
27.因此,在小孢子培养基中添加适宜浓度的类黄酮和角黄素可有效提高小孢子的抗氧化能力,并在后续的再生过程中降低氧化导致的褐化现象。
28.本发明相比现有技术的优点在于:
29.(1)本发明通过在小孢子培养基中同时添加类黄酮和角黄素这两种成分来有效提高小孢子抗氧化能力,从而使胚胎发育再生植株的褐化率有效降低,为加快乌菜杂交育种速度、提高育种效率和种质创新提供强有力的基础;经验证,采用本发明方法进行乌菜小孢子再生植株的培养,最终褐化率可降低至15.4%;
30.(2)本发明提供的方法具有操作简单,生产周期短,高效高等优点,所使用的方法避免了高危、高毒或易爆试剂的使用,具有显著的安全性。
具体实施方式
31.下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
32.实施例1
33.本实施例的一种降低乌菜小孢子再生植株褐化率的方法,包括如下步骤:
34.(1)花序的选择
35.待乌菜植株现蕾后,选取盛花期无虫害且无裂蕾的植株主花序或一级分支的健康花序;将选择的花序置于自封袋中并喷清水,接着置于4℃冰箱中储存1天,备用。
36.(2)小孢子分离
37.选取花瓣长度与花药长度之比在0.5~1之间的花蕾,先用70%酒精震荡消毒30s,用0.1%hgcl2震荡消毒6min,再弃废液用无菌水冲洗3次,每次5min;接着,用玻璃棒在b5培养基中研碎花蕾释放出小孢子,并先后使用300目钢丝网筛和细胞网筛过滤;再接着,收集滤液于离心管中,并于1000r/min条件下离心5min;离心后,用b5培养基重悬沉淀,并将重悬液于1000r/min条件下再次离心5min,最终所得沉淀即为目标所需的纯化小孢子。
38.(3)小孢子培养
39.将纯化小孢子用nln培养基稀释,并调整细胞密度为1
×
105个/ml左右(此时,培养基呈淡黄色);接着,将稀释后的纯化小孢子分装到培养皿中,并添加0.5mg/g浓度的类黄酮和5μg/100g浓度的角黄素;最后,在33℃下热激处理24h后转至25℃下黑暗培养,待出现肉眼可见的胚状体后,置于摇床上振荡培养。
40.(4)胚状体萌发及成苗
41.将培养好的2.5mm长的子叶期胚状体转移到ms培养基上进行分化培养,直至培养成苗;培养条件为:25℃,2000lux光照强度。
42.实施例2
43.本实施例的一种降低乌菜小孢子再生植株褐化率的方法,包括如下步骤:
44.(1)花序的选择
45.待乌菜植株现蕾后,选取盛花期无虫害且无裂蕾的植株主花序或一级分支的健康花序;将选择的花序置于自封袋中并喷清水,接着置于4℃冰箱中储存1天,备用。
46.(2)小孢子分离
47.选取花瓣长度与花药长度之比在0.5~1之间的花蕾,先用70%酒精震荡消毒30s,用0.1%hgcl2震荡消毒6min,再弃废液用无菌水冲洗3次,每次5min;接着,用玻璃棒在b5培养基中研碎花蕾释放出小孢子,并先后使用300目钢丝网筛和细胞网筛过滤;再接着,收集
滤液于离心管中,并于1000r/min条件下离心5min;离心后,用b5培养基重悬沉淀,并将重悬液于1000r/min条件下再次离心5min,最终所得沉淀即为目标所需的纯化小孢子。
48.(3)小孢子培养
49.将纯化小孢子用nln培养基稀释,并调整细胞密度为1.5
×
105个/ml左右(此时,培养基呈淡黄色);接着,将稀释后的纯化小孢子分装到培养皿中,并添加1mg/g浓度的类黄酮和10μg/100g浓度的角黄素;最后,在33℃下热激处理24h后转至25℃下黑暗培养,待出现肉眼可见的胚状体后,置于摇床上振荡培养。
50.(4)胚状体萌发及成苗
51.将培养好的2.8mm长的子叶期胚状体转移到ms培养基上进行分化培养,直至培养成苗;培养条件为:25℃,2000lux光照强度。
52.实施例3
53.本实施例的一种降低乌菜小孢子再生植株褐化率的方法,包括如下步骤:
54.(1)花序的选择
55.待乌菜植株现蕾后,选取盛花期无虫害且无裂蕾的植株主花序或一级分支的健康花序;将选择的花序置于自封袋中并喷清水,接着置于4℃冰箱中储存2天,备用。
56.(2)小孢子分离
57.选取花瓣长度与花药长度之比在0.5~1之间的花蕾,先用70%酒精震荡消毒30s,用0.1%hgcl2震荡消毒6min,再弃废液用无菌水冲洗3次,每次5min;接着,用玻璃棒在b5培养基中研碎花蕾释放出小孢子,并先后使用300目钢丝网筛和细胞网筛过滤;再接着,收集滤液于离心管中,并于1000r/min条件下离心5min;离心后,用b5培养基重悬沉淀,并将重悬液于1000r/min条件下再次离心5min,最终所得沉淀即为目标所需的纯化小孢子。
58.(3)小孢子培养
59.将纯化小孢子用nln培养基稀释,并调整细胞密度为1.5
×
105个/ml左右(此时,培养基呈淡黄色);接着,将稀释后的纯化小孢子分装到培养皿中,并添加2mg/g浓度的类黄酮和20μg/100g浓度的角黄素;最后,在33℃下热激处理24h后转至25℃下黑暗培养,待出现肉眼可见的胚状体后,置于摇床上振荡培养。
60.(4)胚状体萌发及成苗
61.将培养好的2.8mm长的子叶期胚状体转移到ms培养基上进行分化培养,直至培养成苗;培养条件为:25℃,2000lux光照强度。
62.实施例4
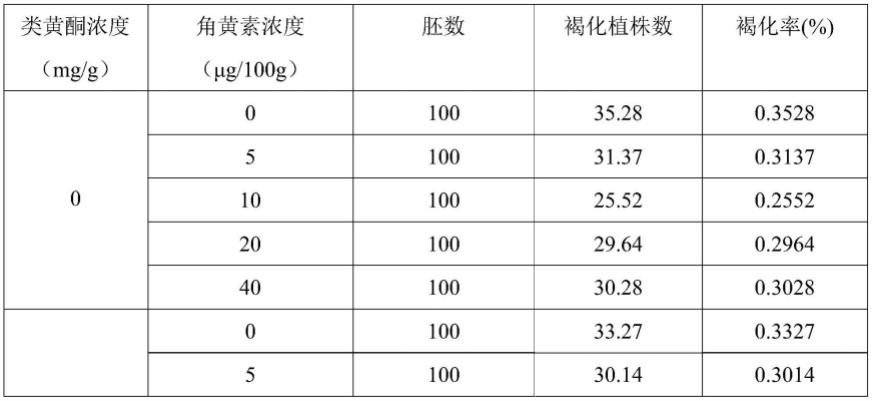
63.本实施例的一种降低乌菜小孢子再生植株褐化率的方法,包括如下步骤:
64.(1)花序的选择
65.待乌菜植株现蕾后,选取盛花期无虫害且无裂蕾的植株主花序或一级分支的健康花序;将选择的花序置于自封袋中并喷清水,接着置于4℃冰箱中储存2天,备用。
66.(2)小孢子分离
67.选取花瓣长度与花药长度之比在0.5~1之间的花蕾,先用70%酒精震荡消毒30s,用0.1%hgcl2震荡消毒6min,再弃废液用无菌水冲洗3次,每次5min;接着,用玻璃棒在b5培养基中研碎花蕾释放出小孢子,并先后使用300目钢丝网筛和细胞网筛过滤;再接着,收集滤液于离心管中,并于1000r/min条件下离心5min;离心后,用b5培养基重悬沉淀,并将重悬
液于1000r/min条件下再次离心5min,最终所得沉淀即为目标所需的纯化小孢子。
68.(3)小孢子培养
69.将纯化小孢子用nln培养基稀释,并调整细胞密度为2
×
105个/ml左右(此时,培养基呈淡黄色);接着,将稀释后的纯化小孢子分装到培养皿中,并添加4mg/g浓度的类黄酮和40μg/100g浓度的角黄素;最后,在33℃下热激处理24h后转至25℃下黑暗培养,待出现肉眼可见的胚状体后,置于摇床上振荡培养。
70.(4)胚状体萌发及成苗
71.将培养好的3mm长的子叶期胚状体转移到ms培养基上进行分化培养,直至培养成苗;培养条件为:25℃,2000lux光照强度。
72.实施例5
73.本实施例用以验证不同浓度类黄酮与角黄素对乌菜胚状体再生植株褐化率的影响:
74.实施方法:待乌菜w22-3植株现蕾后,选取盛花期无虫害且无裂蕾的植株主花序或一级分支的健康花序;将选择的花序置于自封袋中并喷清水,接着置于4℃冰箱中储存1~2天,备用。
75.选取花瓣长度与花药长度之比在0.5~1之间的花蕾,先用70%酒精震荡消毒30s,用0.1%hgcl2震荡消毒6min,再弃废液用无菌水冲洗3次,每次5min;接着,用玻璃棒在b5培养基中研碎花蕾释放出小孢子,并先后使用300目钢丝网筛和细胞网筛过滤;再接着,收集滤液于离心管中,并于1000r/min条件下离心5min;离心后,用b5培养基重悬沉淀,并将重悬液于1000r/min条件下再次离心5min,最终所得沉淀即为目标所需的纯化小孢子。
76.将纯化小孢子用nln培养基稀释,并调整细胞密度为1
×
105~2
×
105个/ml;接着,将稀释后的纯化小孢子分装到培养皿中,并分别添加浓度为0、0.5、1、2、4mg/g的类黄酮和0、5、10、20、40μg/100g的角黄素;最后,在33℃下热激处理24h后转至25℃下黑暗培养,待出现肉眼可见的胚状体后,置于摇床上振荡培养。
77.将培养好的2.5~3mm长的子叶期胚状体转移到ms培养基上进行分化培养(25℃,2000lux光照强度)14天,4周后统计乌菜小孢子褐化情况,分析数据。
78.表1不同类黄酮和角黄素浓度对乌菜胚状体再生植株褐化率的影响
79.[0080][0081]
实施结果:以乌菜w22-3为例,研究在小孢子培养基中添加不同浓度的类黄酮和角黄素对乌菜小孢子胚状体再生过程中褐化率的影响。结果如表1所示,结果表明:与不添加类黄酮的培养基相比,在培养基中添加0.5、1、2、4mg/g的类黄酮,褐化率分别降低2.01%、7.42%、6.13%和5.05%;与不添加角黄素的培养基相比,在培养基中添加5、10、20、40μg/100g的角黄素,褐化率分别降低3.91%、9.76%、5.64%和5%。且综合而言,在所有的组合中,在培养基中添加1mg/g的类黄酮和10μg/100g的角黄素的组合对胚状体再生植株褐化抑制效果最好,且比不添加类黄酮和角黄素的褐化率降低15.4%。
[0082]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1