一种低氧致急性肾损伤动物模型的构建方法
1.本发明属于动物模型构建技术领域,具体涉及一种低氧致急性肾损伤动物模型的构建方法。
背景技术:
2.急性肾损伤(aki)是严重威胁公共健康的疾病之一。目前,aki总患病率逐年增加趋势,给受影响的家庭和整个社会带来了巨大的经济和健康负担。现有研究表明:低氧在aki的发生与发展过程中起着重要的作用。进一步研究指出早期缺氧引起肾脏损伤可逆。但目前对其发生机制尚缺乏全面的认识,由此所致的终末期肾病需要昂贵的肾脏替代治疗来维持治疗。因此阐明低氧致aki的机制具有重大意义。
3.研究指出低氧所致人群aki发生率可达5%~33%。这不同于以往aki的动物模型。因此,开发一种稳定的低氧致aki动物模型尤为重要。目前关于aki的模型研究主要包括:(1)缺血再灌注型;(2)药物诱导型;(3)感染型。
4.(1)缺血再灌注型:实验缺血再灌注型aki模型包括双侧肾蒂夹闭法、一侧肾缺血再灌注加对侧肾切除法、部分结扎腹主动脉法、远端脏器缺血诱导法、失血性休克法等多以外源性手术方式造模。
5.(2)药物诱导型:由药物诱导的aki模型主要以自身毒性物质与肾脏反应所致,常见造模方法包括:氨基糖苷类抗生素诱导法、造影剂诱导法、顺铂诱导法、氯化汞诱导法、其他药物诱导法等给药以注射方式为主。
6.(3)感染型:目前感染性肾损伤模型主要以脓毒症展开研究,通过外源性手术或毒素致使动物感染进而累及肾脏,从而获得急性肾损伤模型。
7.上述三种模型,通常需要进行手术操作,难免引起炎症、肠道粘连等并发症。对动物模型的损伤极大,同时干扰因素大,操作过程专业性要求较高,受到一定的局限性,因此,亟需一种在简化操作下,可以稳定制备定的低氧致aki动物模型,且同时能减轻动物痛苦的aki小鼠动物模型的构建与评价方法。
技术实现要素:
8.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种低氧致急性肾损伤动物模型的构建方法,能够简单、稳定的建立由低氧引起的动物急性肾损伤模型。
9.本发明还提出一种根据上述构建方法构建得到的低氧致急性肾损伤动物模型。
10.根据本发明的一个方面,提出了一种低氧致急性肾损伤动物模型的构建方法,在氧浓度为5%-10%的饲养条件下,对实验动物注射贝伐单抗,所述贝伐单抗的注射时长为 10-15h。
11.在本发明的一些实施方式中,所述实验动物选自鼠、犬、猴、猪和牛中的至少一种。
12.在本发明的一些实施方式中,所述实验动物选自大鼠。
13.在本发明的一些实施方式中,所述方法还包括将实验动物在试验前进行适应性饲养 5~10天的步骤。
14.在本发明的一些实施方式中,所述实验动物的适应性饲养的条件为:温度18-25℃,相对湿度40%-45%,保持光照明暗各10-14h。
15.在本发明的一些实施方式中,所述实验动物的适应性饲养期间,实验动物采用自由取食方式。
16.在本发明的一些实施方式中,所述实验动物的适应性饲养期间,实验动物按需自由饮水。
17.在本发明的一些实施方式中,所述贝伐单抗的注射量为1000-3000μg//kg。
18.在本发明的一些实施方式中,所述贝伐单抗的注射量为1500-2500μg/kg。
19.在本发明的一些实施方式中,所述贝伐单抗的注射量为2000-2500μg/kg。
20.在本发明的一些实施方式中,所述贝伐单抗采用微渗透压泵进行注射。
21.在本发明的一些实施方式中,所述微渗透压泵的流速为15-40μg/h。
22.在本发明的一些实施方式中,所述氧浓度为5%-7%。
23.在本发明的一些实施方式中,所述氧浓度为5%。
24.在本发明的一些实施方式中,所述构建方法还包括在所述实验动物注射贝伐单抗后,通过血清肌酐值和病理形态学方法进行实验验证的步骤。
25.在本发明的一些实施方式中,所述血清肌酐值的实验验证的指标为与建模前相比,大鼠血清肌酐值上升≥50%,满足该条件,则aki的动物模型建模成功。
26.在本发明的第二方面,提出了一种低氧致急性肾损伤动物模型,所述低氧致急性肾损伤动物模型采用上述方法构建得到。
27.根据本发明的一些实施方式,至少具有以下有益效果:本发明采用无创方法构建动物低氧致急性动物模型,在减少动物模型进行伤害的情况下,通过给动物模型进行皮下注射贝伐单抗,再通过外在低氧环境刺激的方法,成功建立了低氧致急性肾损伤动物模型,稳定性、重复性好,简单客观,可操作性强,减少了其他可能干扰因素,为研究低氧引起肾损伤过程提供必要的实验基础。本发明提供的评价方法,对构建得到的低氧致急性动物模型进行评价,可信度高、准确度高,具有普适性。
附图说明
28.下面结合附图和实施例对本发明做进一步的说明,其中:
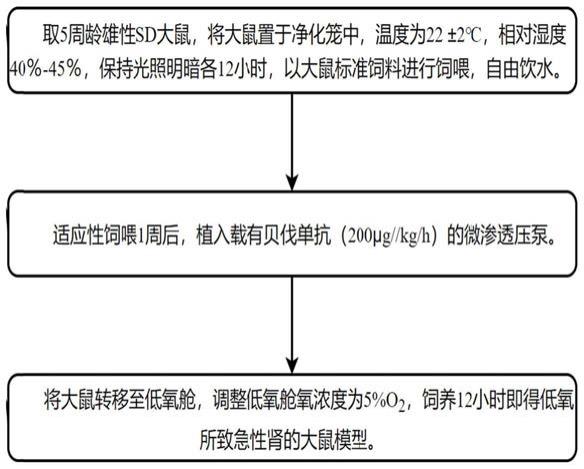
29.图1为本发明实施例1中的实验流程图;
30.图2为本发明实施例1中的大鼠植入微渗透压泵皮下注射贝伐单抗的示意图;
31.图3为本发明实施例1中的动物常压低氧舱模型图;
32.图4为本发明测试例中的大鼠模型血清肌酐值的检测结果图;
33.图5为本发明测试例中的大鼠模型的肾皮质组织病理学检测结果图。
具体实施方式
34.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施
例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
35.实验动物:5周龄雄性sd大鼠,体重均值在150g左右,由上海吉辉实验动物饲养有限公司提供,实验动物在上海交通大学医学院附属新华医院实验动物中心饲养。
36.实验材料:低氧舱(购自上海塔望智能科技有限公司);水合氯醛(购自新华医院动物中心提供);贝伐单抗(购自medchemexpress);微量渗透泵(购自alzet osmoticpumps);大鼠血清elisa肌酐抗体(购自武汉益普生物科技有限公司);4%多聚甲醛(购自biosharp);组织包埋盒(购自碧云天生物技术研究所);苏木素伊红染色试剂盒(购自碧云天生物技术研究所)。
37.实施例1
38.本实施例制备了一种大鼠低氧致aki模型,具体流程图如图1所示,包括如下步骤:
39.(1)选择实验动物:取5周龄雄性sd大鼠,将大鼠置于净化笼中,温度为22
±
2℃,相对湿度40%-45%,保持光照明暗各12h,以大鼠标准饲料进行饲喂,自由饮水。
40.(2)植入透压泵:适应性饲喂1周后,植入载有贝伐单抗(200μg//kg/h)的微渗透压泵皮下注射贝伐单抗。大鼠植入透压泵的模型示意图如图2所示。
41.(3)急性肾损伤构建:将植入载有贝伐单抗(200μg//kg/h)的微渗透压泵的大鼠转移至低氧舱,调整低氧舱(低氧仓采用动物常压低氧仓,如图3所示,低氧舱内有 pid反馈控制,控制电磁阀的通断,向低氧舱通入复气持续维持舱内从而维持氧浓度的稳定,可调节范围为0-25%,精度为0.1%)氧浓度为5%o2,饲养12h(在低氧仓饲养小鼠的同时,连续12h注射贝伐单抗)即得低氧所致急性肾的大鼠模型。
42.对比例1
43.本对比例制备了一种大鼠低氧致aki模型,与实施例1的区别仅在于,步骤(3) 的氧浓度为10%。
44.对比例2
45.本对比例制备了一种大鼠aki模型,与实施例1的区别仅在于,步骤(3)的氧浓度为21%(正常氧)。
46.试验例
47.本试验例采用以下方法对实施例1和对比例1-2制备得到的大鼠aki模型进行了评价。
48.1、血清肌酐检测
49.在实施例1和对比例1-2制备得到的大鼠aki模型的建模前、后(即低氧条件下 0h,3h,6h,9h和12h)通过眼眶采血,elisa法检测大鼠血清肌酐,具体步骤为:
50.(1)称重后,水合氯醛麻醉(350mg/kg,i.p),待动物出现角膜反射消失、肌力下降、软瘫等麻醉反应。
51.(2)抗凝处理过的玻璃毛细采样管,掰成1-2cm长度。
52.(3)右手食指和拇指轻按眼眶两侧皮肤,使眼球突出,毛细管从内侧的眼球与眼睑的缝隙处进入,轻轻旋转毛细管,稍微深入眼球后上方,血液流速快的时候4-5滴即可,温柔的将毛细管取出。
53.(4)用棉签按压大鼠眼眶止血,每次取血100μl,将血液放入冰盒中保存。
54.(5)大鼠血清进行elisa实验检测肌酐(elisa试剂盒购自武汉益普生物科技有限公司),elisa操作按试剂盒要求进行。
55.采用spss 22.0对血清肌酐数据进行分析,采用graphpad prism 6.0软件进行统计作图。计量资料用(均值
±
标准差,
±
s)表示,服从正态分布的计量资料的组间比较采用t检验或方差分析(anova),不服从正态分布时采用非参数秩和检验。p《0.05为差异有统计学意义。与建模前相比,大鼠血清肌酐值较基线上升≥50%,满足该条件,则aki的动物模型建模成功。
56.大鼠血清肌酐值如图4所示,从图中可以看出,在正常氧的条件下,大鼠的血清肌酐值随时间的变化基本没有升高,在氧浓度为10%的条件下,小鼠的血清肌酐值虽有一定的提升,即肾功能出现一定程度的损伤,但是相较建模前,血清肌酐值提升小于50%,不满足aki的动物模型的建模标准,当氧浓度控制在5%时,大鼠的血清肌酐值较建模前上升大于50%,结果表明本发明方案制备得到急性肾损伤的大鼠模型。
57.2、大鼠肾脏的病理检测
58.(1)分别将实施例1和对比例1-2制备得到的大鼠模型,在建模前后(即低氧条件下0h和12h),大鼠称重,水合氯醛麻醉(350mg/kg,i.p),待动物出现角膜反射消失、肌力下降、软瘫等麻醉反应后,俯卧于鼠板固定。
59.(2)肾脏取材:于腹膜外腰部脊柱两侧寻找到肾脏,表面光滑、背腹略扁呈蚕豆形。剪开后腹膜,结扎剪断双侧肾门,钝锐结合,取下双侧肾脏,剔除肾周筋膜组织,放置于盛有无菌生理盐水的培养皿中涮洗去血迹。于中间肾门部横行切开左侧肾脏,4%多聚甲醛中固定,固定24h后进行组织蜡块制作。
60.(3)石蜡切片制作:将组织从固定液中取出,用手术刀修整成合适的形状,放入脱水框中做好标识,流水充分冲洗组织块,以去除多聚甲醛固定液。利用从低浓度到高浓度酒精对组织脱水,将脱水后的组织进行透明、浸蜡、组织包埋及切片。
61.(4)组织he染色:取石蜡切片进行常规脱蜡至水,将组织完全浸没于苏木素中染3-5min至细胞核染色明显。pbs缓冲液中充分荡洗切片,进行伊红复染,镜下观察染色程度,待切片干燥,中性树脂封片,光镜下观察大鼠肾脏形态学改变并拍照。
62.检测结果如图5所示,从图中可以看出,正常氧的条件下饲养0h和12h得到的大鼠模型的肾脏he染色结果无明显差异,肾小管和肾小球均发育良好,无明显凋亡和炎性细胞浸润;氧浓度为10%的条件下饲养0h和12h得到的大鼠模型的肾脏he染色比较结果表明,相较对照组0h,10%氧浓度条件下饲养12h的大鼠模型出现肾小管上皮细胞出现扁平、肾小管扩张;氧浓度为5%的条件下饲养0h和12h得到的大鼠模型的肾脏 he染色比较结果表明,相较对照组0h,5%氧浓度条件下饲养12h的大鼠模型出现肾小管上皮细胞扁平、空泡变性、坏死、脱落,肾小管扩张,近曲小管刷状缘脱落,红细胞管型、蛋白管型,间质水肿,炎性细胞增生,其肾脏损伤评分高于10%氧浓度条件下饲养12h的大鼠模型;综上,只有5%的氧浓度环境下可以构建大鼠急性肾损伤模型。
63.综上所述,本发明方案制备得到的低氧致急性肾损伤动物模型在研究过程中通过大鼠眼眶采血,可以实时监测血清肌酐水平。因此,本发明方案的造模过程为动态过程,可观察不同时间点的肾功能改变,为研究aki提供了很好的实验平台,同时此模型也为药物实验提供了很好的工具。
64.上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1