一种构建绵羊肠炎动物模型的方法及其应用与流程
1.本发明属于动物模型构建技术领域,尤其涉及一种构建绵羊肠炎动物模型的方法及其应用。
背景技术:
2.肠炎是一种严重的消化道疾病,当绵羊患有肠炎时,绵羊会出现腹痛,腹泻等症状。由于绵羊患有肠炎,绵羊的饮食量和饮水量会下降,绵羊的体重会下降。甚至当绵羊的腹泻严重时,绵羊会因为电解质紊乱而死亡。每年都会有许多绵羊因患有肠炎而死亡,给绵羊的养殖业造成严重的经济损失。若要对绵羊肠炎进行深度的研究,以便于探索有效防治绵羊肠炎的方法,势必要构建绵羊肠炎模型,用于实验生理学、实验病理学和实验治疗学(包括新药筛选)研究。但是由于绵羊是一种反刍动物拥有四个胃,所以如何构建靶点在于肠道、发病时间长、病情合适、重复性好、稳定性强的绵羊肠炎疾病模型,是本领域亟需解决的技术问题。
技术实现要素:
3.鉴于此,本发明的目的在于提供一种构建绵羊肠炎动物模型的方法,采用人工喂养葡聚糖硫酸钠的方式,也能构建获得病情合适、重复性好、稳定性强的绵羊肠炎疾病模型。
4.为了实现上述发明目的,本发明提供了以下技术方案:
5.本发明提供了一种构建绵羊肠炎动物模型的方法,包括如下步骤:以3周龄绵羊为构建模型的动物,人工喂养葡聚糖硫酸钠,直至绵羊肠炎动物模型构建成功。
6.优选的,所述喂养葡聚糖硫酸钠的次数为一天一次。
7.优选的,每天喂养葡聚糖硫酸钠的量以小绵羊羔的体重计为2g/kg体重-4g/kg体重。
8.优选的,所述喂养葡聚糖硫酸钠的具体方式为将葡聚糖硫酸钠与绵羊奶混合喂养。
9.优选的,所述绵羊为健康并无腹泻的绵羊。
10.优选的,所述葡聚糖硫酸钠为葡聚糖硫酸钠溶液,所述溶液的浓度为0.013g/ml-0.027g/ml。
11.优选的,评判绵羊肠炎动物模型构建成功的方法为便隐血实验阳性以及绵羊结肠组织中出现炎症。
12.优选的,所述绵羊结肠组织中出现炎症表现为肠绒毛结构遭到破坏,有炎性细胞浸润。
13.本发明还提供了一种上述方法在筛选预防绵羊肠炎产品中的应用。
14.本发明还提供了一种上述方法在筛选治疗绵羊肠炎产品中的应用。
15.本发明的有益效果:
16.以dss作为诱导剂在小鼠、大鼠、仓鼠、猪和兔子上获得了稳定的肠炎模型,但是,在反刍动物上还未成功构建获得肠炎模型。本领域目前尚未有构建绵羊肠炎动物模型的有关报道,由于绵羊是一种反刍动物拥有四个胃,所以采用口服给药的方式很难构建获得绵羊肠炎动物模型。本发明首次提供了一种采用人工喂养葡聚糖硫酸钠构建绵羊肠炎动物模型的方法,能够成功构建获得绵羊肠炎动物模型,且获得的绵羊肠炎动物模型具有病情合适、重复性好、稳定性强的优势。
附图说明
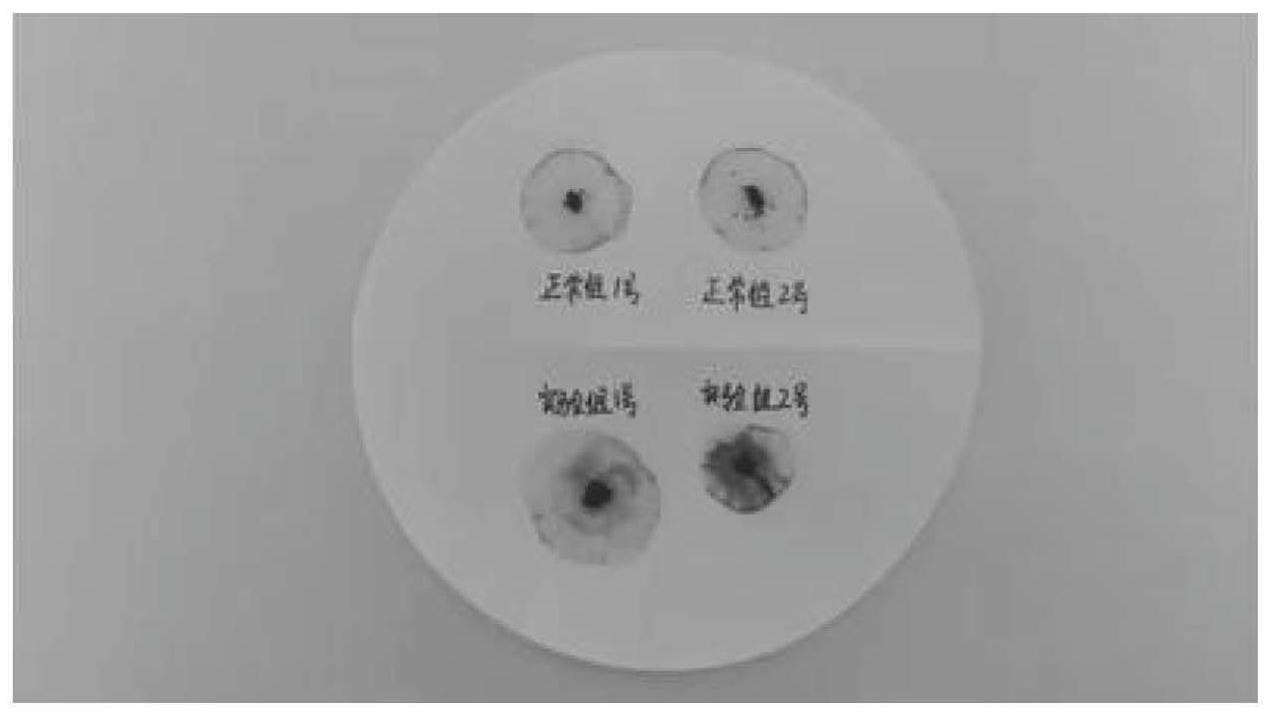
17.图1为不同组别小绵羊便隐血实验结果;
18.图2为不同标尺下实验组1号绵羊结肠组织病理切片;
19.图3为不同标尺下实验组2号绵羊结肠组织病理切片;
20.图4为不同标尺下正常组1号绵羊结肠组织病理切片;
21.图5为不同组别小绵羊便隐血实验结果;
22.图6为不同标尺下实验组3号绵羊结肠组织病理切片;
23.图7为不同标尺下实验组4号绵羊结肠组织病理切片。
具体实施方式
24.本发明提供了一种构建绵羊肠炎动物模型的方法,包括如下步骤:以3周龄绵羊为构建模型的动物,人工喂养葡聚糖硫酸钠,直至绵羊肠炎动物模型构建成功。
25.在本发明中,所述绵羊优选为健康并无腹泻的绵羊,本发明对于绵羊的具体品种没有特殊限定。在本发明中,所述喂养葡聚糖硫酸钠的次数优选为一天一次,每天喂养葡聚糖硫酸钠的量以小绵羊羔的体重计优选为2g/kg体重-4g/kg体重,更优选为2.5g/kg体重-3.5g/kg体重,所述喂养的葡聚糖硫酸钠优选为葡聚糖硫酸钠溶液,所述溶液的浓度优选为0.013g/ml-0.027g/ml,更优选为0.018g/ml-0.023g/ml。所述喂养葡聚糖硫酸钠的具体方式优选为将葡聚糖硫酸钠与绵羊奶混合喂养,更优选的为将硫酸钠葡聚糖放入奶瓶中,加入38℃的温水充分搅拌使硫酸钠葡聚糖溶解,然后与绵羊奶混合,通过人工喂养的方式喂给实验动物绵羊。本发明对于葡聚糖硫酸钠的具体来源没有特殊限定,采用本领域常规市售产品均可。
26.在本发明中,在本发明构建方法中,由于实验动物处于哺乳期内,因此需每日对实验动物进行人工喂养绵羊奶,本发明对于人工喂养绵羊奶的具体方式没有特殊限定,依实验动物具体情况而定,确保实验动物绵羊能够健康生长即可。
27.在本发明中,评判绵羊肠炎动物模型构建成功的方法优选为便隐血实验阳性以及绵羊结肠组织中出现炎症,所述绵羊结肠组织中出现炎症优选为表现肠绒毛结构遭到破坏,有炎性细胞浸润。
28.本发明还提供了一种上述方法在筛选预防或治疗绵羊肠炎产品中的应用。在本发明中,所述产品优选的包括药物和试剂。
29.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
30.下述实施例中,如无特殊说明,均为常规方法。
31.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
32.实施例1
33.挑选3周龄健康精神状态良好并无腹泻的小绵羊羔,作为实验对象。每日称量并记录小绵羊羔的体重,根据小绵羊羔的体重喂养葡聚糖硫酸钠(dss),给药剂量为2g dss/kg体重(同时进行平行试验,分别计为实验组1号、实验组2号),将dss放入奶瓶中,加入38℃的温水100ml充分搅拌使dss溶解,将溶解后的dss溶液与50ml绵羊奶混合后通过人工喂养的方式喂给实验动物。由于实验动物处于哺乳期内,因此每日对实验动物进行人工喂养绵羊奶。
34.每天观察绵羊的排便情况,当观察小绵羊出现腹泻以及血便时,用棉签深入小绵羊的肛门对其直肠的肛门进行按摩,取出粪便,将粪便涂抹在滤纸上,使用隐血试剂盒的试剂按照说明书进行滴加操作,首先向滤纸上的粪便滴加试剂一(邻联甲苯胺溶液)2~3滴,再滴加试剂二(过氧化氢)1~2滴,观察试剂的颜色变化。取同时期出生正常小绵羊的粪便进行便隐血实验(计为正常组1号和2号),结果如图1所示。实验组1号和实验组2号绵羊便隐血阳性,正常组1号和正常组2号便隐血阴性。
35.处死实验动物,对其进行解剖,取出绵羊的结肠组织,用磷酸盐平衡生理进行冲洗结肠组织,将组织冲洗干净,随即将结肠组织放入4%多聚甲醛溶液中进行固定。将固定后的肠道组织在75%乙醇浸泡1h,95%乙醇浸泡i、ii各1h(浸泡2次),100%乙醇浸泡1h,100%乙醇浸泡i、ii各1.5h(浸泡2次),二甲苯浸泡i、ii、iii各45min(浸泡3次),石蜡浸泡i、ii各1h(浸泡2次),石蜡浸泡iii 1.5h。组织处理程序结束后,取出标本,置于包埋机的蜡槽中,进行包埋(蜡槽的温度设置为62℃)。包埋后切片,切片厚度3um。
36.具体染色步骤如下:
37.1.脱蜡:切片常规用二甲苯脱蜡,经各级乙醇至水洗:二甲苯(i)浸泡10min
→
二甲苯(ⅱ)浸泡10min
→
二甲苯(iii)浸泡10min
→
100%乙醇浸泡2min
→
95%的乙醇浸泡1min
→
80%乙醇浸泡1min
→
75%乙醇浸泡1min
→
蒸馏水洗2min。
38.2.he染色:苏木素染色5min,自来水冲洗。盐酸乙醇分化30s。温水浸泡5min。置伊红液2min。
39.3.常规脱水,透明,封片:95%乙醇(i)浸泡1min
→
95%乙醇(ⅱ)浸泡1min
→
100%乙醇(i)浸泡1min
→
100%乙醇(ⅱ)浸泡1min
→
二甲苯石碳酸(3:1)浸泡1min
→
二甲苯(i)浸泡1min
→
二甲苯(ⅱ)浸泡1min
→
使用滴管用中性树脂封固切片。
40.以正常组1号绵羊的结肠组织病理切片为对照,结果如图2-4所示。经图2-4的比对可知,实验组1号和2号绵羊结肠组织中出现炎症,表现肠绒毛结构遭到破坏,有炎性细胞浸润,表明绵羊肠炎模型构建成功。
41.实施例2
42.与实施例1的区别在于给药剂量为4g dss/kg体重(同时进行平行试验,分别计为实验组3号、实验组4号),取同时期出生正常小绵羊的粪便进行便隐血实验(计为正常组1号和2号),其余均同实施例1。结果如图5-7所示。由图5可以看出,实验组3号和实验组4号绵羊便隐血阳性,正常组1号和正常组2号便隐血阴性。由图6-7可以看出,实验组3号和4号绵羊结肠组织中出现炎症,表现肠绒毛结构遭到破坏,有炎性细胞浸润,表明绵羊肠炎模型构建成功。
43.对比例1
44.与实施例1的区别在于给药剂量为4.5g dss/kg体重,其余均同实施例1。结果绵羊便血严重,4天即死亡。
45.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1