利用降落式梯度培养基生产脱毒草莓组培苗的方法与流程
1.本发明属于草莓育苗技术领域,具体涉及利用降落式梯度培养基生产脱毒草莓组培苗的方法。
背景技术:
2.草莓的三级种苗培育体系是原原种苗、原种苗、种苗的培育,决定产业化种植中种苗性状、品质的关键在于原原种苗的组培上。现有技术中草莓主要的组织培养方式有叶片、花药、茎尖等。
3.利用叶片进行组织培养优点是取材方便,便于携带和保存,但大部分草莓品种的叶片再生率低,只有少数几个品种成功获得了简单、高效的叶片再生芽系统,通用性不高。
4.花药组织培养接种容易,从愈伤组织上分化出的不定芽100%不带病毒,比茎尖分生组织培养获得无病毒植株的几率高,但从花药培养到分化出再生苗需要时间较长,因为花药培养首先要经过愈伤组织的诱导和再分化过程,然后才能转人正常的继代快繁培养过程。
5.茎尖分生组织培养优点是不需要诱导愈伤组织和不定芽分化过程,脱毒效果好,培养时间短,并且在培养中植株的变异率低。缺点是剥取较难,并且在分生组织培养过程中培养材料易感染,消毒难,茎尖培养操作繁琐。因此,草莓在繁殖脱毒苗选择外植体主要是茎尖。
6.为进一步提高草莓脱毒种苗的繁殖速度与质量,以表现优异的红玉、雪里香、天仙醉、雪兔的茎尖为外植体,研究其适宜的诱导培养、丛生芽增殖的培养基。根据多年来对红玉、雪里香、天仙醉、雪兔四个品种,每个品种6个梯度实验的诱导率统计,发现这几个品种在特定的调控下诱导率较高,而现有草莓脱毒培养继代培养阶段虽采用前期梯度实验筛选出的最佳浓度,但并未考虑继代培养阶段高浓度的激素培养对后期驯化炼苗、种苗培育的影响。
7.基于以上背景技术中的内容,研发人员便在继代培养阶段尝试采用降落式梯度培养法进行培养。在实践中得到了显著效果,提取出了利用降落式梯度培养基生产脱毒草莓组培苗的方法,
技术实现要素:
8.本发明的目的在于提供利用降落式梯度培养基生产脱毒草莓组培苗的方法,以解决现有方法缺乏考虑继代培养阶段高浓度的激素培养对后期驯化炼苗、种苗培育的影响的问题。
9.为了解决以上问题,本发明技术方案为:
10.利用降落式梯度培养基生产脱毒草莓组培苗的方法,该方法分为以下步骤:
11.步骤s1、梯度筛选实验;
12.步骤s2、ms培养基的配置和灭菌;
13.s2.1.配置培养基;
14.ms培养基配置:称取ms培养基4.43g/l,加入30g/l蔗糖至烧杯中,按照实验设计量溶于一定量的蒸馏水中;
15.同时配置生长调节剂,清理洗涤实验用具;
16.s2.2.灭菌;
17.采用高压灭菌锅灭菌;
18.s2.3.分装;
19.提前将灭好并烘干的培养瓶放入超净工作台中,用紫外杀菌30min以上,彻底灭菌后将装有培养基的三角瓶整齐摆放在试验台上冷却到50-55℃后拿到超净工作台中,及时进行分装,每瓶倒30-40ml,在培养基完全定型之前切勿移动;
20.步骤s3、外植体的获取及灭菌;
21.s3.1.外植体获取;
22.剪取长约3-4cm生长健壮的任意草莓品种的草莓匍匐茎茎尖,作为组织培养的外植体;
23.s3.2.消毒;
24.步骤s4、接种、室内培养及诱导生根;
25.s4.1.接种;
26.s4.2.室内培养;
27.培养室要求干净清洁,室内装有紫外线杀菌灯,每天要对室内进行消毒,以防污染;
28.培养温度25℃,相对湿度70%,光照强度2000lx,每日光照16小时左右;
29.s4.3.丛生芽继代;
30.培养30-40d后,培养瓶内的小茎尖就会分出3-5个丛生芽,把这些丛生芽分出放于继代培养基内培养;
31.本实验采用的继代培养基为降落式梯度培养基,即从继代2、3、4分别采用浓度为ms+0.4mg/l6-ba+0.04mg/lnaa+30g/l蔗糖+7g/l琼脂、ms+0.3mg/l6
‑ꢀ
ba+0.03mg/lnaa+30g/l蔗糖+7g/l琼脂、ms+0.2mg/l6-ba+0.02mg/lnaa+30g/l 蔗糖+7g/l琼脂的培养基进行继代培养;
32.s4.4.诱导生根;
33.步骤s5、温室驯化;
34.s5.1.过度适应;
35.将组培苗从培养箱中移出放在温室内,半遮荫,光照控制在5000-8000lx, 温度控制在22-24℃,在室内慢慢一圈圈打开生好根的组培苗的培养瓶盖进行驯化,移栽前3天左右要每天拧松一圈,直至松盖,常温条件下放置2-3d 后;
36.s5.2.洗苗;
37.温水清洗,防止伤根;
38.操作时需要注意的是:
39.1.一定要冲洗干净根部残留的培养基,以防移栽后发霉;
40.2.如果组培苗根部连在一起,需要小心地将它们分开;
41.3.洗苗后将苗子放置于阴凉处,码好苗子,并做好保湿,滤水约 10min后便可移栽,或用多菌灵等杀菌剂浸泡10-30min,然后用清水清洗后滤水移栽;
42.步骤s6、组培苗移栽;
43.移栽时尽量避开仲夏和寒冬季节练苗;
44.练苗前期要保持湿度在85%以上,90%最佳;
45.s6.1.基质准备;
46.基质准备:炼苗一般均用复合基质;
47.基质消毒:基质在使用前应消毒灭菌;
48.s6.2.场地准备;
49.穴盘移栽搭至拱棚后铺设遮阳网,棚内底面铺5-10cm的滤水材料,再在其上面铺地布,移栽时将容器置于地布上;
50.s6.3.设备用具;
51.洗苗大盆、塑料网框、铁铲、容器(穴盘或营养钵)、镊子、竹签或木棍、喷雾器或自控喷灌系统;
52.s6.4.移栽;
53.将洗净培养基的小苗栽入经过消毒的腐殖土(草炭土)-蛭石-珍珠岩 (1:1:1)为基质的育苗盘中;
54.在移栽前将基质装入育苗盘中,轻压,浇透水,栽时要用镊子夹住幼苗根部插入穴盘深栽,保证幼苗的根部与土表齐平,要露出生长点;
55.组培苗移栽后浇水定根,前期要遮阳,后期逐渐增加光照,以散射光为主;
56.保湿培养,温度控制在15-20℃,湿度控制在90%以上;
57.整个移栽过程的病害控制采取每隔7-10天喷一次杀菌剂的措施,杀菌剂可使用多菌灵、百菌清、甲基托布津等。
58.进一步的,步骤s1中采用0.5mg/l6-ba和0.05mg/lnaa作为任意草莓品种统一的茎尖诱导培养基;
59.且在后期的继代中采用降落式梯度培养基,即从继代2、3、4分别采用浓度为ms+0.4mg/l6-ba+0.04mg/lnaa+30g/l蔗糖+7g/l琼脂、ms+0.3mg/l6
‑ꢀ
ba+0.03mg/lnaa+30g/l蔗糖+7g/l琼脂、ms+0.2mg/l6-ba+0.02mg/lnaa+30g/l 蔗糖+7g/l琼脂的培养基进行继代培养。
60.进一步的,步骤s2.1中生长调节剂配置:根据实验设计量取生长调节剂,混匀加入烧杯,加蒸馏水(用量杯)定容,调节ph至5.8,称取7g/l琼脂于800ml锥形瓶中,将配好的培养基分装于800ml锥形瓶中,培养基勿碰到三角瓶口,用绳子绑住封口膜,将瓶子轻轻摇晃一下,将底部琼脂粉摇匀;
61.用具清理洗涤:各种药品摆放整齐,用过的量筒、移液枪、烧杯、铝锅等清洗干净,放回原位。
62.进一步的,步骤s2.2中高压灭菌锅的压力为0.12-0.15mpa,温度 121℃,保持15-20min。
63.进一步的,步骤s3.2中将所取材料修剪后用纱布包好放在自来水下冲洗2h,进行表面消毒;
64.接着置于超净工作台中,用无菌滤纸吸干水分,用75%酒精漂洗 40s,然后用蒸馏水冲洗3次,每次2min;
65.再用0.1%氯化汞消毒8min,期间注意上下翻动材料;
66.最后再用无菌水冲洗3-5次后将材料放在无菌滤纸上用滤纸吸干水分。
67.进一步的,步骤s4.1中接种的具体过程为:将消过毒的匍匐茎尖在10-20 倍的双目镜下用已消毒并冷却过得解剖针一层层的剥去茎尖外的幼叶和鳞片,直至露出生长点(可带1-2个叶原基),取尖端0.1-0.2mm,迅速接种于实验前准备好的芽诱导培养基上(ms+0.5mg/l6-ba+0.05mg/lnaa+30g/l蔗糖+7g/l琼脂,ph为5.8),封好瓶口,并标记接种相关信息。
68.进一步的,步骤s4.3中具体过程为:培养30-40d后,培养瓶内的小茎尖就会分出3-5个丛生芽,把这些丛生芽分出放于继代培养基内培养;
69.采用的继代培养基为降落式梯度培养基,即从继代2、3、4分别采用浓度为ms+0.4mg/l6-ba+0.04mg/lnaa+30g/l蔗糖+7g/l琼脂、ms+0.3mg/l6
‑ꢀ
ba+0.03mg/lnaa+30g/l蔗糖+7g/l琼脂、ms+0.2mg/l6-ba+0.02mg/lnaa+30g/l 蔗糖+7g/l琼脂的培养基进行继代培养。
70.进一步的,步骤s4.4中具体过程为:继代3次后挑选组培苗长高度为2
‑ꢀ
3cm左右,长势健壮的组培苗,将其接种到生根培养基 (1/2ms+0.5mg/liba+30g/l蔗糖+7g/l琼脂,ph为5.8)中,约30天左右便可长出6-10条长约2-3厘米的小根。
71.进一步的,步骤s6.1中复合基质配比为:草炭土(腐殖土):珍珠岩:蛭石=1:1:1。
72.进一步的,步骤s6.4中具体过程为:
73.移栽后5-7天内,盖严棚膜,使棚内湿度维持在90%左右;
74.练苗前3天喷水每天不少于5次,4天后早晚各喷水一次;
75.一周后,可喷磷酸二氢钾(千分之零点五),起到加厚叶片的作用;
76.7-10天后注意通风和补充浇水;
77.营养钵或穴盘的基质要浇透水,所放置的床面也要浇湿,且初期要常喷雾处理,保持拱棚薄膜上有水珠出现;
78.10-15d后,要减少喷水次数,逐渐打开拱棚膜通风,三周后揭开膜;
79.1个月后,每周喷一次叶面肥,该叶面肥采用低浓度的大量元素水溶肥,浓度不超过千分之一,可根据苗子大小适当提高浓度,当小苗长出3-5片新叶后可以移栽到露地培育良种苗。
80.本发明的有益效果如下:
81.(1)本发明对脱毒草莓组培苗的培养方式采用降落式继代培养,其优势一方面在于能最大限度的降低植物激素在后期甚至驯化炼苗阶段对草莓种苗的调控,更有利于后期的种苗种植。另一方面在于前期的诱导培养阶段不需要对所培养的品种进行前期的浓度梯度筛选,能最大限度的节约时间,降低实验成本。
82.(2)本发明通过多年研发获得红玉、雪里香、天仙醉、雪兔这4个品种在0.5mg/l6-ba、0.05mg/lnaa调控下诱导率均较高,在0.1mg/l6-ba、 0.05mg/lnaa调控下诱导率也相对较高,以此为基础,延伸至继代培养阶段尝试采用降落式梯度培养法进行培养的研发思路,最终获得的组培苗确实在移栽中表现优异。
83.(3)由于茎尖组织培养自身的缺点限制,对操作要求较高,本发明通过大量的失败经验总结出了精确的操作方式和参数,只要按此数据操作,就能复制出成功的脱毒草莓组培苗,可大大降低育苗中剥取难和易感染的技术难题。
具体实施方式
84.为使本发明实施方式的目的、技术方案和优点更加清楚,下面将结合本发明实施方式,对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式是本发明一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。
85.因此,以下对本发明的实施方式的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施方式。
86.实施例1
87.利用降落式梯度培养基生产脱毒草莓组培苗的方法,该方法按以下步骤进行:
88.步骤s1、梯度筛选实验;
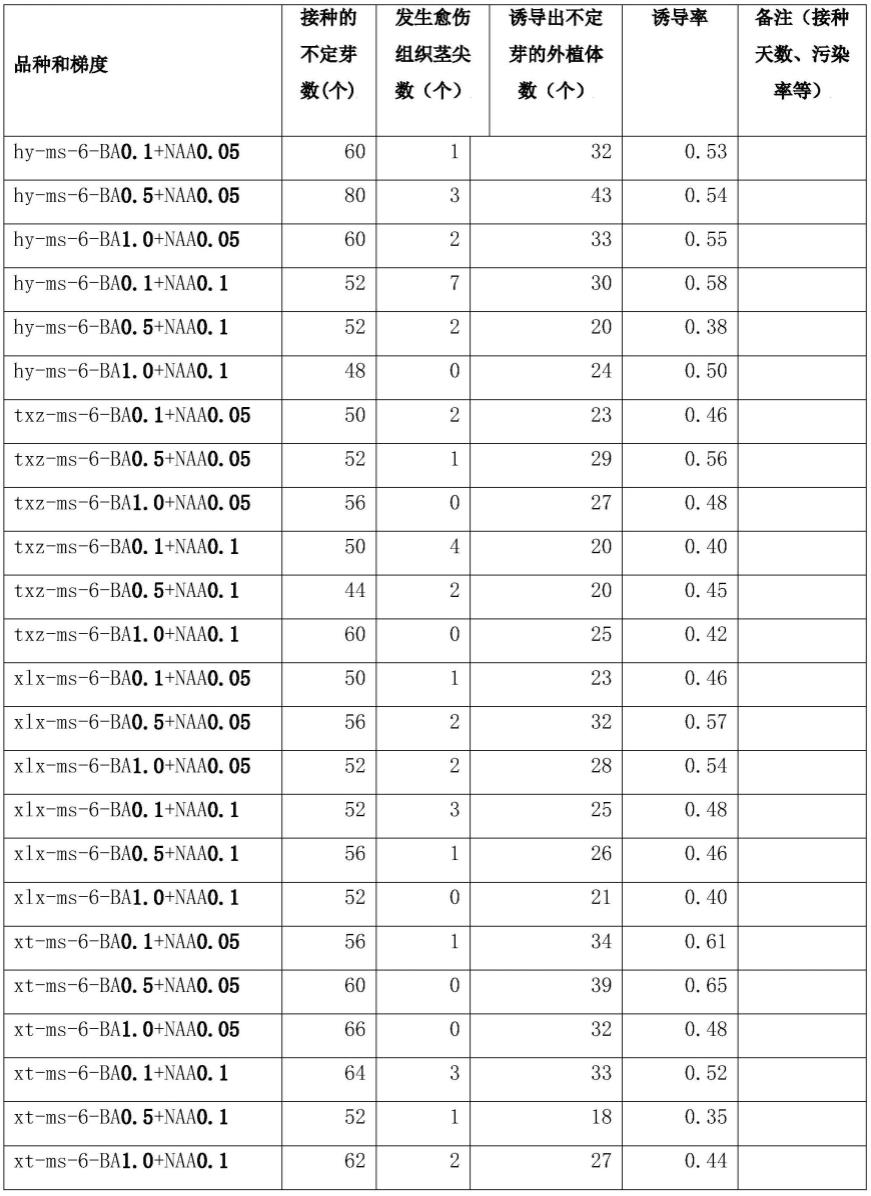
89.为了筛选出最适宜的茎尖诱导培养基,首先需要明确茎尖诱导率:一般接种40d后即可获得草莓丛生芽,统计培养40d、60d的诱导率,诱导率=诱导出不定芽的外植体数/接种的不定芽数量
×
100%。
90.为了获得诱导率,先行进行统计实验:需注意的是,组培瓶要标明品种、日期、梯度,每个梯度的瓶数也要编号,编号示例:hy-t-1/2/3/4/5/6;
91.实验中统计数据如下:
92.表1:茎尖诱导率诱导统计(40天)
[0093][0094]
表2:茎尖诱导统计(时间:60天)
[0095][0096]
上表示出了培养40天和60天的茎尖诱导率,表1和表2结合众多文献资料,本实验采用0.5mg/l6-ba和0.05mg/lnaa作为红玉、雪里香、天仙醉、雪兔这四个品种统一的茎尖诱导培养基。
[0097]
且本实验在后期的继代中采用降落式梯度培养基,即从继代2、3、4分别采用浓度为ms+0.4mg/l6-ba+0.04mg/lnaa+30g/l蔗糖+7g/l琼脂、 ms+0.3mg/l6-ba+0.03mg/lnaa+30g/l蔗糖+7g/l琼脂、ms+0.2mg/l6
‑ꢀ
ba+0.02mg/lnaa+30g/l蔗糖+7g/l琼脂的培养基进行继代培养。
[0098]
本实验采用的基础培养基是ms519,是目前组培上使用最普遍的培养基。其具有较
高的无机盐浓度,能够保证组织生长所需的矿质营养还能加速愈伤组织的生长。
[0099]
步骤s2、ms培养基的配置和灭菌;
[0100]
s2.1.配置培养基;
[0101]
ms培养基配置:称取ms519培养基4.43g/l,加入30g/l蔗糖至烧杯中,按照实验设计量溶于一定量的蒸馏水中;
[0102]
生长调节剂配置:根据实验设计量取生长调节剂,混匀加入烧杯,加蒸馏水(用量杯)定容,调节ph至5.8,称取7g/l琼脂于800ml锥形瓶中,将配好的培养基分装于800ml锥形瓶中,培养基勿碰到三角瓶口,用绳子绑住封口膜,将瓶子轻轻摇晃一下,将底部琼脂粉摇匀。
[0103]
用具清理洗涤:各种药品摆放整齐,用过的量筒、移液枪、烧杯、铝锅等清洗干净,放回原位。
[0104]
s2.2.灭菌;
[0105]
采用高压灭菌锅,其压力0.12-0.15mpa,温度121℃,保持15-20min。
[0106]
s2.3.分装;
[0107]
提前将灭好并烘干的培养瓶放入超净工作台中,用紫外杀菌30min以上,彻底灭菌后将装有培养基的三角瓶整齐摆放在试验台上冷却到50-55℃后拿到超净工作台中,及时进行分装,每瓶倒30-40ml,在培养基完全定型之前切勿移动。
[0108]
步骤s3、外植体的获取及灭菌;
[0109]
s3.1.外植体获取;
[0110]
剪取长约3-4cm生长健壮的红玉、雪里香、天仙醉、雪兔四个品种的草莓匍匐茎茎尖,作为组织培养的外植体。
[0111]
s3.2.消毒;
[0112]
将所取材料修剪后用纱布包好放在自来水下冲洗2h,进行表面消毒。
[0113]
接着置于超净工作台中,用无菌滤纸吸干水分,用75%酒精漂洗 40s,然后用蒸馏水冲洗3次,每次2min。
[0114]
再用0.1%氯化汞消毒8min,期间注意上下翻动材料。
[0115]
最后再用无菌水冲洗3-5次后将材料放在无菌滤纸上用滤纸吸干水分。
[0116]
步骤s4、接种、室内培养及诱导生根;
[0117]
s4.1.接种;
[0118]
将消过毒的匍匐茎尖在10-20倍的双目镜下用已消毒并冷却过得解剖针一层层的剥去茎尖外的幼叶和鳞片,直至露出生长点(可带1-2个叶原基),取尖端0.1-0.2mm,迅速接种于实验前准备好的芽诱导培养基上(ms+0.5mg/l6
‑ꢀ
ba+0.05mg/lnaa+30g/l蔗糖+7g/l琼脂,ph为5.8),封好瓶口,并标记接种日期和品种等相关信息。
[0119]
s4.2.室内培养;
[0120]
培养室要求干净清洁,室内装有紫外线杀菌灯,每天要对室内进行消毒,以防污染。
[0121]
培养温度25℃,相对湿度70%,光照强度2000lx,每日光照16小时左右。
[0122]
s4.3.丛生芽继代;
[0123]
培养30-40d后,培养瓶内的小茎尖就会分出3-5个丛生芽,把这些丛生芽分出放于
继代培养基内培养。
[0124]
本实验采用的继代培养基为降落式梯度培养基,即从继代2、3、4分别采用浓度为ms+0.4mg/l6-ba+0.04mg/lnaa+30g/l蔗糖+7g/l琼脂、ms+0.3mg/l6
‑ꢀ
ba+0.03mg/lnaa+30g/l蔗糖+7g/l琼脂、ms+0.2mg/l6-ba+0.02mg/lnaa+30g/l 蔗糖+7g/l琼脂的培养基进行继代培养。
[0125]
s4.4.诱导生根;
[0126]
继代3次后挑选组培苗长高度为2-3cm左右,长势健壮的组培苗,将其接种到生根培养基(1/2ms+0.5mg/liba+30g/l蔗糖+7g/l琼脂,ph为5.8)中,约30天左右便可长出6-10条长约2-3厘米的小根。
[0127]
步骤s5、温室驯化;
[0128]
s5.1.过度适应;
[0129]
将组培苗从培养箱中移出放在温室内,组培瓶可直接摆放在平整的地面或隔间较高的层架上。适当遮荫处理,光照控制在5000-8000lx,温度控制在22
‑ꢀ
24℃,使组培苗逐渐适应外界避免强光直射,在室内慢慢一圈圈打开生好根的组培苗的培养瓶盖(封口膜)进行驯化,移栽前3天左右要每天拧松一圈,直至松盖,常温条件下放置2-3d后,每天注意喷雾保湿(要用雾化程度较高的喷壶)。
[0130]
注意:甘肃平凉地区一般每年3月下旬左右,白天温度高于10℃左右,夜间5℃左右开始练苗。其他地区参照此温度即可。
[0131]
s5.2.洗苗;
[0132]
准备一盆温水,将培养瓶子横向放置,用镊子将组培苗轻轻取出,放入温水中清洗,注意不能直接用自来水冲洗组培苗,容易伤到根部。
[0133]
操作时需要注意的是:
[0134]
1.一定要冲洗干净根部残留的培养基,以防移栽后发霉;
[0135]
2.如果组培苗根部连在一起,需要小心地将它们分开;
[0136]
3.洗苗后将苗子放置于阴凉处,码好苗子,并做好保湿,滤水约10min后便可移栽,或用多菌灵等杀菌剂浸泡10-30min,然后用清水清洗后滤水移栽。
[0137]
步骤s6、组培苗移栽;
[0138]
移栽时尽量避开仲夏和寒冬季节练苗。
[0139]
练苗前期要盖严棚膜,使棚内湿度维持在90%左右,最低不低于85%,需要覆盖小拱棚并配备喷雾系统或雾化较好的喷壶,头拧到最紧,注意不能喷到叶面下方。
[0140]
s6.1.基质准备;
[0141]
基质准备:炼苗一般均用复合基质。其配比为:草炭土(腐殖土):珍珠岩:蛭石=1:1:1。
[0142]
基质消毒:基质在使用前应消毒灭菌。少量用高压灭菌,多时用多菌灵拌土,前期练苗可加椰糠(保水透水)。
[0143]
s6.2.场地准备;
[0144]
穴盘移栽搭高1-1.5m,宽1.2m的拱棚,长度视地形及操作方便而定。拱棚上铺塑料薄膜,视需要铺设遮阳网。棚内底面铺5-10cm厚沙、煤渣等滤水材料,再在上面铺一层地布,移栽时将容器置于地布上。
[0145]
s6.3.设备用具;
[0146]
洗苗大盆、塑料网框、铁铲、容器(穴盘或营养钵)、镊子、竹签或木棍、喷雾器或自控喷灌系统。
[0147]
s6.4.移栽;
[0148]
将洗净培养基的小苗栽入经过消毒的腐殖土(草炭土)-蛭石-珍珠岩 (1:1:1)为基质的育苗盘中。
[0149]
在移栽前将基质装入育苗盘中,轻压,浇透水,栽时要用镊子夹住幼苗根部插入穴盘深栽,保证幼苗的根部与土表齐平,要露出生长点。
[0150]
组培苗移栽后适当浇水定根,将穴盘苗放入塑料拱棚内遮光,移栽的组培苗前期要遮阳,后期逐渐增加光照,以散射光为主。
[0151]
保湿培养,温度控制在15-20℃,湿度控制在90%以上,移栽后5-7天内,盖严棚膜,使棚内湿度维持在90%左右,根据情况每天或隔天喷水一次,保持土壤湿润而不积水为宜,整个过程避雨。
[0152]
练苗前3天水要喷勤一点,4天后早晚各喷一次,以保证幼苗中途不因水分蒸发过快而萎蔫。
[0153]
一周后,等下午五点左右可喷磷酸二氢钾(千分之零点五),可起到加厚叶片的作用。
[0154]
7-10天后要注意通风和补充浇水。营养钵或穴盘的基质要浇透水,所放置的床面也要浇湿,并且初期要常喷雾处理,保持拱棚薄膜上有水珠出现。
[0155]
10-15d后,要减少喷水次数,将拱棚两端打开通风可逐渐打开拱棚膜,约三周后可揭开膜。
[0156]
1个月后,每周喷一次叶面肥(低浓度的大量元素水溶肥,浓度不超过千分之一,之后可通过苗子大小适当提高浓度,如宝瑞丰等),当小苗长出3-5 片新叶后可以移栽到露地培育良种苗。
[0157]
整个移栽过程的病害控制采取每隔7-10天喷一次杀菌剂的措施,杀菌剂可使用多菌灵、百菌清、甲基托布津等。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1