一种化合物在大豆孢囊线虫几丁质酶抑制剂中的应用
1.本发明属于豆科植物共生保护技术领域,具体涉及一种化合物作为大豆胞囊线虫几丁质酶抑制剂在抑制大豆孢囊线虫对共生建立破坏方面的应用。
背景技术:
2.大豆胞囊线虫(soybean cyst nematode,heterodera glycines ichinohe,scn)为土传定居型内寄生线虫,大豆孢囊线虫在大豆整个生育期均可为害,主要为害大豆根部。一般会造成5-10%的产量损失,发病严重地块减产可达30%以上,甚至颗粒无收,导致严重减产并造成较大经济损失。
3.大豆孢囊线虫的生活史是指线虫从卵开始到又产生卵的过程。大豆胞囊线虫是专性寄生线虫,通过有性繁殖产生后代,以胞囊的形式在土壤中越冬。大豆胞囊线虫的卵是胚胎卵,形成于胞囊或卵囊内,一龄幼虫在卵内发育,蜕皮一次从卵内孵化出来,形成具有侵染活性的二龄幼虫。二龄幼虫进入土壤,受到根系分泌物的吸引找到植物的根尖并侵入,之后定殖在中柱鞘,并从食道腺分泌物质刺激取食位点及周围细胞,形成合胞体,为线虫发育提供营养。
4.除了对大豆的危害,大豆孢囊线虫还会影响根瘤菌结瘤共生的建立,导致根瘤固氮能力减弱,进一步导致大豆减产。根瘤形成过程的开端是豆科宿主通过根系向根际环境释放类黄酮类物质,根瘤菌成功识别类黄酮信号后会被吸引至根系附近并启动自身结瘤基因的表达,产生和分泌一系列带有脂类修饰的几丁聚糖,即结瘤因子。在豆科宿主识别结瘤因子后,就会开始启动共生基因的表达,最终引导根瘤菌形成具有固氮能力的根瘤。
5.大豆胞囊线虫从被根吸引至根尖到形成合胞体的这一过程中会分泌很多效应蛋白来帮助它完成侵染和定殖过程。其中大豆孢囊线虫几丁质酶hgcht2作为一种在侵染前期高表达的效应蛋白,具有结瘤因子水解活性,在大豆孢囊线虫抑制根瘤菌共生过程中发挥重要作用。所以大豆孢囊线虫几丁质酶是理想的豆科植物共生保护剂靶标。
6.有研究表明,线虫的卵和咽部含有几丁质,且在大豆孢囊线虫孵化和侵染过程中,几丁质重塑是非常关键的生理过程。由此可以推测几丁质酶在线虫卵孵化和咽部重塑过程中发挥着关键作用。因此大豆孢囊线虫几丁质酶也是理想的防治大豆孢囊线虫病的潜在靶标。
7.然而,针对线虫几丁质酶抑制剂的开发本身就鲜有报道,对于高效的针对大豆孢囊线虫几丁质酶的具有豆科植物共生保护功能的抑制剂的报道更是空白。
技术实现要素:
8.为了解决上述领域中的技术问题,找到高效抑制线虫几丁质酶抑制剂,本发明通过筛选工作,通过抑制效果对化合物的抑制活性进行了评价研究,最终筛选到了该抑制剂。
9.本发明还提供一种具有抑制大豆孢囊线虫对共生建立破坏功能的几丁质酶的抑制剂,处理得到的结瘤数量与仅接种根瘤菌时的数量持平,完全恢复了hgcht2对根瘤菌结
瘤的抑制作用,在豆科植物共生保护方面有良好的应用前景。
10.基于几丁质和几丁质酶在大豆孢囊线虫生长发育过程中的关键作用,该抑制剂很可能在控制大豆孢囊线虫病害方面也具有很好的应用前景。
11.式(i)、式(ii)或式(iii)所述化合物及其药学上可接受的盐在大豆孢囊线虫几丁质酶抑制剂中的应用,或者式(i)、式(ii)或式(iii)所述化合物及其药学上可接受的盐在防治大豆孢囊线虫中的应用;
[0012][0013]
其中r1为氢或c1-c8的烷基,
[0014]
r3表示为一取代或多取代,
[0015]
r2、r3、r4独立地选自卤素,羟基,氰基,c1-c8的烷基,c1-c8的烷氧基;
[0016]
ar表示为下式之一,n为0-3的整数,
[0017][0018]
其中r1为氢或c1-c4的烷基,
[0019]
r3表示为一取代或二取代,
[0020]
r2、r3、r4独立地选自卤素,羟基,氰基,c1-c4的烷基,c1-c4的烷氧基;
[0021]
其中n=0或1。
[0022]
其中r2表示为c1-c4的烷基,r3独立地选自卤素,羟基,c1-c4的烷基,c1-c4的烷氧基;r4表示为氰基。
[0023]
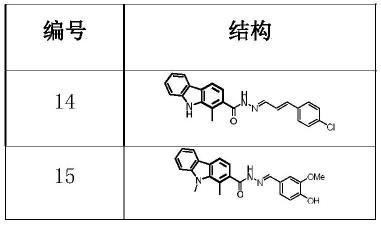
所述化合物为下表结构之一,
[0024][0025]
所述抑制剂的有效使用浓度不低于10μm。
[0026]
所述抑制剂的有效使用浓度为100μm。
[0027]
下述化合物作为豆科植物共生保护剂的应用,
[0028][0029]
所述化合物的有效使用浓度为100μm。
[0030]
本发明提供了评价化合物抑制活性和作为豆科植物共生保护剂活性所获得的数据。结果表明,编号14,15,16,17,25,27,30,31和32的化合物对几丁质酶hgcht2表现出一定的抑制活性。在筛选的化合物中,编号为32的化合物,即1516b具有完全恢复hgcht2对根瘤菌共生破坏的活性。
[0031]
本发明化合物作为豆科植物共生保护剂的使用方法为:用二甲基亚砜作为溶剂溶解化合物,采用先与hgcht2共孵育,随后在与根瘤菌同时接种大豆根部的方法研究抑制剂处理后hgcht2对根瘤菌根瘤形成的影响。
[0032]
本发明实施例的数据证明,1516b在豆科植物共生保护方面有良好的应用前景。所筛选的抑制剂在浓度为100μm时,处理得到的结瘤数量与仅接种根瘤菌时的数量持平,完全
恢复了hgcht2对根瘤菌结瘤的抑制作用。说明该抑制剂能够有效抑制hgcht2进而良好的实现共生保护功能。
附图说明
[0033]
图1为高抑制活性化合物对外源添加hgcht2抑制结瘤的影响分析,
[0034]
图2为化合物32对hgcht2的ki测定。
具体实施方式
[0035]
下述非限定性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。下述实施例中所使用的生物材料或试剂,如无特殊说明,均为本领域技术人员公知的常规生物材料或试剂,或由常规试验方法配置的试剂。
[0036]
实施例1hgcht2的克隆表达
[0037]
将hgcht2的催化域基因克隆到ppic9质粒中,在酵母表达系统中重组表达。使用500ml摇瓶,对酵母表达培养基进行了比较,选择了适宜hgcht2表达的bmmy培养基。通过对表达过程中溶氧、温度、ph等条件的控制,在biostat发酵罐中,采用补料流加甲醇的方法获得了目的蛋白的高表达。使用金属螯合层析方法纯化后,每一批次72小时发酵可以获得高纯度重组hgcht2蛋白。
[0038]
实施例2化合物对hgcht2抑制效率的测定
[0039]
将几丁质酶hgcht2作为靶标,对表i中列举的32个化合物进行抑制剂筛选。具体步骤如下:
[0040]
正对照:设置3组平行正对照。在30℃反应温度,100μl反应体系的条件下,2nmol/l几丁质酶和50μmol/l底物(mu-(glcnac)2)在20mmol/l的ph 6.0的磷酸盐缓冲液中孵育30min,之后加入100μl 0.5mol/l碳酸钠溶液终止反应,反应液用360nm波长的激发光进行激发后测定450nm波长下的吸光度值。
[0041]
实验组:设置3组平行实验组。在30℃反应温度,100μl反应体系的条件下,2nmol/l几丁质酶和50μmol/l底物(mu-(glcnac)2)以及对应表i中浓度为100μm的化合物在20mmol/l的ph 6.0的磷酸盐缓冲液中孵育30min,之后加入100μl 0.5mol/l碳酸钠溶液终止反应,反应液用360nm波长的激发光进行激发后测定450nm波长下的吸光度值。
[0042]
据以下公式计算抑制活性
[0043]
抑制百分数=(正对照-实验组)/正对照*100
[0044]
表i.作为hgcht2抑制剂筛选的化合物信息
[0045]
[0046]
[0047][0048]
结果表明,在筛选的所有32个化合物中,编号14,15,16,17,25,27,30,31和32的化合物对几丁质酶hgcht2表现出一定的抑制活性,同样可以用作防治大豆孢囊线虫。
[0049]
实施例3化合物与hgcht2对根瘤菌结瘤影响试验
[0050]
大豆(williams 82)萌发至5-7天,根瘤菌(bradyrhizobiumjaponicumusda110)培养至od600为0.8-1.2,备用。将hgcht2(1mg/ml)分别与筛选出的具有抑制活性的化合物(100μm)室温孵育1h,将萌发好的大豆移植于无菌蛭石中,然后与根瘤菌(od600稀释至0.01)同时接种大豆根部,14天后统计大豆根部的根瘤数量。如图1所示,hgcht2减少了根瘤菌的结瘤数量,而编号为32的化合物,即1516b的存在恢复了根瘤菌的结瘤数量的表型,而其他具有抑制活性的化合物则没有表型出生物学活性。这一结果充分说明化合物1516b具有大豆结瘤保护功能。
[0051]
实施例4 1516b对hgcht2抑制常数的测定
[0052]
mu-(glcnac)2为底物,反应设置三组底物浓度梯度,终浓度分别为5μm、10μm和15μm。在每组底物浓度下取多组适宜的化合物浓度梯度进行抑制活性测定。反应体系为100μl,缓冲环境为20mm磷酸盐缓冲液,ph6.0,酶终浓度为2nm,反应温度30℃,反应时间20min,之后加入100μl浓度为0.5m的碳酸钠溶液终止反应,释放的mu经由360nm激发光激发后于450nm波长下测定其吸光度值。数据采用dixon法绘图,化合物1516b对hgcht2的抑制常数ki值为118.9μm。结果如图2所示。
[0053]
抑制常数的一般测定方法就是利用三种底物浓度进行测定,绘制出三条反应速率倒数与化合物浓度的线性关系,三条线的交点的负数即为抑制常数。ki抑制常数(inhibition constant),反映的是抑制剂对靶标的抑制强度,这个值越小说明抑制能力越强。本发明的化合物1516b对hgcht2的抑制常数ki值为118.9μm,表明该化合物对hgcht2具有较强的抑制能力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1