一种建立实验小鼠乳腺炎模型的方法
1.本发明涉及属于生物技术领域,具体是一种建立实验小鼠乳腺炎模型的方法。
背景技术:
2.乳腺炎被认为是世界上最常见的乳腺疾病之一,是乳腺组织的炎症,包括发红、肿胀、发热、乳房疼痛和腺体组织损伤;并且对人类和哺乳动物尤其是奶牛构成了严重威胁。对于更严重的乳腺炎,会导致腺泡分泌受损,使感染部位的泌乳功能丧失。乳腺炎也是奶农经济损失的主要来源。乳腺炎典型的临床症状是会受到不同程度的感染和炎症变化。它可由多种病原体引起,一般来说,主要发生在细菌感染中,最常见的病原体是大肠杆菌和金黄色葡萄球菌。大肠杆菌通过细菌细胞壁上的脂多糖(lps)在乳腺中引发强烈的免疫反应,从而引起乳腺炎。金黄色葡萄球菌能反复感染乳腺组织,诱导乳腺炎症反应、细胞凋亡,并且释放的外毒素可引起全身症状,导致奶牛死亡。因此,寻找治疗乳腺炎的安全疗法迫在眉睫,在寻找治疗药物之前,科研工作者需要构建乳腺炎模型来进行实验,但是建立乳腺炎模型的过程中,容易导致小鼠死亡,影响模型构建进程,成模率低。
技术实现要素:
3.本发明的目的在于克服现有技术的不足,提供一种建立实验小鼠乳腺炎模型的方法,有效提高乳腺炎模型的成功构建概率,使得成模率搞到95%。
4.本发明的目的是通过以下技术方案来实现的:一种建立实验小鼠乳腺炎模型的方法,包括以下步骤:
5.s1、实验菌液的制备
6.所述菌液包括大肠杆菌菌液和金黄色葡萄球菌菌液;
7.将大肠杆菌母液稀释,得到大肠杆菌菌液,所述大肠杆菌菌液的浓度为0.2mg/ml;
8.将金黄色葡萄球菌菌株进行摇床培养,当金黄色葡萄球菌扩增至对数期,其后重悬至2
×
108cfu/ml,得到金黄色葡萄球菌菌液;
9.s2、选择小鼠
10.选择性成熟期8-10周的小鼠,所述小鼠中母鼠:公鼠的比例为2:1,在同一笼中进行饲养,妊娠期21天,哺乳期21天,纯系鼠不容易交配上,如果购买的老鼠长时间无法配种、怀孕,则需要在实验室进行实验小鼠的繁育;
11.s3、实验小鼠的处理
12.麻醉小鼠:
13.向所述小鼠的腹腔注射麻醉剂,待所述小鼠完全麻醉后,正面朝上仰卧保定小鼠,进行脱毛,将小鼠乳头暴露,并用酒精棉球擦拭小鼠乳腺及乳腺周围的皮肤,充分消毒,保持乳腺及乳腺周围皮肤的清洁干净;
14.乳腺处理:左手利用平头手术镊将所述小鼠的第四对乳头夹起,右手并利用手术剪将乳尖剪去,将乳头截面暴露出,便于后期注射菌液,剪除的部位长1mm;
15.注射菌液:
16.利用平头微量注射器吸取0.2mg/ml的lps 50μl或2
×
108cfu/ml的金黄色葡萄球菌液20μl,将所述平头微量注射器延伸至所述第四对乳头的乳导管中,延伸深度为4-5mm,所述平头微量注射器垂直进入所述乳导管中,缓慢将所述平头微量注射器中的菌液注入乳腺中,完成刺激,然后缓慢旋转所述平头微量注射器离开乳导管,可用手轻轻乳头及乳腺周围皮肤,使得菌液更好被吸收,小鼠第四对乳头的左右两只乳头均做相同处理,然后将小母鼠放置在鼠笼内,等待麻醉苏醒;
17.s4、一段时间后,对所述小鼠进行眼球采血后处死,制备病理切片。
18.进一步的,步骤s2中所述小鼠均在哺乳期第七天,所述小鼠与仔鼠至少隔离1h,停止哺乳并禁食。
19.进一步的,所述小鼠为balb/c小鼠、昆明小鼠、c57小鼠任意几种。
20.进一步的,步骤s3中所述麻醉剂为10%的水合氯醛,所述水合氯醛的注射量为0.1ml,此计量针对体重为50g小鼠而言。
21.进一步的,步骤s4中,所述病理切片的制备方法为:
22.沿所述小鼠下腹的腹中线切开皮肤(不能切开腹膜),向两侧拨开分离,将第四对乳腺暴露出,将所述第四对乳腺剥离下来,一侧的乳腺放入4%的多聚甲醛溶液中,制作病理切片,剩余乳腺组织放入4℃冰箱短期保存或﹣80℃冰箱冻存,用于后期实验。
23.进一步的,实验菌液的具体制备步骤如下:
24.将1mg/ml的大肠杆菌055:b5母液通过pbs溶液进行稀释,稀释至0.2mg/ml浓度,即为大肠杆菌(lps)菌液;
25.将所述金黄色葡萄球菌atcc 35556菌株接种至肉汤培养基中,在37℃、ph为7.4的摇床环境下进行扩增培养,当所述金黄色葡萄球菌扩增至对数期后,使用高压灭菌后的pbs溶液进行重悬,重悬至所述金黄色葡萄球菌的浓度为2
×
108cfu/ml,其后置于4℃下进行保存,即为金黄色葡萄球菌菌液,保证模型的建立。
26.本发明的有益效果是:本发明利用微量平头注射器将lps或金黄色葡萄球菌悬液等细菌经乳导管灌注到经过处理的实验小鼠乳腺组织中,量平头注射器垂直注射,可使细菌完全进入到乳腺组织中,经肉眼观看病理变化、病理组织学变化和mpo活性的结果显示,利用实验小鼠建立的乳腺炎模型不仅成功被构建,且成模率高达95%;本方法可广泛应用于大肠杆菌和金黄色葡萄球菌诱发的乳腺炎预防及治疗、相关药物的筛选、研发等研究,为探究人与奶牛的大肠杆菌、金黄色葡萄球菌乳腺炎的防治、血乳屏障损伤机制的研究提供很好的实验动物模型。
附图说明
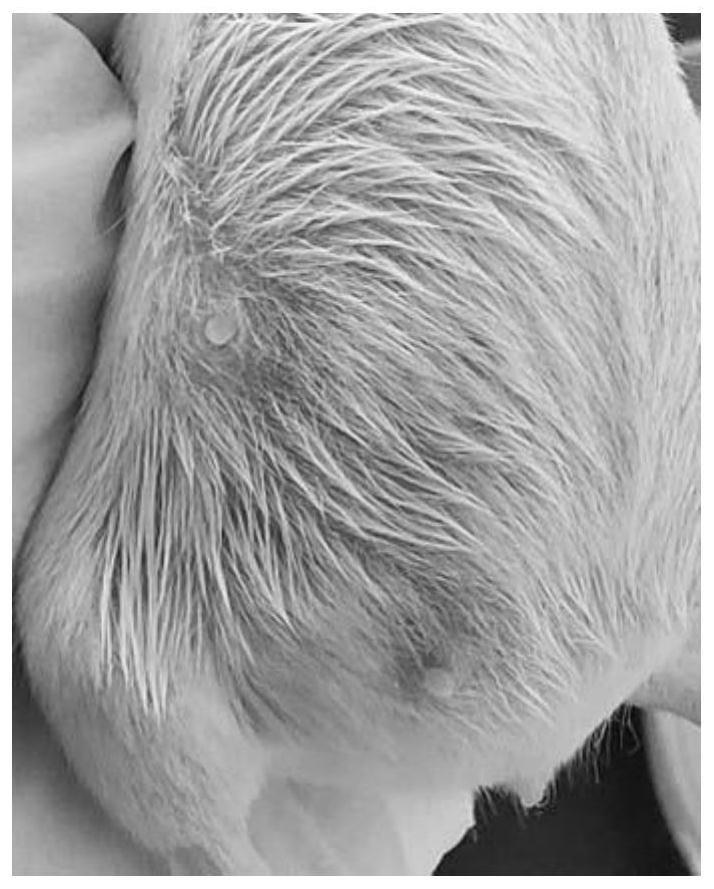
27.图1为建模前健康小鼠乳头;
28.图2为去掉尖端的小鼠乳头;
29.图3为建模后的小鼠;
30.图4为建模后小鼠乳腺组织;
31.图5为小鼠乳腺组织建模后形态学变化图;
32.图6为小鼠乳腺组织建模后病理学变化图;
33.图7为小鼠乳腺组织建模后mpo变化图。
具体实施方式
34.下面结合附图进一步详细描述本发明的技术方案,但本发明的保护范围不局限于以下所述。
35.实施例
36.一种建立实验小鼠乳腺炎模型的方法,包括以下步骤:
37.s1、实验菌液的制备
38.所述菌液包括大肠杆菌菌液和金黄色葡萄球菌菌液;
39.将1mg/ml的大肠杆菌055:b5母液通过pbs溶液进行稀释,稀释至0.2mg/ml浓度,即为大肠杆菌(lps)菌液;
40.将所述金黄色葡萄球菌atcc 35556菌株接种至肉汤培养基中,在37℃、ph为7.4的摇床环境下进行扩增培养,当所述金黄色葡萄球菌扩增至对数期后,使用高压灭菌后的pbs溶液进行重悬,重悬至所述金黄色葡萄球菌的浓度为2
×
108cfu/ml,其后置于4℃下进行保存,即为金黄色葡萄球菌菌液;
41.s2、选择小鼠
42.选择性成熟期8-10周的小鼠,所述小鼠中母鼠:公鼠的比例为2:1,在同一笼中进行饲养,妊娠期21天,哺乳期21天,所述小鼠均在哺乳期第七天,所述小鼠与仔鼠至少隔离1h,停止哺乳并禁食;所述小鼠为balb/c小鼠;
43.s3、实验小鼠的处理
44.麻醉小鼠:
45.向所述小鼠的腹腔注射麻醉剂,待所述小鼠完全麻醉后,正面朝上仰卧保定小鼠,进行脱毛,将小鼠乳头暴露,并用酒精棉球擦拭小鼠乳腺及乳腺周围的皮肤,充分消毒,保持乳腺及乳腺周围皮肤的清洁干净;所述麻醉剂为10%的水合氯醛,50g重的小鼠注射量为0.1ml;
46.乳腺处理:左手利用平头手术镊将所述小鼠的第四对乳头夹起,右手并利用手术剪将乳尖剪去,将乳头截面暴露出,便于后期注射菌液,剪除的部位长1mm;
47.注射菌液:
48.利用平头微量注射器吸取0.2mg/ml的lps 50μl或2
×
108cfu/ml的金黄色葡萄球菌液20μl,将所述平头微量注射器延伸至所述第四对乳头的乳导管中,延伸深度为4-5mm,所述平头微量注射器垂直进入所述乳导管中,缓慢将所述平头微量注射器中的菌液注入乳腺中,完成刺激,然后缓慢旋转所述平头微量注射器离开乳导管,可用手轻轻乳头及乳腺周围皮肤,使得菌液更好被吸收,小鼠第四对乳头的左右两只乳头均做相同处理,然后将小母鼠放置在鼠笼内,等待麻醉苏醒;
49.s4、一段时间后,对所述小鼠进行眼球采血后处死,制备病理切片,所述病理切片的制备方法为:
50.沿所述小鼠下腹的腹中线切开皮肤(不能切开腹膜),向两侧拨开分离,将第四对乳腺暴露出,将所述第四对乳腺剥离下来,一侧的乳腺放入4%的多聚甲醛溶液中,制作病理切片,剩余乳腺组织放入4℃冰箱短期保存或﹣80℃冰箱冻存,用于后期实验。
51.对比例:
52.一种建立实验小鼠乳腺炎模型的方法,包括以下步骤:
53.s1、选择小鼠
54.选择性成熟期8-10周的小鼠,所述小鼠中母鼠:公鼠的比例为2:1,在同一笼中进行饲养,妊娠期21天,哺乳期21天,所述小鼠均在哺乳期第七天,所述小鼠与仔鼠至少隔离1h,停止哺乳并禁食;所述小鼠为balb/c小鼠;
55.s2、实验小鼠的处理
56.麻醉小鼠:
57.向所述小鼠的腹腔注射麻醉剂,待所述小鼠完全麻醉后,正面朝上仰卧保定小鼠,进行脱毛,将小鼠乳头暴露,并用酒精棉球擦拭小鼠乳腺及乳腺周围的皮肤,充分消毒,保持乳腺及乳腺周围皮肤的清洁干净;所述麻醉剂为10%的水合氯醛,50g重的小鼠注射量为0.1ml;
58.乳腺处理:左手利用平头手术镊将所述小鼠的第四对乳头夹起,右手并利用手术剪将乳尖剪去,将乳头截面暴露出,便于后期注射菌液,剪除的部位长1mm;
59.注射生理盐水:
60.利用平头微量注射器吸取生理盐水20μl,将所述平头微量注射器延伸至所述第四对乳头的乳导管中,延伸深度为4-5mm,所述平头微量注射器垂直进入所述乳导管中,缓慢将所述平头微量注射器中的生理盐水注入乳腺中,完成刺激,然后缓慢旋转所述平头微量注射器离开乳导管,可用手轻轻乳头及乳腺周围皮肤,使得菌液更好被吸收,小鼠第四对乳头的左右两只乳头均做相同处理,然后将小母鼠放置在鼠笼内,等待麻醉苏醒;
61.s3、一段时间后,对所述小鼠进行眼球采血后处死,制备病理切片,所述病理切片的制备方法为:
62.沿所述小鼠下腹的腹中线切开皮肤(不能切开腹膜),向两侧拨开分离,将第四对乳腺暴露出,将所述第四对乳腺剥离下来,一侧的乳腺放入4%的多聚甲醛溶液中,制作病理切片,剩余乳腺组织放入4℃冰箱短期保存或﹣80℃冰箱冻存,用于后期实验。
63.对实施例组小鼠和对比例组小鼠进行评价:
64.(一)小鼠乳腺炎模型评价:
65.小鼠乳腺炎构建成功与否,可从以下几个方面进行确定:
66.(1)眼观病理变化:在乳导管注射lps(或金黄色葡萄球菌液)24h后,可观察小鼠第四对乳头的形状和颜色变化,是否充血、肿胀,有无出血点、出血斑、坏死灶等。
67.(2)病理组织学变化:lps(或金黄色葡萄球菌)刺激的小鼠乳腺腺泡壁明显增厚,腺泡腔内充斥大量中性粒细胞和巨噬细胞,并伴有充血和水肿。
68.(3)髓过氧化物酶(mpo)活性:mpo活性是中性粒细胞和巨噬细胞浸润程度的重要指标,lps(或金黄色葡萄球菌)刺激的小鼠乳腺组织mpo活性显著升高。
69.(二)乳腺组织的病理学实验
70.处死小鼠后,收集第4对乳腺组织,将乳腺组织切成0.5cm*0.5cm小块儿装在包埋盒中并标记,于10%甲醛溶液中固定24h
→
酒精梯度脱水(75%酒精24h
→
85%酒精12h
→
95%ⅰ酒精12h
→
95%ⅱ酒精12h
→
100%ⅰ酒精0.5h
→
100%ⅱ酒精0.5h)
→
二甲苯透明2min
→
浸蜡,一共4缸,0.5h/缸
→
石蜡包埋乳腺组织
→
切片5mm
→
40℃水中摊片使组织延展开
→
利用载玻片捞片并标记组织
→
70℃烤片4h
→
常规he染色
→
明胶封片
→
显微镜下观察小鼠乳腺组织病理学变化。
71.(三)将小鼠乳腺组织称重、匀浆并离心,收集上清液,按照mpo试剂盒说明书操作,分别加入指示试剂,测量mpo活性。
72.mpo活性=(odtest-odcontrol)/[11.3*重量(g)]。
[0073]
(四)从形态学观察发现,对照组乳腺组织柔软平整,有边界,颜色呈乳白色,可清晰看到内含的血管及乳汁(图5a)。lps或金黄色葡萄球菌液诱导的乳腺组织,肉眼可见组织发糟发散,乳腺组织呈鲜红色,内含有许多坏死灶且有大量出血点(lps模型组:图5b,金黄色葡萄球菌模型组:5c)。
[0074]
(五)小鼠乳腺组织病理学切片结果如图,对照组乳腺小叶结构清晰,腺泡完整均一,乳腺上皮细胞成扁平状(图6a);lps诱导的乳腺组织:腺泡结构多数被破坏,腔内有大量中性粒细胞等炎性介质浸润,坏死和脱落的腺上皮细胞显著增多(图6b);金黄色葡萄球菌诱导的乳腺组织损伤程度严重,腺泡腔内炎性分泌物增多、有大量的中性粒细胞浸润以及脱落的腺上皮细胞(图6c)。he染色结果表明,利用lps和金黄色葡萄球菌诱导成功的建立了小鼠乳腺炎模型。
[0075]
(六)mpo活力值主要是指中性粒细胞和巨噬细胞浸润组织的程度,可作为评价炎症严重程度的重要指标。如图7,lps和金黄色葡萄球菌诱导乳腺炎后,中性粒细胞等炎症介质浸润明显,mpo活力值3.96
±
0.48u/g,3.38
±
0.40u/g与对照组0.20
±
0.11u/g的相比急剧上升且差异显著(p《0.01)。
[0076]
(七)本发明共进行了60只balb/c实验小鼠的乳腺炎模型建立,60只小鼠中,有1只小鼠在麻醉后意外死亡;有1只小鼠在建立乳腺炎后死亡,未知原因,取样时发现还未建立成模型;另外有一只小鼠建立乳腺炎模型24h后取样,病理学结果发现未建立成乳腺炎;57只小鼠评价后发现建立成乳腺炎,成模率达到95%。
[0077]
以上所述仅是本发明的优选实施方式,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1