猕猴桃溃疡病的生物防治方法与流程
1.本发明涉及猕猴桃溃疡病防治技术领域,具体涉及猕猴桃溃疡病的生物防治方法。
背景技术:
2.猕猴桃溃疡病是由丁香假单胞杆菌猕猴桃致病变种引起的检疫性细菌病害,属于典型的低温型病害,其病原菌是一种腐生性很强的细菌,对猕猴桃树具有毁灭性的危害;发生具有隐蔽性,发病初期难以发现。其病原菌在猕猴桃树体上通常潜伏在伤口、剪锯口和嫁接口,待来年温湿度适宜新叶生长后病原菌便会向枝条及叶片处发展。
3.目前猕猴桃溃疡病的防治方法主要包括化学防治和生物防治,其中化学防治效果好、见效快,但化学药剂一直存在滥用、乱用的现象,造成了严重的环境污染、病菌产生抗药性等弊端,该方法已不再适合目前的农业生产发展的趋势。因此,发展生物防治方法是目前亟待解决的问题。
4.鉴于此,特提出本发明。
技术实现要素:
5.为了解决背景技术中的问题,本发明提供了一种猕猴桃溃疡病的生物防治方法。该方法不依靠化学药剂,不会对环境产生污染,也不会使病菌产生抗药性。
6.为了达到上述目的,本发明采用的技术方案为:猕猴桃溃疡病的生物防治方法,使用生物源试剂进行防治,所述生物源试剂为合欢皮提取物和独活提取物的混合物。
7.优选的,合欢皮提取物与独活提取物按照(2-5):1的质量比混合。
8.优选的,所述合欢皮提取物与独活提取物按照(2.5-4):1的质量比混合。
9.优选的,所述生物源试剂的剂型为农业常用剂型,包含可湿性粉剂、悬浮剂、水剂。
10.优选的,所述合欢皮提取物为合欢皮乙醇提取物或正丁醇提取物,所述独活提取物为独活乙醇提取物。
11.优选的,所述合欢皮乙醇提取物使用的乙醇质量分数为70%-90%;所述合欢皮正丁醇提取物使用的正丁醇质量分数为75%-95%;所述独活乙醇提取物使用的乙醇质量分数为90%-95%。
12.优选的,所述合欢皮乙醇提取物使用的乙醇质量分数为75%-85%;所述合欢皮正丁醇提取物使用的正丁醇质量分数为75%-80%;所述独活乙醇提取物使用的乙醇质量分数为93%-95%。
13.优选的,所述合欢皮乙醇提取物的制备方法为:将合欢皮粉碎后,按照料液比1:(8-12)加入乙醇,密闭浸泡提取2-3次,每次24-48h,每次浸泡后抽滤,合并抽滤后的液体,减压浓缩得到合欢皮乙醇提取物。
14.优选的,所述合欢皮正丁醇提取物的制备方法为:将合欢皮粉碎后,按照料液比1:
(8-12)加入正丁醇,在80-85℃回流提取2-3次,每次2-4h,合并提取液,减压浓缩得到合欢皮正丁醇提取物。
15.优选的,所述独活乙醇提取物的制备方法为:将独活根粉碎后,按照料液比1:(7-10)加入乙醇,在78-83℃回流提取2-3次,每次1.5-3h,合并提取液,减压浓缩得到独活乙醇提取物。
16.与现有技术相比,本发明具有以下有益效果:本发明通过将合欢皮提取物与独活提取物按照(2-5):1的质量比混合后得到的生物源试剂对猕猴桃溃疡病进行防治,能够有效抑制丁香假单胞杆菌猕猴桃致病变种,达到防治猕猴桃溃疡病的效果。本发明的生物源制剂对环境无污染,也不易使病原菌产生抗病性,为猕猴桃溃疡病提供了一种绿色的治理方式。
具体实施方式
17.为使本发明的目的、技术方案和优点更加清楚明了,下面结合具体实施方式,对本发明进一步详细说明。应该理解,这些描述只是示例性的,而并非要限制本发明的范围。此外,在以下说明中,省略了对公知结构和技术的描述,以避免不必要地混淆本发明的概念。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
18.实施例1 用于说明生物源试剂的制备1.合欢皮提取物的制备:方法一:称取2kg的合欢皮粉碎为粉末后,用16-24l质量分数为70%-90%的乙醇密闭浸泡提取2-3次,每次24-48h,在每次浸泡后抽滤,合并每次抽滤后的液体,将该液体在78℃、-0.1mpa的条件下用旋转蒸发器减压浓缩至溶剂蒸干,得到合欢皮乙醇提取物。
19.方法二:称取2kg的合欢皮粉碎为粉末后,用16-24l质量分数为75%-95%正丁醇,在80-85℃回流提取2-3次,每次2-4h,合并提取液,减压浓缩得到合欢皮正丁醇提取物。
20.2.独活提取物的制备:称取2kg独活根粉碎为粉末后,加入14-20l质量百分数为90%-95%的乙醇,在78-83℃回流提取2-3次,每次1.5-3h,合并提取液,减压浓缩得到独活乙醇提取物。
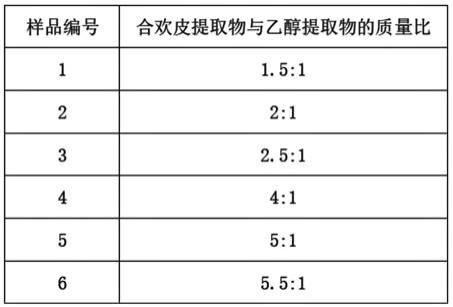
21.3.生物源试剂的制备将步骤1和2制备的合欢皮提取物与乙醇提取物按(2-5):1的质量比混合。该生物源试剂可以制备为可湿性粉剂,加入填料(如高岭土、滑石、黏土等)和湿润剂(如茶枯、纸浆废浆液等)混合加工为可湿性粉剂;该可湿性粉剂在使用时加入水稀释,喷雾到猕猴桃树上即可。该生物试剂也可以制备为水剂,加入少量的染色剂、湿润剂、防腐剂等助剂,并以水为溶剂,加工制备为水剂。该生物源试剂也可制备为悬浮剂,加入分散剂等助剂混合加工得到,加水喷雾施用。
22.该生物源试剂在使用时在所配置的混合液中合欢皮提取物和独活提取物的浓度为0.1-600mg/ml。
23.实施例2 用于比较不同配比的生物源试剂的性能1.合欢皮提取物的制备参照实施例1:称取2kg的合欢皮粉碎为粉末后,用20l质量分数为80%的乙醇密闭浸泡提取3次,
每次28h,在每次浸泡后抽滤,合并3次抽滤后的液体,将该液体在78℃、-0.1mpa的条件下用旋转蒸发器减压浓缩至溶剂蒸干,得到合欢皮提取物。
24.2.独活提取物的制备参照实施例1:称取2kg独活根粉碎为粉末后,加入16l质量百分数为95%的乙醇,在80℃回流提取3次,每次1.5h,合并提取液,减压浓缩得到独活乙醇提取物。
25.3.生物源试剂的制备参照实施例1,将步骤1和2制备的合欢皮提取物与乙醇提取物按表1中的质量比混合得到不同配比的生物源试剂。
26.表1。
27.对步骤3中得到的生物源试剂进行抑菌活性、最小抑菌浓度的比较。
28.菌悬液的制备:将丁香假单胞杆菌猕猴桃致病变种的菌株接种于lb平板,28℃活化培养,将单菌落置于灭菌后的100ml lb培养液中,在28℃,200rpm条件下震荡,培养48h。将培养好的菌悬液稀释为不同浓度,用稀释培养基测数法测菌体个数,调节浓度为7.0*106cfu/ml左右。
29.抑菌活性的测定方法:采用纸片法测定表1中不同配比的生物源试剂对丁香假单胞杆菌猕猴桃致病变种的抑菌活性。
30.取直径为7mm的圆形滤纸片若干并灭菌,将滤纸片分别放入各样品的蒸馏水溶液中浸泡3h。用移液枪取0.2ml菌悬液加在平板上,用涂布棒均匀涂开。将浸泡后的滤纸片等距置于平板上,每个样品设3组平行。同时设置无菌水为阴性对照组,放入培养箱中,37℃培养24h后观察结果,并用十字交叉法测量并记录抑菌圈直径,结果如表2所示。
31.最小抑菌浓度的测定方法:用液体稀释法测定表1中不同配比的生物源试剂的最小抑菌浓度(mic)。将各样品分别配制为0.1、0.4、0.7、1.0、1.3、1.6、1.9、2.2、2.5mg/ml浓度的溶液,配制丁香假单胞杆菌猕猴桃致病变种液体培养基按每管5ml分装试管,并向该试管中分别加入上述配制的样品溶液,制备为系列浓度梯度的培养基。接种等量的菌液,于37℃恒温震荡培养箱中培养48h,另取不接种任何菌种的培养基作为空白对照。以培养基中完全没有菌株生长时为最小抑菌浓度(mic),结果如表2所示。
32.表2
。
33.从表2可看出,当合欢皮提取物与独活提取物质量比在(2-5):1的范围时,二者产生协同作用,能够促进对丁香假单胞杆菌猕猴桃致病变种的抑制作用,尤其在质量比为(2.5-4):1的范围内时,协同效果最佳。在此范围外时合欢皮提取物与独活提取物产生拮抗作用,对丁香假单胞杆菌猕猴桃致病变种的抑制作用明显降低。
34.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1