一种贝莱斯芽孢杆菌水稻生物种衣剂及其制备方法和用途
1.本发明涉及一种生物农药制剂,特别是一种贝莱斯芽孢杆菌水稻生物种衣剂及其制备方法和用途。
背景技术:
2.水稻是我国重要的粮食作物之一,其种植面积占全国粮食作物面积的30%,产量则占粮食总产量的40%。随着种植面积的增加,水稻病虫害呈逐年上升趋势,导致水稻产量损失严重。特别是近几年来,水稻恶苗病、白叶枯病和细菌性条斑病成为水稻病害中难以防治的病害,作为种传病害,一旦发病将造成不可估量的损失,常规的杀菌剂和使用方法很难达到满意的防治效果。特别是大量化学药剂的使用,不仅没有达到满意效果,还造成病害抗药性升高,农药残留超标。
3.种衣剂可以将防治时期提前,在早期防治病害的发生,成为恶苗病和细菌性条斑病防治的新型模式。种衣剂是由杀虫剂、杀菌剂、复合肥料、微量元素、植物生长调节剂、缓释剂和成膜剂等经过先进工艺加工制成的,可直接或经稀释后包裹于种子表面,形成具有一定强度和通透性保护膜的农药制剂。种衣剂播种前使用,可综合防治苗期病虫害,省药、省时、省工、省钱、有利于环境保护,包衣后又能促进作物生长,使其根系强大、抗逆性强,可保产、增产,经济、生态效益显著。
4.现有生物型种衣剂是以活体微生物(有益或拮抗)或微生物代谢产物为活性成分,辅以一些助剂配方(如营养元素、成膜剂、防冻剂和分散剂等),通过发酵、剂型加工等步骤制备。生物种衣剂能在种子表面形成具有一定强度和通透性的生物保护层膜,生物型种衣剂中的微生物能随着种子的萌发在其表面和内部定殖,并随着植株的生长在根系和土壤中扩展和定殖,从而达到防病杀虫的目的。浙江省种子公司在1997年研制出了以芽孢杆菌为生物活性物质的生物种衣剂,该生物种衣剂能防治纹枯病、立枯病、疫霉病等,此外,该生物种衣剂还具有促进植物生长的作用。商晗武等研究表明,zsb生物种衣剂能用于防治水稻细菌性条斑病、白叶枯病、纹枯病、稻瘟病、早稻苗期立枯、烂秧、恶苗病等,还能促进作物的生长和增强其抗逆能力。赵夏初等采用不同浓度的生物种衣剂处理稻麦种子,结果表明,所有处理均能提高种子发芽峰值、发芽指数和种子活力指数,且对植株有促生作用,增加了根长和苗高。梁建红用生物种衣剂处理杂交水稻种子,结果表明,该种衣剂能提高秧苗素质、促进植株生长、防治植物病害。郭建胜研究表明,水稻种子使用生物种衣剂包衣后,苗期无烂秧,生物种衣剂可以降低恶苗病、青枯病、立枯病的发病率。冯斌根据室内生物活性测定和盆栽试验结果,筛选得到了几株枯草芽孢杆菌,这些菌株对水稻纹枯病菌和棉花立枯病菌均有较好的防治效果,经过助剂等的筛选,制备出了以yz和bs-208菌株原粉为活性物质的生物型种衣剂。
5.但这些传统的种衣剂生产采用湿法超微粉碎工艺,将有效成分、分散剂、润湿剂、防腐剂、警戒色、成膜剂、消泡剂、防冻剂、水等,经过剪切釜或剪切泵剪切均匀,经过砂磨机二级砂磨后,经过激光粒度分布仪百特bt-9300h粒径检测,dv90不大于5um为合格,检测合
格后分装入库。生防菌种衣剂属于活体微生物种衣剂,微生物由于其自身的特殊性,高温或者挤压会对微生物造成伤害,影响生防菌种衣剂菌含量。传统的种衣剂生产方法,高速剪切釜或剪切泵剪切(10000rpm)造成微生物菌体破碎,直接或间接杀死了生防菌。砂磨机二级砂磨由于是物理挤压粉碎,也会对微生物菌体造成破坏,严重影响微生物存活率。如何降低加工工艺对生防菌微生物的影响,是现在生防菌种衣剂急需解决的问题。
技术实现要素:
6.针对现有技术的不足,提供一种对环境安全的水稻生物种衣剂,其不但对水稻有促生作用,而且能够有效防治水稻恶苗病、白叶枯病和细菌性条斑病。
7.本发明的目的之二在于提供一种新的水稻生物种衣剂的制备方法。该方法采用自乳化法,与传统加工工艺(常规种衣剂采用二次砂磨工艺,能耗高,产能低,对原材料本身性质要求比较高)相比,减少了高速剪切乳化流程,简化了加工工艺,降低了对设备的依赖,降低了成本,更易于推广应用。
8.本发明的目的之三在于提供一种新的水稻生物种衣剂的用途,本发明采用的制备方法,提供了脂质体囊泡结构,能够起到缓释效果,延长生物种衣剂的防治时间。
9.为达到上述目的之一,本发明通过以下技术方案实现:
10.首先,本技术提供了一种贝莱斯芽孢杆菌水稻生物种衣剂,该种衣剂由如下成分组成:以占生物种衣剂的质量百分比计,卵磷脂5%~15%,高级脂肪酸酯5%~20%,聚天冬胺酸5%~20%,亚磷酸钾5%~20%,乳化剂1%~5%,警戒色0.5%~2%,成膜剂5%-10%,增稠剂0.1%~0.5%,防腐剂0.2%~0.5%,贝莱斯芽孢杆菌zxc-1发酵液补足余量(约10%~50%);所使用的贝莱斯芽孢杆菌zxc-1发酵液的含菌量≥108cfu/ml。
11.进一步的,上述贝莱斯芽孢杆菌水稻生物种衣剂中各组分的含量优选为:卵磷脂5%,高级脂肪酸酯15%,聚天冬胺酸10%,亚磷酸钾10%,乳化剂1%,警戒色1%,成膜剂5%1%,增稠剂0.2%,防腐剂0.2%,贝莱斯芽孢杆菌zxc-1发酵液补足100%。
12.本技术中,所使用的生防菌贝莱斯芽孢杆菌(bacillusvelezensis)zxc-1,已于2021年10月11日保藏在中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),分类命名为bacillus velezensis,菌种保藏编号为cgmcc no.23560。该菌株对恶苗病细菌性条斑病等种子传播病害有抑制作用。
13.进一步而言,上述卵磷脂优选型号为tp(磷脂酰胆碱),高级脂肪酸优选油酸甲酯,乳化剂优选zln-5(脂肪醇醚嵌段共聚物和植物油酯改性物混合物),警戒色优选海舒高巧红(ry),成膜剂优选苯丙乳液(苯乙烯-丙烯酸酯乳液,陶氏3186),增稠剂优选纳米纤维素(hpc851),防腐剂优选卡松(质量百分数为2%的异噻唑啉酮)。
14.其次,本技术提供上述贝莱斯芽孢杆菌水稻生物种衣剂的制备方法,具体步骤如下:
15.(1)制备贝莱斯芽孢杆菌zxc-1发酵液
16.a)活化培养:将贝莱斯芽孢杆菌zxc-1的甘油菌种,划线接种至新鲜na固体平板上,在26℃~30℃条件下培养24h~36h;
17.b)种子液制备:挑取步骤a)固体平板上一个单菌落接种nb液体培养基中,26℃~
30℃下振荡培养16h~24h,振荡频率为100-200rpm,获得种子液;
18.c)将步骤b)所得的种子液以1%~5%(v/v,体积比)的比例接种到40%~60%nb培养基中进行发酵,发酵温度为27℃~30℃,装料量为200~400ml/1000ml;培养基的初始ph为6.8~7.2,搅拌速度为100-180rpm,发酵时间约48h,获得贝莱斯芽孢杆菌zxc-1发酵液;经平板涂布法计数,发酵液菌体密度大于108cfu/ml。
19.(5)将卵磷脂和高级脂肪酸混合,经磁力搅拌器搅拌至澄清透亮,转速800r/min;加入乳化剂,继续搅拌均匀成为油相,备用;
20.(6)将聚天冬胺酸亚磷酸钾加入到步骤(1)获得的贝莱斯芽孢杆菌zxc-1发酵液中,待完全溶解后,获得水相生防菌发酵液;
21.(7)在磁力搅拌(800r/min)作用下,将水相生防菌发酵液逐滴加入步骤(2)获得的油相中,继续以800r/min转速搅拌,随着水相的加入体系逐渐变粘稠,转速提高到1200r/min,达到转相点后搅拌30min;然后加入警戒色、成膜剂、增稠剂、防腐剂,以1500r/min转速搅拌均匀,即得贝莱斯芽孢杆菌zxc-1种衣剂。
22.第三,本技术还提供了上述贝莱斯芽孢杆菌水稻生物种衣剂在防治水稻恶苗病和细菌性条斑病中的应用。具体而言,将上述水稻生物种衣剂与水稻种子以重量比为1:30-50进行包衣,常温阴干后,直接播种育苗。
23.与现有技术相比,本技术制备的贝莱斯芽孢杆菌水稻生物种衣剂具有以下有益效果:
24.1)卵磷脂的加入可以使种衣剂形成囊泡结构,增加植株对药剂的吸收和缓释效果。由于药剂包裹在脂质体囊泡中,脂质体为磷酯类物质,能够延长菌体存活的时间;脂质体结构随着时间降解,药剂随着脂质体的降解,缓慢释放出生防菌,脂质体降解产生的物质为生防菌的萌发提供c源,n源,为微生物萌发提供能量;此外,高级脂肪酸的加入与卵磷脂一起形成小乳滴,增加药效和粘附。聚天冬胺酸和亚磷酸钾可以作为肥料强种子抗逆性,促进萌发。
25.同时由添加了脂质体物质,还可以调整芽孢萌发的时间,即一部分芽孢被包裹,第一时间可能不萌发,随着种子生长吸收脂质体后,芽孢才开始萌发。而没被脂质体包裹的芽孢在第一时间萌发,就造成了芽孢萌发的时间差,能够一直产生次生代谢物质,为植株提供保护。
26.2)警戒色的加入可以区分包衣的种子和未包衣的种子。增稠剂、防腐剂的加入可以维持种衣剂产品的稳定性,同时避免霉菌产生。
27.3)本发明采用自乳化法,通过简单的搅拌乳化加工工艺,减少了剪切和砂磨对微生物的伤害,能够有效保证生物种衣剂中菌含量。所制备的种衣剂成膜性好,附着力强,显著提高了产品的效果和稳定性。此外,该方法制备简单,不需要特殊加工,降低生产成本,易于农业推广利用。
28.4)本发明采用贝莱斯芽孢杆菌zxc-1对恶苗病细菌性条斑病等种子传播病害有抑制作用,所制备的种衣剂能显著降低水稻细菌性病害的发生率,可用于防治水稻恶苗病和细菌性条斑病,防效超过现有化学和生物种衣剂,能显著促进水稻种子发芽、生长、增强抗逆能力、促进作物增产。
29.5)本技术种衣剂完全无毒害,无污染,生产、运输、储存和使用安全、方便、具有极
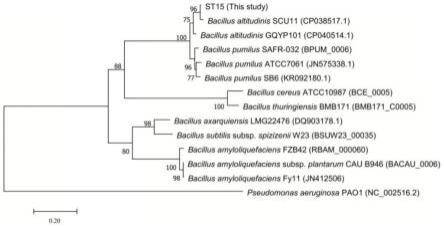
velezensis)。贝莱斯芽孢杆菌zxc-1的gyrb基因序列的进化树分析结果如图1所示。
56.该菌株已于2021年10月11日保藏在中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),菌种保藏编号为cgmcc no.23560。
57.(1)制备生防菌液,菌液制备步骤如下:
58.a)活化培养:贝莱斯芽孢杆菌zxc-1的甘油菌种,划线接种至新鲜na固体平板上,在26℃~30℃条件下培养24h(具体实施中,可以根据实际情况培养24h~36h);图2中,a、b、c分别为贝莱斯芽孢杆菌zxc-1在na培养基平板上的菌落、菌体及芽孢形态。
59.b)种子液制备:挑取步骤a)固体平板上一个单菌落接种nb液体培养基中,26℃~30℃下振荡培养16h~24h,振荡频率为100rpm(实际培养过程中,可以根据菌株生长情况确定震荡频率为100-200rpm),获得种子液;
60.c)生防菌液的制备:将步骤b)所得的种子液以5%(v/v具体实施中,1-5%的接种比均可实现发酵之目的)的体积比接种到nb培养基中进行发酵,发酵温度为27℃~30℃,装料量为400ml/1000ml(具体实施中,发酵罐装料量可以为200~400ml/1000ml);
61.nb培养基的初始ph为6.8~7.2,搅拌速度为100rpm(100-180rpm搅拌速度均可实现发酵之目的),发酵时间为48h,获得贝莱斯芽孢杆菌zxc-1发酵液;经平板涂布法计数,发酵液菌体密度大于108cfu/ml。
62.(2)将步骤(1)获得的生防菌液用冷却至55℃左右的lb固体培养基按照1:10的比例稀释,充分混合均匀后取15ml于无菌培养皿内,轻轻摇动平板使菌液均匀铺平,待其凝固后制成监测平板备用。
63.(3)分别将无菌牛津杯轻轻放在(2)中制备的监测平板中,而后用无菌吸管将(1)中制备的200ul生防菌液加入牛津杯中,空白对照组加入200ul无菌水。将平板正置于37
±
1℃恒温培养箱中培养12~18h,取出,观察是否产生抑菌圈。
64.结果如图3所示,贝莱斯芽孢杆菌(bacillus velezensis)zxc-1发酵液对水稻细菌性条斑病具有显著的拮抗作用。
65.实施例2
66.采用菌丝生长抑制法,测定贝莱斯贝莱斯芽孢杆菌(bacillusvelezensis)zxc-1发酵液对水稻恶苗病(江苏省农业科学院实验室保存)的抑菌活性。
67.(1)制备发酵菌液
68.a)活化培养:贝莱斯芽孢杆菌zxc-1的甘油菌种,划线接种至新鲜na固体平板上,在26℃~30℃条件下培养36h;
69.b)种子液制备:挑取步骤a)固体平板上一个单菌落接种nb液体培养基中,26℃~30℃下振荡培养24h,振荡频率为100rpm,获得种子液;
70.c)生防菌液的制备:将步骤b)所得的种子液以1%(v/v)的比例接种到nb培养基中进行发酵,发酵温度为27℃~30℃,装料量为200/1000ml;
71.培养基的初始ph为7.0,搅拌速度为100-180rpm,发酵时间为48h,获得贝莱斯芽孢杆菌zxc-1发酵液;经平板涂布法计数,发酵液菌体密度大于108cfu/ml。
72.(2)用冷却至55℃左右的pda培养基取15ml于无菌培养皿内,轻轻摇动平板使菌液均匀铺平,待其凝固后制成监测平板备用。
73.(3)用无菌打孔器(内径5mm
±
0.1mm)在pda平板中相同的半径边缘打孔,用无菌镊子取恶苗病菌饼置于pda平板中间,用无菌吸管取200ul发酵液,加入已打孔中,观察是否抑制恶苗病菌丝生长。
74.结果如图4所示,贝莱斯芽孢杆菌(bacillus velezensis)zxc-1发酵液对水稻恶苗病具有显著的拮抗作用,见附图4。
75.实施例3制备种衣剂
76.(1)贝莱斯芽孢杆菌(bacillus velezensis)zxc-1发酵液按照实施例1方法制备,发酵液菌体密度(菌含量)大于108cfu/ml;
77.(2)以下均以占最终制备的种衣剂的质量百分比计,将5%卵磷脂和15%高级脂肪酸混合,经磁力搅拌器搅拌至澄清透亮;加入1%乳化剂,继续搅拌均匀成为油相,备用;
78.(3)将聚天冬胺酸5%,亚磷酸钾5%加入到发酵液84.7%中溶解,完全溶解后,在磁力搅拌作用下,生防菌发酵液(水相)逐滴(速率1ml/滴)加入油相中,以800r/min转速搅拌,随着水相的加入体系逐渐变粘稠,转速提高到1200r/min,达到转相点后搅拌30min;然后加入警戒色1%,成膜剂5%,增稠剂0.1%,防腐剂0.2%,以1500r/min转速搅拌均匀(约15min),搅拌15min,即得108cfu/ml贝莱斯芽孢杆菌zxc-1生物种衣剂。
79.所获得的生物种衣剂sem照片如图5所示,可见种衣剂呈现明显的囊泡结构。
80.实施例4室内测定水稻生物种衣剂对包衣处理对水稻生长的影响
81.将实施例3制备的108cfu/ml贝莱斯芽孢杆菌zxc-1生物种衣剂与水稻种子(九优粤禾丝苗)以1:30、1:40、1:50(质量比)比例混合后进行包衣,再点播在预置蒸馏水润湿的滤纸的培养皿中,每皿播种20粒,重复3次,置于25℃光照培养箱中,定期加蒸馏水保湿,观察生长情况,培养5天后检查株高和根长,如下表1所示:
82.表1不同包衣比例对水稻生长的影响
[0083][0084][0085]
结果表明108cfu/ml贝莱斯芽孢杆菌zxc-1生物种衣剂对水稻出苗具有促进作用,芽长和根长促进率显著,明显高于空白清水对照,见图6和表1。
[0086]
实施例5
[0087]
本实施例以水稻生物种衣剂包衣水稻种子测定有益菌在植株根际的定植作用。将菌株贝莱斯芽孢杆菌zxc-1单菌落接种到至少含有5ug/ml利福平的na平板中,置于28℃下培养。2d后将新长出来的菌落接入同一浓度利福平的na平板中继代培养1次后转移到10ul/
ml利福平的na平板上。再一次重复操作,以2倍系列增加利福平浓度,直至筛选出300ug/ml的利福平标记菌株。标记菌株能在300ug/ml利福平的na平板上正常生长,未标记菌株在该平板上不能生长,且标记贝莱斯芽孢杆菌zxc-1菌株与原始菌株的菌落形态特征一致,抑菌活性相当。
[0088]
以此标记贝莱斯芽孢杆菌zxc-1菌株代替实施例3中贝莱斯芽孢杆菌zxc-1,按照实施例3方法制备含有标记贝莱斯芽孢杆菌zxc-1菌株的水稻生物种衣剂,水稻生物种衣剂与水稻种子(九优粤禾丝苗)按照1:40的质量比例混合包衣,阴干后,播种于预先高温灭绝(120℃,20min)无菌土中,置于光照培养箱中(温度25℃,光照12h,湿度40%),定期浇灌无菌水。以为包衣处理直接种植的黄瓜种子处理为对照。播种出苗后5、10、15、20、25、30d。取适量水稻苗的根际土壤、根、茎组织,采用稀释分离法回收标记贝莱斯芽孢杆菌zxc-1菌株。每处理设3次重复,28℃培养3d后,计算菌落数。
[0089]
结果如图7所示,贝莱斯芽孢杆菌zxc-1菌株在水稻根际土壤中定殖时间超过30d,菌体数量变化幅度不大,5d时略高于其他时间;贝莱斯芽孢杆菌zxc-1菌株可进入水稻体内,并在体内定植传导,接种后5d可在根中回收,茎中含量较低,10d后在茎中含量为2.1
ⅹ
102cfu/g。标记贝莱斯芽孢杆菌zxc-1菌株的定植动态能反映出原始菌株的群体定植动态,即贝莱斯芽孢杆菌zxc-1能在水稻根际土壤、根中迅速定殖,茎组织中贝莱斯芽孢杆定殖量较少。常规的种衣剂只有在5天左右一个菌体释放高峰,而种衣剂定殖菌量呈先增后减再增的趋势,即在15天的时候,由于脂质体被降解出现第2个菌量释放高峰,这与传统的生防菌量趋势不一致,说明脂质体囊泡结构的种衣剂对生防菌具有缓释性能。
[0090]
实施例6水稻生物种衣剂防治水稻细菌性条斑病田间药效试验
[0091]
于2021年度,利用实施例3制备的水稻生物种衣剂进行田间防治水稻细菌性条斑病小区试验,考察其试验剂量下对水稻细菌性条斑病防治效果,试验设置6个处理:生物种衣剂包衣1:50(质量比)、生物种衣剂包衣1:40(质量比)、生物种衣剂包衣1:30(质量比)、20%(质量百分数)噻菌酮悬浮剂300倍液浸种、36%(质量百分数)三氯异氰尿酸可湿性粉剂540倍液浸种、清水对照。
[0092]
6月17日进行播种,于空白对照小区水稻全部齐苗时,定期调查各处理小区出现水稻细菌性条斑病病害症状的时间,在空白对照区出现明显的水稻细菌性条斑病病害症状调查各小区发病情况,并于14天后调查各处理小区病害发生情况。
[0093]
病害初始发病时间调查方法:水稻齐苗后,每10天调查一次田间病害发生情况;分蘖期开始,每7天调查一次田间病害发生情况;全田见病后,每3~4天调查一次,台风暴雨前后及时进行调查。
[0094]
病害发生危害程度调查方法:每小区采用对角线五点取样的方法,每点调查25丛,共125丛。
[0095][0096][0097]
结果分析:
[0098]
清水对照处理发生水稻细菌性条斑病的时间最早,最早见病时间为8月9日,此时水稻处于分蘖后期;相对于清水对照处理,生物种衣剂1:50、1:40、1:30包衣处理小区的见病时间分别平均推迟4.3天、6.3天、7.3天,20%噻菌铜悬浮剂300倍液浸种处理小区的见病时间推迟5.3天,36%三氯异氰尿酸可湿性粉剂540倍液浸种处理小区的见病时间推迟3.3天。
[0099]
8月12日,清水对照处理的4个小区均见病,且病害症状明显,此后第14天(8月26日)调查各处理小区病情指数,统计分析各药剂浸种处理对水稻细菌性条斑病的防治效果。结果如下:生物种衣剂1:50、1:40、1:30包衣处理对水稻细菌性条斑病的防效分别为49.36%、56.61%、60.69%,随着药剂浓度的增加防效逐步增加,且生物种衣剂1:30包衣处理防效显著高于1:50(p<0.05);对照药剂20%噻菌铜悬浮剂300倍液浸种处理对水稻细菌性条斑病的防效为51.30%,显著低于生物种衣剂1:30包衣处理倍液浸种处理(p<0.05);对照药剂36%三氯异氰尿酸可湿性粉剂540倍液浸种处理对水稻细菌性条斑病的防效为50.12%,与生物种衣剂1:40和1:50包衣处理相当(p>0.05),但是显著低于生物种衣剂1:30包衣处理的防效(p<0.05)。所有试验药剂处理在试验范围内对水稻是安全的,见表2。
[0100]
表2各药剂浸种处理对水稻细菌性条斑病的防治效果
[0101][0102]
实施例7水稻生物种衣剂防治水稻恶苗病田间药效试验
[0103]
于2021年度,利用实施例3制备的水稻生物种衣剂进行田间防治水稻恶苗病小区试验,考察其试验剂量下对水稻恶苗病防治效果,试验设置5个处理:生物种衣剂包衣1:50(质量比)、生物种衣剂包衣1:40(质量比)、生物种衣剂包衣1:30(质量比)、36%(质量百分数)三氯异氰尿酸可湿性粉剂540倍液浸种、清水对照。
[0104]
6月17日进行播种,稻苗出齐时(6月22日)调查出苗率,秧苗移栽前(7月16日)调查病株率,大田抽穗前(9月10日)调查病株率。每小区标记连续100粒种子,在水稻苗出齐时调查出苗率,秧苗移栽前,每小区采用5点取样法,没电调查100株的病株率,大田抽穗前,每小区采用5点取样法,每点调查20丛,记录总株数、病株数、计算防效。
[0105][0106][0107]
结果分析:生物种衣剂1:50、1:40、1:30包衣处理对水稻细菌性条斑病的防效分别为49.36%、56.61%、60.69%,随着药剂浓度的增加防效逐步增加,且生物种衣剂1:30包衣处理防效显著高于1:50(p<0.05);对照药剂20%噻菌铜悬浮剂300倍液浸种处理对水稻细菌性条斑病的防效为51.30%,显著低于生物种衣剂1:30包衣处理倍液浸种处理(p<0.05);对照药剂36%三氯异氰尿酸可湿性粉剂540倍液浸种处理对水稻细菌性条斑病的防效为50.12%,与生物种衣剂1:40和1:50包衣处理相当(p>0.05),但是显著低于生物种衣剂1:30包衣处理的防效(p<0.05)。所有试验药剂处理在试验范围内对水稻是安全的,见表3。
[0108]
表3生物种衣剂防治水稻恶苗病防治效果
[0109][0110]
以上结合实施例对本发明做进一步详细说明。但这些实施例仅仅是本发明的简易例子,并不代表或限制本发明的权利保护范围,本发明的权利范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1