一种斜带石斑鱼的养殖方法
1.本发明属于水产养殖领域,具体涉及一种斜带石斑鱼的养殖方法。
背景技术:
2.斜带石斑鱼俗称青斑,隶属于石斑鱼属,是我国南方地区养殖的重要名贵海水鱼类,但随着养殖规模的不断扩大及养殖环境的恶化等,其寄生虫病害暴发日趋频繁。刺激隐核虫是感染我国华南地区海水养殖鱼类类最严重的一种寄生虫,主要感染海水硬骨鱼类,引发致死性、暴发性传染病,对广东、广西、福建等地的海水养殖业造成巨大经济损失。斜带石斑鱼是我国沿海地区重要的海水养殖鱼类,其肉质鲜美、营养丰富,具有很高的经济价值。刺激隐核虫病是石斑鱼养殖中的常见病害,病害的频发也给石斑鱼养殖业造成巨大的经济损失。如何高效且安全地防治石斑鱼刺激隐核虫病一直是国内外研究的热点问题。刺激隐核虫的生活史包括四个阶段,其中对养殖鱼类危害最大的是寄生于宿主体表的滋养体阶段,而最易被杀灭的阶段是游离幼虫阶段。包囊生活史阶段的刺激隐核虫有数层包囊壁,层与层之间有致密物质,包囊外层很难破碎,普通药物难以进入包囊内部,故传统防治方法主要针对刺激隐核虫幼虫进行杀灭。目前海水养殖石斑鱼病虫害的防治方法主要包括化学药剂防治法、物理防治法、中草药防治、免疫防治和生态防治法等。通过杀灭养殖水体中的病原生物可起到病害的防治作用,但传统防治方法存在成本高、对养殖鱼危害大、防治效果不佳等问题。
3.刺激隐核虫(cryptocaryon irritans)属原生动物门、纤毛亚门、寡膜纤毛纲、膜口亚纲、膜口目、凹口科、隐核虫属,常寄生于海水硬骨鱼类的体表和鳃,引起鱼类的传染性疾病。该寄生虫宿主范围广,可以感染几乎所有的海水硬骨鱼类。尽管危害如此严重,但由于该虫寄生部位独特、生活史复杂以及海水养殖环境的开放性等特性,导致该病的防控异常艰难。
4.用刺激隐核虫三个生活史阶段的虫体分别作为抗原对石斑鱼进行腹腔注免疫,发现幼虫的免疫效果最佳,且高剂量的幼虫比低剂量的免疫效果更好,证实可以通过免疫来防控刺激隐核虫病(bai et al.,2008;dan et al.,2013)。然而,刺激隐核虫不能像细菌那样体外培养和繁殖,只能利用活鱼进行传代(yoshinaga et al.,2007);尽管现在已经建立了稳定的刺激隐核虫活体传代技术,但仍很难在短时间内收获足够的全虫抗原进行疫苗的规模化生产,而且利用活体传代生产刺激隐核虫抗原非常昂贵,阻碍了疫苗的产业化应用。
5.利用基因工程疫苗来防治该疾病已陆续被报道。将截短的刺激隐核虫cisa32.6基因连接到pcdna表达载体上制备重组表达质粒,以其作为dna疫苗给大黄鱼免疫,能给予大黄鱼36.26%的相对保护率;把刺激隐核虫的类木瓜蛋白酶的全长或截断的基因序列连接到pcdna3.1表达载体上,或将截断的类木瓜蛋白酶基因与profilin基因串联后再连接到pcdna3.1表达载体上,提取重组表达载体肌肉注射免疫大黄鱼,可提供约40%的相对保护率;将刺激隐核虫profilin基因、actin基因、或profilin与actin的基因先通过pcr串联后再连接到pcdna表达载体上,以其免疫大黄鱼,可以给鱼提供不同程度的免疫保护率;把刺
激隐核虫的一种i-antigen基因连接到pcdna3.1表达载体上,用其单独或与重组表达的i-antigen蛋白复合免疫石斑鱼,能提供40%-46%的相对保护率,当i-antigen基因与刺激隐核虫的hsp70 c-端序列串联到pcdna3.1载体上后,可显著提高对鱼体的免疫保护率;刺激隐核虫cysteine protease的全长或截断序列连接到pcdna3.1表达载体上,以其作为dna疫苗免疫牙鲆,可以提供一定的免疫保护(张一楠,2019;李婷,2019;江水清,2019;josepriya et al.,2012,2015;watanabe et al.,2022)。虽然dna疫苗能给海水鱼类提供抗刺激隐核虫的免疫保护,然而,dna疫苗存在整合到宿主dna中或诱导自身免疫的风险。
6.把刺激隐核虫肌动蛋白解聚因子连接到pgex-4t-1表达载体上,转化到大肠杆菌中,经iptg诱导并纯化后免疫大黄鱼,能给大黄鱼提供59%的相对保护率;扩增获得刺激隐核虫的actin、enolase和26s proteasome基因后,对其密码子进行优化改造,再连接到pet-28a表达载体上,镍柱纯化后给石斑鱼进行免疫,能提供23%-46%的免疫保护;把刺激隐核虫的cysteine protease基因连接到pet-26b或pet-28b表达载体上,转化到bl21中进行诱导表达,以该重组表达的蛋白作为抗原制备疫苗,能给予河豚显著的免疫保护率;把截短的刺激隐核虫cisa32.6基因连接到pet28a表达载体上,转化到大肠杆菌bl21中进行重组表达,以纯化后的重组cisa32.6蛋白为抗原制备的亚单位疫苗,能给予大黄鱼50.1%的相对保护率;我们用重组的刺激隐核虫表面蛋白c1或i-antigen、四膜虫的tubulin免疫石斑鱼,都能提供其抗刺激隐核虫的能力(张一楠,2019;江水清,2019;watanabe et al.,2021;jiang et al.,2022;mo et al.,2019,2022;但学明等,2021)。以上重组表达的刺激隐核虫肌动蛋白解聚因子、actin、enolase、26s proteasome和cysteine protease、以及四膜虫的tubulin都是胞内蛋白,其诱导鱼类产生的抗体要进入刺激隐核虫体内才能发挥抗虫作用。然而,要使刺激隐核虫体内存在足够多的功能性抗体有两个方面的问题:一方面能进入虫体内的抗体总量有限,另一方面,进入虫体内的部分抗体也会被虫子消化。所以,胞内蛋白并不是作为疫苗候选抗原的理想选择。
7.刺激隐核虫表面蛋白作为抗原诱导产生的抗体,能有效识别刺激隐核虫表面的这些蛋白,直接发挥抗虫作用,是更为理想的候选抗原。cisa32.6是一种表面蛋白,但该蛋白在不同刺激隐核虫虫株间是否都存在或是否保守尚不清楚,这会严重影响其作为疫苗对不同虫株的保护效果;课题组前期筛选的表面抗原c1或i-antigen的免疫保护率较低。本专利使用的ciia1蛋白是一种表面膜蛋白,我们课题组分析发现该蛋白在刺激隐核虫的不同地理分离株间都较为保守,且其制备的疫苗能提供25%-50%的免疫保护率。因此,以ciia1蛋白作为抗原制备的疫苗具有较广泛的应用价值,可降低因刺激隐核虫病而造成的海水养殖鱼类的经济损失。
技术实现要素:
8.本发明旨在解决斜带石斑鱼养殖过程中感染刺激隐核虫后死亡率高的问题,在石斑鱼养殖过程中,为其注射一种免疫保护效果较好的重组蛋白疫苗,大大提高了斜带石斑鱼的抗病成活率。本发明也旨在解决刺激隐核虫疫苗制备成本较高且免疫保护效果不佳的技术问题,提供了一种基于刺激隐核虫膜蛋白ciia1的亚单位疫苗制备方法,首次筛选鉴定出刺激隐核虫的ciia1膜蛋白,并对其进行优化重组表达,以其作为抗原制备疫苗,大大提高了石斑鱼的抗刺激隐核虫感染的能力。
9.本发明是通过以下技术方案实现的:
10.一种斜带石斑鱼的养殖方法,其特征在于:将斜带石斑鱼鱼苗投入养殖池,待7月鱼苗长至10-15cm时,留出50-100条放入新的养殖池中作为对照组,剩余的全部鱼苗作为免疫组,向免疫组鱼苗腹腔注射ciia1亚单位疫苗一0.1ml/尾鱼,同时向对照组鱼苗腹腔注射pbs 0.1ml/尾鱼;两周后再向免疫组鱼苗腹腔注射ciia1亚单位疫苗二0.1ml/尾鱼,同时向对照组鱼苗腹腔注射pbs 0.1ml/尾鱼;首次免疫注射四周后,用4000幼虫/尾鱼的刺激隐核虫幼虫对免疫组和对照组的部分石斑鱼进行攻毒;攻毒后第二天,将攻毒的鱼转移到特制包囊收集装置中,收集每尾鱼体脱落的刺激隐核虫包囊并计数,计算免疫组的减虫率;相较于pbs对照组,免疫组减虫率达到25%-50%;
11.上述ciia1亚单位疫苗一的制备方法为:将1.0mg/ml的重组ciia1蛋白溶液与弗氏完全佐剂按1∶1混合,匀浆机乳化;上述ciia1亚单位疫苗二的制备方法为:将1.0mg/ml的重组ciia1蛋白溶液与弗氏不完全佐剂按1∶1混合,匀浆机乳化;两种疫苗中的所述重组ciia1蛋白溶液的制备方法如下:
12.一、表达载体的构建
13.刺激隐核虫膜蛋白ciia1基因序列,共编码320个氨基酸,其中前19个氨基酸为信号肽区域,最后65个氨基酸为跨膜结构域;根据亲疏水性质分析,删除了疏水部分,选取了其中232个氨基酸作为目的蛋白,序列为:kttaadwkgtfvvtsssclatcgwkigttvviadktgdatkvtwqgtvhttdttnvdvatgsckyvsivategqvgtatevlnnddtcefgngactvmgkkqktpgvvafkrdmdldtkpfqilykqvemvkktsttqkaaatdqandcdtqaslvdtttdakaivgtlklskatcdkcswdtskdlkitqdatkkymvtlagtikettagdcankltasetcyvtkkddkt;
14.刺激隐核虫密码子的偏好性以及编码氨基酸类型与大肠杆菌存在巨大差异,为实现其在大肠杆菌中的良好表达,根据大肠杆菌密码子的特点,将编码上述蛋白序列的核酸序列逐个进行重新编码,重新设计后的核酸编码序列为:aaaaccaccgcagcagattggaaagggacgtttgtggtgacctcaagtagctgtttagcaacctgtggctggaaaattggcaccaccgtggttattgcagataaaaccggcgatgcaaccaaagtgacctggcagggcaccgttcataccaccgataccaccaatgttgatgttgcaaccggctcttgtaaatatgtgagtattgttgcaaccgaaggtcaggtgggcaccgcaaccgaagtgctgaataatgatgatacctgtgaatttggtaatggcgcatgtaccgttatgggcaaaaaacagaaaacaccaggcgtggttgcctttaaacgcgatatggatctggataccaaaccgtttcagattctgtataaacaggttgaaatggttaaaaaaacctctaccacccagaaagcagccgcaaccgatcaggccaatgattgtgatacccaggcctcattagttgataccaccaccgatgccaaagccattgtgggtacgctgaaattaagtaaagcaacctgtgataaatgtagctgggatacctctaaggacctgaaaattacccaggatgcaaccaaaaaatatatggtgaccttagccggcaccattaaagaaaccaccgccggcgattgtgccaataaactgaccgcatcagaaacctgttatgttaccaaaaaagatgataaaacc;将上述基因片段进行人工合成,连接到pmd-18t质粒载体,并将pmd-18t-ciia1质粒转化至大肠杆菌dh5α;经扩大培养后,从大肠杆菌dh5α中提出pmd-18t-ciia1质粒;
15.根据密码子优化后的ciia1基因序列设计引物,并在正向引物和反向引物的5’端分别加上pet32a-δtrx载体的同源臂序列,正向引物序列为:caccaccaccaccacggtaccaaaaccaccgcagcagatt,反向引物序列为:ttgtcgacggagctcgaattcttaggttttatcatcttttttggtaaca;扩增ciia1基因表达片段的pcr反应体系为:pmd-18t-ciia1质粒载体4μl、10μm的正向引物4μl、10μm的反向引物4μl、primestar max mix 50μl、加水38μl;pcr反应程序为:98
℃预变性1min,(98℃,15s;55℃,15s;72℃,2min)
×
35个循环,最后72℃延伸5min;pcr产物进行琼脂糖凝胶电泳,切胶回收扩增的ciia1基因片段;
16.从含有pet32a-δtrx质粒的大肠杆菌dh5α中提取pet32a-δtrx质粒,用kpn i与ecor i两个限制性内切酶酶切pet32a-δtrx质粒,酶切反应体系为:pet32a-δtrx质粒1μg、quickcut
tm kpn i 1μl、quickcut
tm ecor i 1μl、10x quickcut green buffer 5μl、加水至总体积50μl;37℃酶切30min后,进行琼脂糖凝胶电泳,从胶上回收双酶切后的pet32a-δtrx质粒;
17.将ciia1基因与酶切后回收的pet32a-δtrx质粒连接,连接反应体系如下:pet32a-δtrx质粒118ng、ciia1基因28ng、5
×
ce ii buffer 4μl、exnase ii 2μl,加水至总体积20μl;37℃连接30min,立即置于冰上冷却;将连接产物转化到新的大肠杆菌dh5α中,挑选阳性克隆测序,测序正确的阳性克隆即含有即pet32a-δtrx-ciia1质粒。
18.二、重组ciia1蛋白表达菌的筛选
19.从上一步骤测序获得的阳性大肠杆菌dh5α中,提取pet32a-δtrx-ciia1质粒,再将其转化到bl21表达菌中;挑取含pet32a-δtrx-ciia1质粒的bl21菌至1ml加入氨苄霉素的lb液体培养基中,37℃、180rpm培养5h;取500μl菌液加入0.5μl的iptg,继续培养2h,作为ciia1蛋白诱导表达组;另取500μl菌液不添加任何试剂,继续培养2h,作为未诱导对照组;收集ciia1蛋白诱导表达组和未诱导对照组的菌液,进行sds-page凝胶电泳;结果表明,ciia1蛋白诱导表达组成功表达了重组ciia1蛋白,而未诱导对照组未有相应蛋白的表达。
20.三、重组ciia1蛋白的纯化
21.(1)将上一步骤确认可以表达重组ciia1蛋白的细菌接种到5ml lb液体培养基中,37℃振荡培养过夜;
22.(2)将培养过夜的5ml菌液全部接种到500ml lb液体培养基中,同时添加250μl氨苄青霉素;
23.(3)37℃、180rpm振荡培养4h,至菌液od600达到0.5;
24.(4)往菌液中加350μl 1m的iptg,37℃、180rpm继续培养3h;
25.(5)将菌液放置于4℃沉淀细菌24h;
26.(6)去除上清,保留100-150ml菌液;
27.(7)10000
×
g离心菌液15min;
28.(8)去掉上清,保留细菌沉淀,再用30ml pbs重悬细菌;
29.(9)超声破碎细菌悬液,250w、超声9s、停9s,共30min;
30.(10)10000
×
g离心超声破碎后的菌液5min,弃上清,保留沉淀;
31.(11)向沉淀中加20ml 1m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,沉淀保留;
32.(12)向沉淀中加20ml 2m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,沉淀保留;
33.(13)向沉淀中加20ml 3m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,沉淀保留;
34.(14)向沉淀中加20ml 4m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,沉淀保留;
35.(15)向沉淀中加20ml 6m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,沉淀保留;
36.(16)向沉淀中加20ml 8m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,弃沉淀;
37.(17)取部分步骤(11)-(16)收集的上清进行sds-page凝胶电泳,再进行考马斯亮蓝染色,发现重组ciia1蛋白主要溶解于8m尿素;
38.(18)取步骤(16)收集的上清,10000
×
g离心10min后,弃沉淀,取上清加入透析袋,并将透析袋依次放入含6m、4m、2.5m、1.5m、1m、0.5m尿素的溶液中进行透析,最终将透析袋转入pbs溶液。透析袋在每种溶液中放置12h。
39.(19)收集经pbs透析后的透析袋中的溶液,即为重组ciia1蛋白溶液,重组ciia1蛋白的浓度为1.18mg/ml。
40.本发明的有益效果在于:首次筛选鉴定、并优化重组表达了刺激隐核虫的膜蛋白ciia1,并首次将其应用于制备亚单位疫苗,用于斜带石斑鱼的养殖过程中,大大提高了斜带石斑鱼对刺激隐核虫的抗病能力,提高了斜带石斑鱼的养殖成活率。一年之中的7月为海水鱼类刺激隐核虫病的高发期,而一般而言,疫苗的保护效果在注射长时间后会逐渐减低,因而将疫苗注射的时间选在7月能最优化的抵抗刺激隐核虫。
附图说明
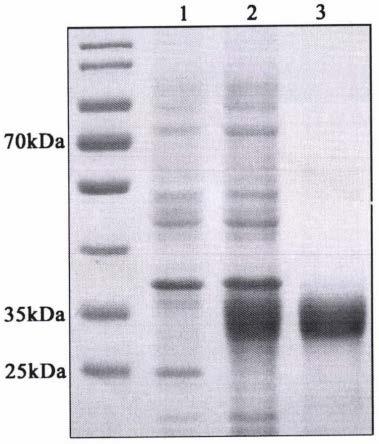
41.图1为重组ciia1蛋白的表达情况。
42.其中,第1泳道为诱导前菌液,第2泳道为诱导后菌液,第3泳道为纯化后重组ciia1蛋白。
具体实施方式
43.1、刺激隐核虫传代
44.刺激隐核虫分离自广东省茂名市电白区养殖的卵形鲳鲹,将感染鱼鳃上的滋养体用玻片刮落,清洗干净后转移到含有100ml海水的烧杯中孵化;用新孵出的刺激隐核虫幼虫感染卵形鲳鲹,2h后将感染后的卵形鲳鲹置于700l的塑料桶中暂养;感染后第2天夜间,将感染的卵形鲳鲹转移到200l的塑料桶,让包囊从鱼体自然脱落,2天后收集塑料桶底脱落的包囊;把包囊置于灭菌海水中充气培养,48-72h后孵出大量幼虫,用幼虫重新感染上述卵形鲳鲹,进行下一轮传代。
45.2、ciia1基因的筛选
46.按步骤1的方法收集刺激隐核虫,提取虫体总rna,构建cdna文库后进行转录组测序,分析并鉴定在各生活史阶段高表达的表面蛋白基因,ciia1即为主要的靶标基因。扩增ciia1基因并按照下面步骤3-5的方法经密码子优化改造后连接到pet32a-δtrx表达载体上,转化到大肠杆菌bl21中诱导表达。以纯化后的ciia1蛋白进行sds-page凝胶电泳,转膜后以石斑鱼抗刺激隐核虫全虫抗血清为一抗进行western blot,结果发现石斑鱼抗血清能有效识别原核表达的ciia1,说明重组ciia1具备其天然蛋白的相同或相似的抗原表位,可以作为良好的抗原制备疫苗。
47.3.、表达载体的构建
48.刺激隐核虫膜蛋白ciia1基因序列,共编码320个氨基酸,其中前19个氨基酸为信号肽区域,最后65个氨基酸为跨膜结构域。根据亲疏水性质分析,删除了疏水部分,选取了其中232个氨基酸作为目的蛋白,序列为:kttaadwkgtfvvtsssclatcgwkigttvviadktgdatkvtwqgtvhttdttnvdvatgsckyvsivategqvgtatevlnnddtcefgngactvmgkkqktpgvvafkrdmdldtkpfqilykqvemvkktsttqkaaatdqandcdtqaslvdtttdakaivgtlklskatcdkcswdtskdlkitqdatkkymvtlagtikettagdcankltasetcyvtkkddkt。
49.刺激隐核虫密码子的偏好性以及编码氨基酸类型与大肠杆菌存在巨大差异,为实现其在大肠杆菌中的良好表达,我们根据大肠杆菌密码子的特点,将编码上述蛋白序列的核酸序列逐个进行重新编码,重新设计后的核酸编码序列为:aaaaccaccgcagcagattggaaagggacgtttgtggtgacctcaagtagctgtttagcaacctgtggctggaaaattggcaccaccgtggttattgcagataaaaccggcgatgcaaccaaagtgacctggcagggcaccgttcataccaccgataccaccaatgttgatgttgcaaccggctcttgtaaatatgtgagtattgttgcaaccgaaggtcaggtgggcaccgcaaccgaagtgctgaataatgatgatacctgtgaatttggtaatggcgcatgtaccgttatgggcaaaaaacagaaaacaccaggcgtggttgcctttaaacgcgatatggatctggataccaaaccgtttcagattctgtataaacaggttgaaatggttaaaaaaacctctaccacccagaaagcagccgcaaccgatcaggccaatgattgtgatacccaggcctcattagttgataccaccaccgatgccaaagccattgtgggtacgctgaaattaagtaaagcaacctgtgataaatgtagctgggatacctctaaggacctgaaaattacccaggatgcaaccaaaaaatatatggtgaccttagccggcaccattaaagaaaccaccgccggcgattgtgccaataaactgaccgcatcagaaacctgttatgttaccaaaaaagatgataaaacc。将上述基因片段进行人工合成,连接到pmd-18t载体,并将pmd-18t-ciia1质粒转化至dh5α。经扩大培养后,从大肠杆菌dh5α中提出pmd-18t-ciia1质粒;
50.根据密码子优化后的ciia1基因序列设计引物,并在正向引物和反向引物的5’端分别加上pet32a-δtrx载体的同源臂序列,正向引物序列为:caccaccaccaccacggtaccaaaaccaccgcagcagatt,反向引物序列为:ttgtcgacggagctcgaattcttaggttttatcatcttttttggtaaca。扩增ciia1基因表达片段的pcr反应体系为:pmd-18t-ciia1质粒载体4μl、10μm的正向引物4μl、10μm的反向引物4μl、primestar max mix 50μl、加水38μl。pcr反应程序为:98℃预变性1min,(98℃,15s;55℃,15s;72℃,2min)
×
35个循环,最后72℃延伸5min。pcr产物进行琼脂糖凝胶电泳,切胶回收扩增的ciia1基因片段。
51.从含有pet32a-δtrx质粒的大肠杆菌dh5α中提取pet32a-δtrx质粒,用kpn i与ecor i两个限制性内切酶酶切pet32a-δtrx质粒,酶切反应体系为:pet32a-δtrx质粒1μg、quickcut
tm kpn i 1μl、quickcut
tm ecor i 1μl、10x quickcut green buffer 5μl、加水至总体积50μl。37℃酶切30min后,进行琼脂糖凝胶电泳,从胶上回收双酶切后的pet32a-δtrx质粒。
52.将ciia1基因与酶切后回收的pet32a-δtrx质粒连接,连接反应体系如下:pet32a-δtrx质粒118ng、ciia1基因28ng、5
×
ce ii buffer 4μl、exnase ii 2μl,加水至总体积20μl。37℃连接30min,立即置于冰上冷却。将连接产物转化到新的大肠杆菌dh5α中,挑选阳性克隆测序,测序正确的阳性克隆即含有即pet32a-δtrx-ciia1质粒。
53.4.重组ciia1蛋白表达菌的筛选
54.从步骤3测序获得的阳性大肠杆菌dh5α中,提取pet32a-δtrx-ciia1质粒,再将其转化到bl21表达菌中。挑取含pet32a-δtrx-ciia1质粒的bl21菌至1ml加入氨苄霉素的lb
液体培养基中,37℃、180rpm培养5h。取500μl菌液加入0.5μl的iptg,继续培养2h,作为ciia1蛋白诱导表达组;另取500μl菌液不添加任何试剂,继续培养2h,作为未诱导对照组。收集ciia1蛋白诱导表达组和未诱导对照组的菌液,进行sds-page凝胶电泳。结果如图1所示,ciia1蛋白诱导表达组成功表达了重组ciia1蛋白(图1,泳道2),而未诱导对照组未有相应蛋白的表达(图1,泳道1)。
55.5.重组ciia1蛋白的纯化
56.(1)将步骤4确认可以表达重组ciia1蛋白的细菌接种到5ml lb液体培养基中,37℃振荡培养过夜;
57.(2)将培养过夜的5ml菌液全部接种到500ml lb液体培养基中,同时添加250μl氨苄青霉素;
58.(3)37℃、180rpm振荡培养4h,至菌液od600达到0.5;
59.(4)往菌液中加350μl 1m的iptg,37℃、180rpm继续培养3h;
60.(5)将菌液放置于4℃沉淀细菌24h;
61.(6)去除上清,保留100-150ml菌液;
62.(7)10000
×
g离心菌液15min;
63.(8)去掉上清,保留细菌沉淀,再用30ml pbs重悬细菌;
64.(9)超声破碎细菌悬液,250w、超声9s、停9s,共30min;
65.(10)10000
×
g离心超声破碎后的菌液5min,弃上清,保留沉淀;
66.(11)向沉淀中加20ml 1m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,沉淀保留;
67.(12)向沉淀中加20ml 2m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,沉淀保留;
68.(13)向沉淀中加20ml 3m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,沉淀保留;
69.(14)向沉淀中加20ml 4m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,沉淀保留;
70.(15)向沉淀中加20ml 6m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,沉淀保留;
71.(16)向沉淀中加20ml 8m的尿素溶液,匀浆机重悬,震荡摇床上摇10min使沉淀充分溶解,10000
×
g离心重悬液15min,吸取上清保存于另一管中,弃沉淀;
72.(17)取部分步骤(11)-(16)收集的上清进行sds-page凝胶电泳,再进行考马斯亮蓝染色,发现重组ciia1蛋白主要溶解于8m尿素;
73.(18)取步骤(16)收集的上清,10000
×
g离心10min后,弃沉淀,取上清加入透析袋,并将透析袋依次放入含6m、4m、2.5m、1.5m、1m、0.5m尿素的溶液中进行透析,最终将透析袋转入pbs溶液。透析袋在每种溶液中放置12h。
74.(19)收集经pbs透析后的透析袋中的溶液,即为重组ciia1蛋白溶液,重组ciia1蛋白的浓度为1.18mg/ml。
75.6.疫苗的制备
76.用pbs将透析到pbs中的重组ciia1蛋白稀释到终浓度1.0mg/ml,把重组ciia1蛋白
溶液与弗氏佐剂按1∶1混合,匀浆机乳化。将制备好的疫苗滴一滴到水面观察,确定疫苗滴不会散开,疫苗4℃保存。
77.7.重组ciia1蛋白对石斑鱼的免疫保护性
78.用步骤6制备的疫苗免疫石斑鱼,首次免疫用弗氏完全佐剂制备的疫苗,两周后加强免疫一次,加强免疫用弗氏不完全佐剂制备的疫苗。pbs注射石斑鱼作为对照组。首次免疫后第4周,用4000幼虫/尾鱼的刺激隐核虫幼虫对免疫组和对照组的石斑鱼进行攻毒。攻毒后第2d,将攻毒的鱼转移到特制包囊收集装置中,收集每尾鱼体脱落的刺激隐核虫包囊并数量,计算疫苗免疫组的减虫率。结果发现:相较于pbs对照组,重组ciia1蛋白免疫组减虫率达到25%-50%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1