一种多子小瓜虫在体阶段药物杀灭效果的评价方法和装置与流程
1.本发明属于生物技术领域,涉及寄生原生动物在体阶段的药物评价技术领域,具体涉及一种多子小瓜虫在体阶段药物杀灭效果的评价方法和装置。
背景技术:
2.多子小瓜虫(ichthyophthirius multifiliis fouquet,1876)隶属于纤毛门、寡膜纲、膜口目、凹口科,是淡水鱼类养殖中危害最大的寄生虫病原之一。它在世界范围内广泛分布;没有宿主特异性,对宿主鱼的种类、年龄均无严格要求,可在短期内造成宿主大量死亡。多子小瓜虫不仅给几乎所有淡水养殖鱼类造成巨大的经济损失,同时也能在自然水域中爆发,给鱼类资源的保护带来严重威胁。多子小瓜虫的生活史简单,不需要中间宿主,主要分为三个阶段:掠食体阶段,滋养体阶段以及包囊阶段。掠食体钻入鱼类皮肤后发育成滋养体,以鱼类表皮分泌的黏液和上皮细胞为食;在生长发育成熟后滋养体主动离开宿主,形成包囊,粘附于水底进行快速的二分裂繁殖;并经过16-24h的分裂进一步分化产生成百上千的具有感染性的掠食体,破囊而出再次寻找新的宿主。
3.如何有效防控小瓜虫病一直以来都是鱼类病害防控领域的研究热点和难点。目前防治小瓜虫病主要有三种方式:一是药物防治,二是免疫防治,三是生态防治。免疫防治由于多子小瓜虫存在不同血清型的问题,至今没有可用的有效疫苗。小瓜虫病生态防治的研究与实践则刚刚起步,相关理论方法和技术手段尚未建立起来。因而,药物仍是当前防治小瓜虫病的主要方式。然而,早期筛选的特效药物—硝酸亚汞和孔雀石绿由于其严重的三致毒性(致畸、致癌、致突变),已被列为禁药。虽然国内外鱼病学工作者在小瓜虫病防治药物的筛选方面做了许多努力,但真正安全、有效的替代药物依然十分匮乏。因此,筛选安全高效的新型替代药物仍然是防治小瓜虫病的当务之急。
4.在多子小瓜虫生活史的三个主要阶段当中:掠食体和包囊是小瓜虫在水体中短暂存活的离体阶段,滋养体则是小瓜虫在鱼体上发育、成熟的在体阶段。掠食体和包囊阶段药物杀灭效果的评价方法简单易行且已比较成熟。但是掠食体和包囊阶段的药物杀灭效果并不能确切地反映出所评价药物防治小瓜虫病的真实有效性。因为离体阶段的小瓜虫相对脆弱,药物杀灭并非难事。而一旦小瓜虫侵入鱼体,会刺激鱼体分泌黏液和造成上皮组织增生把虫体层层包裹起来,形成肉眼可见的滋养体,药物将很难透过上皮组织将其杀死。因此,小瓜虫的滋养体阶段才是防治的瓶颈和评价药物有效性的关键所在。然而,目前对小瓜虫的在体阶段(滋养体)的药物杀灭效果还没有统一的评价标准,已有的研究结果均是在用药一段时间后通过随机取样计算包囊的掉落数量和死亡率来判定药物对小瓜虫的杀灭效果。但由于滋养体喜聚集和掉落后会粘附于水底等因素,对实验水体随机取样存在较大的偶然性,难以真实反映药物对小瓜虫的实际杀灭效果。因此建立一个精准的在体定量评价系统,可为防治小瓜虫病安全高效药物的筛选和相应杀虫机制的研究奠定坚实基础。
技术实现要素:
5.本发明提供了一种适用于评价多子小瓜虫在体阶段药物杀灭效果的装置,同时提供了一种小瓜虫在体阶段药物杀灭效果的评价方法。该方法能够高效、精确地评价药物对小瓜虫滋养体的杀灭效果。
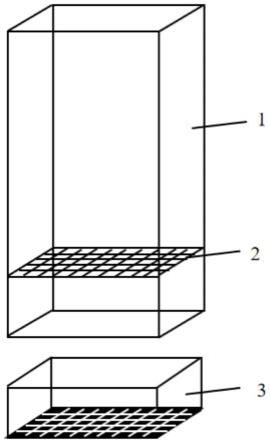
6.一种适用于评价多子小瓜虫在体阶段药物杀灭效果的装置,包括透明亚克力板、铁丝网、网格黑色底板,容易进行组装和拆卸。将自制的小装置放入透明的鱼缸中,透过透明亚克力板可实时观察实验鱼的状态和用药过程中小瓜虫滋养体从鱼体掉落的情况;黑色的网格底板与白色虫体形成鲜明反差,在显微镜下可清楚、准确地记录用药后滋养体掉落形成包囊的数量和状态,用于计算死亡率。该装置可根据实验鱼大小调整装置尺寸,且该装置适用于所有待测药物。
7.一种多子小瓜虫在体阶段药物杀灭效果的评价方法,包括以下步骤:
8.步骤一,选取同批次感染小瓜虫严重程度较为均一的实验鱼分配到多个装置中,每个装置放入1条实验鱼。
9.步骤二,在不同装置中加入不同药物或不同梯度浓度的药液,同时设置一个空白对照组,不加任何药物。
10.步骤三,各组浸泡实验鱼4h后,将装置的底板取出,记录底板上包囊的数量和死活状态,并计算包囊的死亡率。20h后计算此底板(原底板)上收集到的包囊孵化出掠食体的孵出率。
11.步骤四,将一个新的底板装回装置中,将装置及实验鱼置换到曝气水中,每隔10h观察一次底板上包囊的状态。20h后计算此底板(新底板)上收集到的包囊数量和孵化出掠食体的孵出率。该方法适用于所有待测药物。
12.滋养体从鱼体脱落之后会落入水体底部形成包囊,正常情况下包囊经过16-24h会孵化出掠食体,选择24h计算包囊掠食体孵化率。药物刺激不一定能使滋养体马上死亡,滋养体没有死亡但通过药物刺激包囊不能释放掠食体(即包囊失去繁殖能力)来感染健康的鱼类同样能说明药物的作用效果。
13.与现有技术相比,本发明的有益效果是:
14.(1)透明的亚克力板可以方便实验人员随时观察用药后实验鱼的状态,黑色的底板和白色的包囊形成反差可以让实验人员清晰地观察底板上掉落的包囊数量和状态。
15.(2)滋养体被药物驱离鱼体后全部掉落到底板上,便于计数。
16.(3)装置可拆卸,在用药后无需换液,可将实验鱼和装置的上半部分一起换到新的曝气水中连续观察包囊掉落情况。
17.(4)可根据实验鱼体的种类、大小量身定制不同规格的装置。
附图说明
18.图1用于评价多子小瓜虫在体阶段药物杀灭效果的装置
19.图2用于评价药物杀灭效果装置中的黑色网格底板
20.图3用于评价药物杀灭效果装置的各组成部分
21.图4是本发明具体实施过程的示例
22.图5是本发明具体实施过程中底板上收集到的包囊示例
23.图6是本发明实施例一所提供的对照组和用药后包囊状态
24.图7是本发明实施例二所提供的对照组和用药后包囊状态
具体实施方式
25.下面结合附图以及具体实施案例来详细说明本发明,其中的具体实施案例以及说明仅用来解释本发明,但并不作为对本发明的限定。
26.一种适用于评价多子小瓜虫在体阶段药物杀灭效果的装置,包括透明亚克力板(1)、铁丝网(2)、网格黑色底板(3),透明亚克力板和网格黑色底板嵌合而成,容易进行组装和拆卸。将自制的小装置放入透明的鱼缸中,透过透明亚克力板可实时观察实验鱼的状态和用药过程中小瓜虫滋养体从鱼体掉落的情况;黑色的网格底板与白色虫体形成鲜明反差,在显微镜下可清楚、准确地记录用药后滋养体掉落形成包囊的数量和状态,用于计算死亡率。
27.另外,本发明还涉及一种多子小瓜虫在体阶段药物杀灭效果的评价方法,采用两个实施例进行介绍。
28.实施例一
29.以仲丁威乳油为例,介绍多子小瓜虫在体阶段药物杀灭效果的评价方法,包括以下步骤:
30.步骤一,选取4条严重感染小瓜虫且感染程度均一的金鱼,分别放入装置中,每个装置放1条金鱼。
31.步骤二,在其中3个装置中分别加入不同剂量的25%仲丁威乳油,使装置中的仲丁威终浓度分别达到2.5mg/l,5mg/l和7.5mg/l;另外1个装置为空白对照组,不加任何药物。
32.步骤三,各组浸泡金鱼4h后,将装置的底板取出,记录底板上包囊的数量和死活状态,并计算包囊的死亡率。20h后计算此底板(原底板)上收集到的包囊孵化出掠食体的孵出率。
33.步骤四,将一个新的底板装回装置中,将装置及金鱼置换到曝气水中,每隔10h观察一次底板上包囊的状态。20h后计算此底板(新底板)上收集到的包囊数量和孵化出掠食体的孵出率。
34.本实施例中不同浓度仲丁威乳油对多子小瓜虫在体阶段的杀死率如表1所示,包囊状态如图6所示,a、b分别为对照组(0mg/l)和7.5mg/l用药之后的状态。从表1可以看出仲丁威的浓度越高,驱离滋养体的效果越好,掉落到底板上的包囊的死亡率也越高;从图6a可以看出曝气水中的包囊状态正常,颜色为均匀的白色,图6b可以看出7.5mg/l仲丁威浸泡后的包囊皱缩死亡,细胞质聚集塌缩。
35.36.表1在体阶段小瓜虫在不同浓度仲丁威乳油作用下的驱离效果和死亡率
37.实施例二
38.以孔雀石绿为例,介绍多子小瓜虫在体阶段药物杀灭效果评价方法,包括以下步骤:
39.步骤一,选取5条严重感染小瓜虫且感染程度均一的金鱼,分别放入装置中,每个装置放1条金鱼;
40.步骤二,在其中4个装置中分别加入不同剂量的1000mg/l的孔雀石绿溶液,使装置中的药液终浓度分别达到0.05mg/l,0.1mg/l,0.5mg/l和1mg/l;另外1个装置为空白对照组,不加任何药物。
41.步骤三,各组浸泡金鱼4h后,将装置的底板取出,记录底板上包囊的数量和死活状态,并计算包囊的死亡率。20h后计算此底板(原底板)上收集到的包囊孵化出掠食体的孵出率。
42.步骤四,将一个新的底板装回装置中,将装置及金鱼置换到曝气水中,每隔10h观察一次底板上包囊的状态。20h后计算此底板(新底板)上收集到的包囊数量和孵化出掠食体的孵出率。
43.本实施例各浓度孔雀石绿溶液对小瓜虫在体阶段的杀死率如表2所示,包囊状态如图7所示。表2显示,小瓜虫滋养体的驱离效果并没有随着孔雀石绿浓度的升高而增加,最好的驱离效果浓度为0.1mg/l。图7a中为对照组(0mg/l)包囊,已正常分裂;图7b和7c分别为浓度0.1mg/l和0.5mg/l孔雀石绿浸泡液中掉下的包囊,可以看出部分包囊已经死亡,部分包囊虽没有死亡,但形态呈现异常;从图7d可以看出1mg/l的孔雀石绿使小瓜虫包囊破裂死亡。
[0044][0045]
表2在体阶段小瓜虫在不同浓度孔雀石绿溶液作用下的驱离效果和死亡率。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1