一种植物非经典自噬模型的构建及其在调控植物抗性方面的应用
本发明生物,特别涉及一种植物非经典自噬模型的构建及其在调控植物抗性方面的应用。
背景技术:
1、自噬是真核细胞存在的利用溶酶体(动物)或液泡(酵母和植物)降解自身胞质蛋白、损伤细胞器或入侵病原菌的物质周转途径。迄今为止,研究者已鉴定出40多个自噬相关编码基因,它们协同调节自噬的发生。近来,在动物细胞中,发现一种不依赖于自噬上游核心因子参与的催化自噬蛋白atg8锚定到单膜细胞器的过程,称之为非经典自噬。该途径在细胞内吞、病菌免疫及细胞器修复等多个生物学过程中发挥重要作用。
2、与经典自噬途径不同,atg8靶向到单膜结构的非经典自噬最主要的特征是不依赖于上游调节因子如atg1复合体及atg9等,然而,却依赖于atg16-atg5-atg12为核心的脂化修饰系统。此外,在经典自噬途径中,atg8特异地与磷脂酰乙醇胺偶联,并结合到双层膜的自噬小体上。而在非经典自噬中,atg8既可以偶联磷脂酰乙醇胺(pe),也可以共价结合磷脂酰丝氨酸,进而锚定到单层膜的细胞器。
3、相比于动物领域,植物中关于非经典自噬的功能研究显著滞后,其根本原因是缺乏稳定、可靠、有效的非经典自噬模型的构建体系。因此,建立一套快速、可重复的植物非经典自噬模型,可以为探究植物非经典自噬功能提供重要的方法基础。该模型不仅有利于开发新的植物抗性性状,还可为提高植物产量提供更好的理论依据和策略。
技术实现思路
1、本发明的首要目的在于克服现有技术的缺点与不足,提供一种植物非经典自噬模型的构建方法。
2、本发明的另一目的在于提供所述植物非经典自噬模型的构建方法的应用。
3、本发明的目的通过下述技术方案实现:
4、一种植物非经典自噬模型的构建方法,包括如下步骤:
5、(1)幼苗培养:将植物种子点种于固体培养基上,常规培养5~10天,得到植物幼苗;
6、(2)热激处理:将植物幼苗转移到液体培养基中,于40~45℃条件下加热3~10分钟,然后转移到固体培养基上,放置于22±1℃条件下恢复0.5~3小时,得到所述的植物非经典自噬模型。
7、步骤(1)中所述的植物为野生型植物或非atg8脂化修饰系统相关基因突变的转基因植物,其中所述非atg8脂化修饰系统相关基因包括atg5、atg7、atg12、atg3、atg4和atg10基因;本发明中的植物非经典自噬模型依赖于atg8脂化修饰系统,因此,atg5、atg7、atg12、atg3、atg4和atg10基因均需要未发生突变(缺失)。
8、所述的野生型植物包括农作物、水果和烟草中的至少一种;进一步优选为水稻、草莓、烟草和拟南芥中的至少一种;再进一步优选为野生型拟南芥(拉丁学名:arabidopsisthaliana(l.)heynh.)。
9、所述的非atg8脂化修饰系统相关基因突变的转基因植物中的转基因植物包括农作物、水果和烟草中的至少一种;进一步优选为转基因水稻、草莓、烟草和拟南芥中的至少一种;再进一步优选为转基因拟南芥。
10、所述的转基因拟南芥为过表达atg8基因的拟南芥,atg11基因突变(缺失)的拟南芥,atg9基因突变(缺失)的拟南芥,atg11基因突变(缺失)背景下过表达atg8基因的拟南芥,atg9基因突变(缺失)背景下过表达atg8基因的拟南芥和过表达pin2基因的拟南芥中的至少一种。
11、所述的转基因拟南芥,为了方便在荧光显微镜下进行观察,可同时转入荧光蛋白基因。
12、所述的荧光蛋白基因包括黄色荧光蛋白yfp基因、绿色荧光蛋白gfp基因或红色荧光蛋白mcherry基因等。
13、所述的atg8基因包括atg8a基因、atg8b基因、atg8c基因、atg8d基因、atg8e基因、atg8f基因、atg8g基因、atg8h基因和atg8i基因中的至少一种。
14、所述的转基因拟南芥优选为转基因拟南芥yfp-atg8/col-0,yfp-atg8/atg11,yfp-atg8/atg9和pin2-gfp中的至少一种;其中,
15、所述的转基因拟南芥yfp-atg8/col-0、yfp-atg8/atg11和yfp-atg8/atg9通过如下方法获得:
16、(i)将荧光蛋白基因和atg8基因通过同源重组方法构建到pcambia1300载体上,得到荧光蛋白-atg8融合基因的表达载体;其中,荧光蛋白基因包括yfp、gfp和mcherry基因中的至少一种;所述的atg8基因包括atg8a基因、atg8b基因、atg8c基因、atg8d基因、atg8e基因、atg8f基因、atg8g基因、atg8h基因和atg8i基因中的至少一种;
17、(ii)将荧光蛋白-atg8融合基因的表达载体利用农杆菌蘸花法分别导入到野生型拟南芥(col-0)、拟南芥atg11突变体或拟南芥atg9突变体中,经潮霉素抗性筛选,得到转基因拟南芥yfp-atg8/col-0、yfp-atg8/atg11和yfp-atg8/atg9。
18、步骤(i)所述的yfp、gfp和mcherry基因在ncbi的登录号依次为afi26426.1,amq45836.1和ufq89828.1。
19、步骤(i)所述的atg8a基因、atg8b基因、atg8c基因、atg8d基因、atg8e基因、atg8f基因、atg8g基因、atg8h基因和atg8i基因在tair数据库中的locus依次为at4g21980、at4g04620、at1g62040、at2g05630、at2g45170、at4g16520、at3g60640、at3g06420及at3g15580。
20、步骤(ii)中所述的荧光蛋白-atg8融合基因优选为yfp-atg8融合基因。
21、步骤(ii)中所述的潮霉素抗性筛选通过如下方法实现:收获f0代种子,点种在含有50μmol/l潮霉素的ms培养基上,进行阳性转基因植物筛选。
22、步骤(ii)中所述的转基因拟南芥yfp-atg8/col-0、yfp-atg8/atg11或yfp-atg8/atg9优选为t3代纯合种子。
23、步骤(1)中所述的固体培养基优选为ms固体培养基。
24、步骤(1)中所述的幼苗培养优选为通过如下步骤实现:将植物种子点种于ms固体培养基上,4℃放置2~3天后,置于恒温光照培养箱中,设置培养温度为22±1℃,日照16小时,黑暗8小时,培养4~7天,得到植物幼苗。
25、所述的4℃放置的时间优选为2天。
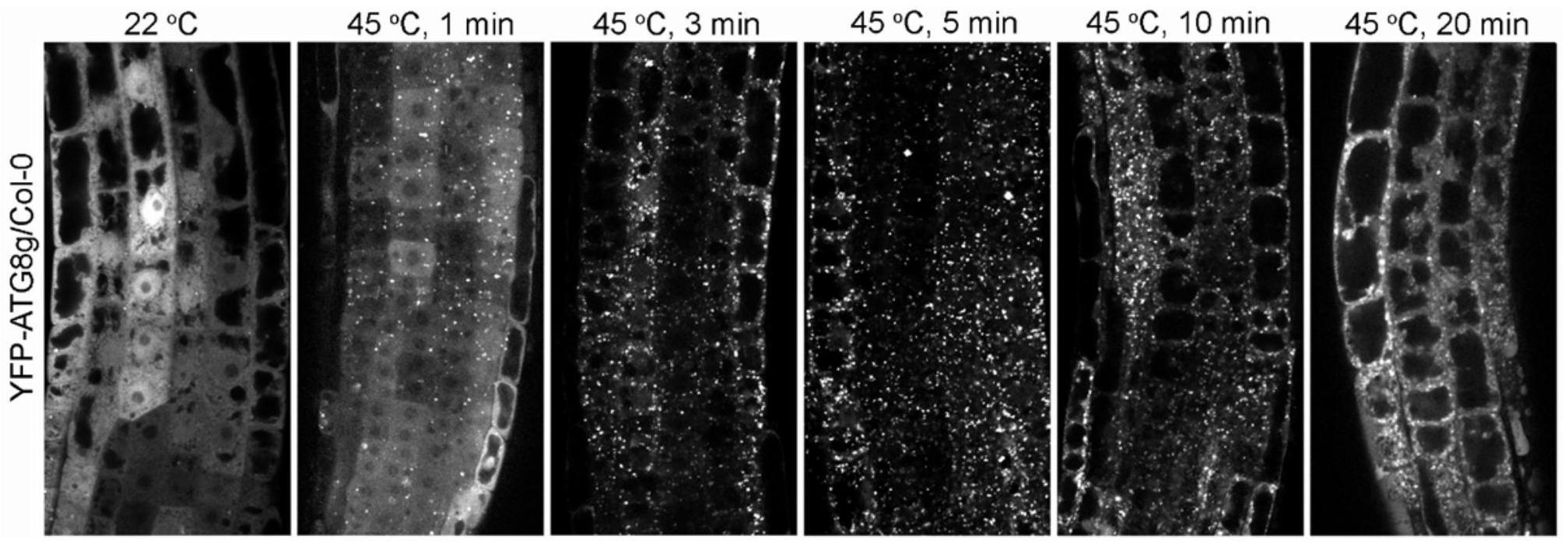
26、所述的培养的时间优选为5天。
27、步骤(2)中所述的液体培养基优选为ms液体培养基。
28、步骤(2)中所述的液体培养基的用量按加入液体培养基能够淹没幼苗即可。
29、步骤(2)中所述的热激处理为采用金属浴或水浴的方式进行。
30、步骤(2)中所述的热激的温度优选为43~45℃;更优选为45℃。
31、步骤(2)中所述的热激的时间优选为5~10分钟;更优选为5分钟。
32、所述的植物非经典自噬模型的构建方法,在步骤(2)之后还包括进一步验证的步骤;具体为:利用激光共聚焦显微镜进行观察,若观察到完全呈现点状信号,说明该植株为非经典自噬模型植株。
33、所述的植物非经典自噬模型的构建方法在调控植物抗性方面的应用。
34、所述的植物抗性为抗热性。
35、所述的植物非经典自噬模型的构建方法在调控植物细胞生长素受体pin2稳定性和/或调控植物细胞蛋白转运能力方面的应用。
36、所述的调控植物细胞生长素受体pin2稳定性为降低植物细胞生长素受体pin2稳定性。
37、所述的调控植物细胞蛋白转运能力为降低植物细胞蛋白转运能力。
38、本发明相对于现有技术具有如下的优点及效果:
39、1、本发明首先提供一种快速、高效、稳定的植物非经典自噬的构建方法,继而通过建立非经典自噬模型,评估非经典自噬对植物细胞的一系列功能,包括质膜生长素受体pin2蛋白稳定性,蛋白转运过程等所造成的影响,建立一种切实可行的植物非经典自噬模型。
40、2、本发明构建了一种可靠的、可重复性俱佳的标准化植物非经典自噬模型,在激光共聚焦荧光显微镜可以观察到热激处理后呈现出大量点状信号,该点状结构的形成不依赖于经典自噬上游调节因子atg11及atg9,却依赖于atg8脂化修饰系统中的atg5,符合非经典自噬,为研究植物非经典自噬引起的细胞器功能改变提供一个新的研究平台。
41、3、本发明利用荧光漂白恢复方法检测pin2在质膜的积累情况分析非经典自噬对植物细胞生长素受体稳定性的影响,并通过检测统计bfa小体的形成情况分析非经典自噬对植物细胞的蛋白转运过程的影响,发现构建的非经典自噬模型够引起植物细胞功能的改变,因此可将其用于植物抗性研究方面。
- 还没有人留言评论。精彩留言会获得点赞!