一种磁场强度诱导无创性缺血性脑卒中模型的建立方法
1.本技术涉及动物模型技术领域,尤其涉及一种磁场强度诱导无创性缺血性脑卒中模型的建立方法。
背景技术:
2.动物疾病模型是指各种医学科学研究中建立的具有人类疾病模拟表现的动物,主要用于实验生理学、实验病理学和实验治疗学(包括新药筛选)研究。人类疾病的发展十分复杂,以人本身作为实验对象来深入探讨疾病发生机制,推动医药学的发展来之缓慢,临床积累的经验不仅在时间和空间上都存在局限性,而且许多实验在道义上和方法上也受到限制。而借助于动物模型的间接研究,可以有意识地改变那些在自然条件下不可能或不易排除的因素,以便更准确地观察模型的实验结果并与人类疾病进行比较研究,有助于更方便、更有效地认识人类疾病的发生发展规律,研究防治措施。
3.缺血性脑卒中作为一种严重的神经系统疾病,已经成为我国主要的致死致残病因,对于缺血性脑卒中的临床研究也较多,但是现有技术的脑卒中模型,都需要进行有创手术,在动物颈部剪开刀口,暴露出颈内动脉,手术本身操作难度高,并且可能对动物的生理造成一定影响,从而影响动物模型的准确性与可靠性,导致所建立的动物模型失去参考价值。
4.因此,需要一种磁场强度诱导无创性缺血性脑卒中模型的建立方法,能够实现无创性缺血性脑卒中模型的建立,操作简单方便,模型准确性与可靠性高。
技术实现要素:
5.针对上述现有技术中存在的问题,本技术提供了一种磁场强度诱导无创性缺血性脑卒中模型的建立方法,能够实现无创性缺血性脑卒中模型的建立,操作简单方便,模型准确性与可靠性高。所述技术方案如下:
6.本技术提供了一种磁场强度诱导无创性缺血性脑卒中模型的建立方法,包括:
7.对多组小鼠的尾静脉分别注射磁性纳米颗粒;
8.将磁场强度控制器分别放置于每组所述小鼠的颈内动脉处;
9.通过所述磁场强度控制器调节所述颈内动脉处的磁场强度;
10.将调节后的所述磁场强度控制器沿所述颈内动脉移动,以使得所述磁性纳米颗粒与流动的血液形成微血栓,得到无创性缺血性脑卒中模型。
11.进一步地,所述小鼠为3~4月龄成年健康雄性c57/b小鼠。
12.进一步地,所述纳米磁性颗粒的粒径为100~120nm,注射入所述尾静脉的所述纳米磁性颗粒的体积为130~150μl。
13.进一步地,所述对多组小鼠的尾静脉分别注射磁性纳米颗粒包括:
14.对多组所述小鼠的尾静脉分别注射不同浓度的所述磁性纳米颗粒;或者
15.对多组所述小鼠的尾静脉分别注射相同浓度的所述磁性纳米颗粒。
16.进一步地,多组所述磁性纳米颗粒的浓度包括第一浓度、第二浓度与第三浓度中的至少一种浓度;所述第一浓度大于0mg/ml且不大于2mg/ml,所述第二浓度大于2mg/ml且不大于4mg/ml,所述第三浓度大于4mg/ml且不大于6mg/ml。
17.进一步地,在所述对多组小鼠的尾静脉分别注射不同浓度的磁性纳米颗粒之前或者之后,所述方法还包括:
18.将所述小鼠麻醉,放置于恒温毯上;
19.剔除所述小鼠的颈部毛发,并标记所述小鼠的颈总动脉、颈内动脉与颈外动脉的位置。
20.进一步地,所述磁场强度控制器的预设调节范围为0~1t。
21.进一步地,所述颈内动脉中微血栓的形成时间为4~5min。
22.进一步地,在所述将调节后的所述磁场强度控制器沿所述颈内动脉移动,以使得所述磁性纳米颗粒与流动的血液形成微血栓,得到无创性缺血性脑卒中模型之后,所述方法还包括:
23.将处理后的多组所述小鼠放回饲养,并进行神经行为评估。
24.进一步地,所述神经行为评估为:
25.在单盲情况下,对每组所述小鼠均进行网格步行测试、圆筒试验与意式面条抓握试验;其中,所述神经行为评估的评估时间包括注射所述磁性纳米颗粒的前一周与注射所述磁性纳米颗粒后1~15周内。
26.实施本技术,具有如下有益效果:
27.本技术利用纳米磁性颗粒随血流动力学流动的特点,在特定位置施加不同大小的磁场强度,将磁性纳米颗粒强力吸引到特定的颈内动脉处,与流动的血液形成微血栓,从而形成一系列不同程度的无创性缺血性脑卒中模型;与传统脑卒中模型的手术方法相比,本技术具有无创、操作简单方便的优点;并且,本技术的无创性缺血性脑卒中模型准确性与可靠性高,便于模拟观察人类缺血性脑卒中不同损伤程度的特点,为脑缺血发病机制及药物筛选打下了坚实基础。
附图说明
28.为了更清楚地说明本发明的技术方案,下面将对实施例中所使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它附图。
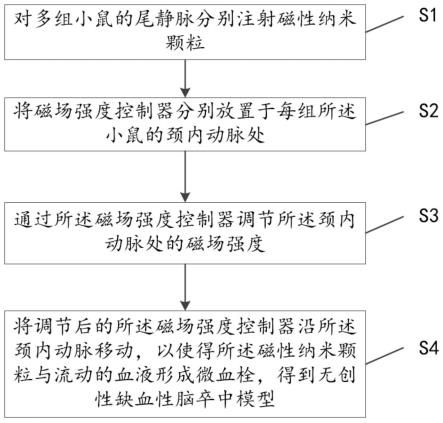
29.图1为本发明的一种可能的实施方式中磁场强度诱导无创性缺血性脑卒中模型的建立方法的流程图。
具体实施方式
30.下面将结合本发明实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术的一部分实施例,而不是全部的实施例,因此不能理解为对本技术的限制。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本技术保护的范围。
31.需要说明的是,本技术的说明书和权利要求书中的术语“包括”和“具有”以及他们
的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或服务器不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
32.实施例1
33.基于现有的小鼠缺血性脑卒中模型不能实现无创建立的现状,本技术提供了一种磁场强度诱导无创性缺血性脑卒中模型的建立方法,如说明书附图1所示,包括:
34.s1,对多组小鼠的尾静脉分别注射磁性纳米颗粒。
35.s2,将磁场强度控制器分别放置于每组所述小鼠的颈内动脉处。
36.s3,通过所述磁场强度控制器调节所述颈内动脉处的磁场强度。
37.s4,将调节后的所述磁场强度控制器沿所述颈内动脉移动,以使得所述磁性纳米颗粒与流动的血液形成微血栓,得到无创性缺血性脑卒中模型。
38.具体地,在本说明书的一个可能的实施方式中,s1步骤中使用的小鼠为3~4月龄成年健康雄性c57/b小鼠。
39.具体地,在s1步骤之前或者之后,该磁场强度诱导无创性缺血性脑卒中模型的建立方法还包括:
40.将所述小鼠麻醉,放置于恒温毯上;
41.剔除所述小鼠的颈部毛发,并标记所述小鼠的颈总动脉、颈内动脉与颈外动脉的位置。
42.其中,恒温毯的温度设置为37
±
0.2℃,尽量贴合小鼠的体温,以避免异常环境对小鼠生理造成影响,进而影响无创性缺血性脑卒中模型的准确性;而剔除小鼠颈部毛发能够暴露出小鼠的颈部皮肤,便于观察和标记小鼠的颈总动脉、颈内动脉和颈外动脉,进而便于s2步骤中将磁场强度控制器对应放置于颈内动脉处,保证微血栓能够形成于颈内动脉处,提升操作便利性与模型准确性。
43.具体地,在本说明书的一个可能的实施方式中,根据所要建立的无创性缺血性脑卒中模型的精细程度,s1步骤中对多组小鼠的尾静脉分别注射磁性纳米颗粒可以包括:
44.s101,对多组所述小鼠的尾静脉分别注射不同浓度的所述磁性纳米颗粒;或者
45.s102,对多组所述小鼠的尾静脉分别注射相同浓度的所述磁性纳米颗粒。
46.其中,当对模型的精细程度要求较低时,可以选择执行s102步骤,在同一注射浓度下,仅通过调节s3步骤中的磁场强度建立一系列不同程度的无创性缺血性脑卒中模型;而当注射入小鼠体内的磁性纳米颗粒在浓度单一的情况下无法满足大量不同程度的无创性缺血性脑卒中模型的建立时,可以选择执行s101步骤,通过不同浓度的磁性纳米颗粒和不同大小的磁场强度共同调节,以扩展模拟出的无创性缺血性脑卒中模型的程度范围,进一步丰富无创性缺血性脑卒中模型,同时保证准确性与可靠性。
47.具体地,在本说明书的一个可能的实施方式中,磁性纳米颗粒可以选择为fe3o4,磁性适中,能够稳定地被磁场强度控制器吸引,形成微血栓时快速方便;并且,在本说明书的另一个可能的实施方式中,该磁性纳米颗粒的粒径可以选择为100~120nm,便于磁性纳米颗粒在血管中移动。
48.具体地,在本说明书的一个可能的实施方式中,在s1步骤中吸取一定体积的磁性纳米颗粒注射入小鼠尾静脉,则所吸取并注射的磁性纳米颗粒的体积可以选择为130~150
μl,而多组所述磁性纳米颗粒的浓度包括第一浓度c1、第二浓度c2与第三浓度c3中的至少一种浓度;其中,0<c1≤2mg/ml,2mg/ml<c2≤4mg/ml,4mg/ml<c3≤6mg/ml,则从小鼠尾静脉注射的磁性纳米颗粒的总数量可以通过调节磁性纳米颗粒的具体体积和具体浓度,实现更多、更详细的变化,从而配合后续s3步骤中不同的磁场强度,模拟出更多不同程度的无创性缺血性脑卒中模型;并且,当注射浓度较低时,其磁性纳米颗粒的总数量具有一个最高的阈值,则磁场强度增大时,其吸引纳米颗粒的能力很可能远远大于实际注射的纳米颗粒的阈值,导致无法形成对应程度的无创性缺血性脑卒中模型,模型失真;而注射高浓度的磁性纳米颗粒就能够与较大的磁场强度相匹配,即注射的磁性纳米颗粒的总数量总是高于对应组的磁场强度所能够吸引的磁性纳米颗粒的数量的,保证能够准确形成对应程度(重度)的无创性缺血性脑卒中模型,可靠性高。
49.例如,在本实施例中,注射的磁性纳米颗粒的体积可以选择为150μl,将s1步骤中的小鼠分为三组,三组的注射浓度分别设置为1mg/ml、3mg/ml和5mg/ml,之后在s3步骤中,对三组小鼠分别施加不同的磁场强度,注射浓度为1mg/ml的一组施加较小的磁场强度,注射浓度为3mg/ml的一组施加中等大小的磁场强度,注射浓度为5mg/ml的一组施加较大的磁场强度,以对应形成不同程度的无创性缺血性脑卒中模型,操作简单方便;而每一组内部,也可以设置多只小鼠,同一组内的多只小鼠均注射相同浓度的磁性纳米颗粒,并施加相同大小的磁场强度,以使得本技术的建立方法具有重现性,可靠性更高。
50.而在本说明书的另一个可能的实施方式中,对每组内的多只小鼠(组内的小鼠均已注射入相同浓度的磁性纳米颗粒)也可以分别施加不同的磁场强度;由于注射浓度本身的限制,小鼠体内的磁性纳米颗粒数量有限,假设注射1mg/ml浓度的磁性纳米颗粒能够满足较小磁场强度范围(设为区间t1)的调节需求,则在较小的磁场强度范围(区间t1)内,可以进一步对该组内的多只小鼠分别施加不同大小的较小磁场强度,而这些不同大小的较小磁场强度均在区间t1范围内,从而得到形成了不同轻度微血栓的小鼠,该组小鼠均表现出不同的轻型程度,即不同程度的无创性缺血性脑卒中模型,进一步细化模型;则在该种情况下,实际上是按照浓度的不同先对小鼠进行第一级分组,再按照磁场强度的不同对小鼠进行第二级分组,最终的分组总数等于第一级分组的组数乘以第二级分组的组数;而需要说明的是,s1步骤中基于浓度的分组并不限定于三组,根据实际需求还可以设置四组、五组甚至更多组,而相邻每组之间的浓度区间间隔更小,从而模拟出更精细的无创性缺血性脑卒中模型;此外,s1步骤中对小鼠的分组仅是为了描述方便,并不限定于基于浓度分组,也可以基于不同的磁场强度进行分组,然后再对组内的多只小鼠(同一组内后续s3步骤中会施加同一磁场强度)分别注射不同浓度的磁性纳米颗粒,建立方式灵活多变。
51.在脑卒中发病机理中,微血栓是形成于颈内动脉中的,则在s3步骤的磁场强度设置完成之后,将该磁场强度控制器沿颈内动脉向上移动,能够更有利于引导磁性纳米颗粒移动入颈内动脉中,保证微血栓准确形成于小鼠颈内动脉中,提升模型可靠性。
52.具体地,在本说明书的一个可能的实施方式中,s3步骤中,磁场强度控制器的预设调节范围设置为0~1t,调节范围广泛,能够允许较大程度范围内脑卒中模型的形成;而在本实施例中,按照注射浓度的增加,在三组小鼠的注射浓度依次为1mg/ml、3mg/ml和5mg/ml的情况下,对三组小鼠所施加的磁场强度依次可以设置在0~10mt(不包括0)、20~30mt和31~40mt范围内,分别形成轻度、中度和重度的无创性缺血性脑卒中模型;类似地,在本说
明书的其他可能的实施方式中,根据分组数量的不同,也可以将每组的磁场强度范围缩小,并根据缩小后的磁场强度范围调整所需注射的纳米磁性颗粒的浓度,以增加更多组无创性缺血性脑卒中模型,进一步丰富无创性缺血性脑卒中模型。
53.具体地,本技术中通过磁场强度吸引磁性纳米颗粒形成微血栓的形成时间为4~5min,所需时间较短,能够快速方便地得到大量无创性缺血性脑卒中模型,节省时间。
54.具体地,在s4步骤之后,即得到无创性缺血性脑卒中模型之后,该方法还包括:
55.将处理后的多组所述小鼠放回饲养,并进行神经行为评估。
56.而神经行为评估的具体可以包括:
57.在单盲情况下,对每组所述小鼠均进行网格步行测试、圆筒试验与意式面条抓握试验。
58.其中,进行神经行为评估的评估时间包括注射磁性纳米颗粒(即对小鼠进行手术,在其颈内动脉中形成微血栓)的前一周与注射磁性纳米颗粒后1~15周内,而术前一周的评估结果可以作为对照组,以便于对比正常小鼠与不同程度的无创性缺血性脑卒中模型;在本实施例中,评估时间可以进一步设置为术前一周至术后1、3、5、7、11、15周。
59.网格步行测试是检测动物脑或脊髓损伤后是否精确控制后爪放置能力的一种评价方法,适用于猫、鼠等小型动物;根据网格放置角度不同,可分为水平网格试验和倾斜网格试验;评估时,将小鼠置于水平或倾斜的网格上(两端之间距离2.5cm),在一定时间内记录小鼠后爪在网格上失足落空次数,发出脚步声次数以及通过这段距离的时间等行为学数据。
60.圆筒试验是针对与不对称中枢神经系统疾病的研究工具,主要研究啮齿类动物在贴壁站立的过程中肢体不对称使用的情况,也称为自发性前肢任务评估试验;评估时,将小鼠放置于直径为20cm、高度为40cm的圆筒内,通过自动记录系统中的摄像机记录小鼠在一定时间内分别以左前肢、右前肢以及两只前肢同时贴壁站立的次数、时间以及比例,经由自动记录系统进行记录和分析,能够保证评估结果的客观性,同时节省评估时间与人力。
61.意式面条抓握试验是用录像分别记录动物在抓取进食未煮熟的2.5厘米长的意大利米粉时前爪的运动变化,在该过程中,可以调整摄像机的位置与角度以获得前爪运动的最佳视野,而慢镜头回放可以清晰的观察到小鼠前爪的调整,并确定小鼠开始进食之后,前爪抓握面条的任何手趾的清晰移动和更替;记录每次试验中小鼠在每支米粉上前爪调整的次数,以及进食完每支米粉的时间,重复至少4次,以确保前爪灵敏度变化的量化分析。
62.本技术根据聚集的纳米磁性颗粒数量与磁场强度控制器的磁场强度大小成正比的关系,利用磁场强度控制器调节不同大小的磁场强度,以控制吸引到颈内动脉的磁性纳米颗粒的数量,使得不同数量的磁性纳米颗粒与流动的血液形成不同大小的微血栓,得到一系列不同程度的无创性缺血性脑卒中模型;以三组小鼠为例,在本实施例中,该建立方法可以具体为:
63.将多只小鼠分别分为三组,将1mg/ml的纳米磁性颗粒注射入第一组小鼠的尾静脉,将3mg/ml的纳米磁性颗粒注射入第二组小鼠的尾静脉,将5mg/ml的纳米磁性颗粒注射入第三组小鼠的尾静脉,并且,以上三组中所注射的磁性纳米颗粒的体积相同,均为150μl。
64.采用异氟烷麻醉小鼠,并将小鼠放置于恒温毯上,剔除小鼠颈部毛发,并标记处小鼠的颈总动脉、颈内动脉与颈外动脉的位置,以便于后续操作与观察。
65.将磁场强度控制器放置于小鼠的颈内动脉处,并调节磁场强度控制器的设定值,使得第一组小鼠颈部所施加的磁场强度在0~10mt范围内(不包括0),第二组小鼠颈部所施加的磁场强度在20~30mt范围内,第三组小鼠颈部所施加的磁场强度为在31~40mt范围内。
66.将调节后的磁场强度控制器沿颈内动脉向上移动,引导纳米磁性颗粒流入颈内动脉,与流动的血液形成微血栓,得到三组无创性缺血性脑卒中模型,则其脑卒中程度的对应关系应当如表1中所示。
67.表1本实施例中注射浓度、磁场强度与脑卒中程度的对应关系
[0068][0069]
将处理后的小鼠均放回饲养,并进行包括网格步行测试、圆筒试验与意式面条抓握试验在内的神经行为评估,而评估结果所表现出的脑卒中程度也与表1中的预测结果一致;即该磁场强度诱导无创性缺血性脑卒中模型的建立方法操作简单方便,且无需手术开刀,建立的无创性缺血性脑卒中模型准确性与可靠性也高,参考价值高,为脑缺血发病机制及药物筛选打下了坚实基础。
[0070]
实施例2
[0071]
本实施例与实施例1的不同之处在于,将小鼠分为九组,对九组小鼠分别施加不同的磁场强度,其对应关系如表2中所示,其余与实施例1相同。
[0072]
表2实施例2中注射浓度、磁场强度与脑卒中程度的对应关系
[0073][0074]
而需要说明的是,对于表2中,注射浓度为1mg/ml且磁场强度为21mt及以上的情形,受限于小鼠体内纳米磁性颗粒的总数量,即使施加更高的磁场强度,也无法形成与磁场强度相对应的微血栓,而只能形成与磁场阈值(即刚好吸引完全1mg/ml的纳米磁性颗粒所对应的磁场强度)相对应的微血栓,实际上并没有意义,故本实施例中并未列出。
[0075]
以上所描述的仅为本技术的一些实施例而已,并不用于限制本技术,本行业的技术人员应当了解,本技术还会有各种变化和改进,任何依照本技术所做的修改、等同替换和改进都落入本技术所要求的保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1